鲁教版 九年级上册化学 第三单元 溶液 单元练习 (含答案)
文档属性
| 名称 | 鲁教版 九年级上册化学 第三单元 溶液 单元练习 (含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 135.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-24 12:16:13 | ||
图片预览

文档简介
鲁教版化学第三单元---溶液
一、单选题
1.下列关于溶液的说法正确的是
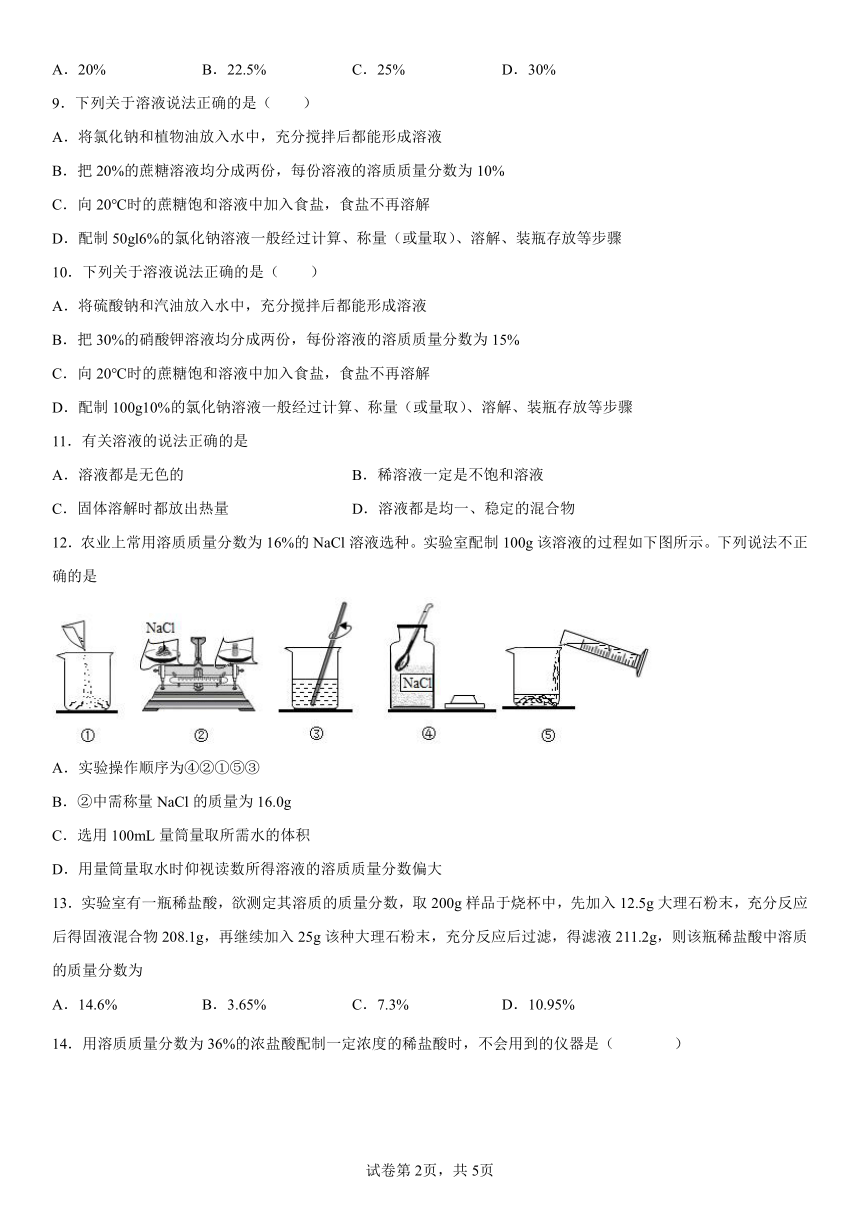
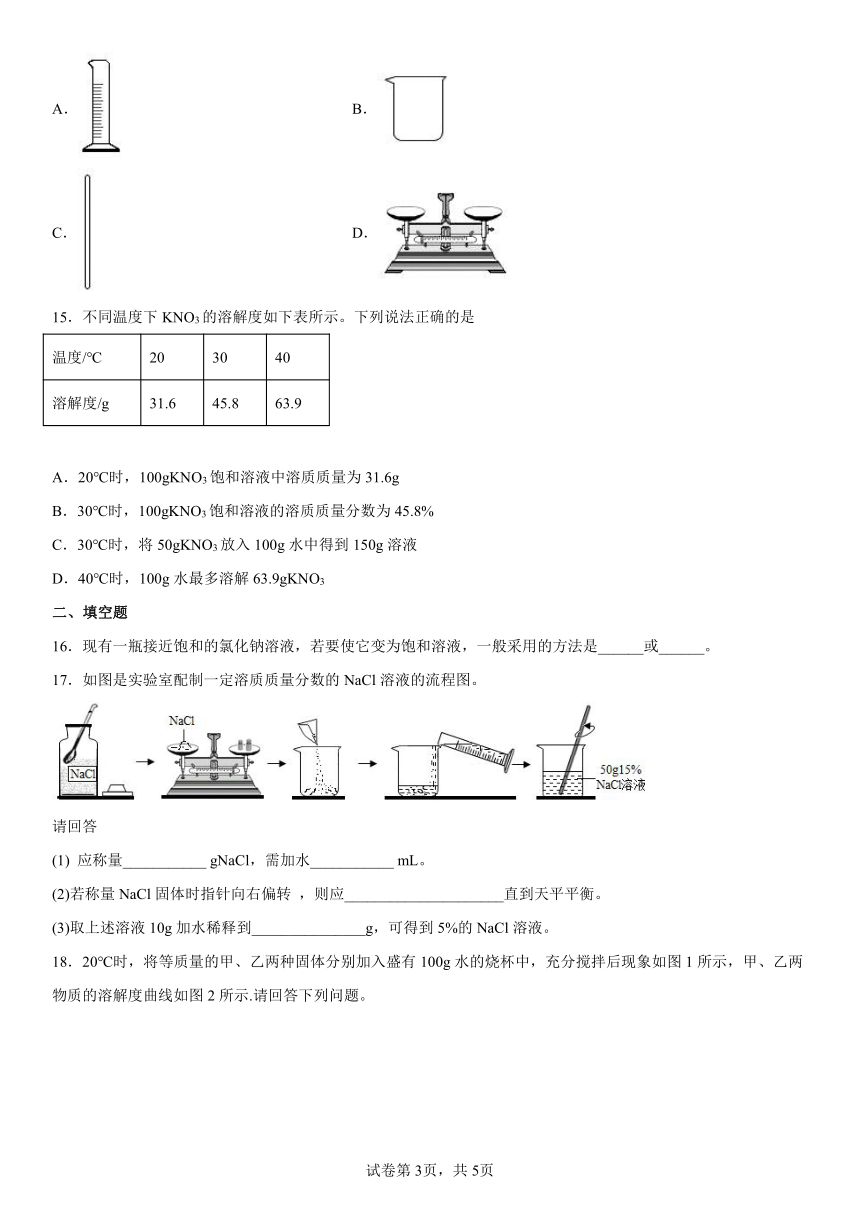
A.溶液一定是无色透明的液体
B.饱和溶液降温后都有溶质结晶析出
C.碘酒溶液中,碘是溶质,酒精是溶剂
D.水加入蔗糖后形成溶液,导电性明显增强
2.若研究温度对食盐溶解快慢的影响,在图中应选用哪两个装置进行对照实验( )
A.甲和乙 B.乙和丙 C.甲和丙 D.丙和丁
3.溶液与人们的生活息息相关。下列有关溶液说法正确的是
A.溶质可以是固体,也可以是液体或气体
B.将汽油与水充分混合,得到的是溶液
C.将10%的某溶液倒出一半,剩余溶液中溶质的质量分数为20%
D.某饱和溶液降温到t℃析出晶体后,得到的溶液是t°C时的不饱和溶液
4.配制50g质量分数为6%的氯化钠溶液,不需要用到的仪器是( )
A.烧杯 B.量筒 C.铁架台 D.玻璃棒
5.下列物质分别加入适量水中,充分搅拌,能够得到溶液的是
A.蔗糖 B.花生油 C.面粉 D.冰块
6.有关溶液的下列说法中不正确的是
①溶液都是透明、均一、稳定的混合物。
②同种溶质的饱和溶液一定比它的不饱和溶液浓。
③把不饱和溶液转变成饱和溶液,溶质质量分数一定变大。
A.①② B.①③ C.①②③ D.②③
7.下列物质不属于溶液的是( )
A.碘酒 B.矿泉水 C.白醋 D.蒸馏水
8.向100 g质量分数为20%的NaCl溶液中加入3 g NaCl固体和12 g水,使其完全溶解,所得溶液中NaCl的质量分数是
A.20% B.22.5% C.25% D.30%
9.下列关于溶液说法正确的是( )
A.将氯化钠和植物油放入水中,充分搅拌后都能形成溶液
B.把20%的蔗糖溶液均分成两份,每份溶液的溶质质量分数为10%
C.向20℃时的蔗糖饱和溶液中加入食盐,食盐不再溶解
D.配制50gl6%的氯化钠溶液一般经过计算、称量(或量取)、溶解、装瓶存放等步骤
10.下列关于溶液说法正确的是( )
A.将硫酸钠和汽油放入水中,充分搅拌后都能形成溶液
B.把30%的硝酸钾溶液均分成两份,每份溶液的溶质质量分数为15%
C.向20℃时的蔗糖饱和溶液中加入食盐,食盐不再溶解
D.配制100g10%的氯化钠溶液一般经过计算、称量(或量取)、溶解、装瓶存放等步骤
11.有关溶液的说法正确的是
A.溶液都是无色的 B.稀溶液一定是不饱和溶液
C.固体溶解时都放出热量 D.溶液都是均一、稳定的混合物
12.农业上常用溶质质量分数为16%的NaCl溶液选种。实验室配制100g该溶液的过程如下图所示。下列说法不正确的是
A.实验操作顺序为④②①⑤③
B.②中需称量NaCl的质量为16.0g
C.选用100mL量筒量取所需水的体积
D.用量筒量取水时仰视读数所得溶液的溶质质量分数偏大
13.实验室有一瓶稀盐酸,欲测定其溶质的质量分数,取200g样品于烧杯中,先加入12.5g大理石粉末,充分反应后得固液混合物208.1g,再继续加入25g该种大理石粉末,充分反应后过滤,得滤液211.2g,则该瓶稀盐酸中溶质的质量分数为
A.14.6% B.3.65% C.7.3% D.10.95%
14.用溶质质量分数为36%的浓盐酸配制一定浓度的稀盐酸时,不会用到的仪器是( )
A. B.
C. D.
15.不同温度下KNO3的溶解度如下表所示。下列说法正确的是
温度/℃ 20 30 40
溶解度/g 31.6 45.8 63.9
A.20℃时,100gKNO3饱和溶液中溶质质量为31.6g
B.30℃时,100gKNO3饱和溶液的溶质质量分数为45.8%
C.30℃时,将50gKNO3放入100g水中得到150g溶液
D.40℃时,100g水最多溶解63.9gKNO3
二、填空题
16.现有一瓶接近饱和的氯化钠溶液,若要使它变为饱和溶液,一般采用的方法是______或______。
17.如图是实验室配制一定溶质质量分数的NaCl溶液的流程图。
请回答
(1) 应称量___________ gNaCl,需加水___________ mL。
(2)若称量NaCl固体时指针向右偏转 ,则应_____________________直到天平平衡。
(3)取上述溶液10g加水稀释到_______________g,可得到5%的NaCl溶液。
18.20℃时,将等质量的甲、乙两种固体分别加入盛有100g水的烧杯中,充分搅拌后现象如图1所示,甲、乙两物质的溶解度曲线如图2所示.请回答下列问题。
(1)图l中一定为饱和溶液的是___________________溶液(填“甲”或“乙”)
(2)图2中P点表示的意义__________。
(3)图2中表示乙物质溶解度曲线的是_______(填“M”或“N”)
19.下图为A、B两种固体物质的溶解度曲线。
(1)溶解度随温度升高而增大的是______物质,t1℃时A、B两物质的溶解度为_______g。
(2)使一定量接近饱和的A物质溶液变为饱和溶液采用的一种方法是_____________________________。
(3)t1℃时,将一定量B的饱和溶液升温至t2℃,溶液的质量将_________(填“增加”、“减少”或“不变”)。
(4)t2℃时,分别用50gA、B制成饱和溶液,需要水的质量A_____B(填“<”“>”或“=”)
三、实验题
20.欲配制50g质量分数为5%的NaCl溶液,下图是某同学配制溶液的操作过程。
(1)A中盛放溶液的仪器名称:___________。配制的操作示意图如上图,该实验的正确操作顺序为___________。(填字母序号)
(2)经检测,所配制溶液的溶质质量分数偏小,其原因可能是___________ (填序号)。
①氯化钠固体不纯 ②称量时,砝码端忘垫质量相同的纸片
③量取水时,仰视读数 ④装瓶时,有少量溶液洒出。
(3)水的密度为1.0g/mL。实验室配制50g溶质质量分数为5%的氯化钠溶液,需要量取水___________mL。
21.某同学配制50g6%氯化钠溶液,整个操作过程如下图所示,回答下列问题:
(1)配制溶液的正确操作顺序为 _____ (填序号,下同),其中操作错误的是 _____ 。
(2)图②中盛放氯化钠固体的仪器名称是 _____ ,需称取氯化钠 _____ g.
(3)量水时选用的量筒的量程最合适的是 _____ (填序号),读数时视线要与量筒内 _____ 保持水平。
A 10mL B 25mL C 50mL D 100mL
(4)经检测,该同学配制的溶液溶质质量分数偏小,可能的原因是 _____ (填序号)。
A 氯化钠固体不纯 B 用生锈砝码称量 C 装瓶时有少量溶液洒出 D 溶解时烧杯内壁有水珠
四、计算题
22.某化学小组的进行硫酸铜溶液和氢氧化钠溶液相混合的实验[反应原理为: CuSO4+2NaOH=Cu(OH)2↓+ Na2SO4]。实验过程及数据如下图所示:
(1)若操作过程中损失水的质量为 3.1g,其它物质的质量损失忽略不计,则 a 的值为____。
(2)计算氢氧化钠溶液中溶质的质量分数为多少?
23.现有溶质质量分数为 4%的硝酸钾溶液 40g,要使溶质质量分数达到 16%,则可以通过下列途径实现,请填空
(1)若蒸发水,应蒸发水的质量为 g;
(2)若加入质量分数为 32%的硝酸钾溶液,应加入溶液的质量为 g。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.C
3.A
4.C
5.A
6.D
7.D
8.A
9.D
10.D
11.D
12.D
13.C
14.D
15.D
16. (1) 增加溶质 (2) 蒸发溶剂
17. (1) 7.5 42.5 (2) 往左盘中继续添加氯化钠固体 30
18. (1) 甲 30℃时,M、N的溶解度相同 (2) N
19.(1)A 25 (2)降低温度(增加A物质或蒸发溶剂) (3)减少 (4)<
20.(1) 烧杯 CBDEA (2) ①②③ 47.5
21. (1) ②①⑤③④ ① (2)广口瓶 3 C (3) 凹液面最低处 AD
22.(1)142g;(2)8%
23.(1)30;(2)30
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列关于溶液的说法正确的是
A.溶液一定是无色透明的液体
B.饱和溶液降温后都有溶质结晶析出
C.碘酒溶液中,碘是溶质,酒精是溶剂
D.水加入蔗糖后形成溶液,导电性明显增强
2.若研究温度对食盐溶解快慢的影响,在图中应选用哪两个装置进行对照实验( )
A.甲和乙 B.乙和丙 C.甲和丙 D.丙和丁
3.溶液与人们的生活息息相关。下列有关溶液说法正确的是
A.溶质可以是固体,也可以是液体或气体
B.将汽油与水充分混合,得到的是溶液
C.将10%的某溶液倒出一半,剩余溶液中溶质的质量分数为20%
D.某饱和溶液降温到t℃析出晶体后,得到的溶液是t°C时的不饱和溶液
4.配制50g质量分数为6%的氯化钠溶液,不需要用到的仪器是( )
A.烧杯 B.量筒 C.铁架台 D.玻璃棒
5.下列物质分别加入适量水中,充分搅拌,能够得到溶液的是
A.蔗糖 B.花生油 C.面粉 D.冰块
6.有关溶液的下列说法中不正确的是
①溶液都是透明、均一、稳定的混合物。
②同种溶质的饱和溶液一定比它的不饱和溶液浓。
③把不饱和溶液转变成饱和溶液,溶质质量分数一定变大。
A.①② B.①③ C.①②③ D.②③
7.下列物质不属于溶液的是( )
A.碘酒 B.矿泉水 C.白醋 D.蒸馏水
8.向100 g质量分数为20%的NaCl溶液中加入3 g NaCl固体和12 g水,使其完全溶解,所得溶液中NaCl的质量分数是
A.20% B.22.5% C.25% D.30%
9.下列关于溶液说法正确的是( )
A.将氯化钠和植物油放入水中,充分搅拌后都能形成溶液
B.把20%的蔗糖溶液均分成两份,每份溶液的溶质质量分数为10%
C.向20℃时的蔗糖饱和溶液中加入食盐,食盐不再溶解
D.配制50gl6%的氯化钠溶液一般经过计算、称量(或量取)、溶解、装瓶存放等步骤
10.下列关于溶液说法正确的是( )
A.将硫酸钠和汽油放入水中,充分搅拌后都能形成溶液
B.把30%的硝酸钾溶液均分成两份,每份溶液的溶质质量分数为15%
C.向20℃时的蔗糖饱和溶液中加入食盐,食盐不再溶解
D.配制100g10%的氯化钠溶液一般经过计算、称量(或量取)、溶解、装瓶存放等步骤
11.有关溶液的说法正确的是
A.溶液都是无色的 B.稀溶液一定是不饱和溶液
C.固体溶解时都放出热量 D.溶液都是均一、稳定的混合物
12.农业上常用溶质质量分数为16%的NaCl溶液选种。实验室配制100g该溶液的过程如下图所示。下列说法不正确的是
A.实验操作顺序为④②①⑤③
B.②中需称量NaCl的质量为16.0g
C.选用100mL量筒量取所需水的体积
D.用量筒量取水时仰视读数所得溶液的溶质质量分数偏大
13.实验室有一瓶稀盐酸,欲测定其溶质的质量分数,取200g样品于烧杯中,先加入12.5g大理石粉末,充分反应后得固液混合物208.1g,再继续加入25g该种大理石粉末,充分反应后过滤,得滤液211.2g,则该瓶稀盐酸中溶质的质量分数为
A.14.6% B.3.65% C.7.3% D.10.95%
14.用溶质质量分数为36%的浓盐酸配制一定浓度的稀盐酸时,不会用到的仪器是( )
A. B.
C. D.
15.不同温度下KNO3的溶解度如下表所示。下列说法正确的是
温度/℃ 20 30 40
溶解度/g 31.6 45.8 63.9
A.20℃时,100gKNO3饱和溶液中溶质质量为31.6g
B.30℃时,100gKNO3饱和溶液的溶质质量分数为45.8%
C.30℃时,将50gKNO3放入100g水中得到150g溶液
D.40℃时,100g水最多溶解63.9gKNO3
二、填空题
16.现有一瓶接近饱和的氯化钠溶液,若要使它变为饱和溶液,一般采用的方法是______或______。
17.如图是实验室配制一定溶质质量分数的NaCl溶液的流程图。
请回答
(1) 应称量___________ gNaCl,需加水___________ mL。
(2)若称量NaCl固体时指针向右偏转 ,则应_____________________直到天平平衡。
(3)取上述溶液10g加水稀释到_______________g,可得到5%的NaCl溶液。
18.20℃时,将等质量的甲、乙两种固体分别加入盛有100g水的烧杯中,充分搅拌后现象如图1所示,甲、乙两物质的溶解度曲线如图2所示.请回答下列问题。
(1)图l中一定为饱和溶液的是___________________溶液(填“甲”或“乙”)
(2)图2中P点表示的意义__________。
(3)图2中表示乙物质溶解度曲线的是_______(填“M”或“N”)
19.下图为A、B两种固体物质的溶解度曲线。
(1)溶解度随温度升高而增大的是______物质,t1℃时A、B两物质的溶解度为_______g。
(2)使一定量接近饱和的A物质溶液变为饱和溶液采用的一种方法是_____________________________。
(3)t1℃时,将一定量B的饱和溶液升温至t2℃,溶液的质量将_________(填“增加”、“减少”或“不变”)。
(4)t2℃时,分别用50gA、B制成饱和溶液,需要水的质量A_____B(填“<”“>”或“=”)
三、实验题
20.欲配制50g质量分数为5%的NaCl溶液,下图是某同学配制溶液的操作过程。
(1)A中盛放溶液的仪器名称:___________。配制的操作示意图如上图,该实验的正确操作顺序为___________。(填字母序号)
(2)经检测,所配制溶液的溶质质量分数偏小,其原因可能是___________ (填序号)。
①氯化钠固体不纯 ②称量时,砝码端忘垫质量相同的纸片
③量取水时,仰视读数 ④装瓶时,有少量溶液洒出。
(3)水的密度为1.0g/mL。实验室配制50g溶质质量分数为5%的氯化钠溶液,需要量取水___________mL。
21.某同学配制50g6%氯化钠溶液,整个操作过程如下图所示,回答下列问题:
(1)配制溶液的正确操作顺序为 _____ (填序号,下同),其中操作错误的是 _____ 。
(2)图②中盛放氯化钠固体的仪器名称是 _____ ,需称取氯化钠 _____ g.
(3)量水时选用的量筒的量程最合适的是 _____ (填序号),读数时视线要与量筒内 _____ 保持水平。
A 10mL B 25mL C 50mL D 100mL
(4)经检测,该同学配制的溶液溶质质量分数偏小,可能的原因是 _____ (填序号)。
A 氯化钠固体不纯 B 用生锈砝码称量 C 装瓶时有少量溶液洒出 D 溶解时烧杯内壁有水珠
四、计算题
22.某化学小组的进行硫酸铜溶液和氢氧化钠溶液相混合的实验[反应原理为: CuSO4+2NaOH=Cu(OH)2↓+ Na2SO4]。实验过程及数据如下图所示:
(1)若操作过程中损失水的质量为 3.1g,其它物质的质量损失忽略不计,则 a 的值为____。
(2)计算氢氧化钠溶液中溶质的质量分数为多少?
23.现有溶质质量分数为 4%的硝酸钾溶液 40g,要使溶质质量分数达到 16%,则可以通过下列途径实现,请填空
(1)若蒸发水,应蒸发水的质量为 g;
(2)若加入质量分数为 32%的硝酸钾溶液,应加入溶液的质量为 g。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.C
3.A
4.C
5.A
6.D
7.D
8.A
9.D
10.D
11.D
12.D
13.C
14.D
15.D
16. (1) 增加溶质 (2) 蒸发溶剂
17. (1) 7.5 42.5 (2) 往左盘中继续添加氯化钠固体 30
18. (1) 甲 30℃时,M、N的溶解度相同 (2) N
19.(1)A 25 (2)降低温度(增加A物质或蒸发溶剂) (3)减少 (4)<
20.(1) 烧杯 CBDEA (2) ①②③ 47.5
21. (1) ②①⑤③④ ① (2)广口瓶 3 C (3) 凹液面最低处 AD
22.(1)142g;(2)8%
23.(1)30;(2)30
答案第1页,共2页
答案第1页,共2页
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 水分子的变化
- 第三节 原子的构成
- 第四节 元素
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 溶液
- 第一节 溶液的形成
- 第二节 溶液组成的定量表示
- 到实验室去:配制一定溶质质量分数的溶液
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 物质组成的表示
- 第三节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去:二氧化碳的实验室制取与性质
