2022-2023学年九年级化学人教版下册 9.2 溶解度 第1课时 课件(共18张PPT 内嵌视频)
文档属性
| 名称 | 2022-2023学年九年级化学人教版下册 9.2 溶解度 第1课时 课件(共18张PPT 内嵌视频) |  | |
| 格式 | zip | ||
| 文件大小 | 33.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-24 14:29:52 | ||
图片预览





文档简介
(共18张PPT)
课题2 溶解度
U9 溶液
1.掌握饱和溶液、不饱和溶液的含义及相互转化的方法。
2.能举例说明结晶现象。掌握常用的两种结晶方法(降温结晶、蒸发结晶),认识海水晒盐的原理。
3. 掌握溶解度的含义和影响因素(固体、气体)。
4.掌握溶解度曲线的含义(点、面、变化趋势等)。
5.掌握溶解度曲线的应用。
6.了解气体溶解度概念及影响因素。
1.饱和溶液
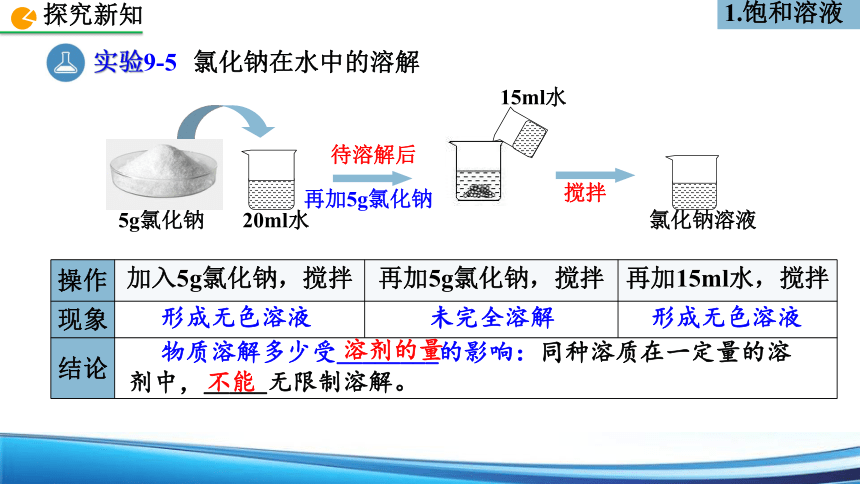
实验9-5
氯化钠在水中的溶解
5g氯化钠
20ml水
再加5g氯化钠
待溶解后
氯化钠溶液
15ml水
搅拌
操作 加入5g氯化钠,搅拌 再加5g氯化钠,搅拌 再加15ml水,搅拌
现象
结论
形成无色溶液
未完全溶解
物质溶解多少受________的影响:同种溶质在一定量的溶剂中,_____无限制溶解。
形成无色溶液
溶剂的量
不能
1.饱和溶液
①一定温度下,硝酸钾不能无限制的溶解在一定量的水中。
总结:
②改变条件会使溶质继续溶解或析出。
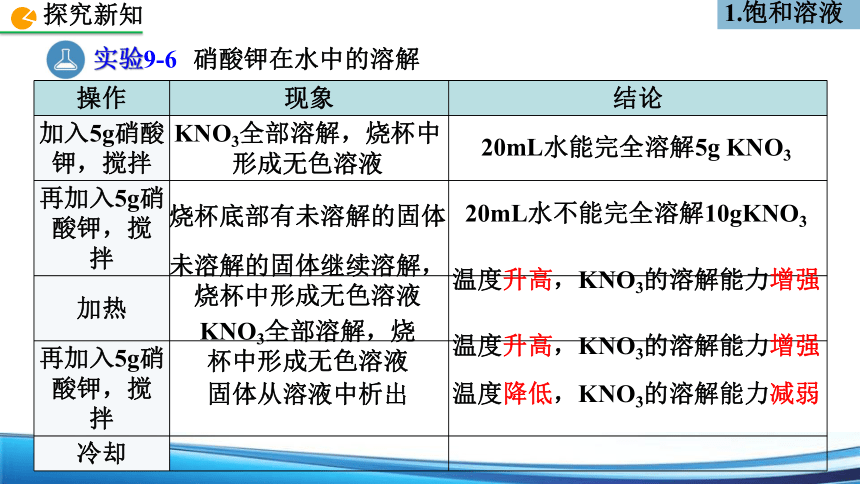
实验9-6
硝酸钾在水中的溶解
当温度不变时,溶解溶质的多少与溶剂的量有关;
当溶剂的量不变时,溶解溶质的多少与温度有关。
1.饱和溶液
实验9-6
硝酸钾在水中的溶解
操作 现象 结论
加入5g硝酸钾,搅拌
再加入5g硝酸钾,搅拌
加热
再加入5g硝酸钾,搅拌
冷却
KNO3全部溶解,烧杯中形成无色溶液
20mL水不能完全溶解10gKNO3
烧杯底部有未溶解的固体
20mL水能完全溶解5g KNO3
未溶解的固体继续溶解,
烧杯中形成无色溶液
温度升高,KNO3的溶解能力增强
KNO3全部溶解,烧
杯中形成无色溶液
温度升高,KNO3的溶解能力增强
固体从溶液中析出
温度降低,KNO3的溶解能力减弱
1.饱和溶液
在一定温度下,向一定量溶剂里加入某种溶质,当溶质不能继续溶解时,所得的溶液叫做这种溶质的饱和溶液。
饱和溶液
不饱和溶液
在一定温度下,向一定量溶剂里加入某种溶质,还能继续溶解的溶液叫做这种溶质的不饱和溶液。
如:在一定条件下的NaCl的饱和溶液,不能再溶解NaCl,但是还能溶解蔗糖。对NaCl来说饱和,对蔗糖来说不饱和。
注意:
1.必须指明“一定温度”、“一定量的溶剂”;
2.应明确“某溶质”的饱和溶液或不饱和溶液;
当温度、溶剂的量确定时,某溶液的饱和状态表示溶质溶解的最大值。
1.饱和溶液
在饱和溶液和不饱和溶液的概念中,为什么要限定“一定温度下”、“一定量的溶剂里”这样的条件?
讨论:
在增加溶剂或升高温度的情况下,原来的饱和溶液可以变成不饱和溶液;在降低温度等情况下,不饱和溶液可以变成饱和溶液;
因此,只有指明“一定温度下”和“一定量的溶剂”,溶液的“饱和”和“不饱和”才有确定的意义。
①只有指明“在一定量溶剂里”和“在一定温度下”,溶液的“饱和”和“不饱和”才有意义。
②“饱和”和“不饱和”是针对“某种溶质”而言。
③一定温度下,大多数物质在一定量的溶剂中都能形成其饱和溶液,但酒精能与水以任意比例互溶,所以不能配制成酒精的饱和溶液。
总结:
3.如何判断溶液是否饱和?
思考:
总结:
“1看2加”
①观察溶液底部是否有_____________。
②若溶液底部没有未溶解的溶质,可以向该溶液中加入少量_________,若______________,则该溶液是饱和溶液。
未溶解的溶质
同种溶质
溶质不再溶解
1.饱和溶液
1.饱和溶液变成不饱和溶液有哪些方法?(课后习题P40T1、6、7)
2.不饱和溶液变成饱和溶液有哪些方法?
增加溶剂;升高温度
降低温度;增加溶质;蒸发溶剂
Pg38 Ca(OH)2溶液例外
不饱和溶液和饱和溶液相互转化
1.饱和溶液
Pg38 Ca(OH)2溶液例外
(一般情况下)
不饱和溶液 饱和溶液
增加溶质、蒸发溶剂或降低温度
增加溶剂或升高温度
1.实验9-5与实验9-6中哪些是饱和溶液,哪些是不饱和溶液?
思考:
熟石灰Ca(OH)2在一定量水中溶解的最大量随温度升高而减小。
1.饱和溶液
实验9-5
氯化钠在水中的溶解
5g氯化钠
20ml水
再加5g氯化钠
待溶解后
氯化钠溶液
15ml水
搅拌
操作 加入5g氯化钠,搅拌 再加5g氯化钠,搅拌 再加15ml水,搅拌
现象
结论
形成无色溶液
未完全溶解
物质溶解受________的影响:同种溶质在一定量的溶剂中,_____无限制溶解。
形成无色溶液
溶剂的量
不能
是否饱和
x
√
无法确定
1.饱和溶液
实验9-6
硝酸钾在水中的溶解
操作 现象 结论
加入5g硝酸钾,搅拌
再加入5g硝酸钾,搅拌
加热
再加入5g硝酸钾,搅拌
冷却
KNO3全部溶解,烧杯中形成无色溶液
20mL水不能完全溶解10gKNO3
烧杯底部有未溶解的固体
20mL水能完全溶解5g KNO3
未溶解的固体继续溶解,
烧杯中形成无色溶液
温度升高,KNO3的溶解能力增强
KNO3全部溶解,烧
杯中形成无色溶液
温度升高,KNO3的溶解能力增强
固体从溶液中析出
温度降低,KNO3的溶解能力减弱
是否饱和
x
√
无法确定
√
x
1.饱和溶液
饱和溶液、不饱和溶液与浓溶液、稀溶液
相同溶质、相同温度
不同溶质
饱和溶液一定比不饱和溶液浓
稀溶液不一定是不饱和溶液
浓溶液不一定是饱和溶液
思考:
判断正误,说明理由。
1.饱和溶液一定比不饱和溶液浓?
2.浓溶液一定是饱和溶液?
x
x
2.下列关于饱和溶液的说法正确的是( )
A.在一定温度下,向KNO3饱和溶液中加KNO3晶体,溶液质量增大
B.饱和溶液是指在任何条件下都不能再溶解同种溶质的溶液
C.在一定温度下,饱和的氯化钠溶液中不能再溶解蔗糖
D.改变条件,可以使KNO3的不饱和溶液变成饱和溶液
D
1.将一瓶接近饱和的硝酸钾溶液变成饱和溶液,下列方法错误的是( )
A.降低温度 B.加入硝酸钾固体
C.恒温蒸发水分 D.升高温度
D
思考:
如何除去粗盐中的泥沙?
1.饱和溶液
溶液中的溶质以____的形式析出的过程叫做结晶。
结晶方法有_________和________
蒸发结晶
降温结晶
降温结晶/冷却热饱和溶液
析出晶体后的溶液叫做母液,母液是_____溶液。
晶体
结晶:
饱和
饱和溶液 结晶
蒸发结晶
降温结晶
1.饱和溶液
思考:
1.如何除去NaCl中的泥沙?
2.海水晒盐运用了哪种结晶方法?
溶解
蒸发结晶
过滤
蒸发结晶
海水晒盐
海水
贮水池
蒸发池
结晶池
多种化工产品
氯化钠
母液
粗盐
将泥沙沉降
利用风吹日晒
使水分蒸发
苦卤,氯化钠的饱和溶液
1.下列有关结晶的说法正确的是( )
A.饱和溶液降低温度一定会析出晶体
B.只有蒸发溶剂才会出现结晶现象
C.腌菜晾晒时表面出现很多小晶体,是因为发生了化学变化
D.析出晶体后的溶液一定是该物质的饱和溶液
D
易错:
A.一定量的溶剂中,大部分物质的溶解能力随温度升高而增强,但也有少数物质的溶解能力随温度升高而降低,如氢氧化钙
1.饱和溶液与不饱和溶液
(1)饱和溶液:
(2)不饱和溶液:
5.结晶:
4.转化:
不饱和
增加溶剂、改变温度
饱和溶液
增加溶质、改变温度、蒸发溶剂
饱和溶液
降温结晶(冷却热饱和溶液)
蒸发结晶
结晶
(“一定温度”、“一定量溶剂”、“某溶质”。)
2.饱和溶液的判断:“1看2加”
3.饱和溶液≠_______,不饱和溶液≠________
浓溶液
稀溶液
课题2 溶解度
U9 溶液
1.掌握饱和溶液、不饱和溶液的含义及相互转化的方法。
2.能举例说明结晶现象。掌握常用的两种结晶方法(降温结晶、蒸发结晶),认识海水晒盐的原理。
3. 掌握溶解度的含义和影响因素(固体、气体)。
4.掌握溶解度曲线的含义(点、面、变化趋势等)。
5.掌握溶解度曲线的应用。
6.了解气体溶解度概念及影响因素。
1.饱和溶液
实验9-5
氯化钠在水中的溶解
5g氯化钠
20ml水
再加5g氯化钠
待溶解后
氯化钠溶液
15ml水
搅拌
操作 加入5g氯化钠,搅拌 再加5g氯化钠,搅拌 再加15ml水,搅拌
现象
结论
形成无色溶液
未完全溶解
物质溶解多少受________的影响:同种溶质在一定量的溶剂中,_____无限制溶解。
形成无色溶液
溶剂的量
不能
1.饱和溶液
①一定温度下,硝酸钾不能无限制的溶解在一定量的水中。
总结:
②改变条件会使溶质继续溶解或析出。
实验9-6
硝酸钾在水中的溶解
当温度不变时,溶解溶质的多少与溶剂的量有关;
当溶剂的量不变时,溶解溶质的多少与温度有关。
1.饱和溶液
实验9-6
硝酸钾在水中的溶解
操作 现象 结论
加入5g硝酸钾,搅拌
再加入5g硝酸钾,搅拌
加热
再加入5g硝酸钾,搅拌
冷却
KNO3全部溶解,烧杯中形成无色溶液
20mL水不能完全溶解10gKNO3
烧杯底部有未溶解的固体
20mL水能完全溶解5g KNO3
未溶解的固体继续溶解,
烧杯中形成无色溶液
温度升高,KNO3的溶解能力增强
KNO3全部溶解,烧
杯中形成无色溶液
温度升高,KNO3的溶解能力增强
固体从溶液中析出
温度降低,KNO3的溶解能力减弱
1.饱和溶液
在一定温度下,向一定量溶剂里加入某种溶质,当溶质不能继续溶解时,所得的溶液叫做这种溶质的饱和溶液。
饱和溶液
不饱和溶液
在一定温度下,向一定量溶剂里加入某种溶质,还能继续溶解的溶液叫做这种溶质的不饱和溶液。
如:在一定条件下的NaCl的饱和溶液,不能再溶解NaCl,但是还能溶解蔗糖。对NaCl来说饱和,对蔗糖来说不饱和。
注意:
1.必须指明“一定温度”、“一定量的溶剂”;
2.应明确“某溶质”的饱和溶液或不饱和溶液;
当温度、溶剂的量确定时,某溶液的饱和状态表示溶质溶解的最大值。
1.饱和溶液
在饱和溶液和不饱和溶液的概念中,为什么要限定“一定温度下”、“一定量的溶剂里”这样的条件?
讨论:
在增加溶剂或升高温度的情况下,原来的饱和溶液可以变成不饱和溶液;在降低温度等情况下,不饱和溶液可以变成饱和溶液;
因此,只有指明“一定温度下”和“一定量的溶剂”,溶液的“饱和”和“不饱和”才有确定的意义。
①只有指明“在一定量溶剂里”和“在一定温度下”,溶液的“饱和”和“不饱和”才有意义。
②“饱和”和“不饱和”是针对“某种溶质”而言。
③一定温度下,大多数物质在一定量的溶剂中都能形成其饱和溶液,但酒精能与水以任意比例互溶,所以不能配制成酒精的饱和溶液。
总结:
3.如何判断溶液是否饱和?
思考:
总结:
“1看2加”
①观察溶液底部是否有_____________。
②若溶液底部没有未溶解的溶质,可以向该溶液中加入少量_________,若______________,则该溶液是饱和溶液。
未溶解的溶质
同种溶质
溶质不再溶解
1.饱和溶液
1.饱和溶液变成不饱和溶液有哪些方法?(课后习题P40T1、6、7)
2.不饱和溶液变成饱和溶液有哪些方法?
增加溶剂;升高温度
降低温度;增加溶质;蒸发溶剂
Pg38 Ca(OH)2溶液例外
不饱和溶液和饱和溶液相互转化
1.饱和溶液
Pg38 Ca(OH)2溶液例外
(一般情况下)
不饱和溶液 饱和溶液
增加溶质、蒸发溶剂或降低温度
增加溶剂或升高温度
1.实验9-5与实验9-6中哪些是饱和溶液,哪些是不饱和溶液?
思考:
熟石灰Ca(OH)2在一定量水中溶解的最大量随温度升高而减小。
1.饱和溶液
实验9-5
氯化钠在水中的溶解
5g氯化钠
20ml水
再加5g氯化钠
待溶解后
氯化钠溶液
15ml水
搅拌
操作 加入5g氯化钠,搅拌 再加5g氯化钠,搅拌 再加15ml水,搅拌
现象
结论
形成无色溶液
未完全溶解
物质溶解受________的影响:同种溶质在一定量的溶剂中,_____无限制溶解。
形成无色溶液
溶剂的量
不能
是否饱和
x
√
无法确定
1.饱和溶液
实验9-6
硝酸钾在水中的溶解
操作 现象 结论
加入5g硝酸钾,搅拌
再加入5g硝酸钾,搅拌
加热
再加入5g硝酸钾,搅拌
冷却
KNO3全部溶解,烧杯中形成无色溶液
20mL水不能完全溶解10gKNO3
烧杯底部有未溶解的固体
20mL水能完全溶解5g KNO3
未溶解的固体继续溶解,
烧杯中形成无色溶液
温度升高,KNO3的溶解能力增强
KNO3全部溶解,烧
杯中形成无色溶液
温度升高,KNO3的溶解能力增强
固体从溶液中析出
温度降低,KNO3的溶解能力减弱
是否饱和
x
√
无法确定
√
x
1.饱和溶液
饱和溶液、不饱和溶液与浓溶液、稀溶液
相同溶质、相同温度
不同溶质
饱和溶液一定比不饱和溶液浓
稀溶液不一定是不饱和溶液
浓溶液不一定是饱和溶液
思考:
判断正误,说明理由。
1.饱和溶液一定比不饱和溶液浓?
2.浓溶液一定是饱和溶液?
x
x
2.下列关于饱和溶液的说法正确的是( )
A.在一定温度下,向KNO3饱和溶液中加KNO3晶体,溶液质量增大
B.饱和溶液是指在任何条件下都不能再溶解同种溶质的溶液
C.在一定温度下,饱和的氯化钠溶液中不能再溶解蔗糖
D.改变条件,可以使KNO3的不饱和溶液变成饱和溶液
D
1.将一瓶接近饱和的硝酸钾溶液变成饱和溶液,下列方法错误的是( )
A.降低温度 B.加入硝酸钾固体
C.恒温蒸发水分 D.升高温度
D
思考:
如何除去粗盐中的泥沙?
1.饱和溶液
溶液中的溶质以____的形式析出的过程叫做结晶。
结晶方法有_________和________
蒸发结晶
降温结晶
降温结晶/冷却热饱和溶液
析出晶体后的溶液叫做母液,母液是_____溶液。
晶体
结晶:
饱和
饱和溶液 结晶
蒸发结晶
降温结晶
1.饱和溶液
思考:
1.如何除去NaCl中的泥沙?
2.海水晒盐运用了哪种结晶方法?
溶解
蒸发结晶
过滤
蒸发结晶
海水晒盐
海水
贮水池
蒸发池
结晶池
多种化工产品
氯化钠
母液
粗盐
将泥沙沉降
利用风吹日晒
使水分蒸发
苦卤,氯化钠的饱和溶液
1.下列有关结晶的说法正确的是( )
A.饱和溶液降低温度一定会析出晶体
B.只有蒸发溶剂才会出现结晶现象
C.腌菜晾晒时表面出现很多小晶体,是因为发生了化学变化
D.析出晶体后的溶液一定是该物质的饱和溶液
D
易错:
A.一定量的溶剂中,大部分物质的溶解能力随温度升高而增强,但也有少数物质的溶解能力随温度升高而降低,如氢氧化钙
1.饱和溶液与不饱和溶液
(1)饱和溶液:
(2)不饱和溶液:
5.结晶:
4.转化:
不饱和
增加溶剂、改变温度
饱和溶液
增加溶质、改变温度、蒸发溶剂
饱和溶液
降温结晶(冷却热饱和溶液)
蒸发结晶
结晶
(“一定温度”、“一定量溶剂”、“某溶质”。)
2.饱和溶液的判断:“1看2加”
3.饱和溶液≠_______,不饱和溶液≠________
浓溶液
稀溶液
同课章节目录
