化学人教版(2019)必修第一册4.3.3分子间作用力 氢键 (共31张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册4.3.3分子间作用力 氢键 (共31张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-26 15:30:07 | ||
图片预览









文档简介
(共31张PPT)
1.下列物质中既含有离子键又含有共价键的是( )
A.CO2 B.KOH
C.MgCl2 D.Na2O
2.下列分子中,所有原子最外层都满足8电子结构的是( )
A、NO2 B、BF3 C、SF6 D、CO2 E、PCl3 F、PCl5 G、 NaOH
DE
3.判断正误(正确的打“√”,错误的打“×”)。
1.分子内共价键越强,分子越稳定,其熔、沸点也越高。 ( )
2.全部由非金属元素形成的化合物一定是共价化合物。 ( )
3.某些金属与非金属原子间能形成共价键。 ( )
4.某元素的原子最外层只有一个电子,它跟卤素原子结合时,所形成的化学键一定是离子键。 ( )
5.在水溶液中能导电的化合物一定是离子化合物。 ( )
6.共价化合物溶于水,分子内共价键被破坏;单质溶于水,分子内共价键不被破坏。 ( )
7.NaHCO3、HCOONa均含有离子键和共价键。 ( )
8.分子内部一定含有共价键。 ( )
9.两个原子或多个原子之间的相互作用叫做化学键 ( )
10.非极性键只存在单质分子中 ( )
11.离子化合物中可能含有共价键,共价化合物中无离子键( )
×
×
×
×
×
√
√
×
×
×
√
4.北京大学和中国科学院的化学工作者已成功研制出碱金属与C60形成的球碳盐K3C60,实验测知该物质属于离子化合物,具有良好的超导性。下列有关分析正确的是( )A.K3C60中只有离子键B.K3C60中不含共价键C.该晶体在熔融状态下能导电D.C60与12C互为同素异形体
B
5.下列有关物质结构的说法正确的是( )
A.78 g Na2O2晶体中所含阴、阳离子个数均为2NA
B.3.4 g氨气中含有0.6NA个N—H键
C.0.1 mol CCl4中含有Cl-Cl键0.2 NA
D. 在氢气与氧气的反应中,每断开1 mol H-H 键,形成4 mol H-O键
B
第四章 物质结构 元素周期律
第三节 化学键
第3课时 分子间作用力 氢键
1.在100℃、101 kPa时,将1 mol H2O(l)变成1 mol H2O(g)需吸收能量47.3 kJ。
H2O(l) H2O(g)
能量
1mol H2O
H + H
O
断裂2mol H-O键,需要436KJ能量
想一想:以上两种变化分别是物理变化,还是化学变化?
所消耗的能量差距为什么这么大呢?
2.将水分子分解为氢气和氧气需2000℃以上的高温,将1 mol H2O拆分为2 mol H和1 mol O需吸收能量436 kJ。
(思考)
物理变化
化学变化
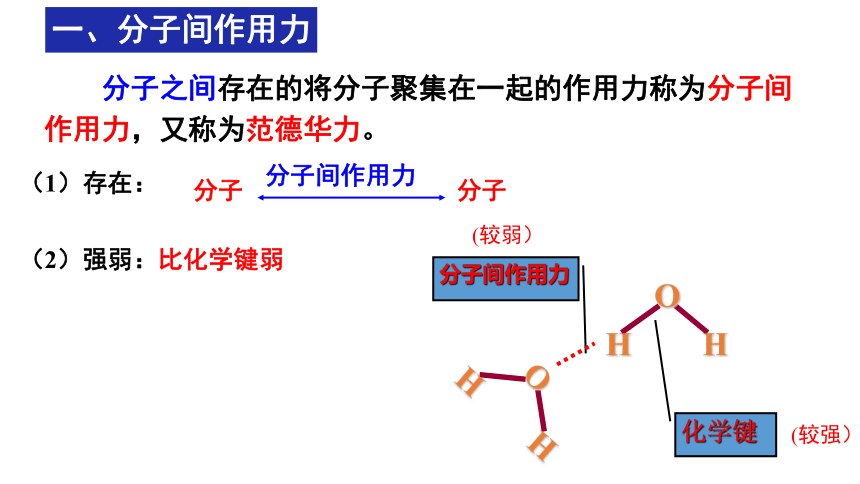
一、分子间作用力
分子之间存在的将分子聚集在一起的作用力称为分子间作用力,又称为范德华力。
(1)存在:
分子 分子
分子间作用力
O
H
H
O
H
H
分子间作用力
化学键
(2)强弱:比化学键弱
(较弱)
(较强)
作用微粒 作用力强弱 大小范围
化学键
分子间作用力(范德华力)
原子或离子之间
分子之间
微弱作用
分子间作用力与化学键的比较
强烈作用
约125--836KJ/mol
约2--20KJ/mol
2.干冰受热汽化转化为二氧化碳气体,而二氧化碳气体在加热条件下却不易被分解。这是为什么
1.为什么NaCl在熔化状态或水溶液中具有导电性,而液态氯化氢却不具有导电性
前者熔化或溶于水破坏了离子键,形成可自由移动的阴阳离子
后者原子间以共价键结合,分子间存在分子间作用力
物质变化时,没有克服化学键的是( )
A、 H2O电解 B 、I2升华
C、烧碱熔化 D、 NaCl溶于水
E、HCl溶于水 F、蔗糖溶于水
G、冰融化
离子键、共价键、分子间作用力都是微粒间的作用力。下列物质中,只存在一种作用力的是 ( )
A.干冰 B.NaCl C.NaOH
D.I2 E.H2SO4 F.Ar
B、F
B、F、G
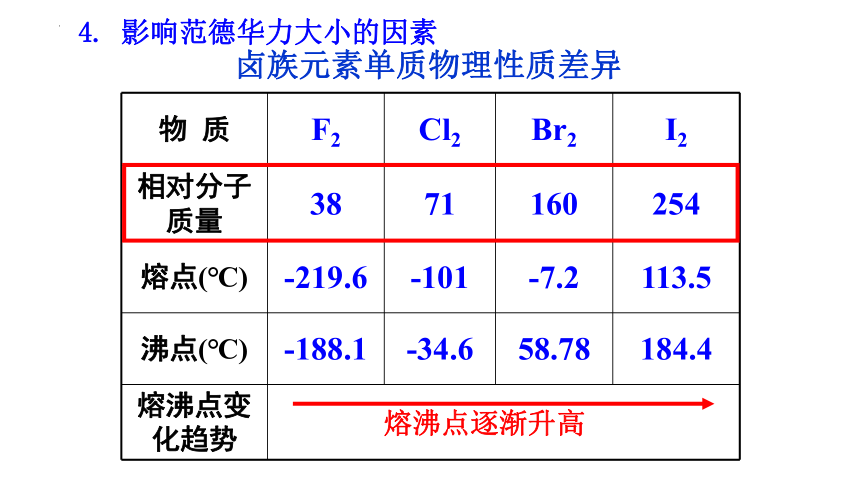
物 质 F2 Cl2 Br2 I2
相对分子质量 38 71 160 254
熔点(℃) -219.6 -101 -7.2 113.5
沸点(℃) -188.1 -34.6 58.78 184.4
熔沸点变化趋势
卤族元素单质物理性质差异
熔沸点逐渐升高
4. 影响范德华力大小的因素
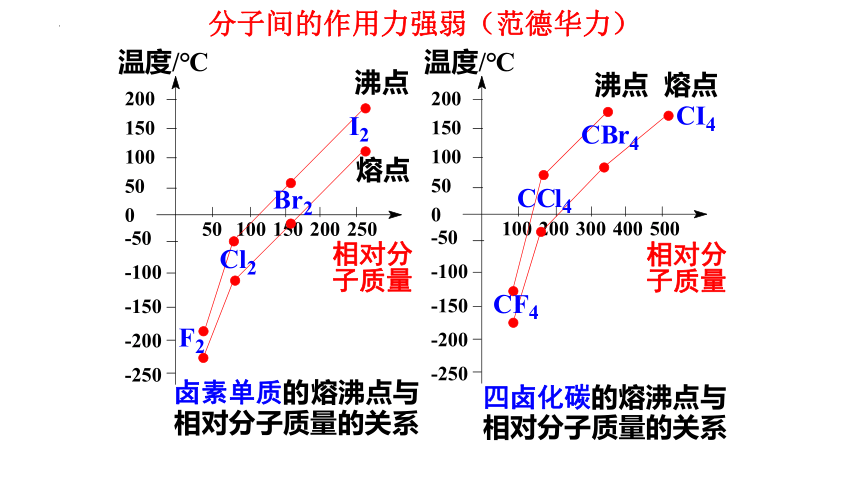
分子间的作用力强弱(范德华力)
结 论
组成和结构相似的物质
相对分子质量越大
分子间作用力越大
物质熔沸点越高
分子间的作用力强弱(范德华力)
比较下列物质的熔沸点的高低
CH4_ CF4 _ CCl4 _ CBr4 _ CI4
H2O_ H2S _ H2Se _ H2Te
HF_HCl_HBr _HI
<
<
<
<
<
<
<
<
<
<
联系生活实际 你能发现什么矛盾吗
水的物理性质特殊:熔沸点高,水的比热容较大,水结成冰后密度变小… …
结论:说明H2O分子间存在着一种________,这种作用比化学键弱,但比范德华力强,是一种:
特殊的分子间作用力——氢键
特殊作用
水分子间的氢键,是一个水分子中的氢原子与另一个水分子中的氧原子间所形成的分子间作用力。
二、氢键
氢键:化合物分子通过它的氢原子与另一分子中吸引电子能力较强的原子间所产生的相互作用,称为氢键。
1个水分子最多形成几个氢键?1个HF分子最多形成几个氢键?
H2O HF
1mol 水分子最多形成几mol 氢键?1mol HF分子呢?
含H的化合物分子之间都有氢键吗?
-150
-125
-100
-75
-50
-25
0
25
50
75
100
2
3
4
5
×
×
×
×
CH4
SiH4
GeH4
SnH4
NH3
PH3
AsH3
SbH3
HF
HCl
HBr
HI
H2O
H2S
H2Se
H2Te
沸点/℃
周期
一些氢化物的沸点
CH4 SiH4 GeH4 SnH4
NH3 PH3 AsH3 SbH3
H2O H2S H2Se H2Te
HF HCl HBr HI
沸点如何变化?
氢键→沸点较高
二、氢键
氢键:化合物分子通过它的氢原子与另一分子中吸引电子能力较强的原子间,所产生的相互作用,称为氢键。
1、表示方法:
X—H…Y
实线:共价键
虚线:氢键
X、Y可以相同,也可以不同(主要F、O、N)
2、氢键的形成条件
(1)分子中必须要带孤电子对、原子半径小且吸引电子能力很强的非金属元素(F、O、N)
(2)分子中必须有一个与吸引电子能力很强的非金属元素形成共价键的氢原子
3、氢键对物质性质的影响
⑴使熔沸点相对较高(如HF、H2O、NH3)
(3)解释一些反常现象:
如水结成冰时,氢键使水分子之间存在空隙,体积会膨胀。
(2)使某些物质在水中的溶解度增 大(如NH3溶于水)
——物理性质
(1)冰熔化或汽化时__________被破坏,分子____变化,属____变化;
(4)干冰升华时___________被破坏,属于_____变化
(5)食盐融化时_______被破坏,属于_____变化
(6) 金刚石融化时_______被破坏,属于_____变化
(3)碘化氢分解时_______被破坏,属于_____变化
(2)水分解时_______被破坏,分子_____变化,属于_____变化;
氢键和分子
间作用力
没有
物理
共价键
发生
化学
共价键
化学
分子间作用力
物理
离子键
物理
共价键
物理
分子直接构成的物质:
物理性质→
化学性质→
原子直接构成的物质:
物理性质→共价键
化学性质→共价键
离子化合物:
物理性质→离子键
化学性质→离子键
分子间作用力
共价键
分子间作用力、氢键与化学键的比较
存在 强弱 强弱因素 影响性质
共价键
离子键
范德华力
氢键 _____________
原子间
分子间
离子间
某些分子间
强烈
强烈
远小于化学键
略大于范德华力
微弱
原子半径
离子半径
带电荷数
相对分子质量
化学性质或物理性质
只物理
性质
1、下列说法正确的是 ( )
A.水很稳定是由于水分子间存在氢键
B.NaOH融化时离子键和共价键发生断裂
C.碳酸钙分解时发生了化学键的断裂和形成
D.冰融化时要吸热,所以共价键断裂
E.任何分子中都含有共价键
F.分子间作用力越大熔化或气化时所需的能量就越多,其化学性质也越稳定
C
2.下列事实与氢键有关的是 ( )
A.水加热到很高的温度都难以分解
B.水结成冰体积膨胀,密度变小
C.CH4、SiH4、GeH4 、 SnH4的熔点随相对分子质量的增大而升高
D.HF、HCl、HBr、HI的热稳定性依次减弱
B
3.下列过程中,共价键被破坏的是( )
A.碘升华
B.溴蒸气被木炭吸附
C.蔗糖溶于水
D.氯化氢气体溶于水
E.烧碱溶于水
D
4下列关于氢键的说法中正确的是( )
A. 每个水分子内含有两个氢键
B. 在所有的水蒸气、水、冰中都含有氢键
C. 分子间能形成氢键,使物质的熔沸点升高
D. HF稳定性很强,是因为其分子间能形成氢键
C
例5、氢原子能与许多元素化合形成化合物。下图中,●代表原子序数在1到10之间的原子实(原子实是原子除去价电子后剩余的部分),小黑点“·”代表未成键价电子,短线代表一个化学键(如H2O表示为
●
●
●
●
①写出A、B两种分子的结构式并推测A的立体结构。
A
B
H—N—H
—
H
A、
三角锥形
B、
H—C—H
=
O
●
●
●
●
A
B
②C、D与A具有相似的分子结构,且A、C、D三种分子的中心原子属于同族非金属,试推测由A、C、D构成的三种纯净物中沸点最高的是哪一种?为什么?
A最高
A分子之间存在氢键,C、D分子间不存在氢键
氢原子能与许多元素化合形成化合物。下图中,●代表原子序数在1到10之间的原子实(原子实是原子除去价电子后剩余的部分),小黑点“·”代表未成键价电子,短线代表一个化学键(如H2O表示为
原子
分子
离子
宏观
物质
或范德华力
得失电子
范德华力
氢键
共价键
金属键或共价键
离子键
离子晶体
分子晶体
原子晶体
金属晶体
小结:
有几种形成方式?
形成氢键条件:
①分子中有H原子
②分子中含X-H,X(指N、O、F)元素
③表示方式 X-H…Y(XY代表NOF中的一种,可以相同也可以不同)
四、氢键
7.(2019福建三明第一中学开学考试)下列过程中化学键被破坏的是( )
①碘升华 ②溴蒸气被木炭吸附 ③酒精溶于水
④HCl气体溶于水 ⑤MgCl2溶解于水 ⑥NaCl熔化
A.全部 B.只有②③④⑤⑥
C.只有④⑤⑥ D.只有⑤⑥
C
D
1.下列物质中既含有离子键又含有共价键的是( )
A.CO2 B.KOH
C.MgCl2 D.Na2O
2.下列分子中,所有原子最外层都满足8电子结构的是( )
A、NO2 B、BF3 C、SF6 D、CO2 E、PCl3 F、PCl5 G、 NaOH
DE
3.判断正误(正确的打“√”,错误的打“×”)。
1.分子内共价键越强,分子越稳定,其熔、沸点也越高。 ( )
2.全部由非金属元素形成的化合物一定是共价化合物。 ( )
3.某些金属与非金属原子间能形成共价键。 ( )
4.某元素的原子最外层只有一个电子,它跟卤素原子结合时,所形成的化学键一定是离子键。 ( )
5.在水溶液中能导电的化合物一定是离子化合物。 ( )
6.共价化合物溶于水,分子内共价键被破坏;单质溶于水,分子内共价键不被破坏。 ( )
7.NaHCO3、HCOONa均含有离子键和共价键。 ( )
8.分子内部一定含有共价键。 ( )
9.两个原子或多个原子之间的相互作用叫做化学键 ( )
10.非极性键只存在单质分子中 ( )
11.离子化合物中可能含有共价键,共价化合物中无离子键( )
×
×
×
×
×
√
√
×
×
×
√
4.北京大学和中国科学院的化学工作者已成功研制出碱金属与C60形成的球碳盐K3C60,实验测知该物质属于离子化合物,具有良好的超导性。下列有关分析正确的是( )A.K3C60中只有离子键B.K3C60中不含共价键C.该晶体在熔融状态下能导电D.C60与12C互为同素异形体
B
5.下列有关物质结构的说法正确的是( )
A.78 g Na2O2晶体中所含阴、阳离子个数均为2NA
B.3.4 g氨气中含有0.6NA个N—H键
C.0.1 mol CCl4中含有Cl-Cl键0.2 NA
D. 在氢气与氧气的反应中,每断开1 mol H-H 键,形成4 mol H-O键
B
第四章 物质结构 元素周期律
第三节 化学键
第3课时 分子间作用力 氢键
1.在100℃、101 kPa时,将1 mol H2O(l)变成1 mol H2O(g)需吸收能量47.3 kJ。
H2O(l) H2O(g)
能量
1mol H2O
H + H
O
断裂2mol H-O键,需要436KJ能量
想一想:以上两种变化分别是物理变化,还是化学变化?
所消耗的能量差距为什么这么大呢?
2.将水分子分解为氢气和氧气需2000℃以上的高温,将1 mol H2O拆分为2 mol H和1 mol O需吸收能量436 kJ。
(思考)
物理变化
化学变化
一、分子间作用力
分子之间存在的将分子聚集在一起的作用力称为分子间作用力,又称为范德华力。
(1)存在:
分子 分子
分子间作用力
O
H
H
O
H
H
分子间作用力
化学键
(2)强弱:比化学键弱
(较弱)
(较强)
作用微粒 作用力强弱 大小范围
化学键
分子间作用力(范德华力)
原子或离子之间
分子之间
微弱作用
分子间作用力与化学键的比较
强烈作用
约125--836KJ/mol
约2--20KJ/mol
2.干冰受热汽化转化为二氧化碳气体,而二氧化碳气体在加热条件下却不易被分解。这是为什么
1.为什么NaCl在熔化状态或水溶液中具有导电性,而液态氯化氢却不具有导电性
前者熔化或溶于水破坏了离子键,形成可自由移动的阴阳离子
后者原子间以共价键结合,分子间存在分子间作用力
物质变化时,没有克服化学键的是( )
A、 H2O电解 B 、I2升华
C、烧碱熔化 D、 NaCl溶于水
E、HCl溶于水 F、蔗糖溶于水
G、冰融化
离子键、共价键、分子间作用力都是微粒间的作用力。下列物质中,只存在一种作用力的是 ( )
A.干冰 B.NaCl C.NaOH
D.I2 E.H2SO4 F.Ar
B、F
B、F、G
物 质 F2 Cl2 Br2 I2
相对分子质量 38 71 160 254
熔点(℃) -219.6 -101 -7.2 113.5
沸点(℃) -188.1 -34.6 58.78 184.4
熔沸点变化趋势
卤族元素单质物理性质差异
熔沸点逐渐升高
4. 影响范德华力大小的因素
分子间的作用力强弱(范德华力)
结 论
组成和结构相似的物质
相对分子质量越大
分子间作用力越大
物质熔沸点越高
分子间的作用力强弱(范德华力)
比较下列物质的熔沸点的高低
CH4_ CF4 _ CCl4 _ CBr4 _ CI4
H2O_ H2S _ H2Se _ H2Te
HF_HCl_HBr _HI
<
<
<
<
<
<
<
<
<
<
联系生活实际 你能发现什么矛盾吗
水的物理性质特殊:熔沸点高,水的比热容较大,水结成冰后密度变小… …
结论:说明H2O分子间存在着一种________,这种作用比化学键弱,但比范德华力强,是一种:
特殊的分子间作用力——氢键
特殊作用
水分子间的氢键,是一个水分子中的氢原子与另一个水分子中的氧原子间所形成的分子间作用力。
二、氢键
氢键:化合物分子通过它的氢原子与另一分子中吸引电子能力较强的原子间所产生的相互作用,称为氢键。
1个水分子最多形成几个氢键?1个HF分子最多形成几个氢键?
H2O HF
1mol 水分子最多形成几mol 氢键?1mol HF分子呢?
含H的化合物分子之间都有氢键吗?
-150
-125
-100
-75
-50
-25
0
25
50
75
100
2
3
4
5
×
×
×
×
CH4
SiH4
GeH4
SnH4
NH3
PH3
AsH3
SbH3
HF
HCl
HBr
HI
H2O
H2S
H2Se
H2Te
沸点/℃
周期
一些氢化物的沸点
CH4 SiH4 GeH4 SnH4
NH3 PH3 AsH3 SbH3
H2O H2S H2Se H2Te
HF HCl HBr HI
沸点如何变化?
氢键→沸点较高
二、氢键
氢键:化合物分子通过它的氢原子与另一分子中吸引电子能力较强的原子间,所产生的相互作用,称为氢键。
1、表示方法:
X—H…Y
实线:共价键
虚线:氢键
X、Y可以相同,也可以不同(主要F、O、N)
2、氢键的形成条件
(1)分子中必须要带孤电子对、原子半径小且吸引电子能力很强的非金属元素(F、O、N)
(2)分子中必须有一个与吸引电子能力很强的非金属元素形成共价键的氢原子
3、氢键对物质性质的影响
⑴使熔沸点相对较高(如HF、H2O、NH3)
(3)解释一些反常现象:
如水结成冰时,氢键使水分子之间存在空隙,体积会膨胀。
(2)使某些物质在水中的溶解度增 大(如NH3溶于水)
——物理性质
(1)冰熔化或汽化时__________被破坏,分子____变化,属____变化;
(4)干冰升华时___________被破坏,属于_____变化
(5)食盐融化时_______被破坏,属于_____变化
(6) 金刚石融化时_______被破坏,属于_____变化
(3)碘化氢分解时_______被破坏,属于_____变化
(2)水分解时_______被破坏,分子_____变化,属于_____变化;
氢键和分子
间作用力
没有
物理
共价键
发生
化学
共价键
化学
分子间作用力
物理
离子键
物理
共价键
物理
分子直接构成的物质:
物理性质→
化学性质→
原子直接构成的物质:
物理性质→共价键
化学性质→共价键
离子化合物:
物理性质→离子键
化学性质→离子键
分子间作用力
共价键
分子间作用力、氢键与化学键的比较
存在 强弱 强弱因素 影响性质
共价键
离子键
范德华力
氢键 _____________
原子间
分子间
离子间
某些分子间
强烈
强烈
远小于化学键
略大于范德华力
微弱
原子半径
离子半径
带电荷数
相对分子质量
化学性质或物理性质
只物理
性质
1、下列说法正确的是 ( )
A.水很稳定是由于水分子间存在氢键
B.NaOH融化时离子键和共价键发生断裂
C.碳酸钙分解时发生了化学键的断裂和形成
D.冰融化时要吸热,所以共价键断裂
E.任何分子中都含有共价键
F.分子间作用力越大熔化或气化时所需的能量就越多,其化学性质也越稳定
C
2.下列事实与氢键有关的是 ( )
A.水加热到很高的温度都难以分解
B.水结成冰体积膨胀,密度变小
C.CH4、SiH4、GeH4 、 SnH4的熔点随相对分子质量的增大而升高
D.HF、HCl、HBr、HI的热稳定性依次减弱
B
3.下列过程中,共价键被破坏的是( )
A.碘升华
B.溴蒸气被木炭吸附
C.蔗糖溶于水
D.氯化氢气体溶于水
E.烧碱溶于水
D
4下列关于氢键的说法中正确的是( )
A. 每个水分子内含有两个氢键
B. 在所有的水蒸气、水、冰中都含有氢键
C. 分子间能形成氢键,使物质的熔沸点升高
D. HF稳定性很强,是因为其分子间能形成氢键
C
例5、氢原子能与许多元素化合形成化合物。下图中,●代表原子序数在1到10之间的原子实(原子实是原子除去价电子后剩余的部分),小黑点“·”代表未成键价电子,短线代表一个化学键(如H2O表示为
●
●
●
●
①写出A、B两种分子的结构式并推测A的立体结构。
A
B
H—N—H
—
H
A、
三角锥形
B、
H—C—H
=
O
●
●
●
●
A
B
②C、D与A具有相似的分子结构,且A、C、D三种分子的中心原子属于同族非金属,试推测由A、C、D构成的三种纯净物中沸点最高的是哪一种?为什么?
A最高
A分子之间存在氢键,C、D分子间不存在氢键
氢原子能与许多元素化合形成化合物。下图中,●代表原子序数在1到10之间的原子实(原子实是原子除去价电子后剩余的部分),小黑点“·”代表未成键价电子,短线代表一个化学键(如H2O表示为
原子
分子
离子
宏观
物质
或范德华力
得失电子
范德华力
氢键
共价键
金属键或共价键
离子键
离子晶体
分子晶体
原子晶体
金属晶体
小结:
有几种形成方式?
形成氢键条件:
①分子中有H原子
②分子中含X-H,X(指N、O、F)元素
③表示方式 X-H…Y(XY代表NOF中的一种,可以相同也可以不同)
四、氢键
7.(2019福建三明第一中学开学考试)下列过程中化学键被破坏的是( )
①碘升华 ②溴蒸气被木炭吸附 ③酒精溶于水
④HCl气体溶于水 ⑤MgCl2溶解于水 ⑥NaCl熔化
A.全部 B.只有②③④⑤⑥
C.只有④⑤⑥ D.只有⑤⑥
C
D
