人教版 九年级下册 化学 第八单元--金属和金属材料 单元检测 (含答案)
文档属性
| 名称 | 人教版 九年级下册 化学 第八单元--金属和金属材料 单元检测 (含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 172.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-25 13:02:35 | ||
图片预览



文档简介
2023年人教版化学中考冲刺复习第八单元--金属和金属材料
一、单选题
1.金属材料在生产,生活中使用广泛。下列金属的用途利用了金属导电性的是
A.铜制电线 B.铁质铁锅 C.金制项链 D.铝制饮料罐
2.下列措施中,不能防止金属制品锈蚀的是
A.在表面刷漆
B.改用不锈钢
C.在表面镀铬
D.用湿布擦拭
3.空气中含①N2 ②O2 ③稀有气体 ④水蒸气等成分,其中与钢铁生锈有关的是( )
A.①③ B.②④ C.③④ D.①④
4.港珠澳大桥的桥、岛、隧以及“雪龙2号”的船身等主要由金属材料制成。下列金属防护措施不正确的是
A.在金属制品表面镀保护层
B.改变金属结构制成合金使用
C.在金属制品表面涂油漆
D.用稀盐酸定期清洗金属制品
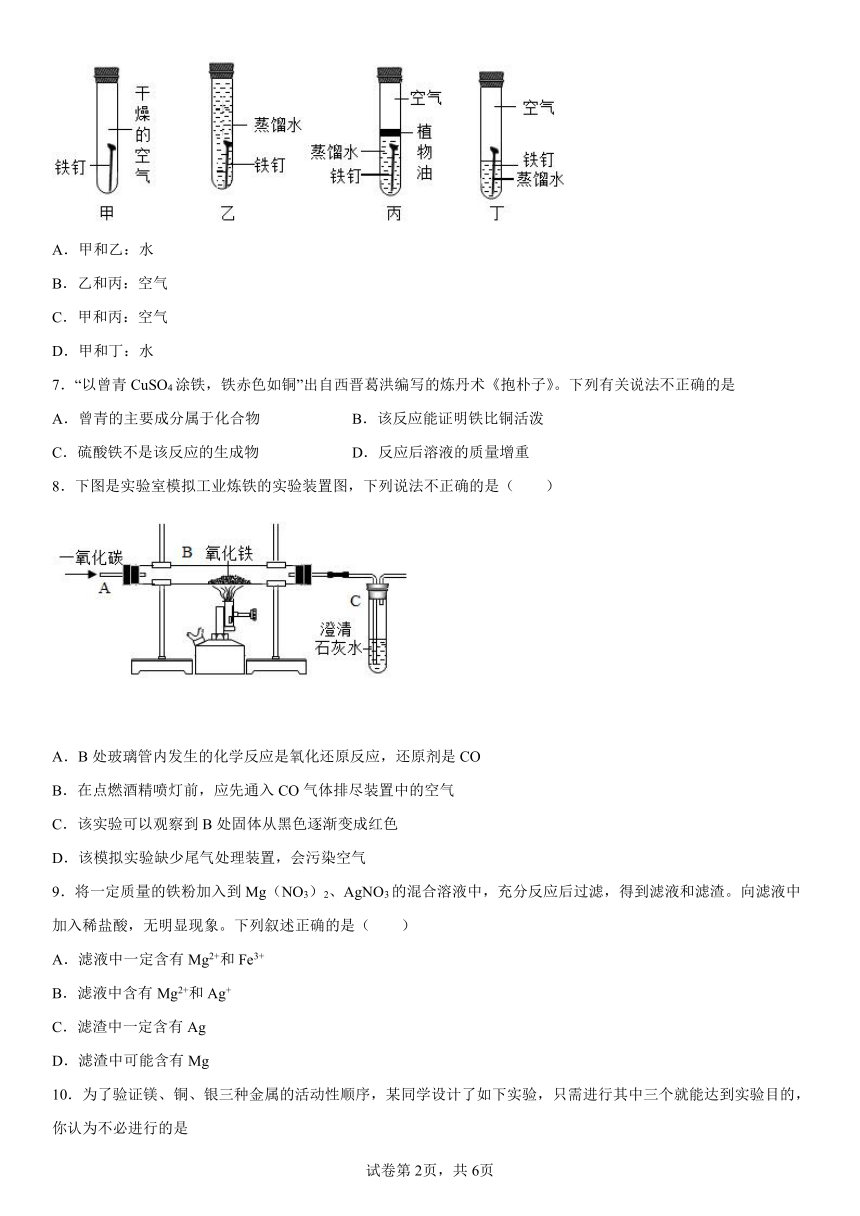
5.如图所示是实验室利用一氧化碳还原氧化铁的装置图。关于该实验,下列说法错误的是
A.实验时可观察到玻璃管中红棕色粉末逐渐变黑
B.反应后玻璃管中固体物质的质量较反应前增加
C.试管中澄清石灰水变浑浊,说明有二氧化碳生成
D.为了防止污染空气,该实验应增加尾气处理装置
6.通过对比实验可探究铁生锈的条件。下列实验设计与探究条件的对应关系正确的是
A.甲和乙:水
B.乙和丙:空气
C.甲和丙:空气
D.甲和丁:水
7.“以曾青CuSO4涂铁,铁赤色如铜”出自西晋葛洪编写的炼丹术《抱朴子》。下列有关说法不正确的是
A.曾青的主要成分属于化合物 B.该反应能证明铁比铜活泼
C.硫酸铁不是该反应的生成物 D.反应后溶液的质量增重
8.下图是实验室模拟工业炼铁的实验装置图,下列说法不正确的是( )
A.B处玻璃管内发生的化学反应是氧化还原反应,还原剂是CO
B.在点燃酒精喷灯前,应先通入CO气体排尽装置中的空气
C.该实验可以观察到B处固体从黑色逐渐变成红色
D.该模拟实验缺少尾气处理装置,会污染空气
9.将一定质量的铁粉加入到Mg(NO3)2、AgNO3的混合溶液中,充分反应后过滤,得到滤液和滤渣。向滤液中加入稀盐酸,无明显现象。下列叙述正确的是( )
A.滤液中一定含有Mg2+和Fe3+
B.滤液中含有Mg2+和Ag+
C.滤渣中一定含有Ag
D.滤渣中可能含有Mg
10.为了验证镁、铜、银三种金属的活动性顺序,某同学设计了如下实验,只需进行其中三个就能达到实验目的,你认为不必进行的是
A.将镁片放入稀盐酸中
B.将铜片放入稀盐酸中
C.将镁片放入硝酸银溶液中
D.将铜片放入硝酸银溶液中
11.下列说法正确的是( )
A.由不同种元素组成的物质一定是混合物
B.某物质能与碱反应生成盐和水,则该物质不一定是酸
C.金属与盐溶液发生置换反应后,溶液的质量一定增加
D.某固体物质的饱和溶液一定比其不饱和溶液的溶质质量分数大
12.某化学兴趣小组为探究铝、铜、银三种金属的活动性顺序,利用实验室中的相关药品设计了如下实验方案(实验用到的三种金属丝均已打磨干净):
①稀盐酸、铝、铜、银
②硫酸铜溶液、铝、银
③硫酸铝溶液、硝酸银溶液、铜
④硫酸铝溶液、铜、银
其中能验证铝、铜、银金属活动性顺序的是
A.②③ B.①③ C.③④ D.②④
13.在一定条件下,A、B能发生化学反应生成C和D,其微观示意图如下:
下列说法不正确的是
A.从宏观角度看,物质B由两种元素组成,化学式为NH3
B.从微观角度看,该化学变化中发生变化的微粒是分子
C.若D为空气中体积分数最大的气体,则该反应为置换反应
D.若D为氧化物NO2,则参加反应的A和B的分子个数比为5:4
14.在托盘天平的两端各放一个盛有相同质量、相同浓度盐酸的烧杯,并使天平保持平衡,在左、右两个烧杯中分别放入等质量的两种金属(保持盐酸过量),完全反应后发现左盘升高、右盘下降,则左右两个烧杯中分别放入的金属可能是,
A.镁和铝 B.锌和镁 C.锌和铜 D.铜和铁
15.东汉时期的“马踏飞燕”堪称我国古代青铜器艺术中无与伦比的珍品。其制作材料属于
A.合成材料
B.天然材料
C.金属材料
D.复合材料
二、填空题
16.炼铁的主要原料是赤铁矿(主要成分是Fe2O3)、焦炭、空气、石灰石,转化过程如图:
(1)在此转化过程中体现了焦炭的化学性质有_______。(写一条即可)
(2)③中发生反应的化学方程式是_______。
(3)世界上每年因腐蚀而报废的金属设备和材料相当于其年产量的20%~40%,请你写出一种防止铁制品锈蚀的方法_______。
17.工业上炼铁炼钢和轧制钢材的主要流程如下图:
已知:生铁的含碳量为2%~4.3%,钢的含碳量为 0.03%~2%。
(1)反应:①Fe2O3+3CO[Math Processing Error] 2Fe+3CO,②Fe2O3+3C[Math Processing Error]2Fe+3CO。属于置换反应的是________,用于高炉炼铁的原理是______________(填序号)。
(2)炼铁的固体原料需经过粉碎,其目的是__________________________。
(3)热空气和高炉气体的主要成分有一种相同,这种气体的化学式是______________。炉渣中含有硅酸钙(CaSiO3),其中硅元素的化合价是______________。
(4)炼钢炉中,通入纯氧的目的是_______________。将钢锭轧成钢板,体现了金属的______________性。
(5)钢铁制品可能会生锈,写出用稀硫酸除锈反应的化学方程式:______________。
18.2017年5月5日,我国国产大型客机C919在上海浦东机场首飞成功,标准着我国航空事业有了最大突破。结合所学知识回答下列问题:
(1)大型客机大量使用了铝锂合金、钛合金等,其原因是合金比纯金属具有 _______。
(2)空气中,铝比铁具有更好的抗腐蚀性。原因是________(用化学方程式表示);铁制品锈蚀的主要条件是铁与______________接触.
(3)已知金属M和N能够发生如下反应:Fe+MCl2=M+FeCl2,N+FeCl2=Fe+NCl2,判断Fe、M、N三种金属的活动性有强到弱的顺序是__________。
19.金属在生产和生活中有着广泛应用。
(1)高铁刹车制动盘使用合金锻钢制作,主要利用该合金耐高温和_____等特性。
(2)铝比铁活泼,但铝在空气中比铁稳定,其原因是_____。
(3)工业上用盐酸除去钢板表面上的锈要严格控制盐酸的用量,用量过多会发生反应而损坏钢板,用化学方程式表示损坏钢板的反应_____。
(4)高铁的迅速发展对钢轨的需求量越来越大,质量要求越来越高。工业上经常用“铝热反应”来焊接钢轨,其原理是8Al+3Fe3O44Al2O3+9Fe,反应中具有还原性的物质是_____。
三、实验题
20.根据下图回答问题
(1)实验三进行一段时间之后,A玻璃管内观察到的现象是____;其反应方程式为____
(2)实验三B装置中石灰水的作用是_____;
21.根据如图所示的实验回答问题。
(1)甲是实验室制取氧气的实验。仪器a的名称是_____________,试管口放一团棉花的作用是_________,当观察到导管口有___________时,再开始收集。
(2)乙是金属性质的实验。步骤①体现了铜具有__________性,步骤②验证了三种金属活动性强弱的依据是_______________。
四、计算题
22.将8g含杂质的粗锌,加入到盛有100g稀硫酸的烧杯中(杂质不溶于水,也不与稀硫酸反应),恰好完全反应,称得烧杯内物质的总质量为107.8g。试计算:
(1)生成氢气的质量为______g。
(2)所用粗锌中锌的质量是多少?所用稀硫酸中溶质的质量分数是多少?
23.某铁矿粉,主要成分为铁的氧化物(FeXOy),一学生利用实验作进一步分析,过程及数据如下。(注:铁矿粉中杂质不参与下列过程中的反应)
Ⅰ.取30g该铁矿粉在CO气流中充分加热,将反应后的气体用烧碱溶液充分吸收,烧碱溶液增重17.6g
Ⅱ.将上述加热后的固体取出后,再向固体逐滴加入稀硫酸,测得产生气体与滴入稀硫酸的质量关系如图:
通过计算回答下列问题:
(1)30g铁矿粉所含铁的氧化物中,铁元素的质量为______g,氧元素的质量为______g。
(2)该铁的氧化物化学式中,x、y的最简整数比x:y=______。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
2.D
3.B
4.D
5.B
6.D
7.D
8.C
9.C
10.C
11.B
12.A
13.D
14.C
15.C
16.(1)还原性##可燃性
(2)
(3)刷漆(合理即可)
17. (1) ② ① 增大反应接触面积,加快反应速率 (2) N2 +4 使生铁中的碳转化为二氧化碳,降低生铁中碳含量 (3) 延展 Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
18. (1) 更优良的性能_ 4Al+3O2====2Al2O3 (2) 氧气和水 (3) _N Fe M_
19.(1) 耐磨 铝与空气中的氧气反应生成致密的氧化铝薄膜,阻止铝的进一步反应 (2) (3) 铝(或Al)
20.(1) 红色粉末变黑
(2)证明生成了二氧化碳气体
21.(1) 集气瓶 防止高锰酸钾粉末进入导管 (2) 连续均匀气泡冒出 延展 (3) 在金属活动性顺序表中,前面的金属和后面金属的盐溶液反应,把其从盐溶液中置换出来
22.(1)0.2
(2)解:设粗锌中锌的质量为 x;所用稀硫酸中溶质的质量为y
答:所用粗锌中锌的质量是6.5g;所用稀硫酸中溶质的质量分数是9.8%。
23. (1) 16.8 6.4 (2) 3:4
答案第1页,共2页
答案第1页,共2页
一、单选题
1.金属材料在生产,生活中使用广泛。下列金属的用途利用了金属导电性的是
A.铜制电线 B.铁质铁锅 C.金制项链 D.铝制饮料罐
2.下列措施中,不能防止金属制品锈蚀的是
A.在表面刷漆
B.改用不锈钢
C.在表面镀铬
D.用湿布擦拭
3.空气中含①N2 ②O2 ③稀有气体 ④水蒸气等成分,其中与钢铁生锈有关的是( )
A.①③ B.②④ C.③④ D.①④
4.港珠澳大桥的桥、岛、隧以及“雪龙2号”的船身等主要由金属材料制成。下列金属防护措施不正确的是
A.在金属制品表面镀保护层
B.改变金属结构制成合金使用
C.在金属制品表面涂油漆
D.用稀盐酸定期清洗金属制品
5.如图所示是实验室利用一氧化碳还原氧化铁的装置图。关于该实验,下列说法错误的是
A.实验时可观察到玻璃管中红棕色粉末逐渐变黑
B.反应后玻璃管中固体物质的质量较反应前增加
C.试管中澄清石灰水变浑浊,说明有二氧化碳生成
D.为了防止污染空气,该实验应增加尾气处理装置
6.通过对比实验可探究铁生锈的条件。下列实验设计与探究条件的对应关系正确的是
A.甲和乙:水
B.乙和丙:空气
C.甲和丙:空气
D.甲和丁:水
7.“以曾青CuSO4涂铁,铁赤色如铜”出自西晋葛洪编写的炼丹术《抱朴子》。下列有关说法不正确的是
A.曾青的主要成分属于化合物 B.该反应能证明铁比铜活泼
C.硫酸铁不是该反应的生成物 D.反应后溶液的质量增重
8.下图是实验室模拟工业炼铁的实验装置图,下列说法不正确的是( )
A.B处玻璃管内发生的化学反应是氧化还原反应,还原剂是CO
B.在点燃酒精喷灯前,应先通入CO气体排尽装置中的空气
C.该实验可以观察到B处固体从黑色逐渐变成红色
D.该模拟实验缺少尾气处理装置,会污染空气
9.将一定质量的铁粉加入到Mg(NO3)2、AgNO3的混合溶液中,充分反应后过滤,得到滤液和滤渣。向滤液中加入稀盐酸,无明显现象。下列叙述正确的是( )
A.滤液中一定含有Mg2+和Fe3+
B.滤液中含有Mg2+和Ag+
C.滤渣中一定含有Ag
D.滤渣中可能含有Mg
10.为了验证镁、铜、银三种金属的活动性顺序,某同学设计了如下实验,只需进行其中三个就能达到实验目的,你认为不必进行的是
A.将镁片放入稀盐酸中
B.将铜片放入稀盐酸中
C.将镁片放入硝酸银溶液中
D.将铜片放入硝酸银溶液中
11.下列说法正确的是( )
A.由不同种元素组成的物质一定是混合物
B.某物质能与碱反应生成盐和水,则该物质不一定是酸
C.金属与盐溶液发生置换反应后,溶液的质量一定增加
D.某固体物质的饱和溶液一定比其不饱和溶液的溶质质量分数大
12.某化学兴趣小组为探究铝、铜、银三种金属的活动性顺序,利用实验室中的相关药品设计了如下实验方案(实验用到的三种金属丝均已打磨干净):
①稀盐酸、铝、铜、银
②硫酸铜溶液、铝、银
③硫酸铝溶液、硝酸银溶液、铜
④硫酸铝溶液、铜、银
其中能验证铝、铜、银金属活动性顺序的是
A.②③ B.①③ C.③④ D.②④
13.在一定条件下,A、B能发生化学反应生成C和D,其微观示意图如下:
下列说法不正确的是
A.从宏观角度看,物质B由两种元素组成,化学式为NH3
B.从微观角度看,该化学变化中发生变化的微粒是分子
C.若D为空气中体积分数最大的气体,则该反应为置换反应
D.若D为氧化物NO2,则参加反应的A和B的分子个数比为5:4
14.在托盘天平的两端各放一个盛有相同质量、相同浓度盐酸的烧杯,并使天平保持平衡,在左、右两个烧杯中分别放入等质量的两种金属(保持盐酸过量),完全反应后发现左盘升高、右盘下降,则左右两个烧杯中分别放入的金属可能是,
A.镁和铝 B.锌和镁 C.锌和铜 D.铜和铁
15.东汉时期的“马踏飞燕”堪称我国古代青铜器艺术中无与伦比的珍品。其制作材料属于
A.合成材料
B.天然材料
C.金属材料
D.复合材料
二、填空题
16.炼铁的主要原料是赤铁矿(主要成分是Fe2O3)、焦炭、空气、石灰石,转化过程如图:
(1)在此转化过程中体现了焦炭的化学性质有_______。(写一条即可)
(2)③中发生反应的化学方程式是_______。
(3)世界上每年因腐蚀而报废的金属设备和材料相当于其年产量的20%~40%,请你写出一种防止铁制品锈蚀的方法_______。
17.工业上炼铁炼钢和轧制钢材的主要流程如下图:
已知:生铁的含碳量为2%~4.3%,钢的含碳量为 0.03%~2%。
(1)反应:①Fe2O3+3CO[Math Processing Error] 2Fe+3CO,②Fe2O3+3C[Math Processing Error]2Fe+3CO。属于置换反应的是________,用于高炉炼铁的原理是______________(填序号)。
(2)炼铁的固体原料需经过粉碎,其目的是__________________________。
(3)热空气和高炉气体的主要成分有一种相同,这种气体的化学式是______________。炉渣中含有硅酸钙(CaSiO3),其中硅元素的化合价是______________。
(4)炼钢炉中,通入纯氧的目的是_______________。将钢锭轧成钢板,体现了金属的______________性。
(5)钢铁制品可能会生锈,写出用稀硫酸除锈反应的化学方程式:______________。
18.2017年5月5日,我国国产大型客机C919在上海浦东机场首飞成功,标准着我国航空事业有了最大突破。结合所学知识回答下列问题:
(1)大型客机大量使用了铝锂合金、钛合金等,其原因是合金比纯金属具有 _______。
(2)空气中,铝比铁具有更好的抗腐蚀性。原因是________(用化学方程式表示);铁制品锈蚀的主要条件是铁与______________接触.
(3)已知金属M和N能够发生如下反应:Fe+MCl2=M+FeCl2,N+FeCl2=Fe+NCl2,判断Fe、M、N三种金属的活动性有强到弱的顺序是__________。
19.金属在生产和生活中有着广泛应用。
(1)高铁刹车制动盘使用合金锻钢制作,主要利用该合金耐高温和_____等特性。
(2)铝比铁活泼,但铝在空气中比铁稳定,其原因是_____。
(3)工业上用盐酸除去钢板表面上的锈要严格控制盐酸的用量,用量过多会发生反应而损坏钢板,用化学方程式表示损坏钢板的反应_____。
(4)高铁的迅速发展对钢轨的需求量越来越大,质量要求越来越高。工业上经常用“铝热反应”来焊接钢轨,其原理是8Al+3Fe3O44Al2O3+9Fe,反应中具有还原性的物质是_____。
三、实验题
20.根据下图回答问题
(1)实验三进行一段时间之后,A玻璃管内观察到的现象是____;其反应方程式为____
(2)实验三B装置中石灰水的作用是_____;
21.根据如图所示的实验回答问题。
(1)甲是实验室制取氧气的实验。仪器a的名称是_____________,试管口放一团棉花的作用是_________,当观察到导管口有___________时,再开始收集。
(2)乙是金属性质的实验。步骤①体现了铜具有__________性,步骤②验证了三种金属活动性强弱的依据是_______________。
四、计算题
22.将8g含杂质的粗锌,加入到盛有100g稀硫酸的烧杯中(杂质不溶于水,也不与稀硫酸反应),恰好完全反应,称得烧杯内物质的总质量为107.8g。试计算:
(1)生成氢气的质量为______g。
(2)所用粗锌中锌的质量是多少?所用稀硫酸中溶质的质量分数是多少?
23.某铁矿粉,主要成分为铁的氧化物(FeXOy),一学生利用实验作进一步分析,过程及数据如下。(注:铁矿粉中杂质不参与下列过程中的反应)
Ⅰ.取30g该铁矿粉在CO气流中充分加热,将反应后的气体用烧碱溶液充分吸收,烧碱溶液增重17.6g
Ⅱ.将上述加热后的固体取出后,再向固体逐滴加入稀硫酸,测得产生气体与滴入稀硫酸的质量关系如图:
通过计算回答下列问题:
(1)30g铁矿粉所含铁的氧化物中,铁元素的质量为______g,氧元素的质量为______g。
(2)该铁的氧化物化学式中,x、y的最简整数比x:y=______。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
2.D
3.B
4.D
5.B
6.D
7.D
8.C
9.C
10.C
11.B
12.A
13.D
14.C
15.C
16.(1)还原性##可燃性
(2)
(3)刷漆(合理即可)
17. (1) ② ① 增大反应接触面积,加快反应速率 (2) N2 +4 使生铁中的碳转化为二氧化碳,降低生铁中碳含量 (3) 延展 Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
18. (1) 更优良的性能_ 4Al+3O2====2Al2O3 (2) 氧气和水 (3) _N Fe M_
19.(1) 耐磨 铝与空气中的氧气反应生成致密的氧化铝薄膜,阻止铝的进一步反应 (2) (3) 铝(或Al)
20.(1) 红色粉末变黑
(2)证明生成了二氧化碳气体
21.(1) 集气瓶 防止高锰酸钾粉末进入导管 (2) 连续均匀气泡冒出 延展 (3) 在金属活动性顺序表中,前面的金属和后面金属的盐溶液反应,把其从盐溶液中置换出来
22.(1)0.2
(2)解:设粗锌中锌的质量为 x;所用稀硫酸中溶质的质量为y
答:所用粗锌中锌的质量是6.5g;所用稀硫酸中溶质的质量分数是9.8%。
23. (1) 16.8 6.4 (2) 3:4
答案第1页,共2页
答案第1页,共2页
同课章节目录
