3.3.2 盐类水解的影响因素及其应用 课件2022-2023学年高二化学人教版(2019)选择性必修1(31张ppt)
文档属性
| 名称 | 3.3.2 盐类水解的影响因素及其应用 课件2022-2023学年高二化学人教版(2019)选择性必修1(31张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 925.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-26 15:47:37 | ||
图片预览









文档简介
(共31张PPT)
第三章 水溶液中的离子反应与平衡
第三节 盐类的水解
盐类水解的影响因素
一、影响盐类水解的因素
1、内因:
盐类水解程度的大小,主要是由盐的性质决定的。
越弱越水解
例:对于强碱弱酸盐MA,写出水解方程式并表示其平衡常数。
A- + H2O HA + OH-
弱酸的电离常数
弱碱的电离常数
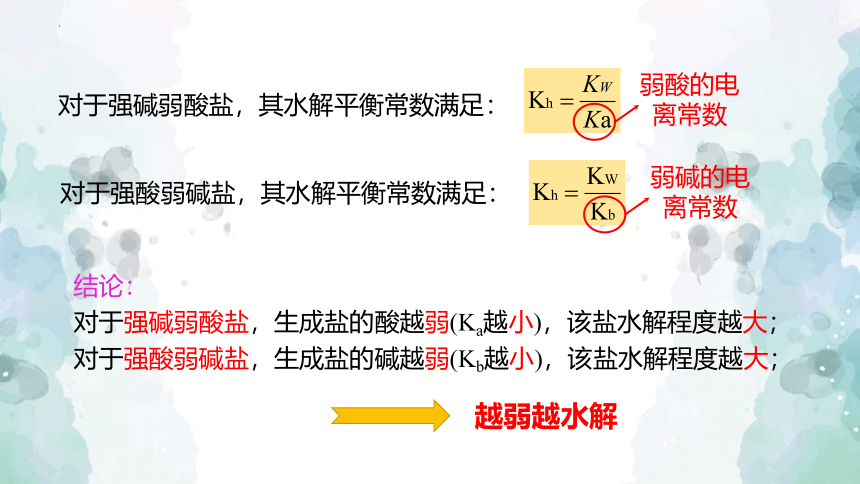
对于强酸弱碱盐,其水解平衡常数满足:
弱酸的电离常数
弱碱的电离常数
结论:
对于强碱弱酸盐,生成盐的酸越弱(Ka越小),该盐水解程度越大;对于强酸弱碱盐,生成盐的碱越弱(Kb越小),该盐水解程度越大;
对于强酸弱碱盐,其水解平衡常数满足:
对于强碱弱酸盐,其水解平衡常数满足:
越弱越水解
常见弱酸的酸性强弱:
H2SO3>HF>CH3COOH>H2CO3>HSO3->H2S>HClO>HCN>HCO3-
CO32->CN->ClO->HS->SO32->HCO3->CH3COO->F->HSO3-
对应离子的水解能力:
(1)不同弱酸对应的强碱弱酸盐
对应的盐的碱性:CH3COONa (aq) NaClO(aq)
弱酸的酸性: CH3COOH HClO
<
(2)不同弱碱对应的强酸弱碱盐
对应的盐的酸性:MgCl2 (aq) AlCl3 (aq)
弱碱的碱性:Mg(OH)2 Al(OH)3
>
>
<
(3)同一弱酸对应的正盐和酸式盐
对应的盐的碱性:NaHCO3 (aq) Na2CO3(aq)
弱酸的酸性: H2CO3 HCO3-
>
<
【思考】强碱弱酸盐溶液一定显碱性吗?
正盐一定,酸式盐不一定
例: ①NaHCO3溶液显碱性 ②NaHSO3溶液显酸性
水解:
HCO3- + H2O H2CO3 + OH- HSO3- + H2O H2SO3 + OH-
电离:
HCO3- CO32- + H+ HSO3- SO32- + H+
显碱性
显酸性
程度比较:水解 电离 水解 电离
>
<
酸式盐的酸碱性需要具体看酸式酸根离子电离和水解程度的相对大小
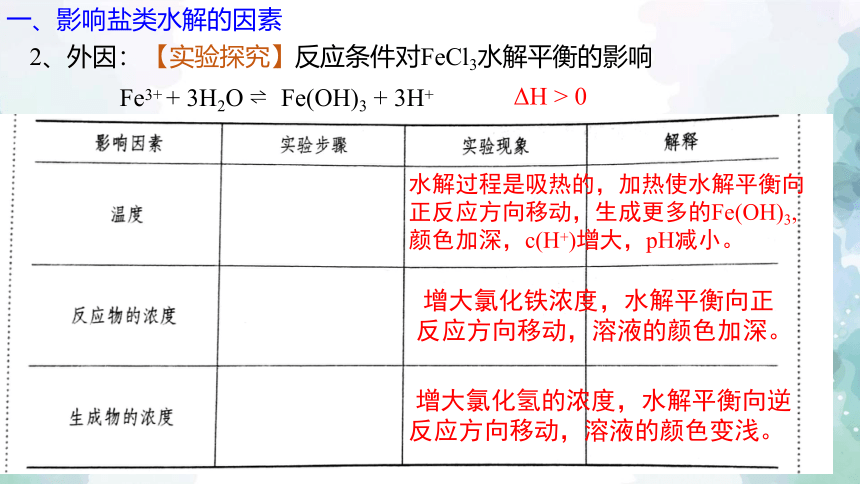
2、外因:
【实验探究】反应条件对FeCl3水解平衡的影响
Fe3+ + 3H2O Fe(OH)3 + 3H+
ΔH > 0
一、影响盐类水解的因素
水解过程是吸热的,加热使水解平衡向正反应方向移动,生成更多的Fe(OH)3,颜色加深,c(H+)增大,pH减小。
增大氯化铁浓度,水解平衡向正反应方向移动,溶液的颜色加深。
增大氯化氢的浓度,水解平衡向逆反应方向移动,溶液的颜色变浅。
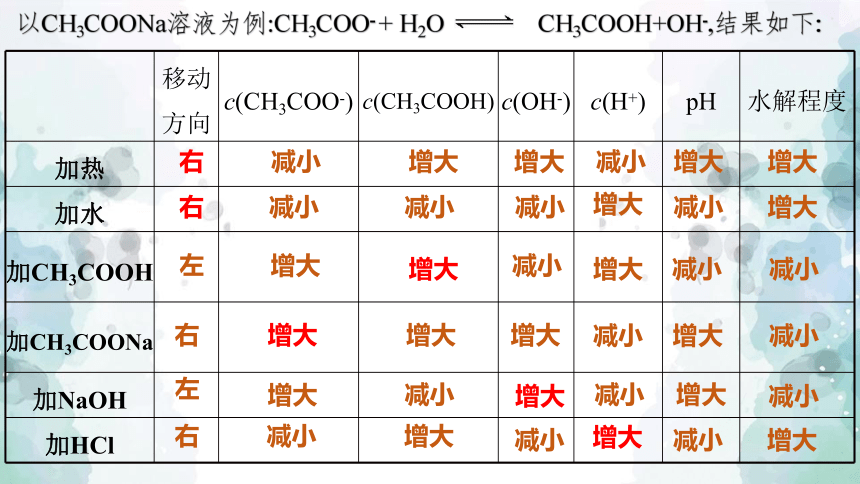
以CH3COONa溶液为例:CH3COO- + H2O CH3COOH+OH-,结果如下:
移动方向 c(CH3COO-) c(CH3COOH) c(OH-) c(H+) pH 水解程度
加热
加水
加CH3COOH
加CH3COONa
加NaOH
加HCl
减小
右
增大
增大
减小
增大
增大
右
减小
减小
减小
减小
增大
增大
左
增大
增大
增大
减小
减小
减小
右
增大
增大
增大
减小
增大
减小
左
增大
减小
增大
减小
增大
减小
减小
右
增大
减小
减小
增大
增大
2、外因:
越热越水解:平衡向水解方向移动
越稀越水解:平衡向水解方向移动
同离子效应:加入相同离子酸或碱,可以抑制水解
离子反应效应:加入可以反应的物质,可以促进水解
练 习
比较下列溶液的pH大小(填“>”“<”或“=”)
1)0.2mol/LNH4Cl溶液____0.1mol/LNH4Cl溶液
2)0.1mol/LNa2CO3溶液____0.1mol/LNaHCO3溶液
3)25℃1mol/LFeCl3溶液___80℃1mol/LFeCl3溶液
4)0.1mol/L(NH4)2CO3溶液___0.1mol/LNa2CO3溶液
<
>
>
<
1、已知:HCN是一种弱酸,相同物质的量浓度的NaCN溶液和NaClO溶液相比,NaCN溶液的pH较大,则对同温同体积同浓度的HCN溶液和HClO溶液,下列说法正确的是( )
A. 酸的强弱:HCN>HClO
B. pH: HClO>HCN
C. 与NaOH恰好完全反应时,消耗NaOH的量:HClO>HCN
D. 酸根离子浓度:c(CN-)<c(ClO-)
D
2、为了使(NH4)2SO4 溶液中 接近2∶1,可采取的措施是 ( )
A. 加热
B. 加适量NaOH(s)
C. 加水
D. 通HCl(g)
D
盐类水解的应用
二、盐类水解反应的应用
谁强显谁性,同强显中性
酸
Fe3++3H2O Fe(OH)3+3H+
1、判断盐溶液的酸碱性
例:FeCl3溶液显 _ 性,原因是__________________________;
NaF溶液显 _ 性,原因是____________________。
碱
F-+H2O HF+OH-
2、判断盐溶液的酸(碱)性强弱
例:相同条件下NaX、NaY、NaZ三种盐溶液的pH分别为8、9、10,则对应三种酸的酸性:HX_____HY_____HZ。
越弱越水解
>
>
3、水解显碱性的盐溶液可用来清洗油污
例:热的Na2CO3有很好的去油污效果。
CO32-+H2O HCO3- +OH- (吸热)
HCO3-+H2O H2CO3+OH- (吸热)
加热_____CO32-的水解,溶液碱性_____,去污能力增强。
促进
增强
4、水解显酸性的盐溶液可用作除锈剂
例:NH4Cl与ZnCl2溶液可作焊接时的除锈剂。
NH4++H2O NH3 H2O+H +
Zn2++2H2O Zn(OH)2+2H +
较浓的盐酸
抑制Fe3+水解
5、易水解盐溶液的配制或贮存
例1:配制FeCl3溶液,将FeCl3固体溶解在 ______ 中,然后加水稀释至所需浓度,目的是 _________ ;配制 FeCl2溶液时加少量_____________;配制CuSO4溶液时,加入少量_______。
例2:贮存Na2CO3、Na2SiO3等溶液的试剂瓶不能用__________,应用_______,防止碱腐蚀玻璃或Na2SiO3粘接玻璃;会水解生成HF的盐溶液不能贮存在_______中,会腐蚀玻璃。
磨口玻璃塞
橡胶塞
玻璃瓶
稀盐酸和Fe粉
稀硫酸
6、制备胶体
Fe(OH)3胶体的制备:向____中逐滴加入FeCl3饱和溶液,继续煮沸至出现透明的红褐色,停止加热。
沸水
继续煮沸是为了增大Fe3+的水解程度
7、胶体净水
原理:Fe3+ + 3H2O == Fe(OH)3(胶体) + 3H+
Δ
可溶性的铝盐、铁盐常用作净水剂。
如:明矾(KAl(SO4)2·12H2O)净水
原理:Al3+ + 3H2O Al(OH)3 (胶体) + 3H+
胶体表面积大,吸附能力强,能吸附水中杂质生成沉淀而起到净水作用。
8、易水解盐的制备
例:加热蒸干AlCl3、FeCl3等溶液时,得不到AlCl3、FeCl3晶体,必须在蒸发过程中不断通入 _ 气体,以抑制AlCl3、FeCl3的水解,才能得到其固体。
HCl
9、判断离子是否大量共存
若阴阳离子间会发生相互促进的彻底水解反应,则不能大量共存。如:Fe3+与AlO2-、CO32-、HCO3- ;Al3+与AlO2-、CO32-、HCO3-、 HS-、S2-;NH4+与AlO2-、SiO32-等。
10、泡沫灭火器的原理
NaHCO3溶液
Al2(SO4)3溶液
混合后发生彻底双水解:
Al3+ + 3HCO3- = Al(OH)3↓ + 3CO2↑
11、化肥的施用
铵态氮肥(含NH4+)与草木灰(含CO32-)不要混合施用,会降低肥效,原因是:________________________________________。
2NH4+ + CO32- + 2H2O 2NH3 ·H2O + H2CO3
12、利用盐类水解除杂
例: MgCl2溶液中混有FeCl3杂质。
Fe3+ + 3H2O Fe(OH)3 + 3H+
Mg2+ + 3H2O Mg(OH)2 + 2H+
(主)
(次)
① 加入Mg(OH)2
② 加入MgO
③ 加入MgCO3
13、制备无机化合物
例: 用TiCl4制取TiO2。
TiCl4+(x+2)H2O = TiO2·xH2O↓+4HCl
制备时,加入大量的水,同时加热,促使水解趋于完全,所TiO2·xH2O经焙烧得TiO2 。类似的方法可以制备SnO,Sn2O3等。
不同类型盐蒸干产物的判断
常见类型 溶液蒸干所得物质
金属阳离子易水解的挥发性强酸盐
金属阳离子易水解的难挥发性强酸盐
蒸干时得氢氧化物,灼烧时得氧化物,如AlCl3(FeCl3)溶液蒸干时得到Al(OH)3 [Fe(OH)3]
蒸干得原溶质,如Al2(SO4)3溶液蒸干仍得Al2(SO4)3固体
酸根阴离子易水解的强碱盐
阴、阳离子均易水解,且水解产物均易挥发的盐
蒸干得原溶质,如Na2CO3溶液蒸干得Na2CO3固体
蒸干后得不到任何物质,如(NH4)2S、(NH4)2CO3等蒸干后得不到任何物质
不稳定的化合物的水溶液
易被氧化的盐
加热时在溶液中就能分解,得不到原物质,如Ca(HCO3)2溶液蒸干后得CaCO3,KHCO3溶液蒸干后得K2CO3
蒸干后得不到原物质,蒸干后得其氧化产物,如FeSO4溶液蒸干后得Fe2(SO4)3,Na2SO3溶液蒸干后得Na2SO4
(2)降低温度和加水稀释,都会使盐的水解平衡向逆反应方向移动。 ( )
(3)在CH3COONa溶液中加入适量CH3COOH,可使c(Na+)=c(CH3COO-)。( )
(4)水解平衡右移,盐的离子的水解程度一定增大。 ( )
1.判断正误(正确的打“√”,错误的打“×”)
逆向移动。 ( )
√
×
×
×
×
(8)纯碱是盐,不是碱,之所以被称为纯碱,是因为它的水溶液显碱性。
( )
(9)加热时促进了CH3COO-的水解,抑制了CH3COOH的电离。 ( )
(10)向NH4Cl溶液中加入适量氯化钠固体,抑制了NH4+的水解。( )
(11)实验室配制FeCl3溶液,常将FeCl3固体溶解在稀盐酸中而不是直接溶解在水中。 ( )
√
×
×
√
(6)碳酸钠可用作食用碱,是利用了其溶液显碱性。 ( )
(7)施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用。 ( )
√
×
1、以下与实验操作相关的说法正确的是( )
氯化铵溶液可以除铁锈
B. 施肥时,草木灰能与NH4Cl混合使用
C. 使用明矾对自来水进行杀菌消毒
D. 除去CuCl2溶液中的少量FeCl3杂质,加入NaOH固体后过滤
A
2、下列说法中正确的是( )
AlCl3溶液和Al2(SO4)3溶液加热,蒸发,浓缩结晶,灼烧,所得固体的成分相同
B. 配制FeCl3溶液时,将FeCl3固体溶解在硫酸中,后再加水稀释到所需的浓度
C. 向CuCl2溶液中加入CuO,调节pH可除去溶液中混有的Fe3+
D. 泡沫灭火器中常使用的原料是Na2CO3和Al2(SO4)3
C
3.在蒸发皿中加热蒸干下列物质的溶液并灼烧(低于400 ℃),可以得到该固体物质的是( )
A.AlCl3 B.NaHCO3
C.Fe2(SO4)3 D.KMnO4
C
4.下列与盐类水解有关的是( )
①为保存FeCl3溶液,要在溶液中加入少量盐酸 ②实验室盛放Na2CO3溶液、Na2SiO3溶液的试剂瓶应用橡胶塞 ③在NH4Cl溶液中加入镁条会产生气泡 ④长期施用硫酸铵,土壤的酸性增强
A.①②④ B.②③④ C.①③④ D.全部
D
5.0.1 mol·L-1的K2CO3溶液中,由于CO32-的水解,使得c(CO32-)<0.1 mol·L-1。如果要使c(CO32-)更接近于0.1 mol·L-1,可以采取的措施是( )
A.加入少量盐酸 B.加入适量的水
C.加入适量的KOH D.加热
C
第三章 水溶液中的离子反应与平衡
第三节 盐类的水解
盐类水解的影响因素
一、影响盐类水解的因素
1、内因:
盐类水解程度的大小,主要是由盐的性质决定的。
越弱越水解
例:对于强碱弱酸盐MA,写出水解方程式并表示其平衡常数。
A- + H2O HA + OH-
弱酸的电离常数
弱碱的电离常数
对于强酸弱碱盐,其水解平衡常数满足:
弱酸的电离常数
弱碱的电离常数
结论:
对于强碱弱酸盐,生成盐的酸越弱(Ka越小),该盐水解程度越大;对于强酸弱碱盐,生成盐的碱越弱(Kb越小),该盐水解程度越大;
对于强酸弱碱盐,其水解平衡常数满足:
对于强碱弱酸盐,其水解平衡常数满足:
越弱越水解
常见弱酸的酸性强弱:
H2SO3>HF>CH3COOH>H2CO3>HSO3->H2S>HClO>HCN>HCO3-
CO32->CN->ClO->HS->SO32->HCO3->CH3COO->F->HSO3-
对应离子的水解能力:
(1)不同弱酸对应的强碱弱酸盐
对应的盐的碱性:CH3COONa (aq) NaClO(aq)
弱酸的酸性: CH3COOH HClO
<
(2)不同弱碱对应的强酸弱碱盐
对应的盐的酸性:MgCl2 (aq) AlCl3 (aq)
弱碱的碱性:Mg(OH)2 Al(OH)3
>
>
<
(3)同一弱酸对应的正盐和酸式盐
对应的盐的碱性:NaHCO3 (aq) Na2CO3(aq)
弱酸的酸性: H2CO3 HCO3-
>
<
【思考】强碱弱酸盐溶液一定显碱性吗?
正盐一定,酸式盐不一定
例: ①NaHCO3溶液显碱性 ②NaHSO3溶液显酸性
水解:
HCO3- + H2O H2CO3 + OH- HSO3- + H2O H2SO3 + OH-
电离:
HCO3- CO32- + H+ HSO3- SO32- + H+
显碱性
显酸性
程度比较:水解 电离 水解 电离
>
<
酸式盐的酸碱性需要具体看酸式酸根离子电离和水解程度的相对大小
2、外因:
【实验探究】反应条件对FeCl3水解平衡的影响
Fe3+ + 3H2O Fe(OH)3 + 3H+
ΔH > 0
一、影响盐类水解的因素
水解过程是吸热的,加热使水解平衡向正反应方向移动,生成更多的Fe(OH)3,颜色加深,c(H+)增大,pH减小。
增大氯化铁浓度,水解平衡向正反应方向移动,溶液的颜色加深。
增大氯化氢的浓度,水解平衡向逆反应方向移动,溶液的颜色变浅。
以CH3COONa溶液为例:CH3COO- + H2O CH3COOH+OH-,结果如下:
移动方向 c(CH3COO-) c(CH3COOH) c(OH-) c(H+) pH 水解程度
加热
加水
加CH3COOH
加CH3COONa
加NaOH
加HCl
减小
右
增大
增大
减小
增大
增大
右
减小
减小
减小
减小
增大
增大
左
增大
增大
增大
减小
减小
减小
右
增大
增大
增大
减小
增大
减小
左
增大
减小
增大
减小
增大
减小
减小
右
增大
减小
减小
增大
增大
2、外因:
越热越水解:平衡向水解方向移动
越稀越水解:平衡向水解方向移动
同离子效应:加入相同离子酸或碱,可以抑制水解
离子反应效应:加入可以反应的物质,可以促进水解
练 习
比较下列溶液的pH大小(填“>”“<”或“=”)
1)0.2mol/LNH4Cl溶液____0.1mol/LNH4Cl溶液
2)0.1mol/LNa2CO3溶液____0.1mol/LNaHCO3溶液
3)25℃1mol/LFeCl3溶液___80℃1mol/LFeCl3溶液
4)0.1mol/L(NH4)2CO3溶液___0.1mol/LNa2CO3溶液
<
>
>
<
1、已知:HCN是一种弱酸,相同物质的量浓度的NaCN溶液和NaClO溶液相比,NaCN溶液的pH较大,则对同温同体积同浓度的HCN溶液和HClO溶液,下列说法正确的是( )
A. 酸的强弱:HCN>HClO
B. pH: HClO>HCN
C. 与NaOH恰好完全反应时,消耗NaOH的量:HClO>HCN
D. 酸根离子浓度:c(CN-)<c(ClO-)
D
2、为了使(NH4)2SO4 溶液中 接近2∶1,可采取的措施是 ( )
A. 加热
B. 加适量NaOH(s)
C. 加水
D. 通HCl(g)
D
盐类水解的应用
二、盐类水解反应的应用
谁强显谁性,同强显中性
酸
Fe3++3H2O Fe(OH)3+3H+
1、判断盐溶液的酸碱性
例:FeCl3溶液显 _ 性,原因是__________________________;
NaF溶液显 _ 性,原因是____________________。
碱
F-+H2O HF+OH-
2、判断盐溶液的酸(碱)性强弱
例:相同条件下NaX、NaY、NaZ三种盐溶液的pH分别为8、9、10,则对应三种酸的酸性:HX_____HY_____HZ。
越弱越水解
>
>
3、水解显碱性的盐溶液可用来清洗油污
例:热的Na2CO3有很好的去油污效果。
CO32-+H2O HCO3- +OH- (吸热)
HCO3-+H2O H2CO3+OH- (吸热)
加热_____CO32-的水解,溶液碱性_____,去污能力增强。
促进
增强
4、水解显酸性的盐溶液可用作除锈剂
例:NH4Cl与ZnCl2溶液可作焊接时的除锈剂。
NH4++H2O NH3 H2O+H +
Zn2++2H2O Zn(OH)2+2H +
较浓的盐酸
抑制Fe3+水解
5、易水解盐溶液的配制或贮存
例1:配制FeCl3溶液,将FeCl3固体溶解在 ______ 中,然后加水稀释至所需浓度,目的是 _________ ;配制 FeCl2溶液时加少量_____________;配制CuSO4溶液时,加入少量_______。
例2:贮存Na2CO3、Na2SiO3等溶液的试剂瓶不能用__________,应用_______,防止碱腐蚀玻璃或Na2SiO3粘接玻璃;会水解生成HF的盐溶液不能贮存在_______中,会腐蚀玻璃。
磨口玻璃塞
橡胶塞
玻璃瓶
稀盐酸和Fe粉
稀硫酸
6、制备胶体
Fe(OH)3胶体的制备:向____中逐滴加入FeCl3饱和溶液,继续煮沸至出现透明的红褐色,停止加热。
沸水
继续煮沸是为了增大Fe3+的水解程度
7、胶体净水
原理:Fe3+ + 3H2O == Fe(OH)3(胶体) + 3H+
Δ
可溶性的铝盐、铁盐常用作净水剂。
如:明矾(KAl(SO4)2·12H2O)净水
原理:Al3+ + 3H2O Al(OH)3 (胶体) + 3H+
胶体表面积大,吸附能力强,能吸附水中杂质生成沉淀而起到净水作用。
8、易水解盐的制备
例:加热蒸干AlCl3、FeCl3等溶液时,得不到AlCl3、FeCl3晶体,必须在蒸发过程中不断通入 _ 气体,以抑制AlCl3、FeCl3的水解,才能得到其固体。
HCl
9、判断离子是否大量共存
若阴阳离子间会发生相互促进的彻底水解反应,则不能大量共存。如:Fe3+与AlO2-、CO32-、HCO3- ;Al3+与AlO2-、CO32-、HCO3-、 HS-、S2-;NH4+与AlO2-、SiO32-等。
10、泡沫灭火器的原理
NaHCO3溶液
Al2(SO4)3溶液
混合后发生彻底双水解:
Al3+ + 3HCO3- = Al(OH)3↓ + 3CO2↑
11、化肥的施用
铵态氮肥(含NH4+)与草木灰(含CO32-)不要混合施用,会降低肥效,原因是:________________________________________。
2NH4+ + CO32- + 2H2O 2NH3 ·H2O + H2CO3
12、利用盐类水解除杂
例: MgCl2溶液中混有FeCl3杂质。
Fe3+ + 3H2O Fe(OH)3 + 3H+
Mg2+ + 3H2O Mg(OH)2 + 2H+
(主)
(次)
① 加入Mg(OH)2
② 加入MgO
③ 加入MgCO3
13、制备无机化合物
例: 用TiCl4制取TiO2。
TiCl4+(x+2)H2O = TiO2·xH2O↓+4HCl
制备时,加入大量的水,同时加热,促使水解趋于完全,所TiO2·xH2O经焙烧得TiO2 。类似的方法可以制备SnO,Sn2O3等。
不同类型盐蒸干产物的判断
常见类型 溶液蒸干所得物质
金属阳离子易水解的挥发性强酸盐
金属阳离子易水解的难挥发性强酸盐
蒸干时得氢氧化物,灼烧时得氧化物,如AlCl3(FeCl3)溶液蒸干时得到Al(OH)3 [Fe(OH)3]
蒸干得原溶质,如Al2(SO4)3溶液蒸干仍得Al2(SO4)3固体
酸根阴离子易水解的强碱盐
阴、阳离子均易水解,且水解产物均易挥发的盐
蒸干得原溶质,如Na2CO3溶液蒸干得Na2CO3固体
蒸干后得不到任何物质,如(NH4)2S、(NH4)2CO3等蒸干后得不到任何物质
不稳定的化合物的水溶液
易被氧化的盐
加热时在溶液中就能分解,得不到原物质,如Ca(HCO3)2溶液蒸干后得CaCO3,KHCO3溶液蒸干后得K2CO3
蒸干后得不到原物质,蒸干后得其氧化产物,如FeSO4溶液蒸干后得Fe2(SO4)3,Na2SO3溶液蒸干后得Na2SO4
(2)降低温度和加水稀释,都会使盐的水解平衡向逆反应方向移动。 ( )
(3)在CH3COONa溶液中加入适量CH3COOH,可使c(Na+)=c(CH3COO-)。( )
(4)水解平衡右移,盐的离子的水解程度一定增大。 ( )
1.判断正误(正确的打“√”,错误的打“×”)
逆向移动。 ( )
√
×
×
×
×
(8)纯碱是盐,不是碱,之所以被称为纯碱,是因为它的水溶液显碱性。
( )
(9)加热时促进了CH3COO-的水解,抑制了CH3COOH的电离。 ( )
(10)向NH4Cl溶液中加入适量氯化钠固体,抑制了NH4+的水解。( )
(11)实验室配制FeCl3溶液,常将FeCl3固体溶解在稀盐酸中而不是直接溶解在水中。 ( )
√
×
×
√
(6)碳酸钠可用作食用碱,是利用了其溶液显碱性。 ( )
(7)施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用。 ( )
√
×
1、以下与实验操作相关的说法正确的是( )
氯化铵溶液可以除铁锈
B. 施肥时,草木灰能与NH4Cl混合使用
C. 使用明矾对自来水进行杀菌消毒
D. 除去CuCl2溶液中的少量FeCl3杂质,加入NaOH固体后过滤
A
2、下列说法中正确的是( )
AlCl3溶液和Al2(SO4)3溶液加热,蒸发,浓缩结晶,灼烧,所得固体的成分相同
B. 配制FeCl3溶液时,将FeCl3固体溶解在硫酸中,后再加水稀释到所需的浓度
C. 向CuCl2溶液中加入CuO,调节pH可除去溶液中混有的Fe3+
D. 泡沫灭火器中常使用的原料是Na2CO3和Al2(SO4)3
C
3.在蒸发皿中加热蒸干下列物质的溶液并灼烧(低于400 ℃),可以得到该固体物质的是( )
A.AlCl3 B.NaHCO3
C.Fe2(SO4)3 D.KMnO4
C
4.下列与盐类水解有关的是( )
①为保存FeCl3溶液,要在溶液中加入少量盐酸 ②实验室盛放Na2CO3溶液、Na2SiO3溶液的试剂瓶应用橡胶塞 ③在NH4Cl溶液中加入镁条会产生气泡 ④长期施用硫酸铵,土壤的酸性增强
A.①②④ B.②③④ C.①③④ D.全部
D
5.0.1 mol·L-1的K2CO3溶液中,由于CO32-的水解,使得c(CO32-)<0.1 mol·L-1。如果要使c(CO32-)更接近于0.1 mol·L-1,可以采取的措施是( )
A.加入少量盐酸 B.加入适量的水
C.加入适量的KOH D.加热
C
