华师大版中考专区二轮专题:化学总结(器材篇)
文档属性
| 名称 | 华师大版中考专区二轮专题:化学总结(器材篇) |  | |
| 格式 | zip | ||
| 文件大小 | 570.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 华东师大版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2022-11-28 08:41:57 | ||
图片预览

文档简介
化学总结----器材篇
发生装置(注意发生装置和制取装置的区别)
固固加热型:
举例:
PS:①试管口应略向下倾斜,防止生成的冷凝水倒流至热的试管底部,使试管炸裂;
②用高锰酸钾制氧气应在试管口塞一团棉花,作用是以防加热时高锰酸钾粉末随气流进入导管,堵塞导管;
③实验结束时,一定要先将导管移出水面,再熄灭酒精灯,防止水槽中的水倒流至热的试管底部,使试管炸裂
固液不加热型
举例: 2H2O22H2O+O2↑
PS:①长颈漏斗的下端管口应伸入液面以下,形成“液封”,防止生成的气体从长颈漏斗逸出;
②分液漏斗的优点:能随时控制反应的发生和停止(或能控制反应的速率等合理即可)
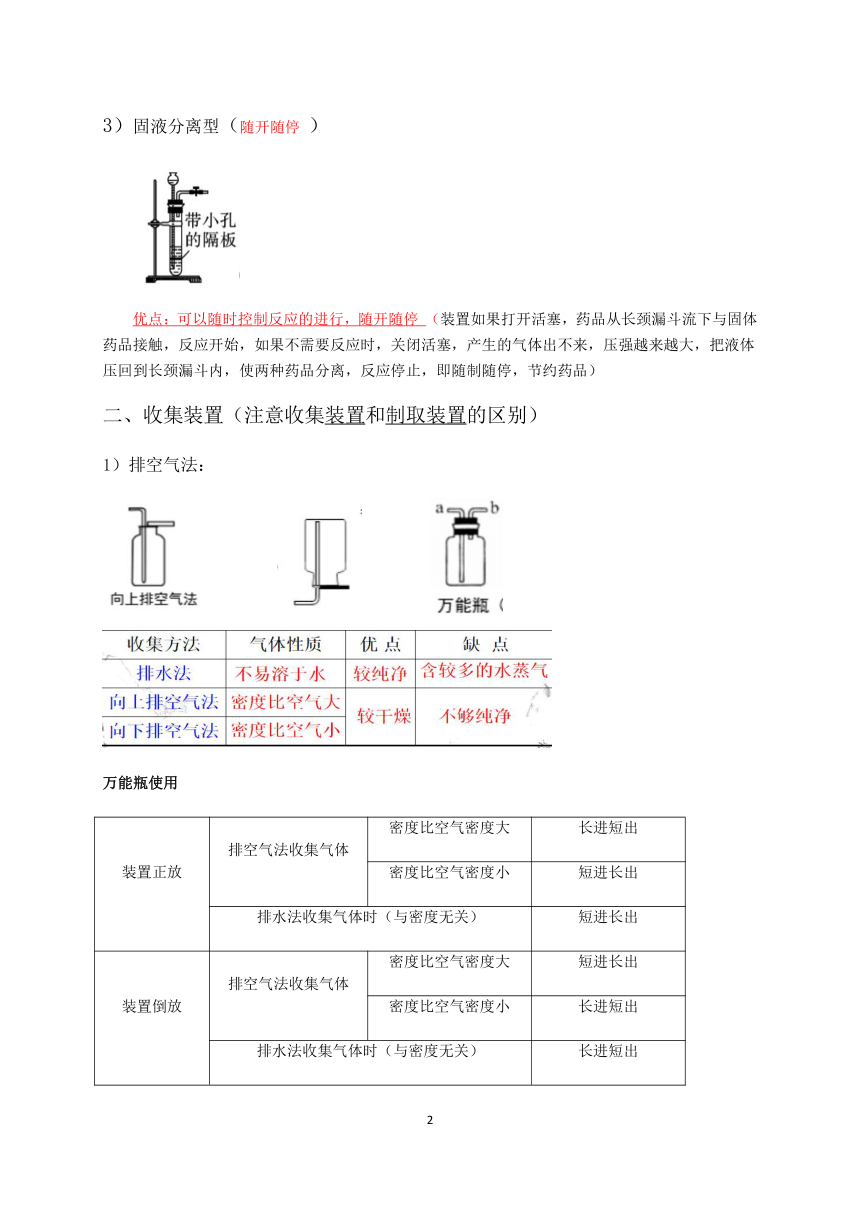
固液分离型(随开随停 )
优点:可以随时控制反应的进行,随开随停 (装置如果打开活塞,药品从长颈漏斗流下与固体药品接触,反应开始,如果不需要反应时,关闭活塞,产生的气体出不来,压强越来越大,把液体压回到长颈漏斗内,使两种药品分离,反应停止,即随制随停,节约药品)
收集装置(注意收集装置和制取装置的区别)
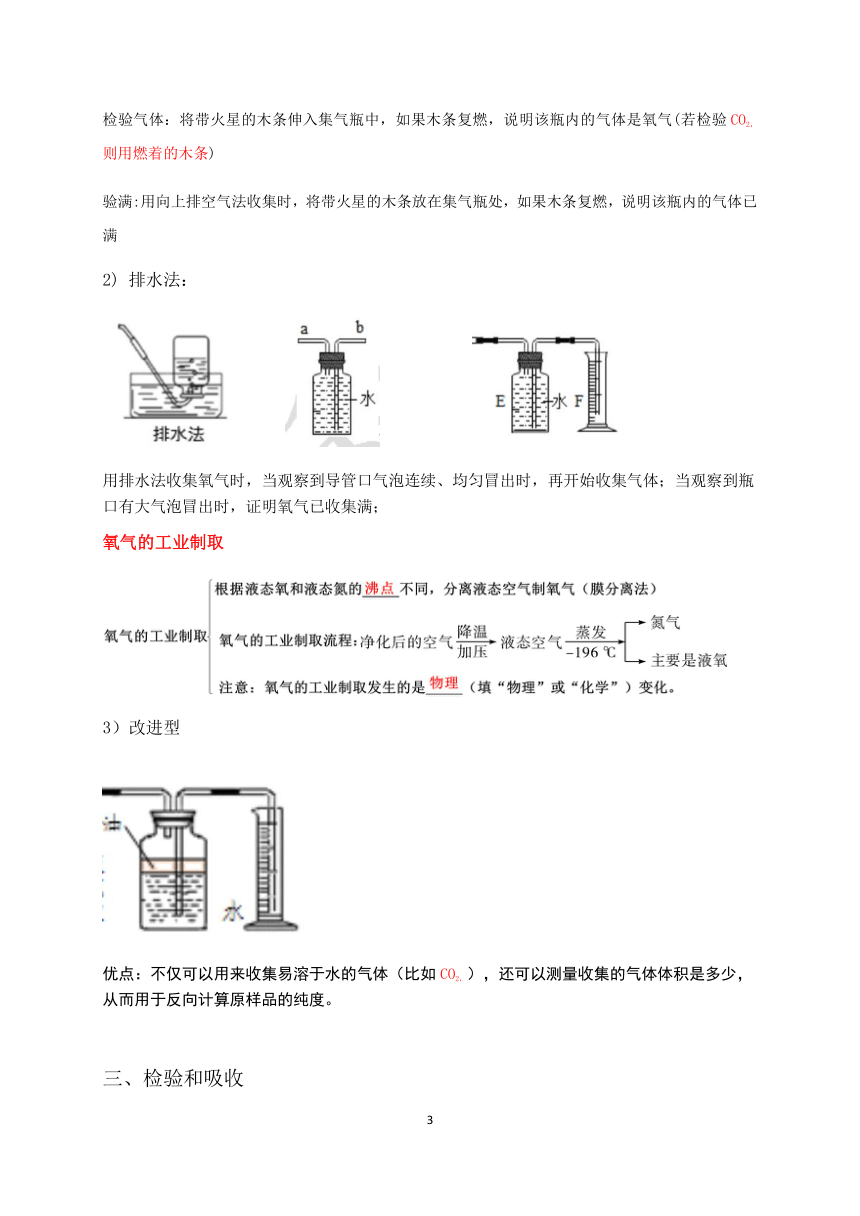
排空气法:
万能瓶使用
装置正放 排空气法收集气体 密度比空气密度大 长进短出
密度比空气密度小 短进长出
排水法收集气体时(与密度无关) 短进长出
装置倒放 排空气法收集气体 密度比空气密度大 短进长出
密度比空气密度小 长进短出
排水法收集气体时(与密度无关) 长进短出
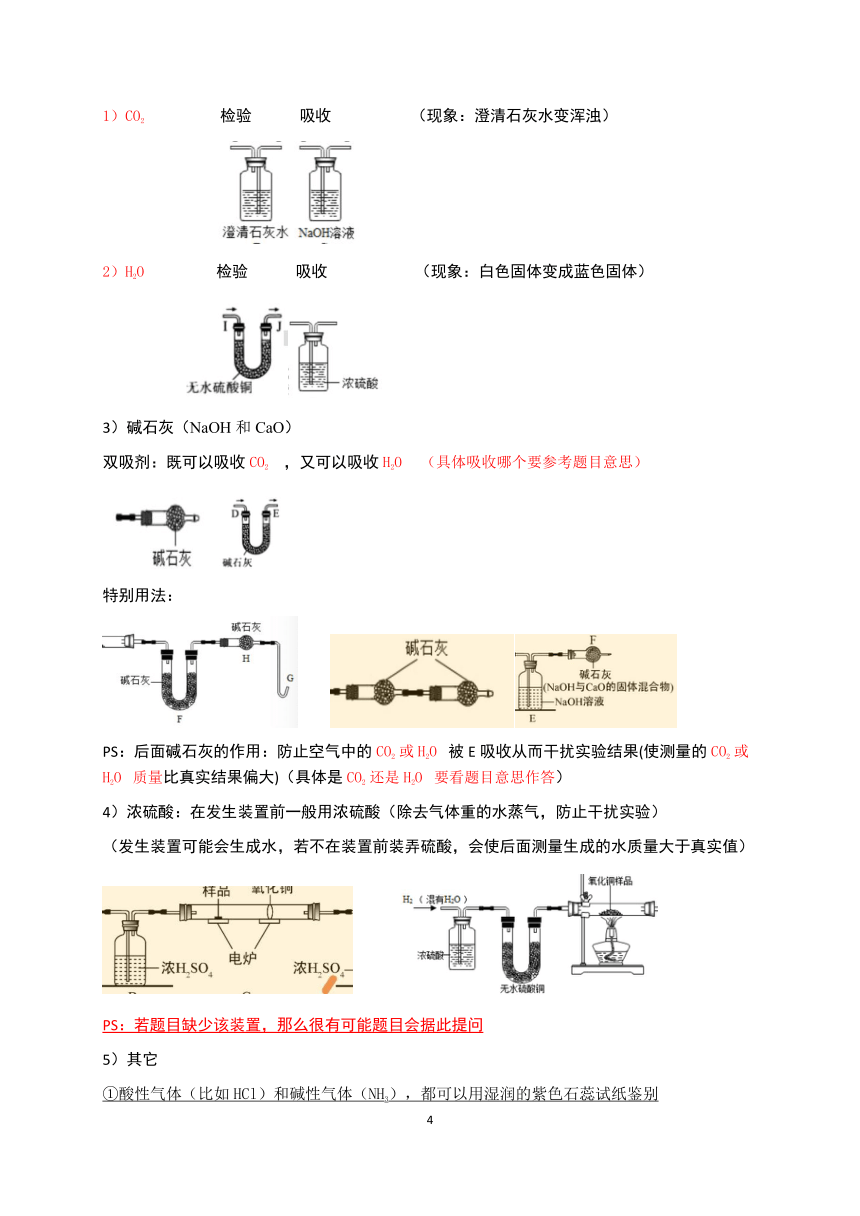
检验气体:将带火星的木条伸入集气瓶中,如果木条复燃,说明该瓶内的气体是氧气(若检验CO2,则用燃着的木条)
验满:用向上排空气法收集时,将带火星的木条放在集气瓶处,如果木条复燃,说明该瓶内的气体已满
2) 排水法:
用排水法收集氧气时,当观察到导管口气泡连续、均匀冒出时,再开始收集气体;当观察到瓶口有大气泡冒出时,证明氧气已收集满;
氧气的工业制取
3)改进型
优点:不仅可以用来收集易溶于水的气体(比如CO2,),还可以测量收集的气体体积是多少,从而用于反向计算原样品的纯度。
检验和吸收
1)CO2 检验 吸收 (现象:澄清石灰水变浑浊)
2)H2O 检验 吸收 (现象:白色固体变成蓝色固体)
碱石灰(NaOH和CaO)
双吸剂:既可以吸收CO2 ,又可以吸收H2O (具体吸收哪个要参考题目意思)
特别用法:
PS:后面碱石灰的作用:防止空气中的CO2 或H2O 被E吸收从而干扰实验结果(使测量的CO2 或H2O 质量比真实结果偏大)(具体是CO2 还是H2O 要看题目意思作答)
浓硫酸:在发生装置前一般用浓硫酸(除去气体重的水蒸气,防止干扰实验)
(发生装置可能会生成水,若不在装置前装弄硫酸,会使后面测量生成的水质量大于真实值)
PS:若题目缺少该装置,那么很有可能题目会据此提问
其它
①酸性气体(比如HCl)和碱性气体(NH3),都可以用湿润的紫色石蕊试纸鉴别
②SO2可使湿润的有色布条褪色(还原性,不稳定,只需加热即可恢复原来的颜色)
③用CO还原金属氧化物时,切记要处理尾气(去除杂质后,点燃即可)
【例题1】用氢气还原氧化铜的方法测定某氧化铜样品的纯度(杂质不与氢气反应),同学们设计了以下实验装置。准确称取15g干燥样品进行实验。
(1)该实验中,装置乙的作用是
(2)准确称取完全反应前后装置丙和丁的质量如表:
装置丙 装置丁
反应前 48.8g 161.2g
反应后 46.5g 163.9g
(2)小明根据装置丙减少的质量就是氧元素质量,求得氧化铜的质量为 g,氧化铜的纯度为 %。
(3)小丽想根据装置丁的质量变化进行计算,请帮小丽求出氧化铜样品的纯度。(写出计算过程)
(4)比较小明和小丽的计算结果,请分析导致这一结果的原因可能是 。
A.装置的气密性不好 B.空气中的水分被丁处浓硫酸吸收
C.通入的氢气量不足 D.空气中的二氧化碳被丁处浓硫酸吸收。
【解答】解:(1)氢气通过浓硫酸是为了除去氢气中的水分,无水硫酸铜遇到水由白色变蓝,所以通过无水硫酸铜就是检验浓硫酸是否把氢气中水分除尽;
(2)根据方程式H2+CuOCu+H2O可知丙减少的质量就是氧元素质量,氧化铜中氧元素的质量为:48.8g﹣46.5g=2.3g,所以氧化铜的质量为2.3g11.5g,氧化铜的质量分数为100%=76.7%;
(3)根据浓硫酸质量的增加量就是生成的水的质量,所以生成水的质量为:163.9g﹣161.2g=2.7g,设要生成2.7g水需要参加反应的氧化铜的质量为x则:
H2+CuOCu+H2O
80 18
x 2.7g
根据:,解得x=12g
所以氧化铜的质量分数:100%=80%
答:氧化铜样品的纯度为80%。
(4)根据浓硫酸质量的增加量计算结果偏大,原因是浓硫酸与空气通着,吸收了空气中的水分。
故答案为:(1)检验氢气中水分是否全部被吸收;(2)11.5;76.7;(3)80%;(4)B。
【例题2】.如下图是用燃烧法来确定有机物组成的常用装置,这种方法是在电炉加热时用纯净氧气氧化管内样品,根据产物的质量确定有机物的组成(已知:C中的氧化铜是确保有机物中的碳元素完全转化为二氧化碳;A中的反应为:2H2O22H2O+O2↑)
回答下列问题:
(1)A装置中a仪器的名称是
(2)若去掉B装置会对 元素的测量结果有影响,会使测量结果 (填“偏大”或“偏小”).
(3)E装置中所盛放物质最好选用 (填:①氢氧化钙溶液;②氢氧化钠溶液;③水).
(4)若准确称取1.12g样品(样品只含C、H、O三种元素中的两种或三种).经充分燃烧,D装置增重1.44g,E装置增重3.52g,则该有机物样品中所含的元素为 .
【解答】解:(1)A装置中a仪器的名称是烧瓶.
故填:烧瓶.
(2)B装置用来吸收氧气中的水蒸气,若去掉B装置时,氧气中的水蒸气会被D装置吸收,导致测定的反应生成的水的质量偏大,从而会对氢元素的测量结果有影响,会使测量结果偏大.
故填:氢;偏大.
(3)氢氧化钙的溶解度很小,可能不能完全吸收反应生成的二氧化碳,二氧化碳在水中的溶解度较小,可能不能完全吸收反应生成的二氧化碳,氢氧化钠溶液能和二氧化碳反应生成碳酸钠和水,并且氢氧化钠的溶解度较大,因此为了完全吸收反应生成的二氧化碳,E装置中所盛放物质最好选用氢氧化钠溶液.
故填:②.
(4)参加反应的氧气质量为:1.44g+3.52g﹣1.12g=3.84g,
1.44g水中氢元素质量为:1.44g100%=0.16g,氧元素质量为:1.44g﹣0.16g=1.28g,
3.52g中碳元素质量为:3.52g100%=0.96g,氧元素质量为:3.52g﹣0.96g=2.56g,
该物质中氧元素质量为:1.28g+2.56g﹣3.84g=0,
水中的氢元素和二氧化碳中的碳元素一定来自于该物质,则该有机物样品中所含的元素的碳元素和氢元素.
故填:碳元素、氢元素.
【例题3】.按如图进行实验,已知A为H2、CO中的一种或两者的混合物,甲装置中的黑色粉末为CuO、炭粉中的一种或两者的混合物.
(1)若黑色粉末是纯净物,甲、乙、丙装置中的固体或溶液依次出现红色、蓝色、浑浊,则气体A是 ,黑色粉末为 .
(2)若A为纯净物,反应现象与(1)同,则A是 ,黑色粉末为 .
(3)若第(1)问中:乙装置的物质增重1.8g,丙装置中的物质增重2.2g,则通入气体的质量可能是 (把正确的选项填入空格).(A)0.8g(B)1.6g(C)3g
(4)若A为纯净物,充分反应后,甲装置生成3.2g红色固体,乙装置中物质增重0.9g,则黑色固体的质量为 g,写出计算过程: .
【解答】解:(1)由题意可知,若黑色粉末是纯净物实验时出现红色,说明了黑色粉末为氧化铜;由无水硫酸铜变成了蓝色,说明了有水生成,则通入的气体中含有氢气;由澄清的石灰水变浑浊,说明了有二氧化碳气体生成,通入的气体中含有一氧化碳.故填:H2和CO;CuO;
(2)由题意可知,若A为纯净物,实验时出现红色,说明了黑色粉末有氧化铜;由无水硫酸铜变成了蓝色,说明了有水生成,则通入的气体中含有氢气;由澄清的石灰水变浑浊,说明了有二氧化碳气体生成,则二氧化碳应该是碳和氧化铜反应产生的,因此黑色粉末是碳和氧化铜.故填:H2;C和CuO;
(3)设氢气的质量为x
H2+CuOCu+H2O
2 18
x 1.8g
解得:x=0.2g
设一氧化碳的质量为y
CO+CuOCu+CO2↑
28 44
y 2.2g
解得:y=1.4g
参加反应的气体的质量是:0.2g+1.4g=1.6g
由于反应前和反应后都需要通入气体,故气体的质量要大于1.6g,故填:C;
(4)乙装置中物质增重0.9g,其中含有氧元素的质量为:0.9g100%=0.8g,故黑色固体的质量为:3.2g+0.8g=4g;故填:4.
故答案为:(1)H2和CO;CuO;(2)H2;C和CuO;(3)C;(4)4;含有氧元素的质量为:0.9g100%=0.8g,故黑色固体的质量为:3.2g+0.8g=4g.
(
1
)
发生装置(注意发生装置和制取装置的区别)
固固加热型:
举例:
PS:①试管口应略向下倾斜,防止生成的冷凝水倒流至热的试管底部,使试管炸裂;
②用高锰酸钾制氧气应在试管口塞一团棉花,作用是以防加热时高锰酸钾粉末随气流进入导管,堵塞导管;
③实验结束时,一定要先将导管移出水面,再熄灭酒精灯,防止水槽中的水倒流至热的试管底部,使试管炸裂
固液不加热型
举例: 2H2O22H2O+O2↑
PS:①长颈漏斗的下端管口应伸入液面以下,形成“液封”,防止生成的气体从长颈漏斗逸出;
②分液漏斗的优点:能随时控制反应的发生和停止(或能控制反应的速率等合理即可)
固液分离型(随开随停 )
优点:可以随时控制反应的进行,随开随停 (装置如果打开活塞,药品从长颈漏斗流下与固体药品接触,反应开始,如果不需要反应时,关闭活塞,产生的气体出不来,压强越来越大,把液体压回到长颈漏斗内,使两种药品分离,反应停止,即随制随停,节约药品)
收集装置(注意收集装置和制取装置的区别)
排空气法:
万能瓶使用
装置正放 排空气法收集气体 密度比空气密度大 长进短出
密度比空气密度小 短进长出
排水法收集气体时(与密度无关) 短进长出
装置倒放 排空气法收集气体 密度比空气密度大 短进长出
密度比空气密度小 长进短出
排水法收集气体时(与密度无关) 长进短出
检验气体:将带火星的木条伸入集气瓶中,如果木条复燃,说明该瓶内的气体是氧气(若检验CO2,则用燃着的木条)
验满:用向上排空气法收集时,将带火星的木条放在集气瓶处,如果木条复燃,说明该瓶内的气体已满
2) 排水法:
用排水法收集氧气时,当观察到导管口气泡连续、均匀冒出时,再开始收集气体;当观察到瓶口有大气泡冒出时,证明氧气已收集满;
氧气的工业制取
3)改进型
优点:不仅可以用来收集易溶于水的气体(比如CO2,),还可以测量收集的气体体积是多少,从而用于反向计算原样品的纯度。
检验和吸收
1)CO2 检验 吸收 (现象:澄清石灰水变浑浊)
2)H2O 检验 吸收 (现象:白色固体变成蓝色固体)
碱石灰(NaOH和CaO)
双吸剂:既可以吸收CO2 ,又可以吸收H2O (具体吸收哪个要参考题目意思)
特别用法:
PS:后面碱石灰的作用:防止空气中的CO2 或H2O 被E吸收从而干扰实验结果(使测量的CO2 或H2O 质量比真实结果偏大)(具体是CO2 还是H2O 要看题目意思作答)
浓硫酸:在发生装置前一般用浓硫酸(除去气体重的水蒸气,防止干扰实验)
(发生装置可能会生成水,若不在装置前装弄硫酸,会使后面测量生成的水质量大于真实值)
PS:若题目缺少该装置,那么很有可能题目会据此提问
其它
①酸性气体(比如HCl)和碱性气体(NH3),都可以用湿润的紫色石蕊试纸鉴别
②SO2可使湿润的有色布条褪色(还原性,不稳定,只需加热即可恢复原来的颜色)
③用CO还原金属氧化物时,切记要处理尾气(去除杂质后,点燃即可)
【例题1】用氢气还原氧化铜的方法测定某氧化铜样品的纯度(杂质不与氢气反应),同学们设计了以下实验装置。准确称取15g干燥样品进行实验。
(1)该实验中,装置乙的作用是
(2)准确称取完全反应前后装置丙和丁的质量如表:
装置丙 装置丁
反应前 48.8g 161.2g
反应后 46.5g 163.9g
(2)小明根据装置丙减少的质量就是氧元素质量,求得氧化铜的质量为 g,氧化铜的纯度为 %。
(3)小丽想根据装置丁的质量变化进行计算,请帮小丽求出氧化铜样品的纯度。(写出计算过程)
(4)比较小明和小丽的计算结果,请分析导致这一结果的原因可能是 。
A.装置的气密性不好 B.空气中的水分被丁处浓硫酸吸收
C.通入的氢气量不足 D.空气中的二氧化碳被丁处浓硫酸吸收。
【解答】解:(1)氢气通过浓硫酸是为了除去氢气中的水分,无水硫酸铜遇到水由白色变蓝,所以通过无水硫酸铜就是检验浓硫酸是否把氢气中水分除尽;
(2)根据方程式H2+CuOCu+H2O可知丙减少的质量就是氧元素质量,氧化铜中氧元素的质量为:48.8g﹣46.5g=2.3g,所以氧化铜的质量为2.3g11.5g,氧化铜的质量分数为100%=76.7%;
(3)根据浓硫酸质量的增加量就是生成的水的质量,所以生成水的质量为:163.9g﹣161.2g=2.7g,设要生成2.7g水需要参加反应的氧化铜的质量为x则:
H2+CuOCu+H2O
80 18
x 2.7g
根据:,解得x=12g
所以氧化铜的质量分数:100%=80%
答:氧化铜样品的纯度为80%。
(4)根据浓硫酸质量的增加量计算结果偏大,原因是浓硫酸与空气通着,吸收了空气中的水分。
故答案为:(1)检验氢气中水分是否全部被吸收;(2)11.5;76.7;(3)80%;(4)B。
【例题2】.如下图是用燃烧法来确定有机物组成的常用装置,这种方法是在电炉加热时用纯净氧气氧化管内样品,根据产物的质量确定有机物的组成(已知:C中的氧化铜是确保有机物中的碳元素完全转化为二氧化碳;A中的反应为:2H2O22H2O+O2↑)
回答下列问题:
(1)A装置中a仪器的名称是
(2)若去掉B装置会对 元素的测量结果有影响,会使测量结果 (填“偏大”或“偏小”).
(3)E装置中所盛放物质最好选用 (填:①氢氧化钙溶液;②氢氧化钠溶液;③水).
(4)若准确称取1.12g样品(样品只含C、H、O三种元素中的两种或三种).经充分燃烧,D装置增重1.44g,E装置增重3.52g,则该有机物样品中所含的元素为 .
【解答】解:(1)A装置中a仪器的名称是烧瓶.
故填:烧瓶.
(2)B装置用来吸收氧气中的水蒸气,若去掉B装置时,氧气中的水蒸气会被D装置吸收,导致测定的反应生成的水的质量偏大,从而会对氢元素的测量结果有影响,会使测量结果偏大.
故填:氢;偏大.
(3)氢氧化钙的溶解度很小,可能不能完全吸收反应生成的二氧化碳,二氧化碳在水中的溶解度较小,可能不能完全吸收反应生成的二氧化碳,氢氧化钠溶液能和二氧化碳反应生成碳酸钠和水,并且氢氧化钠的溶解度较大,因此为了完全吸收反应生成的二氧化碳,E装置中所盛放物质最好选用氢氧化钠溶液.
故填:②.
(4)参加反应的氧气质量为:1.44g+3.52g﹣1.12g=3.84g,
1.44g水中氢元素质量为:1.44g100%=0.16g,氧元素质量为:1.44g﹣0.16g=1.28g,
3.52g中碳元素质量为:3.52g100%=0.96g,氧元素质量为:3.52g﹣0.96g=2.56g,
该物质中氧元素质量为:1.28g+2.56g﹣3.84g=0,
水中的氢元素和二氧化碳中的碳元素一定来自于该物质,则该有机物样品中所含的元素的碳元素和氢元素.
故填:碳元素、氢元素.
【例题3】.按如图进行实验,已知A为H2、CO中的一种或两者的混合物,甲装置中的黑色粉末为CuO、炭粉中的一种或两者的混合物.
(1)若黑色粉末是纯净物,甲、乙、丙装置中的固体或溶液依次出现红色、蓝色、浑浊,则气体A是 ,黑色粉末为 .
(2)若A为纯净物,反应现象与(1)同,则A是 ,黑色粉末为 .
(3)若第(1)问中:乙装置的物质增重1.8g,丙装置中的物质增重2.2g,则通入气体的质量可能是 (把正确的选项填入空格).(A)0.8g(B)1.6g(C)3g
(4)若A为纯净物,充分反应后,甲装置生成3.2g红色固体,乙装置中物质增重0.9g,则黑色固体的质量为 g,写出计算过程: .
【解答】解:(1)由题意可知,若黑色粉末是纯净物实验时出现红色,说明了黑色粉末为氧化铜;由无水硫酸铜变成了蓝色,说明了有水生成,则通入的气体中含有氢气;由澄清的石灰水变浑浊,说明了有二氧化碳气体生成,通入的气体中含有一氧化碳.故填:H2和CO;CuO;
(2)由题意可知,若A为纯净物,实验时出现红色,说明了黑色粉末有氧化铜;由无水硫酸铜变成了蓝色,说明了有水生成,则通入的气体中含有氢气;由澄清的石灰水变浑浊,说明了有二氧化碳气体生成,则二氧化碳应该是碳和氧化铜反应产生的,因此黑色粉末是碳和氧化铜.故填:H2;C和CuO;
(3)设氢气的质量为x
H2+CuOCu+H2O
2 18
x 1.8g
解得:x=0.2g
设一氧化碳的质量为y
CO+CuOCu+CO2↑
28 44
y 2.2g
解得:y=1.4g
参加反应的气体的质量是:0.2g+1.4g=1.6g
由于反应前和反应后都需要通入气体,故气体的质量要大于1.6g,故填:C;
(4)乙装置中物质增重0.9g,其中含有氧元素的质量为:0.9g100%=0.8g,故黑色固体的质量为:3.2g+0.8g=4g;故填:4.
故答案为:(1)H2和CO;CuO;(2)H2;C和CuO;(3)C;(4)4;含有氧元素的质量为:0.9g100%=0.8g,故黑色固体的质量为:3.2g+0.8g=4g.
(
1
)
