人教版九年级化学下册第八单元第3课时《金属活动性顺序的应用》(课件25页)
文档属性
| 名称 | 人教版九年级化学下册第八单元第3课时《金属活动性顺序的应用》(课件25页) |  | |
| 格式 | pptx | ||
| 文件大小 | 1000.4KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-28 07:33:54 | ||
图片预览








文档简介
(共23张PPT)
金属活动性
顺序的应用
学习目标
1.能判断金属与酸、与盐溶液的置换反应能否发生;
2.能设计实验验证两种金属或三种金属的活动性顺序;
3.能根据金属活动性顺序研究金属冶炼的历史;
4.能解决一些除杂问题;
5.能根据金属活动性顺序判断金属与酸反应的速率或根据反应速率判断金属的活动性;
6.能根据金属与盐溶液的反应,判断滤液、滤渣的成分;
7.根据金属与盐溶液的反应,比较反应前后溶液质量或金属质量的变化。
1.判断金属与酸、与盐溶液的置换反应能否发生
银与稀硫酸
铁与氯化银
铝与硝酸银溶液
不反应,氯化银不溶于水
Al+3AgNO3=Al(NO3)3 + 3Ag
不反应,Ag例题:请你判断下列反应能否发生?
如果能,写出反应的化学方程式。
1.金属锰与氯化亚铁溶液可发生如下反应:
Mn+FeCl2 = MnCl2+Fe,下列说法错误的是( )
A
该反应属于置换反应
B
锰的金属活动性比铁强
C
锰能置换出盐酸中的氢
D
反应前后元素化合价都不变
D
评价1
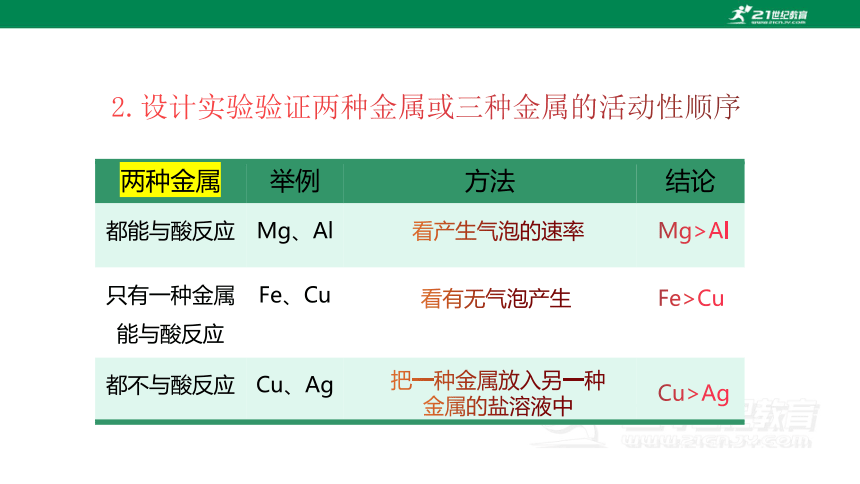
2.设计实验验证两种金属或三种金属的活动性顺序
两种金属 举例 方法 结论
都能与酸反应 Mg、Al
只有一种金属能与酸反应 Fe、Cu
都不与酸反应 Cu、Ag
看产生气泡的速率
看有无气泡产生
Mg>Al
Fe>Cu
把一种金属放入另一种金属的盐溶液中
Cu>Ag
再次探究Al、Cu、Ag三种金属的活动性顺序。
药品:打磨过的Al丝、Cu丝、Ag丝、AgNO3溶液、CuSO4溶液、Al2(SO4)3溶液。
步骤:
1.由强到弱的顺序排序:Al>Cu>Ag
2.选择方法:(1)两头金属,中间溶液【金、盐、金】:Al丝、CuSO4溶液、Ag丝。步骤:分别取打磨后形状、大小相同的铝丝和银丝,分别插入硫酸铜溶液中。(2)两头溶液,中间金属【盐、金、盐】:Al2(SO4)3溶液、Cu丝、AgNO3溶液。步骤:取两根打磨后形状、大小相同的铜丝,分别插入等体积AgNO3、Al2(SO4)3溶液中。(3)加入酸A.若都能与酸反应,看生成气泡的速率;B.若一种金属反应,另两种金属不反应【方法:把一种金属放入另一种金属盐溶液中】
C
评价2
1.为验证Fe、Cu、Ag的金属活动性顺序,下列方案中合理的是( )
A.将Fe、Cu、Ag分别放入稀盐酸中
B.将Cu、Ag分别放入FeCl2溶液中
C.将Fe、Ag分别放入Cu(NO3)2溶液中
D.将Fe放入CuCl2溶液中,将Fe放入AgNO3溶液中
变式:把金属X放入Cu(NO3)2溶液中,X表面有红色固体析出;若放入Mg(NO3)2溶液中,无明显现象。则X、Cu、Mg三种金属活动性由强到弱的顺序正确的是( )
A
Mg、X、Cu
A
B
X、Mg、Cu
C
Mg、Cu、X
D
Cu、X、Mg
3.根据金属活动性顺序研究金属冶炼的历史
金属活动性弱,冶炼历史悠久。
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
钾 钙 钠 镁 铝 锌 铁 锡 铅 氢 铜 汞 银 铂 金
,
,
约6000年前
约6000年前
约200年前
约2500年前
4.解决一些除杂问题
思考:如何除去Cu粉中混有的Fe粉?
(1)物理方法:
用磁铁吸引
(2)化学方法:
①先加入足量稀盐酸
②先加入足量硫酸铜溶液
除杂原则:不引入新的杂质
Fe+2HCl=FeCl2+H2↑
Fe+CuSO4=FeSO4+Cu
然后过滤、洗涤、干燥。
然后过滤、洗涤、干燥。
评价3
如何除去Ag粉中混有的Zn粉?
先加入足量稀盐酸
Zn+2HCl=ZnCl2+H2↑
然后过滤、洗涤、干燥。
5.根据金属活动性顺序判断金属与酸反应的速率或根据反应速率判断金属的活动性
(1)等量金属、足量酸。
将等量Al、Mg、Zn、Fe分别同时放入足量稀盐酸中。
反应时间/s
H2的质量/g
0
Al
Mg
Zn
Fe
(2)足量金属、等量酸。
将足量Al、Mg、Zn、Fe分别同时放入等质量、等浓度的稀盐酸中。
反应时间/s
H2的质量/g
0
Al
Mg
Zn
Fe
反应生成H2的质量由酸的质量决定;
金属活动性越强,反应时间越短,拐点出现越早。
(3)等量金属、足量酸。
向等量Al、Mg、Zn、Fe中,分别同时逐滴滴加等质量、等浓度的稀盐酸。
H2的质量/g
酸的质量/g
Al
Mg
Zn
Fe
开始:金属过量,酸不足。生成氢气质量相等;
最终:酸过量,金属不足。生成氢气的质量用
计算。
H2的质量/g
m(金属)/g
Mg
Al
Fe
Zn
足量金属、等量酸
H2的质量/g
m(金属)/g
Al
Mg
Fe
Zn
足量金属、足量酸
1.等质量的铁粉和锌粉与足量同浓度的稀硫酸反应,下列图象正确的是( )
BD
A B C D
评价4
6.根据金属与盐溶液的反应,判断滤液、滤渣的成分
滤液:已被过滤的液体,如已通过过滤器的液体。
滤渣:过滤时分离出来的固体颗粒。
【一金一盐】一种金属与一种盐溶液反应。
如:Cu+2AgNO3=Cu(NO3)2+2Ag
讨论Cu的量 滤液 滤渣
Cu不足
Cu恰好
Cu过量
Ag
AgNO3、Cu(NO3)2
Ag
Cu(NO3)2
Cu、Ag
Cu(NO3)2
【一金多盐】一种金属与多种盐溶液反应。
1. Zn + CuCl2= Cu + ZnCl2
2. Zn + FeCl2 = Fe + ZnCl2
例:将一定量的Zn加入CuCl2和FeCl2的混合溶液中。
优先原则:金属先与最不活泼的金属的盐溶液反应。
滤液成分 滤渣成分
a.Zn不足:反应1刚开始即结束,反应2未开始
b.Zn不足:反应1结束,反应2未开始
c.Zn不足:反应1结束,反应2刚开始即结束
d.Zn适量:反应1、2恰好结束
e.Zn过量
CuCl2
FeCl2
ZnCl2
讨论Zn的质量
Cu
FeCl2
ZnCl2
Cu
FeCl2
ZnCl2
Cu、Fe
ZnCl2
Cu、Fe
ZnCl2
Cu、Fe、Zn
【一盐多金】多种金属与一种盐溶液反应
例:将铜粉、铁粉的混合物加入一定量AgNO3溶液中。
优先原则:最活泼的金属先与盐溶液反应。
滤液成分 滤渣成分
a.AgNO3不足:反应1刚开始即结束,2未开始
b.AgNO3不足:反应1结束,反应2未开始
c.AgNO3不足:反应1结束,2刚开始即结束
d.AgNO3适量:反应1、2恰好结束
e.AgNO3过量
讨论AgNO3的质量
1. Fe + 2AgNO3 =2Ag+Fe(NO3)2
2. Cu + 2AgNO3= 2Ag+ Cu(NO3)2
Fe、Cu、Ag
Fe(NO3)2
Fe(NO3)2
Cu、Ag
Cu、Ag
Ag
Ag
Fe(NO3)2
Cu(NO3)2
Fe(NO3)2
Cu(NO3)2
Fe(NO3)2
Cu(NO3)2
AgNO3
1.某溶液中仅含有AgNO3和Cu(NO3)2两种溶质,向溶液中加入一定量的锌粉,充分反应后,过滤,分别得到滤渣和滤液。
(1)若将滤渣加入到稀盐酸中,有气泡产生,则该滤渣中含有的物质是______________;滤液中含有的金属阳离子是______。
(2)若反应前后固体质量不变,则滤渣中一定有__________,滤液一定没有_________。
(3)若滤液呈蓝色,写出可能发生反应的化学方程式__________________________。
锌、铜、银
Zn2+
Cu、Ag
AgNO3
评价5
7.根据金属与盐溶液的反应,比较反应前后溶液质量或金属质量的变化
比较方法:
(1)若要比较反应前后溶液质量的变化,只需要比较盐的相对分子质量变化;
(2)若要比较反应前后金属质量的变化,只需要比较金属的相对原子质量变化;
Cu + 2AgNO3 = 2Ag + Cu(NO3)2
64 + 2×(108+62) = 2×108 + 64+2×62
64 340 216 188
由此可见:反应后,溶液质量变小;金属质量变大。
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
兼职招聘:
https://www.21cnjy.com/recruitment/home/admin
金属活动性
顺序的应用
学习目标
1.能判断金属与酸、与盐溶液的置换反应能否发生;
2.能设计实验验证两种金属或三种金属的活动性顺序;
3.能根据金属活动性顺序研究金属冶炼的历史;
4.能解决一些除杂问题;
5.能根据金属活动性顺序判断金属与酸反应的速率或根据反应速率判断金属的活动性;
6.能根据金属与盐溶液的反应,判断滤液、滤渣的成分;
7.根据金属与盐溶液的反应,比较反应前后溶液质量或金属质量的变化。
1.判断金属与酸、与盐溶液的置换反应能否发生
银与稀硫酸
铁与氯化银
铝与硝酸银溶液
不反应,氯化银不溶于水
Al+3AgNO3=Al(NO3)3 + 3Ag
不反应,Ag
如果能,写出反应的化学方程式。
1.金属锰与氯化亚铁溶液可发生如下反应:
Mn+FeCl2 = MnCl2+Fe,下列说法错误的是( )
A
该反应属于置换反应
B
锰的金属活动性比铁强
C
锰能置换出盐酸中的氢
D
反应前后元素化合价都不变
D
评价1
2.设计实验验证两种金属或三种金属的活动性顺序
两种金属 举例 方法 结论
都能与酸反应 Mg、Al
只有一种金属能与酸反应 Fe、Cu
都不与酸反应 Cu、Ag
看产生气泡的速率
看有无气泡产生
Mg>Al
Fe>Cu
把一种金属放入另一种金属的盐溶液中
Cu>Ag
再次探究Al、Cu、Ag三种金属的活动性顺序。
药品:打磨过的Al丝、Cu丝、Ag丝、AgNO3溶液、CuSO4溶液、Al2(SO4)3溶液。
步骤:
1.由强到弱的顺序排序:Al>Cu>Ag
2.选择方法:(1)两头金属,中间溶液【金、盐、金】:Al丝、CuSO4溶液、Ag丝。步骤:分别取打磨后形状、大小相同的铝丝和银丝,分别插入硫酸铜溶液中。(2)两头溶液,中间金属【盐、金、盐】:Al2(SO4)3溶液、Cu丝、AgNO3溶液。步骤:取两根打磨后形状、大小相同的铜丝,分别插入等体积AgNO3、Al2(SO4)3溶液中。(3)加入酸A.若都能与酸反应,看生成气泡的速率;B.若一种金属反应,另两种金属不反应【方法:把一种金属放入另一种金属盐溶液中】
C
评价2
1.为验证Fe、Cu、Ag的金属活动性顺序,下列方案中合理的是( )
A.将Fe、Cu、Ag分别放入稀盐酸中
B.将Cu、Ag分别放入FeCl2溶液中
C.将Fe、Ag分别放入Cu(NO3)2溶液中
D.将Fe放入CuCl2溶液中,将Fe放入AgNO3溶液中
变式:把金属X放入Cu(NO3)2溶液中,X表面有红色固体析出;若放入Mg(NO3)2溶液中,无明显现象。则X、Cu、Mg三种金属活动性由强到弱的顺序正确的是( )
A
Mg、X、Cu
A
B
X、Mg、Cu
C
Mg、Cu、X
D
Cu、X、Mg
3.根据金属活动性顺序研究金属冶炼的历史
金属活动性弱,冶炼历史悠久。
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
钾 钙 钠 镁 铝 锌 铁 锡 铅 氢 铜 汞 银 铂 金
,
,
约6000年前
约6000年前
约200年前
约2500年前
4.解决一些除杂问题
思考:如何除去Cu粉中混有的Fe粉?
(1)物理方法:
用磁铁吸引
(2)化学方法:
①先加入足量稀盐酸
②先加入足量硫酸铜溶液
除杂原则:不引入新的杂质
Fe+2HCl=FeCl2+H2↑
Fe+CuSO4=FeSO4+Cu
然后过滤、洗涤、干燥。
然后过滤、洗涤、干燥。
评价3
如何除去Ag粉中混有的Zn粉?
先加入足量稀盐酸
Zn+2HCl=ZnCl2+H2↑
然后过滤、洗涤、干燥。
5.根据金属活动性顺序判断金属与酸反应的速率或根据反应速率判断金属的活动性
(1)等量金属、足量酸。
将等量Al、Mg、Zn、Fe分别同时放入足量稀盐酸中。
反应时间/s
H2的质量/g
0
Al
Mg
Zn
Fe
(2)足量金属、等量酸。
将足量Al、Mg、Zn、Fe分别同时放入等质量、等浓度的稀盐酸中。
反应时间/s
H2的质量/g
0
Al
Mg
Zn
Fe
反应生成H2的质量由酸的质量决定;
金属活动性越强,反应时间越短,拐点出现越早。
(3)等量金属、足量酸。
向等量Al、Mg、Zn、Fe中,分别同时逐滴滴加等质量、等浓度的稀盐酸。
H2的质量/g
酸的质量/g
Al
Mg
Zn
Fe
开始:金属过量,酸不足。生成氢气质量相等;
最终:酸过量,金属不足。生成氢气的质量用
计算。
H2的质量/g
m(金属)/g
Mg
Al
Fe
Zn
足量金属、等量酸
H2的质量/g
m(金属)/g
Al
Mg
Fe
Zn
足量金属、足量酸
1.等质量的铁粉和锌粉与足量同浓度的稀硫酸反应,下列图象正确的是( )
BD
A B C D
评价4
6.根据金属与盐溶液的反应,判断滤液、滤渣的成分
滤液:已被过滤的液体,如已通过过滤器的液体。
滤渣:过滤时分离出来的固体颗粒。
【一金一盐】一种金属与一种盐溶液反应。
如:Cu+2AgNO3=Cu(NO3)2+2Ag
讨论Cu的量 滤液 滤渣
Cu不足
Cu恰好
Cu过量
Ag
AgNO3、Cu(NO3)2
Ag
Cu(NO3)2
Cu、Ag
Cu(NO3)2
【一金多盐】一种金属与多种盐溶液反应。
1. Zn + CuCl2= Cu + ZnCl2
2. Zn + FeCl2 = Fe + ZnCl2
例:将一定量的Zn加入CuCl2和FeCl2的混合溶液中。
优先原则:金属先与最不活泼的金属的盐溶液反应。
滤液成分 滤渣成分
a.Zn不足:反应1刚开始即结束,反应2未开始
b.Zn不足:反应1结束,反应2未开始
c.Zn不足:反应1结束,反应2刚开始即结束
d.Zn适量:反应1、2恰好结束
e.Zn过量
CuCl2
FeCl2
ZnCl2
讨论Zn的质量
Cu
FeCl2
ZnCl2
Cu
FeCl2
ZnCl2
Cu、Fe
ZnCl2
Cu、Fe
ZnCl2
Cu、Fe、Zn
【一盐多金】多种金属与一种盐溶液反应
例:将铜粉、铁粉的混合物加入一定量AgNO3溶液中。
优先原则:最活泼的金属先与盐溶液反应。
滤液成分 滤渣成分
a.AgNO3不足:反应1刚开始即结束,2未开始
b.AgNO3不足:反应1结束,反应2未开始
c.AgNO3不足:反应1结束,2刚开始即结束
d.AgNO3适量:反应1、2恰好结束
e.AgNO3过量
讨论AgNO3的质量
1. Fe + 2AgNO3 =2Ag+Fe(NO3)2
2. Cu + 2AgNO3= 2Ag+ Cu(NO3)2
Fe、Cu、Ag
Fe(NO3)2
Fe(NO3)2
Cu、Ag
Cu、Ag
Ag
Ag
Fe(NO3)2
Cu(NO3)2
Fe(NO3)2
Cu(NO3)2
Fe(NO3)2
Cu(NO3)2
AgNO3
1.某溶液中仅含有AgNO3和Cu(NO3)2两种溶质,向溶液中加入一定量的锌粉,充分反应后,过滤,分别得到滤渣和滤液。
(1)若将滤渣加入到稀盐酸中,有气泡产生,则该滤渣中含有的物质是______________;滤液中含有的金属阳离子是______。
(2)若反应前后固体质量不变,则滤渣中一定有__________,滤液一定没有_________。
(3)若滤液呈蓝色,写出可能发生反应的化学方程式__________________________。
锌、铜、银
Zn2+
Cu、Ag
AgNO3
评价5
7.根据金属与盐溶液的反应,比较反应前后溶液质量或金属质量的变化
比较方法:
(1)若要比较反应前后溶液质量的变化,只需要比较盐的相对分子质量变化;
(2)若要比较反应前后金属质量的变化,只需要比较金属的相对原子质量变化;
Cu + 2AgNO3 = 2Ag + Cu(NO3)2
64 + 2×(108+62) = 2×108 + 64+2×62
64 340 216 188
由此可见:反应后,溶液质量变小;金属质量变大。
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
兼职招聘:
https://www.21cnjy.com/recruitment/home/admin
同课章节目录
