化学人教版(2019)选择性必修2 1.1.1能层与能级 基态与激发态 原子光谱 (共28张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修2 1.1.1能层与能级 基态与激发态 原子光谱 (共28张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 4.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-27 11:11:41 | ||
图片预览





文档简介
(共28张PPT)
POWERPOINT
第一章原子结构与性质
第一节 原子结构
第一课时:能层与能级 基态与激发态 原子光谱
第一章第一节第一课时
1.通过认识原子结构与核外电子的排布,理解能层与能级的关系,理解核外电子的排布规律。
2.理解基态与激发态的含义与关系,能辨识光谱与电子跃迁之间的关系。
学习目标
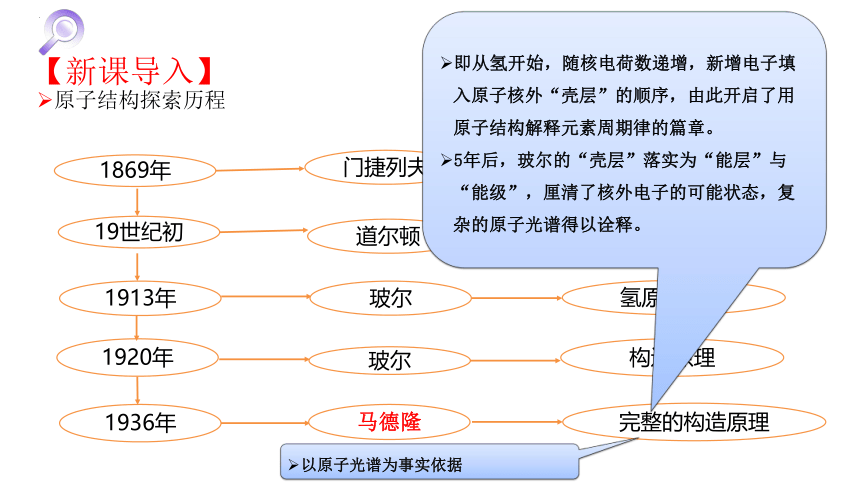
【新课导入】
原子结构探索历程
19世纪初
道尔顿
近代原子学说
1913年
玻尔
氢原子模型
1920年
玻尔
构造原理
1869年
门捷列夫
元素周期律
马德隆
完整的构造原理
1936年
即从氢开始,随核电荷数递增,新增电子填入原子核外“壳层”的顺序,由此开启了用原子结构解释元素周期律的篇章。
5年后,玻尔的“壳层”落实为“能层”与“能级”,厘清了核外电子的可能状态,复杂的原子光谱得以诠释。
以原子光谱为事实依据
复习回忆:原子结构
原子:是化学变化中最小的粒子
化学反应的实质:是原子的重新组合。
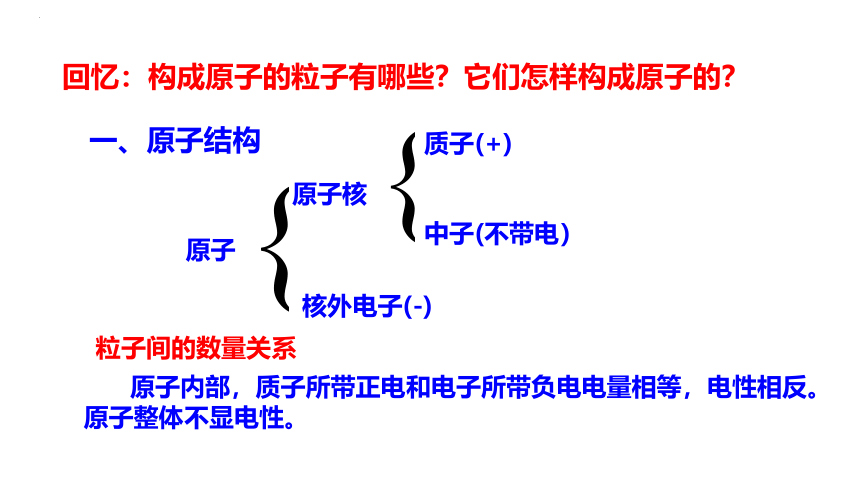
一、原子结构
原子
原子核
核外电子(-)
质子(+)
中子(不带电)
粒子间的数量关系
原子内部,质子所带正电和电子所带负电电量相等,电性相反。原子整体不显电性。
回忆:构成原子的粒子有哪些?它们怎样构成原子的?
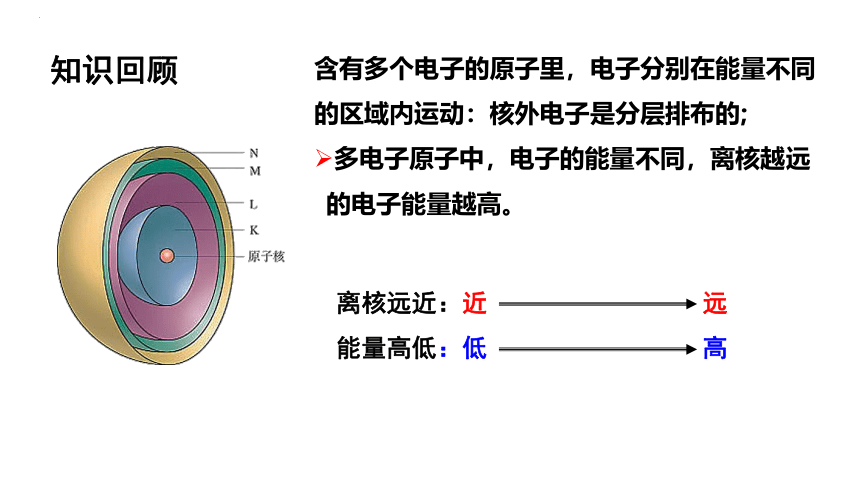
含有多个电子的原子里,电子分别在能量不同的区域内运动:核外电子是分层排布的;
多电子原子中,电子的能量不同,离核越远的电子能量越高。
离核远近:近 远
能量高低:低 高
知识回顾
学 与 问
核外电子是怎样排布的?
观察1-18号元素的原子结构示意图,讨论为什么原子核外的电子分层运动?
能层与能级
量子力学对原子核外电子运动状态的描述
原子轨道:量子力学理论用原子轨道来描述原子中单个电子的空间运动状态,某一个原子轨道,应属于某个能层(电子层n)的某个能级(s、p、d、f等)。
一、能层与能级
1.能层
在多电子原子中,核外电子能量不同,按照核外电子的能量不同分成能层。(强调电子的能量差异)
电子层:多电子原子里,电子分别在能量不同的区域内运动。把电子运动的能量不同的区域简化为不连续的壳层,称作电子层。(“电子层”强调电子运动)
符号:第一、二、三、四、五、六、七能层可分别用K、L、M、N、O、P、Q表示。
能量关系:由K能层→Q能层,能量逐渐升高。
电子层数 一 二 三 四 五 六 七
符号 K L M N O P Q
每层最多容纳电子数 2 8 18 32 50 72 98
回顾每一能层所能容纳的最多电子数?
能层越高,电子的能量越高(K数量规律:
每层容纳的电子数不超过2n2
最外层电子数不超过8(K层为最外层时,电子数不超过2)
次外层电子数不超过18
倒数第三层电子数不超过32
2.能级
同一能层的电子,能量也可能不同,还可分成不同能级(s、p、d、f...)。
能层 K L M N O
能级 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p …
最多电子数 2 2 6 2 6 10 2 6 10 14 2 6 …
由上表可知:
①能层序数____该能层所包含的能级数,如第三能层有_个能级。
② s、p、d、f 各能级可容纳的电子数分别为_、_、_、_的2倍。
等于
3
1
3
5
7
3.能层与能级的组成以及能量的关系
(1)任一能层的能级总是从s能级开始,能级数=能层序数,即第一能层只有1个能级(1s),第二能层有2个能级(2s和2p),第三能层有3个能级(3s、3p和3d),依此次类推。
(2)在每一个能层中,能级符号的顺序是ns、np、nd、nf......(n为能层序数)。
(3)在相同能层各能级能量由低到高的顺序是ns(4)不同能层中同一能级,能层数越大,能量越高。例如:1s<2s<3s<4s……
1.一个能层的能级数与能层序数(n)间存在什么关系?一个能层最多可容纳的电子数与能层序数(n)间存在什么关系
【思考交流】
能层的能级数等于该能层序数。一个能层最多可容纳的电子数为2n2个。
2.以s、p、d、f为符号的能级分别最多可容纳多少个电子 ?3d、4d、5d能级所能容纳的最多电子数是否相同?
以s、p、d、f为符号的各能级可容纳的最多电子数依次为1、3、5、7的二倍。
3d、4d、5d能级所能容纳的最多电子数相同。
3.第五能层最多可容纳多少个电子?它们分别容纳在几个能级中?各能级最多容纳多少个电子?
第五能层最多可容纳50个电子;5个能级;各能级最多容纳电子数分别为2,6,10,14,18个。
√
×
×
√
1. 已知n为能层序数,下列有关认识正确的是( )
A.各能层含有的电子数为2n2
B.各能层的能级都是从s能级开始至f能级结束
C.各能层含有的能级数为n-1
D.各能级最多容纳的电子数按s、p、d、f的顺序依次为1、3、5、7的2倍
D
2、若n=3,以下能级符号错误的是( )
A.np B.nd C.nf D.ns
C
4.(双选)下列有关能层和能级的叙述中正确的是( )
A.M能层有s、p共2个能级,最多能容纳8个电子
B.3d能级最多容纳10个电子,4f能级最多容纳14个电子
C.无论哪一能层的s能级最多容纳的电子数均为2
D.任一能层都有s、p能级,但不一定有d能级
5.(1)Cl原子核外电子能量最高的电子所在的能级是_____。
(2)基态Si原子中,核外电子占据最高能层的符号为____,该能层上有___个能级,电子数为____。
3p
M
3
4
BC
基态与激发态
原子光谱
二、基态与激发态 原子光谱
1.基态与激发态
原子
基态原子
激发态原子
吸收能量
释放能量
处于最低能量
处于较高能量
光(辐射)是电子跃迁释放能量的重要形式。
注意:电子的跃迁是物理变化
基态与激发态相互转化的应用
焰色反应
激光笔
LED灯装饰的建筑夜景
(1)不同元素原子的电子发生跃迁时会吸收或释放不同的光,可以用光谱仪摄取各种元素原子的吸收光谱或发射光谱,总称原子光谱。
E0
E1
E2
E3
En
激发态能级
基态能级
吸收光谱
发射光谱
锂、氦、汞的发射光谱
锂、氦、汞的吸收光谱
特征:暗背景, 亮线,
线状不连续
特征:亮背景,
暗线,
线状不连续
2.原子光谱
基态
K
L
M
N
激发态
K
L
M
N
能量
能量
K
L
M
N
光
K
L
M
N
不稳定
吸收能量
电子跃迁
释放能量
(2)原子光谱的成因与分类
(3)光谱分析:现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为光谱分析。
1.金属元素的焰色试验属于吸收光谱还是发射光谱?
2.霓虹灯内因为充油稀薄氖气或其它稀有气体才会发出颜色各异的光。你能解释其中的原理吗?
发射光谱
当外电源电路接通后,变压器输出端就会产生 几千伏甚至上万伏的高压。当这一高压加到霓虹灯管两端电极上时,霓虹灯管内的稀有气体原子中的带电粒子电子就会发生跃迁,发出五颜六色的光。
【思考与讨论】
6.以下现象与核外电子的跃迁有关的是( )
①霓虹灯发出有色光 ②棱镜分光 ③激光器产生激光 ④石油蒸馏 ⑤凸透镜聚光 ⑥燃放的焰火,在夜空中呈现五彩缤纷的礼花 ⑦日光灯通电发光 ⑧冷却结晶
A.①③⑥⑦ B.②④⑤⑧
C.①③⑤⑥⑦ D.①②③⑤⑥⑦
A
7.下列说法中有错误的是( )
A.某原子K层上只有一个电子
B.某离子M层和L层上的电子数均为K层的4倍
C.某原子M层上的电子数为L层电子数的4倍
D.存在核电荷数与最外层电子数相等的离子
C
8.下列多电子原子不同能级能量高低的比较错误的是( )
A.1s<2s<3s B.2p<3p<4p
C.3s<3p<3d D.4s>3d>3p
D
POWERPOINT
谢谢您的观看
THANKS FOR WATCHING
POWERPOINT
第一章原子结构与性质
第一节 原子结构
第一课时:能层与能级 基态与激发态 原子光谱
第一章第一节第一课时
1.通过认识原子结构与核外电子的排布,理解能层与能级的关系,理解核外电子的排布规律。
2.理解基态与激发态的含义与关系,能辨识光谱与电子跃迁之间的关系。
学习目标
【新课导入】
原子结构探索历程
19世纪初
道尔顿
近代原子学说
1913年
玻尔
氢原子模型
1920年
玻尔
构造原理
1869年
门捷列夫
元素周期律
马德隆
完整的构造原理
1936年
即从氢开始,随核电荷数递增,新增电子填入原子核外“壳层”的顺序,由此开启了用原子结构解释元素周期律的篇章。
5年后,玻尔的“壳层”落实为“能层”与“能级”,厘清了核外电子的可能状态,复杂的原子光谱得以诠释。
以原子光谱为事实依据
复习回忆:原子结构
原子:是化学变化中最小的粒子
化学反应的实质:是原子的重新组合。
一、原子结构
原子
原子核
核外电子(-)
质子(+)
中子(不带电)
粒子间的数量关系
原子内部,质子所带正电和电子所带负电电量相等,电性相反。原子整体不显电性。
回忆:构成原子的粒子有哪些?它们怎样构成原子的?
含有多个电子的原子里,电子分别在能量不同的区域内运动:核外电子是分层排布的;
多电子原子中,电子的能量不同,离核越远的电子能量越高。
离核远近:近 远
能量高低:低 高
知识回顾
学 与 问
核外电子是怎样排布的?
观察1-18号元素的原子结构示意图,讨论为什么原子核外的电子分层运动?
能层与能级
量子力学对原子核外电子运动状态的描述
原子轨道:量子力学理论用原子轨道来描述原子中单个电子的空间运动状态,某一个原子轨道,应属于某个能层(电子层n)的某个能级(s、p、d、f等)。
一、能层与能级
1.能层
在多电子原子中,核外电子能量不同,按照核外电子的能量不同分成能层。(强调电子的能量差异)
电子层:多电子原子里,电子分别在能量不同的区域内运动。把电子运动的能量不同的区域简化为不连续的壳层,称作电子层。(“电子层”强调电子运动)
符号:第一、二、三、四、五、六、七能层可分别用K、L、M、N、O、P、Q表示。
能量关系:由K能层→Q能层,能量逐渐升高。
电子层数 一 二 三 四 五 六 七
符号 K L M N O P Q
每层最多容纳电子数 2 8 18 32 50 72 98
回顾每一能层所能容纳的最多电子数?
能层越高,电子的能量越高(K
每层容纳的电子数不超过2n2
最外层电子数不超过8(K层为最外层时,电子数不超过2)
次外层电子数不超过18
倒数第三层电子数不超过32
2.能级
同一能层的电子,能量也可能不同,还可分成不同能级(s、p、d、f...)。
能层 K L M N O
能级 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p …
最多电子数 2 2 6 2 6 10 2 6 10 14 2 6 …
由上表可知:
①能层序数____该能层所包含的能级数,如第三能层有_个能级。
② s、p、d、f 各能级可容纳的电子数分别为_、_、_、_的2倍。
等于
3
1
3
5
7
3.能层与能级的组成以及能量的关系
(1)任一能层的能级总是从s能级开始,能级数=能层序数,即第一能层只有1个能级(1s),第二能层有2个能级(2s和2p),第三能层有3个能级(3s、3p和3d),依此次类推。
(2)在每一个能层中,能级符号的顺序是ns、np、nd、nf......(n为能层序数)。
(3)在相同能层各能级能量由低到高的顺序是ns
1.一个能层的能级数与能层序数(n)间存在什么关系?一个能层最多可容纳的电子数与能层序数(n)间存在什么关系
【思考交流】
能层的能级数等于该能层序数。一个能层最多可容纳的电子数为2n2个。
2.以s、p、d、f为符号的能级分别最多可容纳多少个电子 ?3d、4d、5d能级所能容纳的最多电子数是否相同?
以s、p、d、f为符号的各能级可容纳的最多电子数依次为1、3、5、7的二倍。
3d、4d、5d能级所能容纳的最多电子数相同。
3.第五能层最多可容纳多少个电子?它们分别容纳在几个能级中?各能级最多容纳多少个电子?
第五能层最多可容纳50个电子;5个能级;各能级最多容纳电子数分别为2,6,10,14,18个。
√
×
×
√
1. 已知n为能层序数,下列有关认识正确的是( )
A.各能层含有的电子数为2n2
B.各能层的能级都是从s能级开始至f能级结束
C.各能层含有的能级数为n-1
D.各能级最多容纳的电子数按s、p、d、f的顺序依次为1、3、5、7的2倍
D
2、若n=3,以下能级符号错误的是( )
A.np B.nd C.nf D.ns
C
4.(双选)下列有关能层和能级的叙述中正确的是( )
A.M能层有s、p共2个能级,最多能容纳8个电子
B.3d能级最多容纳10个电子,4f能级最多容纳14个电子
C.无论哪一能层的s能级最多容纳的电子数均为2
D.任一能层都有s、p能级,但不一定有d能级
5.(1)Cl原子核外电子能量最高的电子所在的能级是_____。
(2)基态Si原子中,核外电子占据最高能层的符号为____,该能层上有___个能级,电子数为____。
3p
M
3
4
BC
基态与激发态
原子光谱
二、基态与激发态 原子光谱
1.基态与激发态
原子
基态原子
激发态原子
吸收能量
释放能量
处于最低能量
处于较高能量
光(辐射)是电子跃迁释放能量的重要形式。
注意:电子的跃迁是物理变化
基态与激发态相互转化的应用
焰色反应
激光笔
LED灯装饰的建筑夜景
(1)不同元素原子的电子发生跃迁时会吸收或释放不同的光,可以用光谱仪摄取各种元素原子的吸收光谱或发射光谱,总称原子光谱。
E0
E1
E2
E3
En
激发态能级
基态能级
吸收光谱
发射光谱
锂、氦、汞的发射光谱
锂、氦、汞的吸收光谱
特征:暗背景, 亮线,
线状不连续
特征:亮背景,
暗线,
线状不连续
2.原子光谱
基态
K
L
M
N
激发态
K
L
M
N
能量
能量
K
L
M
N
光
K
L
M
N
不稳定
吸收能量
电子跃迁
释放能量
(2)原子光谱的成因与分类
(3)光谱分析:现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为光谱分析。
1.金属元素的焰色试验属于吸收光谱还是发射光谱?
2.霓虹灯内因为充油稀薄氖气或其它稀有气体才会发出颜色各异的光。你能解释其中的原理吗?
发射光谱
当外电源电路接通后,变压器输出端就会产生 几千伏甚至上万伏的高压。当这一高压加到霓虹灯管两端电极上时,霓虹灯管内的稀有气体原子中的带电粒子电子就会发生跃迁,发出五颜六色的光。
【思考与讨论】
6.以下现象与核外电子的跃迁有关的是( )
①霓虹灯发出有色光 ②棱镜分光 ③激光器产生激光 ④石油蒸馏 ⑤凸透镜聚光 ⑥燃放的焰火,在夜空中呈现五彩缤纷的礼花 ⑦日光灯通电发光 ⑧冷却结晶
A.①③⑥⑦ B.②④⑤⑧
C.①③⑤⑥⑦ D.①②③⑤⑥⑦
A
7.下列说法中有错误的是( )
A.某原子K层上只有一个电子
B.某离子M层和L层上的电子数均为K层的4倍
C.某原子M层上的电子数为L层电子数的4倍
D.存在核电荷数与最外层电子数相等的离子
C
8.下列多电子原子不同能级能量高低的比较错误的是( )
A.1s<2s<3s B.2p<3p<4p
C.3s<3p<3d D.4s>3d>3p
D
POWERPOINT
谢谢您的观看
THANKS FOR WATCHING
