2022-2023学年人教版九年级化学上册 第1-7单元复习检测题(含答案)
文档属性
| 名称 | 2022-2023学年人教版九年级化学上册 第1-7单元复习检测题(含答案) |  | |
| 格式 | zip | ||
| 文件大小 | 383.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-26 19:25:20 | ||
图片预览



文档简介
第1-7单元复习检测题
一、选择题(每小题3分,共45分)
1. 2021年5月29日,搭载天舟二号货运飞船的长征七号遥三运载火箭在文昌成功发射。下列操作属于化学变化的是 ( D )
A. 火箭转运 B. 总装调试 C. 燃料注入 D. 点火发射
2. 2021年我国政府工作报告中提出“做好碳中和工作”。碳中和是指通过植树造林,节能减排等措施,抵消因人类活动产生的二氧化碳等温室气体排放量,达到相对“零排放”。下列行为不利于实现碳中和的是 ( A )
A. 大量使用一次性餐具
B. 使用新技术提高传统能源的利用效率
C. 利用风能实现清洁发电
D. 研发新工艺将二氧化碳转化为化工产品
3. 安全问题与人类生活、生产息息相关。下列说法正确的是 ( C )
A. 发现家中天然气泄漏,立刻打开换气扇通风
B. 在有明火的区域内,可以喷洒含酒精的消毒剂
C. 油库、面粉加工厂等场所,必须严禁烟火
D. 扑灭图书档案火灾,最适宜用干粉灭火器
4. “宏观辨识与微观探析”是化学学科核心素养之一。下列微观解释正确的是 ( B )
选项 客观事实 微观解释
A 用水银温度计测温度 原子的质量和体积都很小
B 用过滤法去除水中的杂质 分子种类没有发生变化
C Ca、Ca2+的化学性质不同 微粒中的质子数不同
D O2和O3的化学性质有差异 氧原子的结构不同
5. 口罩是抗击新冠肺炎的“必备武器”。医用口罩生产过程中采用环氧乙烷(C2H4O)杀菌消毒,下列说法正确的是 ( D )
A. 环氧乙烷是氧化物
B. 环氧乙烷中含有7个原子
C. 环氧乙烷由三种非金属组成
D. 环氧乙烷中的碳元素、氢元素的质量比为6∶1
6. 下列涉及化学学科观点的有关说法,其中正确的是 ( B )
A. 微粒观:氯化钠是由氯化钠分子构成的
B. 转化观:O2和CO2在一定条件下可以相互转化
C. 守恒观:1g氢气和1g氧气充分反应后所得水蒸气的质量为2g
D. 结构观:氖原子和钠离子最外层电子数相同,化学性质相同
7. 在试管中进行的下列操作中,正确的是 ( A )
A. 加固体粉末 B. 收集气体 C. 加热液体 D. 滴加液体
8. 根据如图所示的实验判断,下列说法错误的是 ( D )
A. 点燃氢气前要检验纯度
B. 干冷烧杯内壁出现无色液滴
C. 两个实验均可证明水的组成
D. a管气体能使带火星的木条复燃
第8题图
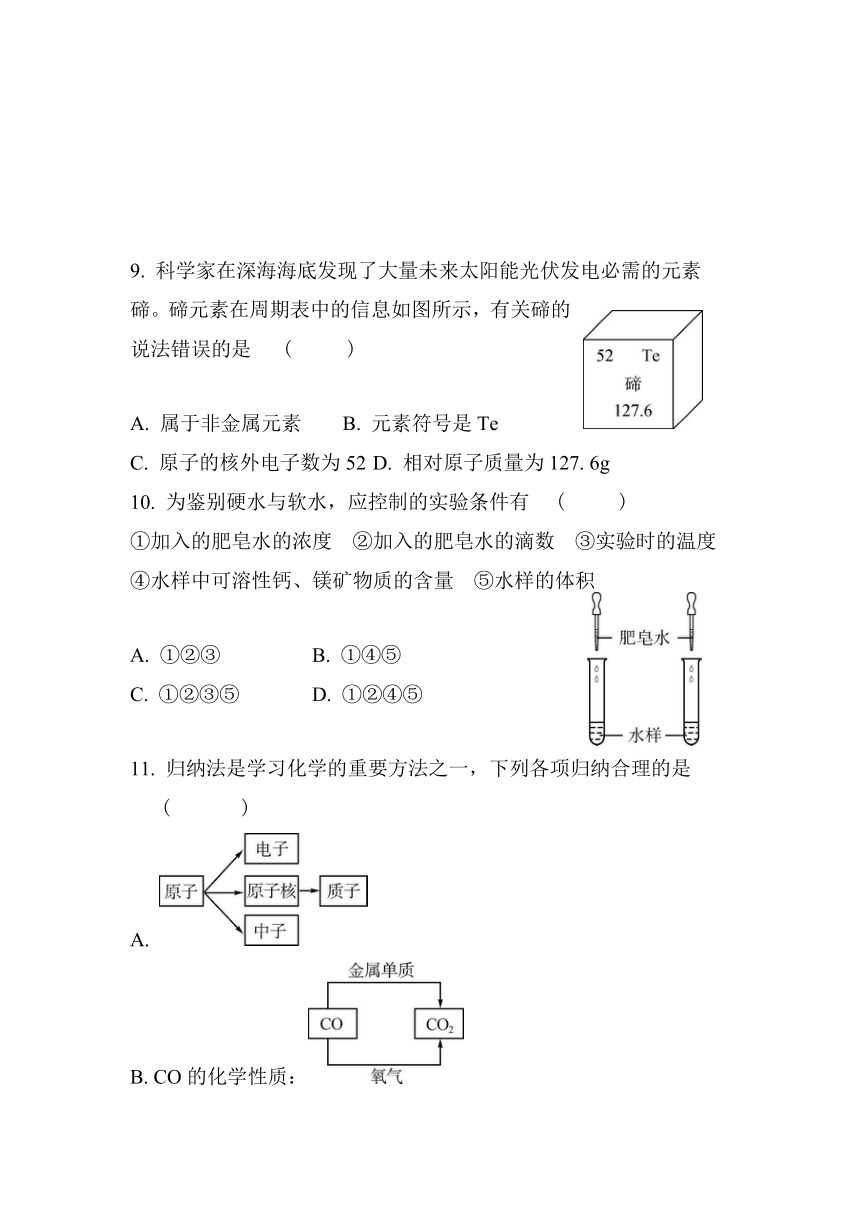
9. 科学家在深海海底发现了大量未来太阳能光伏发电必需的元素碲。碲元素在周期表中的信息如图所示,有关碲的说法错误的是 ( D )
A. 属于非金属元素 B. 元素符号是Te
C. 原子的核外电子数为52 D. 相对原子质量为127. 6g
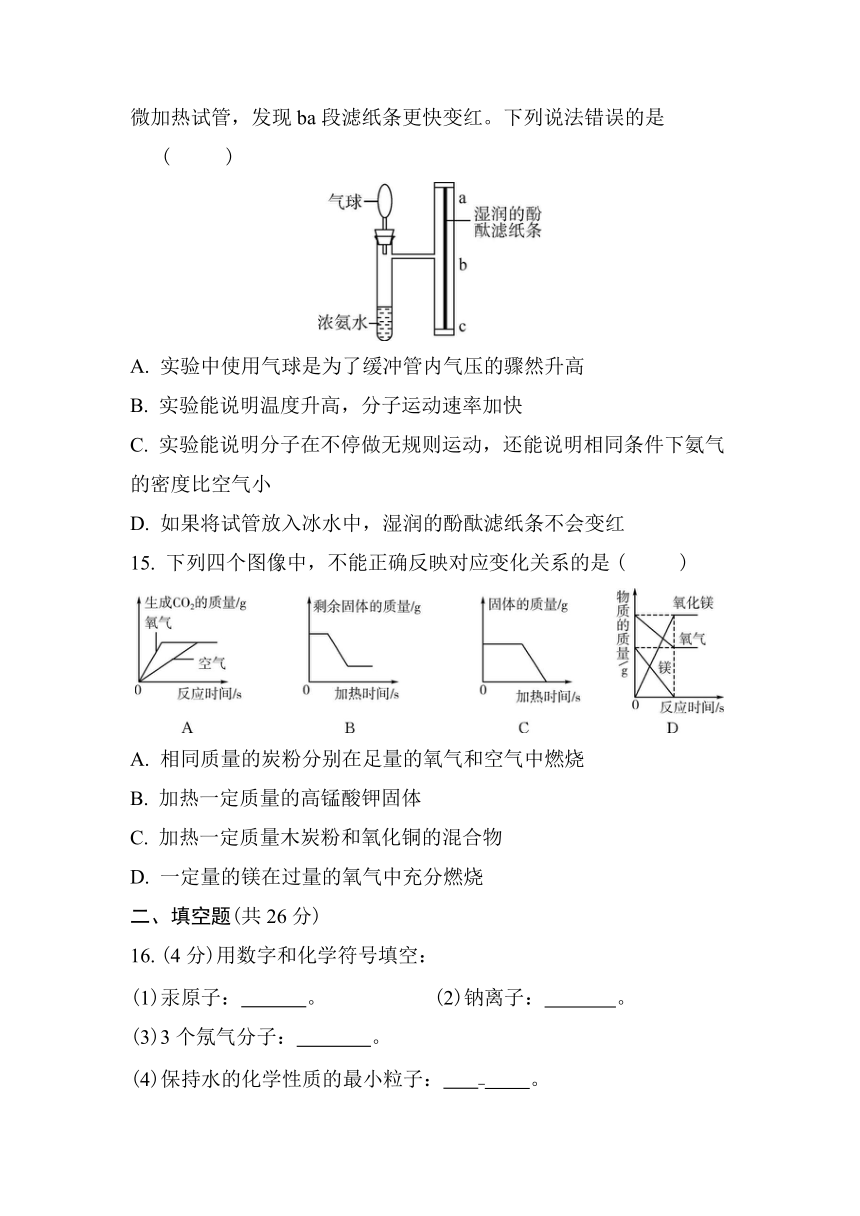
10. 为鉴别硬水与软水,应控制的实验条件有 ( C )
①加入的肥皂水的浓度 ②加入的肥皂水的滴数 ③实验时的温度 ④水样中可溶性钙、镁矿物质的含量 ⑤水样的体积
A. ①②③ B. ①④⑤
C. ①②③⑤ D. ①②④⑤
11. 归纳法是学习化学的重要方法之一,下列各项归纳合理的是 ( )
A.
B. CO的化学性质:
C. 氮元素的化合价:
D. 水的净化方法
12. 化学实验中常用到木条或火柴梗,下列实验方案或操作不能达到目的的是 ( D )
A. 用带火星的木条检验氧气
B. 将火柴梗迅速平放入火焰中,约1~2s后取出,比较火焰各层温度
C. 将火柴系在细铁丝下端,点燃后待火柴快燃尽时伸入氧气中
D. 用燃着的木条区分氮气和二氧化碳
13. 近期,我国科学家成功研制出天然气(主要成分为甲烷)在液态锡催化作用下的高效制氢设备,该设备发生反应的微观原理如图所示,下列说法错误的是 ( A )
A. 甲烷是由碳原子和氢分子构成的
B. 反应前后液态锡的质量和化学性质不变
C. 甲烷中的碳元素转化成碳单质,用于制造高级炭黑
D. 此反应的化学方程式为CH4C+2H2
14. 某化学兴趣小组为探究分子的运动情况,在T形管的粗玻璃管里,固定一根湿润的酚酞滤纸条,进行实验。将浓氨水加入左侧试管中,3分钟后观察到ba段滤纸条先变红。换一根湿润的酚酞滤纸条,微微加热试管,发现ba段滤纸条更快变红。下列说法错误的是 ( D )
A. 实验中使用气球是为了缓冲管内气压的骤然升高
B. 实验能说明温度升高,分子运动速率加快
C. 实验能说明分子在不停做无规则运动,还能说明相同条件下氨气的密度比空气小
D. 如果将试管放入冰水中,湿润的酚酞滤纸条不会变红
15. 下列四个图像中,不能正确反映对应变化关系的是 ( C )
A. 相同质量的炭粉分别在足量的氧气和空气中燃烧
B. 加热一定质量的高锰酸钾固体
C. 加热一定质量木炭粉和氧化铜的混合物
D. 一定量的镁在过量的氧气中充分燃烧
二、填空题(共26分)
16. (4分)用数字和化学符号填空:
(1)汞原子: Hg 。 (2)钠离子: Na+ 。
(3)3个氖气分子: 3Ne 。
(4)保持水的化学性质的最小粒子: H2O 。
17. (14分)自来水厂净水过程的主要操作流程如图,回答下列问题。
资料:常用的絮凝剂有明矾[KAl(SO4)·12H2O],消毒剂有液氯(Cl2)。
(1)操作X的名称是 滤 ,试剂A的名称是 活性炭 。
(2)明矾作絮凝剂是因为明矾与水反应生成氢氧化铝胶状物,氢氧化铝的化学式为 Al 。液氯与水中杂质反应生成一些对人体有害的物质,例如三氯甲烷(CHCl3),三氯甲烷属于 纯净物 (填“纯净物”或“混合物”)。
(3)高铁酸钾(K2FeO4)能作消毒剂与絮凝剂,它杀菌时会生成氢氧化铁胶状物。高铁酸钾中,铁元素的化合价是 +6 。
(4)自来水厂的净水过程 不能 (填“能”或“不能”)将硬水软化成软水,生活中将硬水软化的方法是 煮沸 。
18. (8分)农谚“雷雨发庄稼”的化学原理是雷电时雨水里含有微量硝酸,硝酸的形成过程如图:
(1)HNO3中,N元素的化合价为 。
(2)反应①属于基本反应类型中的 合 反应。
(3)写出反应②的化学方程式: 2N +O22NO2 (无需注明反应条件)。
(4)为了提高氮原子的利用率,可循环利用的物质是 NO (填化学式)。
三、实验探究题(共23分)
19. (9分)下图是初中化学常用的实验装置,请回答下列问题。
(1)仪器a的名称是 。
(2)实验室里可选用装置A制备氧气,写出该反应的化学方程式: 2KClO32KC ;如图F,用制得的氧气做硫燃烧的实验,集气瓶要留少量水的作用是 吸收SO2,减少污染 。
(3)实验室制取CO2应选择的装置组合为 BC ,选择此发生装置的突出优点是 制反应速率 ;检验CO2是否收集满的操作为 把燃着的 在集气瓶口,木条熄灭说明集满 。
(4)图G的装置在化学中有“万能瓶”的美称。若用该装置收集H2,则H2从 b 端进入;若用排水法收集H2,将装置装满水,则H2从 b 端进入。
20. (14分)某校化学探究小组为研究影响石灰石与稀盐酸反应速率的因素,于是进行了以下探究:
【提出问题】石灰石与稀盐酸反应的快慢受哪些因素的影响呢
【猜想与假设】猜想1:可能与温度有关; 猜想2:可能与石灰石形状有关。
【设计实验】
(1)小明设计的实验方案:实验时,小明同时将注射器内足量稀盐酸全部推出后,观察到图1所示现象,于是他得出粉末状石灰石和稀盐酸反应产生二氧化碳较快的结论,写出石灰石与稀盐酸反应的化学方程式: CaCO3+2HCl CaCl2+CO2↑+ 。班级同学对小明设计的实验方案提出质疑,请你指出小明设计方案的不科学之处是 没有控制稀盐酸的体积、浓度( 可) 。
图1
图2
(2)小明按照图2所示实验装置进行实验,并比较收集60mL二氧化碳的时间。
实验编号 温度/℃ 石灰石颗粒(3g) 稀盐酸的浓度 收集60mL二氧化碳的时间/s
① 20 块状 10% 84
② 20 粉末状 10% 43
③ 30 块末状 10% 68
④ 30 粉末状 10% 32
①C装置应该选择 C1 (填“C1”或“C2”)。
②通过对比实验①②,得出的结论是 其他条件相同时,石灰石的颗粒越小,反应速率越快 ;要比较温度对该反应的影响,可以通过实验 ①③或②④ (填实验编号)对比。
【拓展延伸】
(3)除了上述比较的方法外,比较快慢还可以采用的方法是 比较相同时间内收集到的CO2体积(合 。
(4)为探究二氧化碳的性质,小美同学设计了图所示的装置(a、d为浸有紫色石蕊溶液的湿润棉花,b、c为用紫色石蕊溶液浸过的干燥棉花,垂直固定玻璃管的装置未画出)。
①棉球b和c均不变红,这是因为 二氧化碳 变色 。
②棉球d比a先变红,说明 二氧化碳 大(合理即可) 。
四、计算题(共6分)
21. (6分)某锅炉内含较多水垢,水垢的主要成分为碳酸钙。为测定其中碳酸钙的含量,取5. 0g样品并加热,加热过程中剩余固体的质量随加热时间的变化如图所示。
已知:CaCO3CaO+CO2↑,假设其他物质不反应。
(1)纵坐标m点的值为 5. 0 。
(2)求样品中碳酸钙的质量分数。
参考答案
一、1. D 2. A 3. C 4. B 5. D 6. B 7.A 8. D 9. D 10. C 11. C 12. D 13. A 14. D
15.C
二、16. (1)Hg (2)Na+ (3)3Ne (4)H2O
17. (1)过滤 活性炭 (2)Al(OH)3 纯净物 (3)+6 (4)不能 煮沸
18. (1)+5 (2)化合 (3)2NO+O22NO2
(4)NO
三、19.(1)酒精灯 (2)2KClO32KCl+3O2↑ 吸收SO2,减少污染 (3)BC 可以控制反应速率 把燃着的木条放在集气瓶口,木条熄灭说明集满 (4)b b
20. (1) CaCO3+2HCl CaCl2+CO2↑+H2O 没有控制稀盐酸的体积、浓度(合理即可) (2)①C1 ②其他条件相同时,石灰石的颗粒越小,反应速率越快 ①③或②④ (3)比较相同时间内收集到的CO2体积(合理即可) (4)①二氧化碳不能使紫色石蕊变色 ②二氧化碳的密度比空气的大(合理即可)
四、21. (1)5.0
(2)解: 设样品中碳酸钙的质量为x。
CaCO3CaO+CO2↑
100 44
x 5. 0g-3. 68g
= x=3. 0g
样品中碳酸钙的质量分数:×100%=60%。
答:样品中碳酸钙的质量分数为60%。
一、选择题(每小题3分,共45分)
1. 2021年5月29日,搭载天舟二号货运飞船的长征七号遥三运载火箭在文昌成功发射。下列操作属于化学变化的是 ( D )
A. 火箭转运 B. 总装调试 C. 燃料注入 D. 点火发射
2. 2021年我国政府工作报告中提出“做好碳中和工作”。碳中和是指通过植树造林,节能减排等措施,抵消因人类活动产生的二氧化碳等温室气体排放量,达到相对“零排放”。下列行为不利于实现碳中和的是 ( A )
A. 大量使用一次性餐具
B. 使用新技术提高传统能源的利用效率
C. 利用风能实现清洁发电
D. 研发新工艺将二氧化碳转化为化工产品
3. 安全问题与人类生活、生产息息相关。下列说法正确的是 ( C )
A. 发现家中天然气泄漏,立刻打开换气扇通风
B. 在有明火的区域内,可以喷洒含酒精的消毒剂
C. 油库、面粉加工厂等场所,必须严禁烟火
D. 扑灭图书档案火灾,最适宜用干粉灭火器
4. “宏观辨识与微观探析”是化学学科核心素养之一。下列微观解释正确的是 ( B )
选项 客观事实 微观解释
A 用水银温度计测温度 原子的质量和体积都很小
B 用过滤法去除水中的杂质 分子种类没有发生变化
C Ca、Ca2+的化学性质不同 微粒中的质子数不同
D O2和O3的化学性质有差异 氧原子的结构不同
5. 口罩是抗击新冠肺炎的“必备武器”。医用口罩生产过程中采用环氧乙烷(C2H4O)杀菌消毒,下列说法正确的是 ( D )
A. 环氧乙烷是氧化物
B. 环氧乙烷中含有7个原子
C. 环氧乙烷由三种非金属组成
D. 环氧乙烷中的碳元素、氢元素的质量比为6∶1
6. 下列涉及化学学科观点的有关说法,其中正确的是 ( B )
A. 微粒观:氯化钠是由氯化钠分子构成的
B. 转化观:O2和CO2在一定条件下可以相互转化
C. 守恒观:1g氢气和1g氧气充分反应后所得水蒸气的质量为2g
D. 结构观:氖原子和钠离子最外层电子数相同,化学性质相同
7. 在试管中进行的下列操作中,正确的是 ( A )
A. 加固体粉末 B. 收集气体 C. 加热液体 D. 滴加液体
8. 根据如图所示的实验判断,下列说法错误的是 ( D )
A. 点燃氢气前要检验纯度
B. 干冷烧杯内壁出现无色液滴
C. 两个实验均可证明水的组成
D. a管气体能使带火星的木条复燃
第8题图
9. 科学家在深海海底发现了大量未来太阳能光伏发电必需的元素碲。碲元素在周期表中的信息如图所示,有关碲的说法错误的是 ( D )
A. 属于非金属元素 B. 元素符号是Te
C. 原子的核外电子数为52 D. 相对原子质量为127. 6g
10. 为鉴别硬水与软水,应控制的实验条件有 ( C )
①加入的肥皂水的浓度 ②加入的肥皂水的滴数 ③实验时的温度 ④水样中可溶性钙、镁矿物质的含量 ⑤水样的体积
A. ①②③ B. ①④⑤
C. ①②③⑤ D. ①②④⑤
11. 归纳法是学习化学的重要方法之一,下列各项归纳合理的是 ( )
A.
B. CO的化学性质:
C. 氮元素的化合价:
D. 水的净化方法
12. 化学实验中常用到木条或火柴梗,下列实验方案或操作不能达到目的的是 ( D )
A. 用带火星的木条检验氧气
B. 将火柴梗迅速平放入火焰中,约1~2s后取出,比较火焰各层温度
C. 将火柴系在细铁丝下端,点燃后待火柴快燃尽时伸入氧气中
D. 用燃着的木条区分氮气和二氧化碳
13. 近期,我国科学家成功研制出天然气(主要成分为甲烷)在液态锡催化作用下的高效制氢设备,该设备发生反应的微观原理如图所示,下列说法错误的是 ( A )
A. 甲烷是由碳原子和氢分子构成的
B. 反应前后液态锡的质量和化学性质不变
C. 甲烷中的碳元素转化成碳单质,用于制造高级炭黑
D. 此反应的化学方程式为CH4C+2H2
14. 某化学兴趣小组为探究分子的运动情况,在T形管的粗玻璃管里,固定一根湿润的酚酞滤纸条,进行实验。将浓氨水加入左侧试管中,3分钟后观察到ba段滤纸条先变红。换一根湿润的酚酞滤纸条,微微加热试管,发现ba段滤纸条更快变红。下列说法错误的是 ( D )
A. 实验中使用气球是为了缓冲管内气压的骤然升高
B. 实验能说明温度升高,分子运动速率加快
C. 实验能说明分子在不停做无规则运动,还能说明相同条件下氨气的密度比空气小
D. 如果将试管放入冰水中,湿润的酚酞滤纸条不会变红
15. 下列四个图像中,不能正确反映对应变化关系的是 ( C )
A. 相同质量的炭粉分别在足量的氧气和空气中燃烧
B. 加热一定质量的高锰酸钾固体
C. 加热一定质量木炭粉和氧化铜的混合物
D. 一定量的镁在过量的氧气中充分燃烧
二、填空题(共26分)
16. (4分)用数字和化学符号填空:
(1)汞原子: Hg 。 (2)钠离子: Na+ 。
(3)3个氖气分子: 3Ne 。
(4)保持水的化学性质的最小粒子: H2O 。
17. (14分)自来水厂净水过程的主要操作流程如图,回答下列问题。
资料:常用的絮凝剂有明矾[KAl(SO4)·12H2O],消毒剂有液氯(Cl2)。
(1)操作X的名称是 滤 ,试剂A的名称是 活性炭 。
(2)明矾作絮凝剂是因为明矾与水反应生成氢氧化铝胶状物,氢氧化铝的化学式为 Al 。液氯与水中杂质反应生成一些对人体有害的物质,例如三氯甲烷(CHCl3),三氯甲烷属于 纯净物 (填“纯净物”或“混合物”)。
(3)高铁酸钾(K2FeO4)能作消毒剂与絮凝剂,它杀菌时会生成氢氧化铁胶状物。高铁酸钾中,铁元素的化合价是 +6 。
(4)自来水厂的净水过程 不能 (填“能”或“不能”)将硬水软化成软水,生活中将硬水软化的方法是 煮沸 。
18. (8分)农谚“雷雨发庄稼”的化学原理是雷电时雨水里含有微量硝酸,硝酸的形成过程如图:
(1)HNO3中,N元素的化合价为 。
(2)反应①属于基本反应类型中的 合 反应。
(3)写出反应②的化学方程式: 2N +O22NO2 (无需注明反应条件)。
(4)为了提高氮原子的利用率,可循环利用的物质是 NO (填化学式)。
三、实验探究题(共23分)
19. (9分)下图是初中化学常用的实验装置,请回答下列问题。
(1)仪器a的名称是 。
(2)实验室里可选用装置A制备氧气,写出该反应的化学方程式: 2KClO32KC ;如图F,用制得的氧气做硫燃烧的实验,集气瓶要留少量水的作用是 吸收SO2,减少污染 。
(3)实验室制取CO2应选择的装置组合为 BC ,选择此发生装置的突出优点是 制反应速率 ;检验CO2是否收集满的操作为 把燃着的 在集气瓶口,木条熄灭说明集满 。
(4)图G的装置在化学中有“万能瓶”的美称。若用该装置收集H2,则H2从 b 端进入;若用排水法收集H2,将装置装满水,则H2从 b 端进入。
20. (14分)某校化学探究小组为研究影响石灰石与稀盐酸反应速率的因素,于是进行了以下探究:
【提出问题】石灰石与稀盐酸反应的快慢受哪些因素的影响呢
【猜想与假设】猜想1:可能与温度有关; 猜想2:可能与石灰石形状有关。
【设计实验】
(1)小明设计的实验方案:实验时,小明同时将注射器内足量稀盐酸全部推出后,观察到图1所示现象,于是他得出粉末状石灰石和稀盐酸反应产生二氧化碳较快的结论,写出石灰石与稀盐酸反应的化学方程式: CaCO3+2HCl CaCl2+CO2↑+ 。班级同学对小明设计的实验方案提出质疑,请你指出小明设计方案的不科学之处是 没有控制稀盐酸的体积、浓度( 可) 。
图1
图2
(2)小明按照图2所示实验装置进行实验,并比较收集60mL二氧化碳的时间。
实验编号 温度/℃ 石灰石颗粒(3g) 稀盐酸的浓度 收集60mL二氧化碳的时间/s
① 20 块状 10% 84
② 20 粉末状 10% 43
③ 30 块末状 10% 68
④ 30 粉末状 10% 32
①C装置应该选择 C1 (填“C1”或“C2”)。
②通过对比实验①②,得出的结论是 其他条件相同时,石灰石的颗粒越小,反应速率越快 ;要比较温度对该反应的影响,可以通过实验 ①③或②④ (填实验编号)对比。
【拓展延伸】
(3)除了上述比较的方法外,比较快慢还可以采用的方法是 比较相同时间内收集到的CO2体积(合 。
(4)为探究二氧化碳的性质,小美同学设计了图所示的装置(a、d为浸有紫色石蕊溶液的湿润棉花,b、c为用紫色石蕊溶液浸过的干燥棉花,垂直固定玻璃管的装置未画出)。
①棉球b和c均不变红,这是因为 二氧化碳 变色 。
②棉球d比a先变红,说明 二氧化碳 大(合理即可) 。
四、计算题(共6分)
21. (6分)某锅炉内含较多水垢,水垢的主要成分为碳酸钙。为测定其中碳酸钙的含量,取5. 0g样品并加热,加热过程中剩余固体的质量随加热时间的变化如图所示。
已知:CaCO3CaO+CO2↑,假设其他物质不反应。
(1)纵坐标m点的值为 5. 0 。
(2)求样品中碳酸钙的质量分数。
参考答案
一、1. D 2. A 3. C 4. B 5. D 6. B 7.A 8. D 9. D 10. C 11. C 12. D 13. A 14. D
15.C
二、16. (1)Hg (2)Na+ (3)3Ne (4)H2O
17. (1)过滤 活性炭 (2)Al(OH)3 纯净物 (3)+6 (4)不能 煮沸
18. (1)+5 (2)化合 (3)2NO+O22NO2
(4)NO
三、19.(1)酒精灯 (2)2KClO32KCl+3O2↑ 吸收SO2,减少污染 (3)BC 可以控制反应速率 把燃着的木条放在集气瓶口,木条熄灭说明集满 (4)b b
20. (1) CaCO3+2HCl CaCl2+CO2↑+H2O 没有控制稀盐酸的体积、浓度(合理即可) (2)①C1 ②其他条件相同时,石灰石的颗粒越小,反应速率越快 ①③或②④ (3)比较相同时间内收集到的CO2体积(合理即可) (4)①二氧化碳不能使紫色石蕊变色 ②二氧化碳的密度比空气的大(合理即可)
四、21. (1)5.0
(2)解: 设样品中碳酸钙的质量为x。
CaCO3CaO+CO2↑
100 44
x 5. 0g-3. 68g
= x=3. 0g
样品中碳酸钙的质量分数:×100%=60%。
答:样品中碳酸钙的质量分数为60%。
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
