第四单元我们周围的空气复习课件—2022-2023学年八年级化学鲁教版(五四学制)全一册(共17张PPT)
文档属性
| 名称 | 第四单元我们周围的空气复习课件—2022-2023学年八年级化学鲁教版(五四学制)全一册(共17张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-26 21:13:55 | ||
图片预览





文档简介
(共17张PPT)
复习课
我们周围的空气
知识点一:
空气
要点:
1.空气的成分
2.空气的污染
3.空气中氧气体积的测定
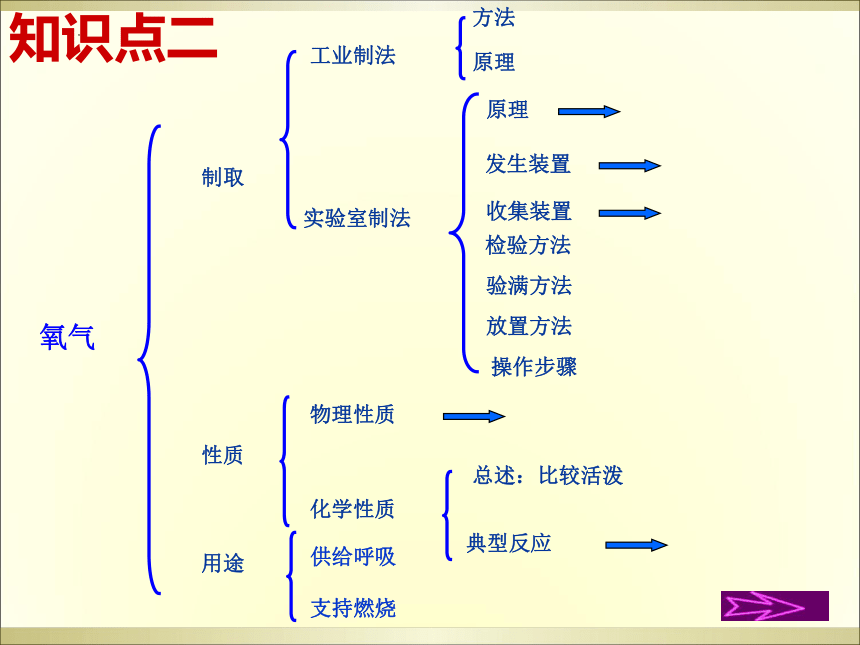
氧气
制取
性质
用途
工业制法
实验室制法
物理性质
化学性质
总述:比较活泼
典型反应
原理
发生装置
检验方法
操作步骤
收集装置
验满方法
放置方法
方法
原理
供给呼吸
支持燃烧
知识点二
实验室制氧气的化学反应原理
1、氯酸钾 氯化钾+氧气
(KClO3) (KCl)(O2)
2、高锰酸钾 锰酸钾+二氧化锰+氧气
(KMnO4) (K2MnO4 (MnO2) (O2)
3、过氧化氢 水 + 氧气
(H2O2) (H2O)(O2)
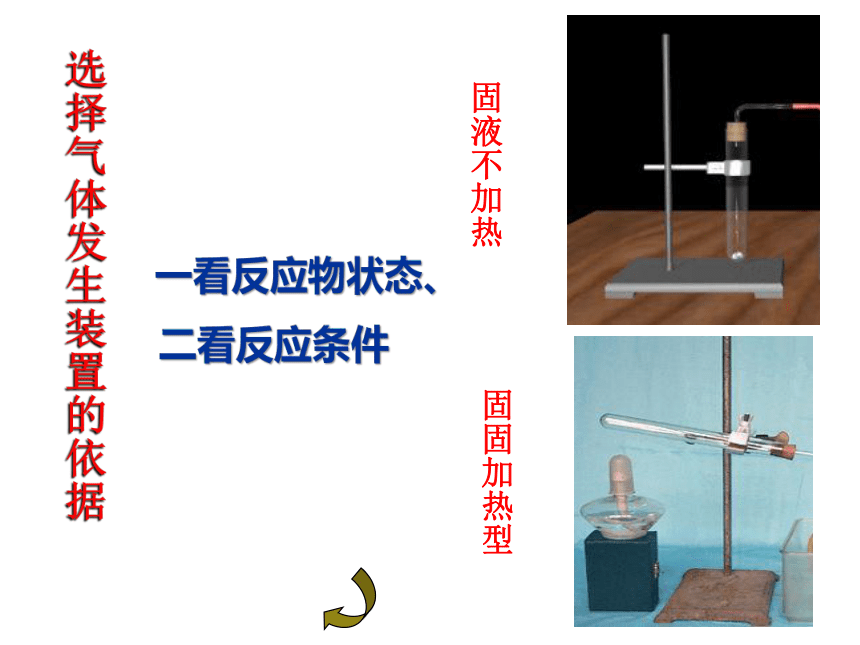
一看反应物状态、
二看反应条件
固液不加热
固固加热型
选择气体发生装置的依据
排水集气法:
向上排空气法:
向下排空气法:
难溶或不易溶于水
且不与水反应
密度比空气大
且不与空气中的物质反应
密度比空气小且不与空气中的物质反应
一看密度、
二看溶解性
选择气体收集装置的依据:
氧气的物理性质
1、色、味、态:
2、密度:
3、水溶性:
4、三态变化:
在通常情况下是无色、无味的气体
密度比空气略大(标准状况下)
不易溶于水
气体 液体 固体(无色) (淡蓝色) (淡蓝色)
降温、加压
降温、加压
碳+氧气 点 燃 二氧化碳
( CO2 )
铁+氧气 点 燃 四氧化三铁
( Fe3O4 )
石蜡+氧气 点 燃 二氧化碳+水
典型反应
(2)化学性质:
氧气是一种化学性质比较活泼的气体,它在氧化反应中提供氧,具有氧化性,是一种常见的氧化剂。
氧化反应与化合反应的关系:
硫化氢(H2S)是一种有毒气体,其密度比空气的密度大,且能溶于水形成氢硫酸。实验室通常用块状固体硫化亚铁(FeS)和稀硫酸混合,在常温下通过发生复分解反应制得硫化氢气体。试回答:
①制取硫化氢气体的发生装置可以选用
②若用C装置收集硫化氢气体,进气口应为 ,原因是
③做上述实验时,为了防止多余的硫化氢逸出污染环境,可以将其通入装置 吸收.
中考热点一:气体的制取
若气体密度大于空气密度,应从___端进;
a
b
a
a
b
----H2O
若气体难溶于水,可用排水法收集,
应从___端进
b
若气体密度小于空气密度,应从___端进
b
长进短出
短进长出
短进长出
比较下列装置的优点及各自的适用范围(从反应的剧烈程度和制取气体量的多少来考虑)
仪器简单组装方便用于制取少量气体
可随时添加液体用于平稳反应并制取较多气体
可连续制取并控制反应速率用于剧烈反应并制取较多气体
可控制反应的发生和停止用于平稳反应并持续时间较长的制取气体
热点 二 空气中氧气含量的测定
比较下列测定空气中氧气含量的装置,它们的原理是什么?
想一想:反应物的选择应符合什么样的条件?
1.易与氧气反应
2.只与氧气反应
3.不能生成气体
磷(白磷或红磷)
铜(铜丝或铜粉)
用磷(红磷或白磷)作反应物
这些装置虽然各不相同,但原理都是一样的都是通过物质与空气中的氧气反应,使密闭容器中的气体减少,减少的体积即为氧气的体积。
由此我们知道了:要测混合物中某一成分的体积分数,若不能直接测出也可以通过“消耗法”法间接的得出。
用铜(铜丝或铜粉)作反应物
实验过程中应注意的问题:
1.装置必须气密性良好。
2.反应物必须过量。
3.装置必须冷却到室温才能读数。
4.用铜作反应物时要注意注射器活塞的推拉速度和次数。
加油!
复习课
我们周围的空气
知识点一:
空气
要点:
1.空气的成分
2.空气的污染
3.空气中氧气体积的测定
氧气
制取
性质
用途
工业制法
实验室制法
物理性质
化学性质
总述:比较活泼
典型反应
原理
发生装置
检验方法
操作步骤
收集装置
验满方法
放置方法
方法
原理
供给呼吸
支持燃烧
知识点二
实验室制氧气的化学反应原理
1、氯酸钾 氯化钾+氧气
(KClO3) (KCl)(O2)
2、高锰酸钾 锰酸钾+二氧化锰+氧气
(KMnO4) (K2MnO4 (MnO2) (O2)
3、过氧化氢 水 + 氧气
(H2O2) (H2O)(O2)
一看反应物状态、
二看反应条件
固液不加热
固固加热型
选择气体发生装置的依据
排水集气法:
向上排空气法:
向下排空气法:
难溶或不易溶于水
且不与水反应
密度比空气大
且不与空气中的物质反应
密度比空气小且不与空气中的物质反应
一看密度、
二看溶解性
选择气体收集装置的依据:
氧气的物理性质
1、色、味、态:
2、密度:
3、水溶性:
4、三态变化:
在通常情况下是无色、无味的气体
密度比空气略大(标准状况下)
不易溶于水
气体 液体 固体(无色) (淡蓝色) (淡蓝色)
降温、加压
降温、加压
碳+氧气 点 燃 二氧化碳
( CO2 )
铁+氧气 点 燃 四氧化三铁
( Fe3O4 )
石蜡+氧气 点 燃 二氧化碳+水
典型反应
(2)化学性质:
氧气是一种化学性质比较活泼的气体,它在氧化反应中提供氧,具有氧化性,是一种常见的氧化剂。
氧化反应与化合反应的关系:
硫化氢(H2S)是一种有毒气体,其密度比空气的密度大,且能溶于水形成氢硫酸。实验室通常用块状固体硫化亚铁(FeS)和稀硫酸混合,在常温下通过发生复分解反应制得硫化氢气体。试回答:
①制取硫化氢气体的发生装置可以选用
②若用C装置收集硫化氢气体,进气口应为 ,原因是
③做上述实验时,为了防止多余的硫化氢逸出污染环境,可以将其通入装置 吸收.
中考热点一:气体的制取
若气体密度大于空气密度,应从___端进;
a
b
a
a
b
----H2O
若气体难溶于水,可用排水法收集,
应从___端进
b
若气体密度小于空气密度,应从___端进
b
长进短出
短进长出
短进长出
比较下列装置的优点及各自的适用范围(从反应的剧烈程度和制取气体量的多少来考虑)
仪器简单组装方便用于制取少量气体
可随时添加液体用于平稳反应并制取较多气体
可连续制取并控制反应速率用于剧烈反应并制取较多气体
可控制反应的发生和停止用于平稳反应并持续时间较长的制取气体
热点 二 空气中氧气含量的测定
比较下列测定空气中氧气含量的装置,它们的原理是什么?
想一想:反应物的选择应符合什么样的条件?
1.易与氧气反应
2.只与氧气反应
3.不能生成气体
磷(白磷或红磷)
铜(铜丝或铜粉)
用磷(红磷或白磷)作反应物
这些装置虽然各不相同,但原理都是一样的都是通过物质与空气中的氧气反应,使密闭容器中的气体减少,减少的体积即为氧气的体积。
由此我们知道了:要测混合物中某一成分的体积分数,若不能直接测出也可以通过“消耗法”法间接的得出。
用铜(铜丝或铜粉)作反应物
实验过程中应注意的问题:
1.装置必须气密性良好。
2.反应物必须过量。
3.装置必须冷却到室温才能读数。
4.用铜作反应物时要注意注射器活塞的推拉速度和次数。
加油!
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 自然界中的水
- 第三节 水分子的变化
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 物质构成的奥秘
- 第一节 原子的构成
- 第二节 元素
- 第三节 物质组成的表示
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去 二氧化碳的实验室制取与性质
