化学人教版(2019)必修第二册7.3.1乙醇(共45张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册7.3.1乙醇(共45张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-27 15:19:27 | ||
图片预览








文档简介
(共45张PPT)
第三节 乙醇与乙酸
第1课时 乙醇
【课程标准】
1.通过联系卤代烃及乙醇结构,了解烃的衍生物和官能团的概念。
2.联系生活实际,了解乙醇的物理性质和主要用途。
3.掌握乙醇的分子结构和主要化学性质。
【素养目标】
1.通过乙醇结构式中键的断裂认识乙醇的化学性质,从微观角度分析乙醇的结构,形成“结构决定性质”的观念。 (宏观辨识与微观探析)
2.通过利用有机物分子结构上的变化,建立有机反应原理的学习模型,并能运用模型解释化学现象。 (证据推理与模型认知)
课前自主学习
学习任务 乙醇的结构、性质及烃的衍生物
任务驱动:
乙醇与烃相比较分子结构中多了氧元素,乙醇属于哪类有机物 具有什么样的性质
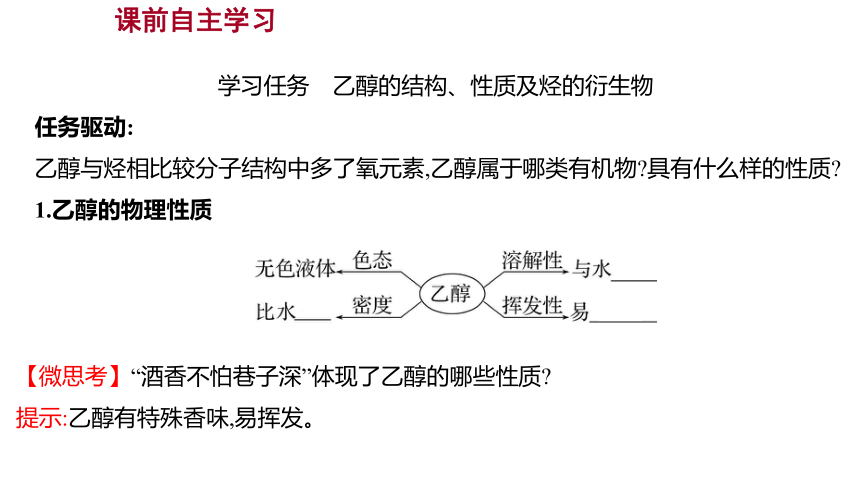
1.乙醇的物理性质
【微思考】“酒香不怕巷子深”体现了乙醇的哪些性质
提示:乙醇有特殊香味,易挥发。
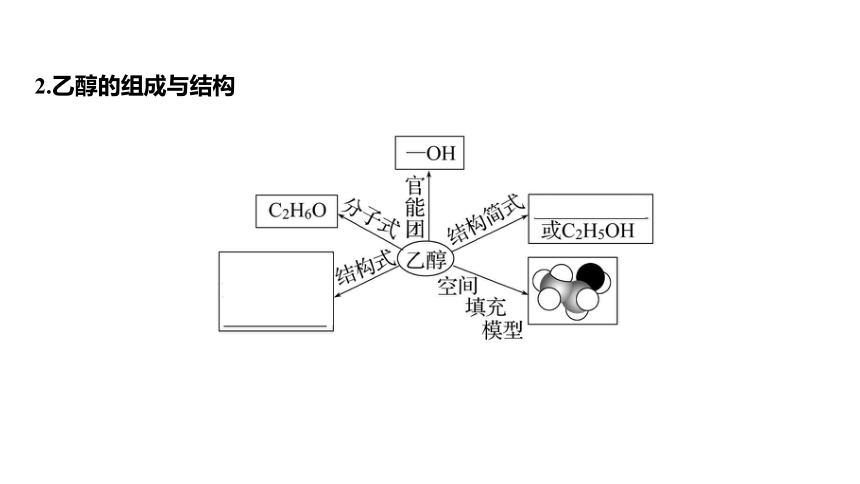
2.乙醇的组成与结构
3.烃的衍生物
(1)概念:烃分子中的_______被其他原子或原子团所_____而生成的一系列化合物。
(2)官能团:决定有机化合物的_________的原子或原子团。
(3)实例。
CH2=CH2的官能团为碳碳双键( ),CH≡CH的官能团为碳碳三键(—C≡C—)。
氢原子
取代
化学特性
【巧判断】(1)乙烯的官能团是碳碳双键,乙烷的官能团是碳碳单键。 ( )
提示:乙烷中没有官能团。
(2)乙醇的官能团是OH-。 ( )
提示:官能团均为电中性基团,乙醇的官能团是羟基(—OH)不是OH-。
×
×
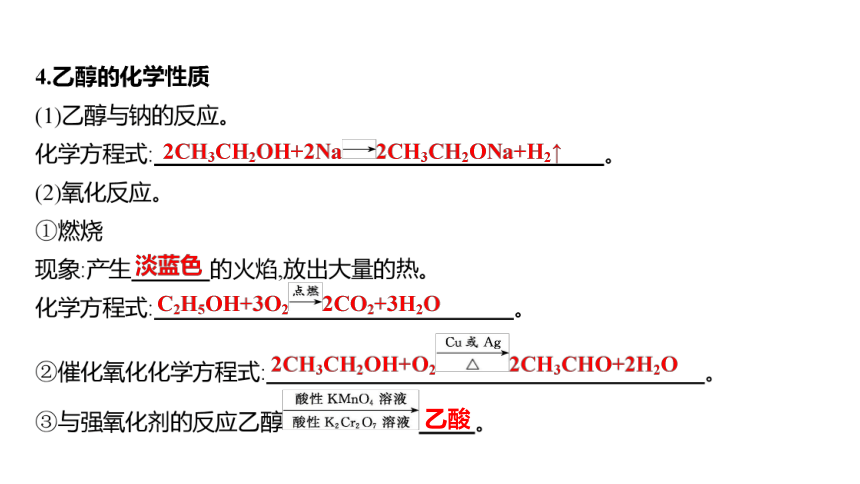
乙酸
课堂合作探究
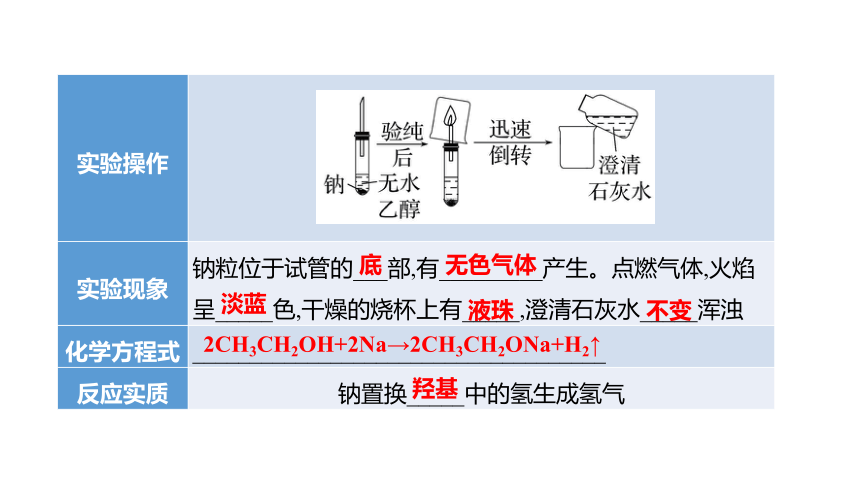
实验操作
实验现象 钠粒位于试管的___部,有_________产生。点燃气体,火焰
呈_____色,干燥的烧杯上有_____,澄清石灰水_____浑浊
化学方程式 ____________________________________
反应实质 钠置换_____中的氢生成氢气
底
无色气体
淡蓝
液珠
不变
2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
羟基
红色
黑色
红色
刺激性
课堂学业达标
第三节 乙醇与乙酸
第1课时 乙醇
【课程标准】
1.通过联系卤代烃及乙醇结构,了解烃的衍生物和官能团的概念。
2.联系生活实际,了解乙醇的物理性质和主要用途。
3.掌握乙醇的分子结构和主要化学性质。
【素养目标】
1.通过乙醇结构式中键的断裂认识乙醇的化学性质,从微观角度分析乙醇的结构,形成“结构决定性质”的观念。 (宏观辨识与微观探析)
2.通过利用有机物分子结构上的变化,建立有机反应原理的学习模型,并能运用模型解释化学现象。 (证据推理与模型认知)
课前自主学习
学习任务 乙醇的结构、性质及烃的衍生物
任务驱动:
乙醇与烃相比较分子结构中多了氧元素,乙醇属于哪类有机物 具有什么样的性质
1.乙醇的物理性质
【微思考】“酒香不怕巷子深”体现了乙醇的哪些性质
提示:乙醇有特殊香味,易挥发。
2.乙醇的组成与结构
3.烃的衍生物
(1)概念:烃分子中的_______被其他原子或原子团所_____而生成的一系列化合物。
(2)官能团:决定有机化合物的_________的原子或原子团。
(3)实例。
CH2=CH2的官能团为碳碳双键( ),CH≡CH的官能团为碳碳三键(—C≡C—)。
氢原子
取代
化学特性
【巧判断】(1)乙烯的官能团是碳碳双键,乙烷的官能团是碳碳单键。 ( )
提示:乙烷中没有官能团。
(2)乙醇的官能团是OH-。 ( )
提示:官能团均为电中性基团,乙醇的官能团是羟基(—OH)不是OH-。
×
×
乙酸
课堂合作探究
实验操作
实验现象 钠粒位于试管的___部,有_________产生。点燃气体,火焰
呈_____色,干燥的烧杯上有_____,澄清石灰水_____浑浊
化学方程式 ____________________________________
反应实质 钠置换_____中的氢生成氢气
底
无色气体
淡蓝
液珠
不变
2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
羟基
红色
黑色
红色
刺激性
课堂学业达标
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
