人教版必修一 1.2.2 离子反应(离子反应)课件(24张PPT)
文档属性
| 名称 | 人教版必修一 1.2.2 离子反应(离子反应)课件(24张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-27 15:46:49 | ||
图片预览






文档简介
(共24张PPT)
第一章 第二节
离子反应
第二课时 离子反应
【学习任务二】学习分散系的分类
【课前思考】
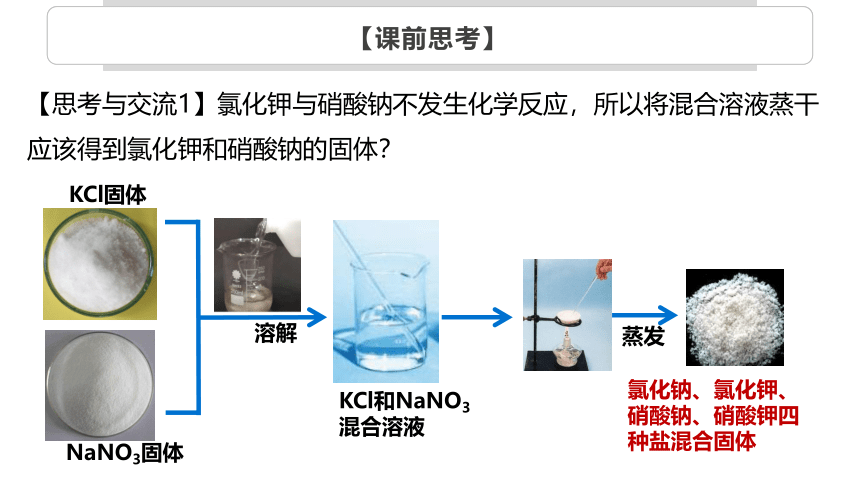
【思考与交流1】氯化钾与硝酸钠不发生化学反应,所以将混合溶液蒸干应该得到氯化钾和硝酸钠的固体?
KCl固体
NaNO3固体
溶解
KCl和NaNO3
混合溶液
蒸发
氯化钠、氯化钾、硝酸钠、硝酸钾四种盐混合固体
【学习任务一】离子反应
Na2SO4
溶液
BaCl2溶液
现象 分析 Na2SO4和BaCl2的 电离方程式 混合前两溶液中的离子 混合后溶液
中的离子
向盛有2mL Na2SO4稀溶液的试管中加入2mL BaCl2稀溶液,观察现象并进行分析。请同学们互相讨论填写下表。
【实验与探究】
Na2SO4=2Na+ + SO42-
BaCl2=Ba2+ + 2Cl-
白色沉淀
【学习任务二】学习分散系的分类
【学习任务一】离子反应
Na2SO4溶液
BaCl2溶液
混合氯化钡和硫酸钠溶液,实际上是将四种离子(Na+、SO42-、Ba2+、Cl-)混合,SO42-和Ba2+结合为BaSO4沉淀析出,Na+和Cl-并未参与反应,只是剩余在溶液中。
Na2SO4 + BaCl2= BaSO4↓ + 2NaCl
SO42- + Ba2+ = BaSO4↓
电解质在溶液中实际是以离子形式发生反应
Na+
SO42-
Ba2+、
Cl-
BaSO4
Na+、Cl-
宏观
微观
【学习任务二】学习分散系的分类
KCl固体
NaNO3固体
溶解
KCl和NaNO3
混合溶液
蒸发
K+ Cl-
Na+ NO3-
KCl
KNO3
NaCl
K+、NO3-
Na+、Cl-
在溶液中电解质常常以离子形式存在,我们不能停留在物质层面上理解溶液中的电解质,应该深入到微观领域,从离子的角度出发,重新审视溶液中的电解质。
NaNO3
【学习任务一】离子反应
【学习任务二】学习分散系的分类
【学习任务二】离子反应及方程式
一、离子反应
定义:电解质在溶液中的反应实质上是离子之间的反应,在中学阶段仅限于在溶液中进行的反应。
二、离子方程式
1. 用实际参加反应的离子符号来表示反应的式子。
Na2SO4 + BaCl2= BaSO4↓ + 2NaCl
化学方程式:
SO42- + Ba2+ = BaSO4↓
离子方程式:
【学习任务二】学习分散系的分类
【学习任务二】离子反应及方程式
(1)写出化学方程式:Na2SO4 + BaCl2= BaSO4↓ + 2NaCl
(2)将易溶于水且易电离的物质拆写成离子形式,其余物质仍以化学式表示:
2Na+ + SO42- + Ba2+ + 2Cl- = BaSO4↓ + 2Na+ + 2Cl-
(3)删去方程式两边不参加反应的离子,并将方程式化成最简:
SO42- + Ba2+ = BaSO4↓
(4)检查离子方程式两边各元素的原子个数和电荷总数是否相等:
离子方程式的书写方法
SO42- + Ba2+ = BaSO4↓
2- + 2+ = 0
电荷守恒
【学习任务二】学习分散系的分类
【学习任务二】离子反应及方程式
(2)将易溶于水且易电离的物质拆写成离子形式,难溶的物质、气体和水等仍用化学式表示。
电解质的拆分是离子方程式书写的关键,在拆分时一定要注意以下问题:
①能够进行拆分的只有易溶易电离的物质(强酸、强碱和大多数可溶盐)
②拆分时应该按照电离方程式的形式进行拆分,注意方程式中的系数。
③其余不能拆分的物质不变,注意反应条件和沉淀、气体符号都不能改变。
【书写关键】
书写原则 物质类型
能拆成离子的物质 ①强酸:HCl、H2SO4、HNO3等
②强碱:KOH、NaOH、Ba(OH)2等
③可溶性盐:NaCl、K2SO4、NaNO3等
不能拆成离子的物质 ①单质 ②气体 ③氧化物
④难溶物:Cu(OH)2、BaSO4、AgCl等
⑤难电离的物质:CH3COOH、NH3·H2O、H2O
⑥非电解质:乙醇等
⑦浓硫酸
常见物质的拆分原则
2、微溶物的书写原则[Ca(OH)2、CaSO4、Ag2SO4、MgCO3等]
【学习活动1】阅读P127部分酸、碱、盐的溶解性表,总结出规律。
补充:溶解性口诀:
钾钠铵盐硝酸溶;
氨钾钠钡溶钙微(碱);
铵钾和钠溶镁微(碳酸盐);
盐酸不溶亚汞银;
硫酸不溶铅和钡,
还有钙和银是微。
OH- NO3- Cl- SO42- CO32-
H+
NH4+
K+
Na+
Ba2+
Ca2+
Mg2+
Al3+
Mn2+
Zn2+
Fe2+
Fe3+
Cu2+
Ag+
【学习任务二】学习分散系的分类
【学习任务三】学习中和反应的本质及离子反应的意义
反应物 化学方程式 离子方程式
①HCl + NaOH HCl + NaOH = NaCl + H2O H+ + OH- = H2O
②HCl + KOH HCl + KOH = KCl + H2O H+ + OH- = H2O
③H2SO4 + NaOH H2SO4 + 2NaOH = Na2SO4 + 2H2O H+ + OH- = H2O
④H2SO4 + KOH H2SO4 + 2KOH = K2SO4 + 2H2O H+ + OH- = H2O
【学习活动2】完成P17“思考与讨论”表中各反应的化学方程式和离子方程式,思考两种方程式在表示某一类反应时,表达的含义有什么不同,并进行讨论。
4个反应的化学方程式不同,但其离子方程式却相同
【学习任务二】学习分散系的分类
【学习任务三】学习中和反应的本质及离子反应的意义
反应物 化学方程式 离子方程式
①AgNO3+NaCl
②AgNO3+HCl
③Ba(OH)2+H2SO4
④CaCO3 + HCl
⑤NaHCO3+H2SO4
【学习任务二】学习分散系的分类
【学习任务三】学习中和反应的本质及离子反应的意义
反应物 化学方程式 离子方程式
①AgNO3+NaCl AgNO3 + NaCl = AgCl↓ + NaNO3 Ag+ + Cl- = AgCl↓
②AgNO3+HCl AgNO3 + HCl = AgCl↓ + HNO3 Ag+ + Cl- = AgCl↓
③Ba(OH)2+H2SO4 Ba(OH)2 + H2SO4 = BaSO4↓ + 2H2O Ba2+ + 2OH- + 2H+ + SO42- = BaSO4↓ + 2H2O
④CaCO3 + HCl CaCO3 + 2HCl = CaCl2 + H2O + CO2↑ CaCO3 + 2H+ = Ca2+ + H2O + CO2↑
⑤NaHCO3+H2SO4 2NaHCO3+H2SO4 = Na2SO4 + 2H2O + 2CO2↑ HCO3- + H+ = H2O + CO2↑
有的离子方程式可能出现某一侧所有物质均不能拆分的情况,例如③中所有生成物均不能拆分。
2HCO3- + 2H+ = 2H2O + 2CO2↑
化简
【学习任务二】学习分散系的分类
【学习任务三】学习中和反应的本质及离子反应的意义
反应物 化学方程式 离子方程式
①HCl + NaOH HCl + NaOH = NaCl + H2O H+ + OH- = H2O
②HCl + KOH HCl + KOH = KCl + H2O H+ + OH- = H2O
③H2SO4 + NaOH H2SO4 + 2NaOH = Na2SO4 + 2H2O H+ + OH- = H2O
④H2SO4 + KOH H2SO4 + 2KOH = K2SO4 + 2H2O H+ + OH- = H2O
反应物 化学方程式 离子方程式
①AgNO3+NaCl AgNO3 + NaCl = AgCl↓ + NaNO3 Ag+ + Cl- = AgCl↓
②AgNO3+HCl AgNO3 + HCl = AgCl↓ + HNO3 Ag+ + Cl- = AgCl↓
2. 离子方程式表示的意义
①表示某一个具体的化学反应
如CaCl2+Na2CO3 = CaCO3↓+2NaCl可用离子方程式
Ca2++ = CaCO3↓表示。
②表示同一类型的离子反应
如NaOH和HCl、NaOH和HNO3、KOH和H2SO4的反应都 可用离子方程式H++OH- = H2O表示。
【学习任务二】学习分散系的分类
【学习任务三】学习中和反应的本质及离子反应的意义
【学习任务二】学习分散系的分类
【学习任务四】离子反应发生的条件
【思考与交流3】
问题1:以下反应属于哪一类反应?
问题2:为什么都可以发生离子反应?
问题3:发生离子反应的条件是什么?
【学习任务二】学习分散系的分类
【学习任务四】离子反应发生的条件
4.离子反应发生的条件
(1)复分解型的离子反应发生的条件是:生成沉淀、放出气体或者生成水。
(2)其他类型的离子反应,例如有离子参加的置换反应:
锌与稀硫酸反应 :Zn + 2H+= Zn2+ + H2 ↑
这三个条件之间有无共性?
(从溶液中离子浓度的角度思考)
溶液中某些离子浓度的变小
离子反应的实质:
【学习任务二】学习分散系的分类
【学习任务五】书写离子反应注意的问题
【学习活动3】判断离子方程式的正误,并将错误的改正。
⑧少量CO2通入烧碱溶液:CO2 + OH- = CO32-+H2O
①铁放入稀硫酸中:2Fe+6H+=2Fe3++3H2↑
③盐酸和碳酸钙反应:CO32-+2H+ =CO2 ↑+H2O
⑥CuSO4液和Ba(OH)2液反应: Ba2++SO42-=BaSO4↓
⑦H2SO4溶液和Ba(OH)2溶液反应:Ba2++OH-+H++SO42-= BaSO4↓+H2O
②铜与硫酸锌反应: Cu +Zn2+ = Zn + Cu2+
④向澄清的石灰水中滴加稀盐酸:Ca(OH)2 +2H+= Ca2+ + 2H2O
⑤氧化铜与盐酸反应:O2- + 2H+ =H2O
不符合客观事实
不符合客观事实
拆分错误
拆分错误
拆分错误
⑨氯气通入亚铁溶液:Fe2+ + Cl2 = Fe3+ + 2Cl-
漏写离子
电荷不守恒
原子、电荷不守恒
离子配比错误
【学习任务二】学习分散系的分类
【学习任务五】书写离子反应注意的问题
3.书写离子方程式应注意的问题
(2)正确拆解或完整写出
②弱酸(HF、H2S、HClO、H2SO3等)、弱碱(NH3·H2O)等难电离物质写化学式;
③难溶于水的物质(如CaCO3、BaSO3、FeS、BaSO4、Fe(OH)3等)写化学式。
①单质、氧化物在离子方程式中一律写化学式。
弱酸酸式盐的酸根离子在离子方程式中不能拆开,而多元强酸酸式盐的酸根离子要拆开。
(1) 符合客观事实
(4)对于微溶物的处理:
①当反应物里有微溶物处于溶液状态(稀溶液),写成离子符号。
例:CO2气体通入澄清石灰水中:
CO2 + Ca2+ + 2OH- =CaCO3 ↓+H2O
②当反应物里有微溶物处于悬浊液或固态时,应写成化学式。
例:在石灰乳中加入Na2CO3溶液:
Ca(OH)2 + CO32- = CaCO3↓+ 2OH-
【学习任务二】学习分散系的分类
【学习任务五】书写离子反应注意的问题
(3)不是溶液中进行的反应一般不能写离子方程式。
如:NH4Cl固体与Ca(OH)2固体混合加热,只能写化学方程式。
即:2NH4Cl(固)+Ca(OH)2(固) = CaCl2+2NH3↑+2H2O
△
【学习任务二】学习分散系的分类
【学习任务六】离子反应的应用
一、解决离子共存问题:
原则:能反应生成沉淀、气体、难电离物质的不能共存。
1 . 与H+ 不能共存的离子:
OH- 、CO32- 、CH3COO- 、HCO3-
H+ 、会生成弱碱沉淀的离子
3. 能生成微溶物、难溶物的两种离子不能共存:如CaSO4是
微溶物,故Ca2+与SO42-不共存, AgCl是难溶物故Ag+与Cl-不共存。
2. 与OH— 不能共存的离子:
4. 要注意隐含条件:
Fe3+(棕黄)
Cu2+(蓝)
Fe2+(浅绿)
MnO4-(紫红色)
溶液的酸碱性、pH等
溶液有无颜色:
【学习任务二】学习分散系的分类
【学习任务六】离子反应的应用
蒸发
过量HCl
溶于水
二、物质的提纯
粗盐中含有少量的泥沙、硫酸钠、氯化镁、氯化钙。请设计由粗盐制取精盐的实验方案,写出相关的离子方程式。
泥沙
粗盐
过滤
Cl-、SO42-、Na+、
Mg2+、Ca2+
过量BaCl2
过滤
BaSO4↓
Cl-、Ba2+、Na+、
Mg2+、Ca2+
过量NaOH
过滤
Mg(OH)2↓
Cl-、OH-、Ba2+
、Na+、Ca2+
过滤
过量Na2CO3
Cl-、OH-、
CO32-、Na+、
CaCO3 ↓
BaCO3↓
Cl-、H+、
Na+
CO2 ↑
NaCl
晶体
HCl↑
H2O↑
除杂遵循:不增、不减、易分、易复原的原则
【学习任务二】学习分散系的分类
【学习任务六】离子反应的应用
除此之外,离子反应在物质制备和分离、物质鉴定,以及消除水中污染物等方面都有广泛的应用。
第一章 第二节
离子反应
第二课时 离子反应
【学习任务二】学习分散系的分类
【课前思考】
【思考与交流1】氯化钾与硝酸钠不发生化学反应,所以将混合溶液蒸干应该得到氯化钾和硝酸钠的固体?
KCl固体
NaNO3固体
溶解
KCl和NaNO3
混合溶液
蒸发
氯化钠、氯化钾、硝酸钠、硝酸钾四种盐混合固体
【学习任务一】离子反应
Na2SO4
溶液
BaCl2溶液
现象 分析 Na2SO4和BaCl2的 电离方程式 混合前两溶液中的离子 混合后溶液
中的离子
向盛有2mL Na2SO4稀溶液的试管中加入2mL BaCl2稀溶液,观察现象并进行分析。请同学们互相讨论填写下表。
【实验与探究】
Na2SO4=2Na+ + SO42-
BaCl2=Ba2+ + 2Cl-
白色沉淀
【学习任务二】学习分散系的分类
【学习任务一】离子反应
Na2SO4溶液
BaCl2溶液
混合氯化钡和硫酸钠溶液,实际上是将四种离子(Na+、SO42-、Ba2+、Cl-)混合,SO42-和Ba2+结合为BaSO4沉淀析出,Na+和Cl-并未参与反应,只是剩余在溶液中。
Na2SO4 + BaCl2= BaSO4↓ + 2NaCl
SO42- + Ba2+ = BaSO4↓
电解质在溶液中实际是以离子形式发生反应
Na+
SO42-
Ba2+、
Cl-
BaSO4
Na+、Cl-
宏观
微观
【学习任务二】学习分散系的分类
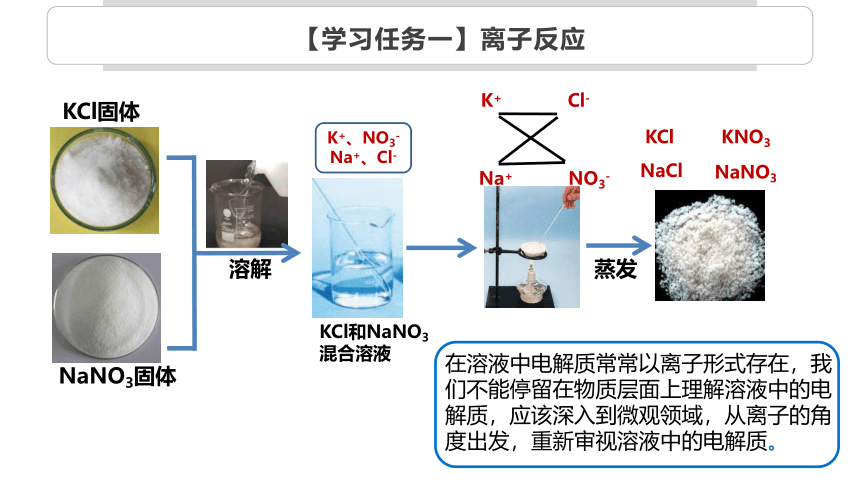
KCl固体
NaNO3固体
溶解
KCl和NaNO3
混合溶液
蒸发
K+ Cl-
Na+ NO3-
KCl
KNO3
NaCl
K+、NO3-
Na+、Cl-
在溶液中电解质常常以离子形式存在,我们不能停留在物质层面上理解溶液中的电解质,应该深入到微观领域,从离子的角度出发,重新审视溶液中的电解质。
NaNO3
【学习任务一】离子反应
【学习任务二】学习分散系的分类
【学习任务二】离子反应及方程式
一、离子反应
定义:电解质在溶液中的反应实质上是离子之间的反应,在中学阶段仅限于在溶液中进行的反应。
二、离子方程式
1. 用实际参加反应的离子符号来表示反应的式子。
Na2SO4 + BaCl2= BaSO4↓ + 2NaCl
化学方程式:
SO42- + Ba2+ = BaSO4↓
离子方程式:
【学习任务二】学习分散系的分类
【学习任务二】离子反应及方程式
(1)写出化学方程式:Na2SO4 + BaCl2= BaSO4↓ + 2NaCl
(2)将易溶于水且易电离的物质拆写成离子形式,其余物质仍以化学式表示:
2Na+ + SO42- + Ba2+ + 2Cl- = BaSO4↓ + 2Na+ + 2Cl-
(3)删去方程式两边不参加反应的离子,并将方程式化成最简:
SO42- + Ba2+ = BaSO4↓
(4)检查离子方程式两边各元素的原子个数和电荷总数是否相等:
离子方程式的书写方法
SO42- + Ba2+ = BaSO4↓
2- + 2+ = 0
电荷守恒
【学习任务二】学习分散系的分类
【学习任务二】离子反应及方程式
(2)将易溶于水且易电离的物质拆写成离子形式,难溶的物质、气体和水等仍用化学式表示。
电解质的拆分是离子方程式书写的关键,在拆分时一定要注意以下问题:
①能够进行拆分的只有易溶易电离的物质(强酸、强碱和大多数可溶盐)
②拆分时应该按照电离方程式的形式进行拆分,注意方程式中的系数。
③其余不能拆分的物质不变,注意反应条件和沉淀、气体符号都不能改变。
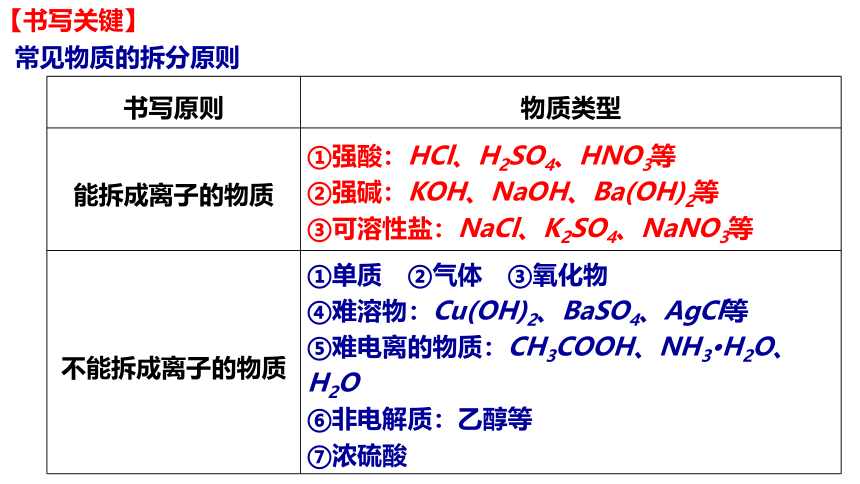
【书写关键】
书写原则 物质类型
能拆成离子的物质 ①强酸:HCl、H2SO4、HNO3等
②强碱:KOH、NaOH、Ba(OH)2等
③可溶性盐:NaCl、K2SO4、NaNO3等
不能拆成离子的物质 ①单质 ②气体 ③氧化物
④难溶物:Cu(OH)2、BaSO4、AgCl等
⑤难电离的物质:CH3COOH、NH3·H2O、H2O
⑥非电解质:乙醇等
⑦浓硫酸
常见物质的拆分原则
2、微溶物的书写原则[Ca(OH)2、CaSO4、Ag2SO4、MgCO3等]
【学习活动1】阅读P127部分酸、碱、盐的溶解性表,总结出规律。
补充:溶解性口诀:
钾钠铵盐硝酸溶;
氨钾钠钡溶钙微(碱);
铵钾和钠溶镁微(碳酸盐);
盐酸不溶亚汞银;
硫酸不溶铅和钡,
还有钙和银是微。
OH- NO3- Cl- SO42- CO32-
H+
NH4+
K+
Na+
Ba2+
Ca2+
Mg2+
Al3+
Mn2+
Zn2+
Fe2+
Fe3+
Cu2+
Ag+
【学习任务二】学习分散系的分类
【学习任务三】学习中和反应的本质及离子反应的意义
反应物 化学方程式 离子方程式
①HCl + NaOH HCl + NaOH = NaCl + H2O H+ + OH- = H2O
②HCl + KOH HCl + KOH = KCl + H2O H+ + OH- = H2O
③H2SO4 + NaOH H2SO4 + 2NaOH = Na2SO4 + 2H2O H+ + OH- = H2O
④H2SO4 + KOH H2SO4 + 2KOH = K2SO4 + 2H2O H+ + OH- = H2O
【学习活动2】完成P17“思考与讨论”表中各反应的化学方程式和离子方程式,思考两种方程式在表示某一类反应时,表达的含义有什么不同,并进行讨论。
4个反应的化学方程式不同,但其离子方程式却相同
【学习任务二】学习分散系的分类
【学习任务三】学习中和反应的本质及离子反应的意义
反应物 化学方程式 离子方程式
①AgNO3+NaCl
②AgNO3+HCl
③Ba(OH)2+H2SO4
④CaCO3 + HCl
⑤NaHCO3+H2SO4
【学习任务二】学习分散系的分类
【学习任务三】学习中和反应的本质及离子反应的意义
反应物 化学方程式 离子方程式
①AgNO3+NaCl AgNO3 + NaCl = AgCl↓ + NaNO3 Ag+ + Cl- = AgCl↓
②AgNO3+HCl AgNO3 + HCl = AgCl↓ + HNO3 Ag+ + Cl- = AgCl↓
③Ba(OH)2+H2SO4 Ba(OH)2 + H2SO4 = BaSO4↓ + 2H2O Ba2+ + 2OH- + 2H+ + SO42- = BaSO4↓ + 2H2O
④CaCO3 + HCl CaCO3 + 2HCl = CaCl2 + H2O + CO2↑ CaCO3 + 2H+ = Ca2+ + H2O + CO2↑
⑤NaHCO3+H2SO4 2NaHCO3+H2SO4 = Na2SO4 + 2H2O + 2CO2↑ HCO3- + H+ = H2O + CO2↑
有的离子方程式可能出现某一侧所有物质均不能拆分的情况,例如③中所有生成物均不能拆分。
2HCO3- + 2H+ = 2H2O + 2CO2↑
化简
【学习任务二】学习分散系的分类
【学习任务三】学习中和反应的本质及离子反应的意义
反应物 化学方程式 离子方程式
①HCl + NaOH HCl + NaOH = NaCl + H2O H+ + OH- = H2O
②HCl + KOH HCl + KOH = KCl + H2O H+ + OH- = H2O
③H2SO4 + NaOH H2SO4 + 2NaOH = Na2SO4 + 2H2O H+ + OH- = H2O
④H2SO4 + KOH H2SO4 + 2KOH = K2SO4 + 2H2O H+ + OH- = H2O
反应物 化学方程式 离子方程式
①AgNO3+NaCl AgNO3 + NaCl = AgCl↓ + NaNO3 Ag+ + Cl- = AgCl↓
②AgNO3+HCl AgNO3 + HCl = AgCl↓ + HNO3 Ag+ + Cl- = AgCl↓
2. 离子方程式表示的意义
①表示某一个具体的化学反应
如CaCl2+Na2CO3 = CaCO3↓+2NaCl可用离子方程式
Ca2++ = CaCO3↓表示。
②表示同一类型的离子反应
如NaOH和HCl、NaOH和HNO3、KOH和H2SO4的反应都 可用离子方程式H++OH- = H2O表示。
【学习任务二】学习分散系的分类
【学习任务三】学习中和反应的本质及离子反应的意义
【学习任务二】学习分散系的分类
【学习任务四】离子反应发生的条件
【思考与交流3】
问题1:以下反应属于哪一类反应?
问题2:为什么都可以发生离子反应?
问题3:发生离子反应的条件是什么?
【学习任务二】学习分散系的分类
【学习任务四】离子反应发生的条件
4.离子反应发生的条件
(1)复分解型的离子反应发生的条件是:生成沉淀、放出气体或者生成水。
(2)其他类型的离子反应,例如有离子参加的置换反应:
锌与稀硫酸反应 :Zn + 2H+= Zn2+ + H2 ↑
这三个条件之间有无共性?
(从溶液中离子浓度的角度思考)
溶液中某些离子浓度的变小
离子反应的实质:
【学习任务二】学习分散系的分类
【学习任务五】书写离子反应注意的问题
【学习活动3】判断离子方程式的正误,并将错误的改正。
⑧少量CO2通入烧碱溶液:CO2 + OH- = CO32-+H2O
①铁放入稀硫酸中:2Fe+6H+=2Fe3++3H2↑
③盐酸和碳酸钙反应:CO32-+2H+ =CO2 ↑+H2O
⑥CuSO4液和Ba(OH)2液反应: Ba2++SO42-=BaSO4↓
⑦H2SO4溶液和Ba(OH)2溶液反应:Ba2++OH-+H++SO42-= BaSO4↓+H2O
②铜与硫酸锌反应: Cu +Zn2+ = Zn + Cu2+
④向澄清的石灰水中滴加稀盐酸:Ca(OH)2 +2H+= Ca2+ + 2H2O
⑤氧化铜与盐酸反应:O2- + 2H+ =H2O
不符合客观事实
不符合客观事实
拆分错误
拆分错误
拆分错误
⑨氯气通入亚铁溶液:Fe2+ + Cl2 = Fe3+ + 2Cl-
漏写离子
电荷不守恒
原子、电荷不守恒
离子配比错误
【学习任务二】学习分散系的分类
【学习任务五】书写离子反应注意的问题
3.书写离子方程式应注意的问题
(2)正确拆解或完整写出
②弱酸(HF、H2S、HClO、H2SO3等)、弱碱(NH3·H2O)等难电离物质写化学式;
③难溶于水的物质(如CaCO3、BaSO3、FeS、BaSO4、Fe(OH)3等)写化学式。
①单质、氧化物在离子方程式中一律写化学式。
弱酸酸式盐的酸根离子在离子方程式中不能拆开,而多元强酸酸式盐的酸根离子要拆开。
(1) 符合客观事实
(4)对于微溶物的处理:
①当反应物里有微溶物处于溶液状态(稀溶液),写成离子符号。
例:CO2气体通入澄清石灰水中:
CO2 + Ca2+ + 2OH- =CaCO3 ↓+H2O
②当反应物里有微溶物处于悬浊液或固态时,应写成化学式。
例:在石灰乳中加入Na2CO3溶液:
Ca(OH)2 + CO32- = CaCO3↓+ 2OH-
【学习任务二】学习分散系的分类
【学习任务五】书写离子反应注意的问题
(3)不是溶液中进行的反应一般不能写离子方程式。
如:NH4Cl固体与Ca(OH)2固体混合加热,只能写化学方程式。
即:2NH4Cl(固)+Ca(OH)2(固) = CaCl2+2NH3↑+2H2O
△
【学习任务二】学习分散系的分类
【学习任务六】离子反应的应用
一、解决离子共存问题:
原则:能反应生成沉淀、气体、难电离物质的不能共存。
1 . 与H+ 不能共存的离子:
OH- 、CO32- 、CH3COO- 、HCO3-
H+ 、会生成弱碱沉淀的离子
3. 能生成微溶物、难溶物的两种离子不能共存:如CaSO4是
微溶物,故Ca2+与SO42-不共存, AgCl是难溶物故Ag+与Cl-不共存。
2. 与OH— 不能共存的离子:
4. 要注意隐含条件:
Fe3+(棕黄)
Cu2+(蓝)
Fe2+(浅绿)
MnO4-(紫红色)
溶液的酸碱性、pH等
溶液有无颜色:
【学习任务二】学习分散系的分类
【学习任务六】离子反应的应用
蒸发
过量HCl
溶于水
二、物质的提纯
粗盐中含有少量的泥沙、硫酸钠、氯化镁、氯化钙。请设计由粗盐制取精盐的实验方案,写出相关的离子方程式。
泥沙
粗盐
过滤
Cl-、SO42-、Na+、
Mg2+、Ca2+
过量BaCl2
过滤
BaSO4↓
Cl-、Ba2+、Na+、
Mg2+、Ca2+
过量NaOH
过滤
Mg(OH)2↓
Cl-、OH-、Ba2+
、Na+、Ca2+
过滤
过量Na2CO3
Cl-、OH-、
CO32-、Na+、
CaCO3 ↓
BaCO3↓
Cl-、H+、
Na+
CO2 ↑
NaCl
晶体
HCl↑
H2O↑
除杂遵循:不增、不减、易分、易复原的原则
【学习任务二】学习分散系的分类
【学习任务六】离子反应的应用
除此之外,离子反应在物质制备和分离、物质鉴定,以及消除水中污染物等方面都有广泛的应用。
