人教版选修一 4.2.1 电解原理 课件(24张PPT)
文档属性
| 名称 | 人教版选修一 4.2.1 电解原理 课件(24张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 18.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-27 16:10:49 | ||
图片预览



文档简介
(共24张PPT)
第2节 电解池
第1课时:电解原理
第四章
水的电解-宏观分析
实验现象 实验结论
负极上生成气体体积为20 mL 正极上生成气体体积为10 mL
负极上生成的气体能使带火星的木条复燃
正极上生成的气体能点燃
宏观现象分析
负极产生了氢气
正极产生了氧气
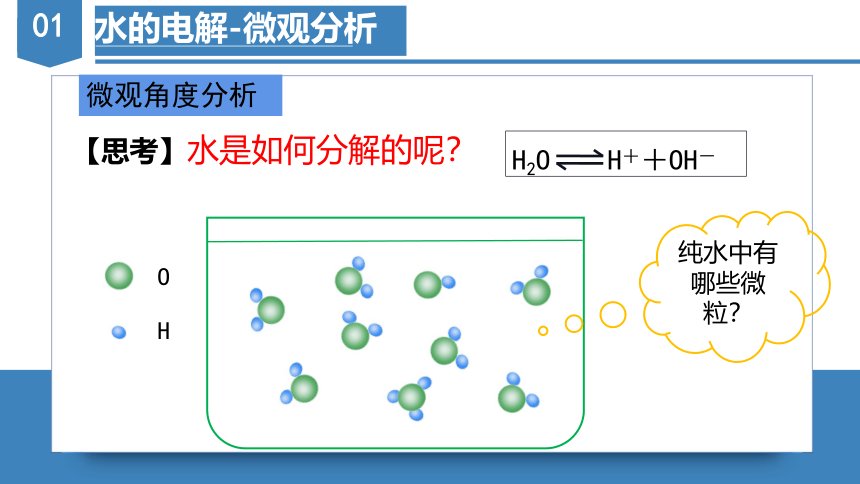
水的电解-微观分析
微观角度分析
【思考】水是如何分解的呢?
纯水中有哪些微粒?
O
H
H2O H++OH-
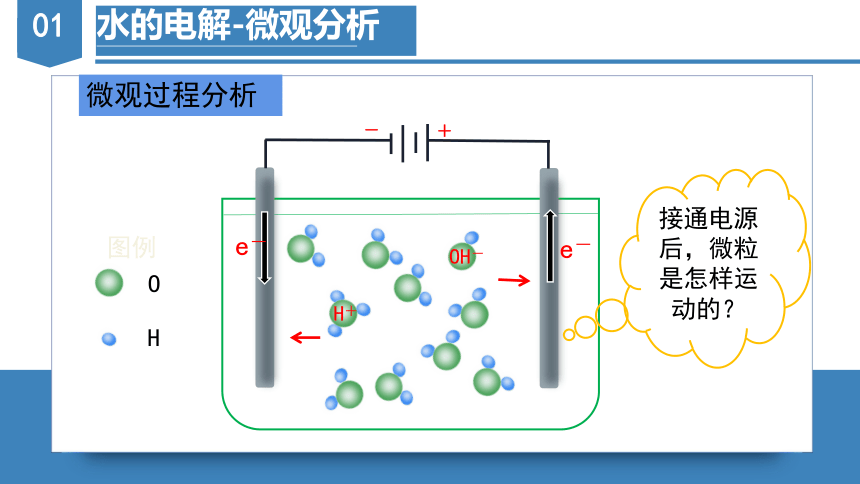
水的电解-微观分析
微观过程分析
接通电源后,微粒是怎样运动的?
-
+
O
H
图例
H+
OH-
e-
e-
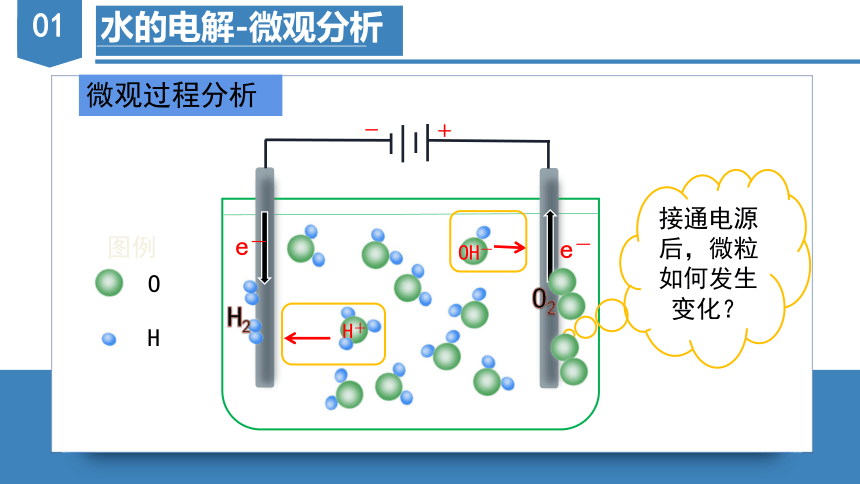
水的电解-微观分析
微观过程分析
接通电源后,微粒如何发生变化?
-
+
O
H
图例
e-
e-
H+
OH-
H2
O2
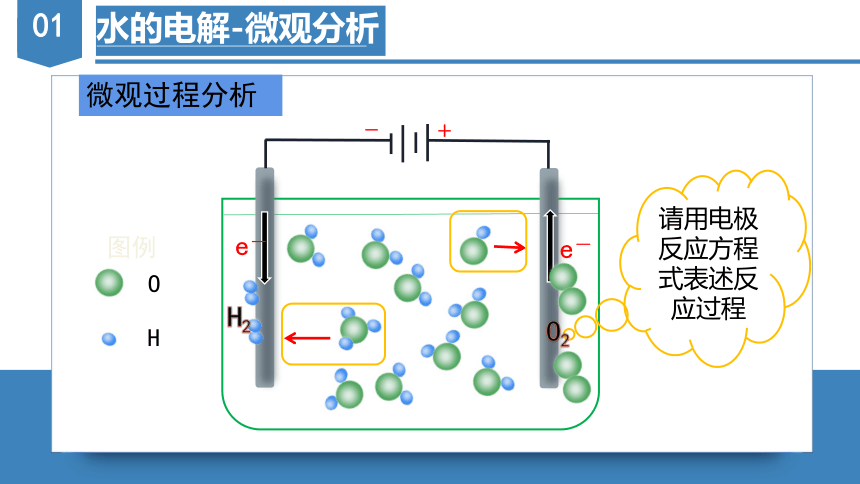
水的电解-微观分析
微观过程分析
请用电极反应方程式表述反应过程
-
+
O
H
图例
e-
e-
H2
O2
水的电解-微观分析
微观过程分析
-
+
e-
e-
H2O H++OH-
2H2O+2e- = H2↑+2OH-
2H2O-4e-=O2↑+4H+
2H2O 2H2↑+O2↑
电解
总反应::
水的电解-微观分析
电解池原理分析
2H2O+2e- = H2↑+2OH-
2H2O-4e-=O2↑+4H+
还原反应
得电子
阴极
电极与电源负极相连
失电子
氧化反应
阳极
电极与电源正极相连
电解原理分析
借助电流引起氧化还原反应的装置,也
就是把电能转化为化学能的装置。
电解池:
电解池概念
电解原理分析
电解池构成
直流电源:
电解池构成
电极材料
导 线:
电 解 质:
提供电能
得电子场所
离子导体
电子导体
阳极材料:
阴极材料:
失电子场所
电解原理分析
电解原理分析
电解是使电流通过电解质溶液而在阴阳两极引起氧化还原反应的过程,这方法又称为电解法。
电解法是最强有力的氧化还原手段,借助电解法
可以使非自发的氧化还原反应进行。
知识迁移与应用
【思考与交流】在水电解实验前常常会加强电解质,这是为什么?
请书写H2SO4溶液电极方程式及总反应方程式
请书写NaOH溶液电极方程式及总反应方程式
知识迁移与应用
【思考】是否任意加强电解质对水的电离没有影响呢?
请试着书写CuSO4溶液电极方程式及总反应方程式
请试着书写CuCl2溶液电极方程式及总反应方程式
一、电解原理初探
[思考]:在水中加入CuSO4为什么会生成Cu和O2呢?
CuSO4溶液
一、电解原理初探
Cu2+
H3O+
OH-
Cu2+
H2O
H2O
-
+
SO42-
OH-
阳
极
Cu2+
H+
阴极
Cu
O2
√
√
e-
e-
SO42-
SO42-
SO42-
一、电解原理初探
[实验4-2]用石墨电极电解CuCl2溶液
一、电解原理初探
[实验4-2]用石墨电极电解CuCl2溶液
一、电解原理初探
[实验4-2]用石墨电极电解CuCl2溶液
实验现象 实验结论
阳极有刺激性气味的气体产生,能使湿润的淀粉 KI试纸变蓝
阴极逐渐覆盖了一层红色物质,溶液颜色变浅
阳极产生了氯气
阴极析出金属铜
一、电解原理初探
思考:电解CuCl2溶液为什么会生成Cu和Cl2呢?
一、电解原理初探
Cu2+
Cl-
H3O+
OH-
Cu2+
Cl-
Cl-
Cl-
H2O
H2O
-
+
Cl-
OH-
阳
极
Cu2+
H+
阴极
Cu
Cl2
√
√
e-
e-
知识点都掌握了吗?来做几道题检测下~
设计硫酸溶液电解池装置图
阴极
阳极
生成H2
阳极: H2O - 2e- = O2 ↑
+ 2H +
阴极: 2H ++ 2e- = H2 ↑
H2O H2 ↑ + O2 ↑
通电
电解CuCl2与NaCl的混合溶液(惰性电极),阴极上和阳极上最先析出的物质为( )
A.H2和Cl2 B.Cu和Cl2
C.H2和O2 D.Cu和O2
B
如右图所示,烧杯中盛有足量的CuCl2溶液。
(1)C是______极,发生_______反应,电极反应 ______________;
Pt是______极,发生_______反应,电极反应 ______________;
发生的总反应是__________________。
(2)当收集到 2.24L 氯气(标准状况)时,____极析出铜,该极增
重 ________g,电路中通过电子______mol e-。
阴
阳
氧化
还原
Cu2++ 2e- =Cu
2 Cl- -2e- =Cl2↑
Cu2+ + 2 Cl- === Cu + Cl2↑
阴
6.4
0.2
Cl 2
Cu
——
2e-
——
1
1
2
n (Cl2) =0.1 mol
0.1 mol
0.2 mol
m (Cu) =6.4 g
电解
第四章 化学反应与电能
第2节 电解池
第1课时:电解原理
第四章
水的电解-宏观分析
实验现象 实验结论
负极上生成气体体积为20 mL 正极上生成气体体积为10 mL
负极上生成的气体能使带火星的木条复燃
正极上生成的气体能点燃
宏观现象分析
负极产生了氢气
正极产生了氧气
水的电解-微观分析
微观角度分析
【思考】水是如何分解的呢?
纯水中有哪些微粒?
O
H
H2O H++OH-
水的电解-微观分析
微观过程分析
接通电源后,微粒是怎样运动的?
-
+
O
H
图例
H+
OH-
e-
e-
水的电解-微观分析
微观过程分析
接通电源后,微粒如何发生变化?
-
+
O
H
图例
e-
e-
H+
OH-
H2
O2
水的电解-微观分析
微观过程分析
请用电极反应方程式表述反应过程
-
+
O
H
图例
e-
e-
H2
O2
水的电解-微观分析
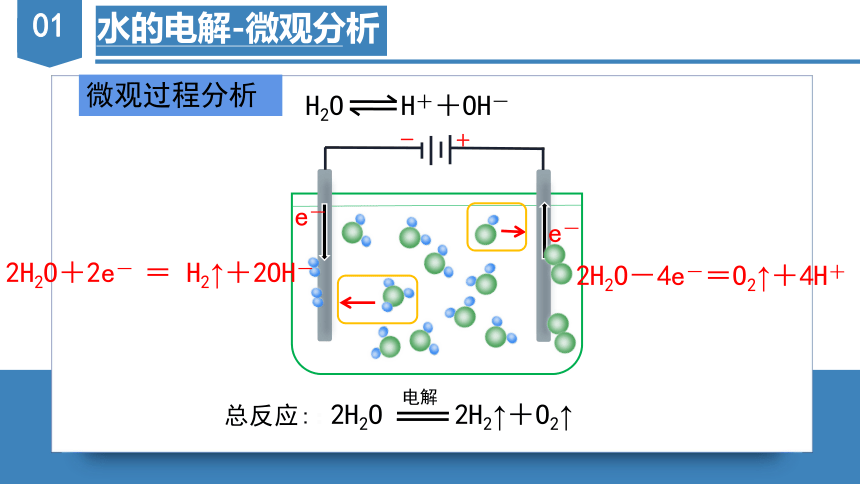
微观过程分析
-
+
e-
e-
H2O H++OH-
2H2O+2e- = H2↑+2OH-
2H2O-4e-=O2↑+4H+
2H2O 2H2↑+O2↑
电解
总反应::
水的电解-微观分析
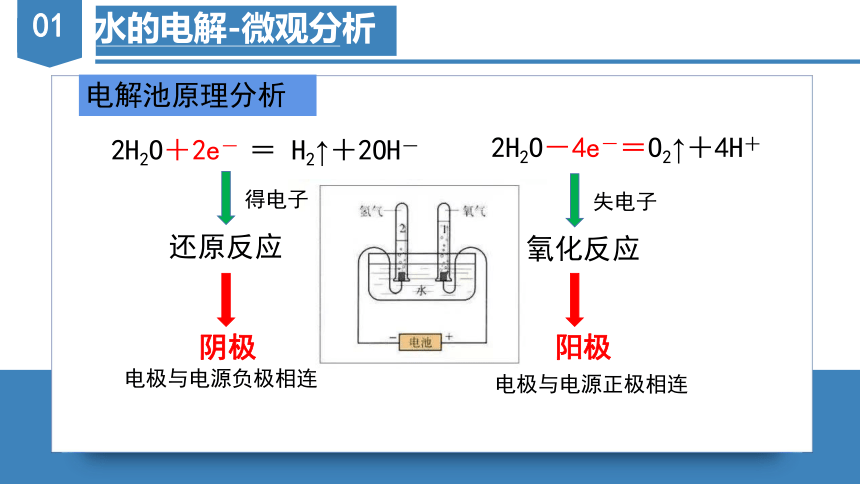
电解池原理分析
2H2O+2e- = H2↑+2OH-
2H2O-4e-=O2↑+4H+
还原反应
得电子
阴极
电极与电源负极相连
失电子
氧化反应
阳极
电极与电源正极相连
电解原理分析
借助电流引起氧化还原反应的装置,也
就是把电能转化为化学能的装置。
电解池:
电解池概念
电解原理分析
电解池构成
直流电源:
电解池构成
电极材料
导 线:
电 解 质:
提供电能
得电子场所
离子导体
电子导体
阳极材料:
阴极材料:
失电子场所
电解原理分析
电解原理分析
电解是使电流通过电解质溶液而在阴阳两极引起氧化还原反应的过程,这方法又称为电解法。
电解法是最强有力的氧化还原手段,借助电解法
可以使非自发的氧化还原反应进行。
知识迁移与应用
【思考与交流】在水电解实验前常常会加强电解质,这是为什么?
请书写H2SO4溶液电极方程式及总反应方程式
请书写NaOH溶液电极方程式及总反应方程式
知识迁移与应用
【思考】是否任意加强电解质对水的电离没有影响呢?
请试着书写CuSO4溶液电极方程式及总反应方程式
请试着书写CuCl2溶液电极方程式及总反应方程式
一、电解原理初探
[思考]:在水中加入CuSO4为什么会生成Cu和O2呢?
CuSO4溶液
一、电解原理初探
Cu2+
H3O+
OH-
Cu2+
H2O
H2O
-
+
SO42-
OH-
阳
极
Cu2+
H+
阴极
Cu
O2
√
√
e-
e-
SO42-
SO42-
SO42-
一、电解原理初探
[实验4-2]用石墨电极电解CuCl2溶液
一、电解原理初探
[实验4-2]用石墨电极电解CuCl2溶液
一、电解原理初探
[实验4-2]用石墨电极电解CuCl2溶液
实验现象 实验结论
阳极有刺激性气味的气体产生,能使湿润的淀粉 KI试纸变蓝
阴极逐渐覆盖了一层红色物质,溶液颜色变浅
阳极产生了氯气
阴极析出金属铜
一、电解原理初探
思考:电解CuCl2溶液为什么会生成Cu和Cl2呢?
一、电解原理初探
Cu2+
Cl-
H3O+
OH-
Cu2+
Cl-
Cl-
Cl-
H2O
H2O
-
+
Cl-
OH-
阳
极
Cu2+
H+
阴极
Cu
Cl2
√
√
e-
e-
知识点都掌握了吗?来做几道题检测下~
设计硫酸溶液电解池装置图
阴极
阳极
生成H2
阳极: H2O - 2e- = O2 ↑
+ 2H +
阴极: 2H ++ 2e- = H2 ↑
H2O H2 ↑ + O2 ↑
通电
电解CuCl2与NaCl的混合溶液(惰性电极),阴极上和阳极上最先析出的物质为( )
A.H2和Cl2 B.Cu和Cl2
C.H2和O2 D.Cu和O2
B
如右图所示,烧杯中盛有足量的CuCl2溶液。
(1)C是______极,发生_______反应,电极反应 ______________;
Pt是______极,发生_______反应,电极反应 ______________;
发生的总反应是__________________。
(2)当收集到 2.24L 氯气(标准状况)时,____极析出铜,该极增
重 ________g,电路中通过电子______mol e-。
阴
阳
氧化
还原
Cu2++ 2e- =Cu
2 Cl- -2e- =Cl2↑
Cu2+ + 2 Cl- === Cu + Cl2↑
阴
6.4
0.2
Cl 2
Cu
——
2e-
——
1
1
2
n (Cl2) =0.1 mol
0.1 mol
0.2 mol
m (Cu) =6.4 g
电解
第四章 化学反应与电能
