2022-2023学年人教版九年级化学下册 9.2 溶解度 第3课时 (溶解度曲线)课件(共16张PPT)
文档属性
| 名称 | 2022-2023学年人教版九年级化学下册 9.2 溶解度 第3课时 (溶解度曲线)课件(共16张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 6.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-27 07:57:21 | ||
图片预览





文档简介
(共16张PPT)
课题2 溶解度
U9 溶液
1.掌握饱和溶液、不饱和溶液的含义及相互转化的方法。
2.能举例说明结晶现象。掌握常用的两种结晶方法(降温结晶、蒸发结晶),认识海水晒盐的原理。
3. 掌握溶解度的含义和影响因素(固体、气体)。
4.掌握溶解度曲线的含义(点、面、变化趋势等)。
5.掌握溶解度曲线的应用。
6.了解气体溶解度概念及影响因素。
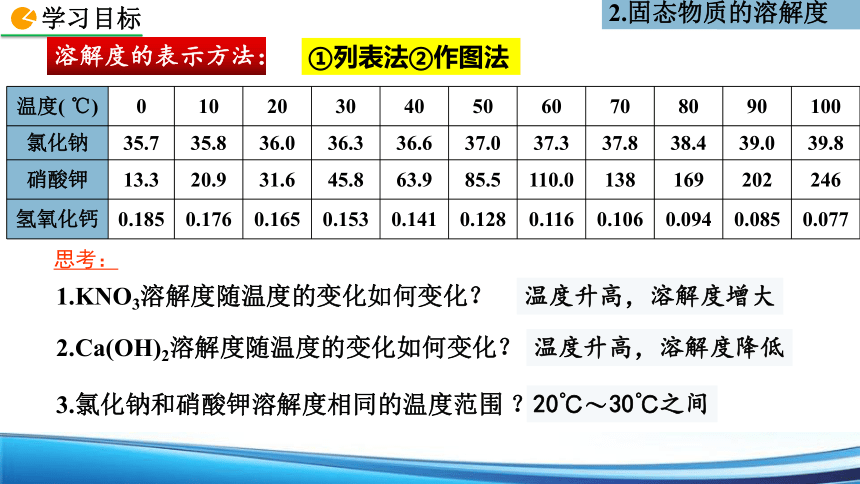
溶解度的表示方法:
温度( ℃) 0 10 20 30 40 50 60 70 80 90 100
氯化钠 35.7 35.8 36.0 36.3 36.6 37.0 37.3 37.8 38.4 39.0 39.8
硝酸钾 13.3 20.9 31.6 45.8 63.9 85.5 110.0 138 169 202 246
氢氧化钙 0.185 0.176 0.165 0.153 0.141 0.128 0.116 0.106 0.094 0.085 0.077
3.氯化钠和硝酸钾溶解度相同的温度范围 ?
1.KNO3溶解度随温度的变化如何变化?
20℃ 30℃之间
温度升高,溶解度增大
2.Ca(OH)2溶解度随温度的变化如何变化?
温度升高,溶解度降低
2.溶解度
思考:
①列表法②作图法
2.固态物质的溶解度
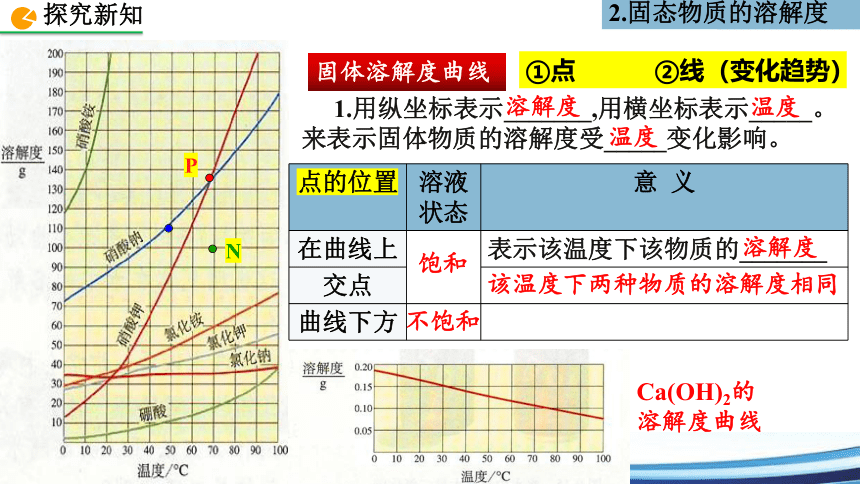
固体溶解度曲线
1.用纵坐标表示_______,用横坐标表示_____。来表示固体物质的溶解度受_____变化影响。
溶解度
温度
温度
2.溶解度
2.固态物质的溶解度
P
N
点的位置 溶液状态 意 义
在曲线上 表示该温度下该物质的_______
交点
曲线下方
该温度下两种物质的溶解度相同
溶解度
饱和
不饱和
Ca(OH)2的溶解度曲线
①点 ②线(变化趋势)
固体溶解度曲线
大多数固体物质的溶解度随温度升高而 ,如 ;
少数固体物质的溶解度受温度影响 ,如 ;
极少数固体物质的溶解度随温度升高而 ,如 。
增大
KNO3
不大
NaCl
减小
Ca(OH)2
2.溶解度
①点②线(变化趋势)
Pg37-3(1):
固体物质溶解度受温度变化有什么规律?
讨论:
P
N
Ca(OH)2的溶解度曲线
陡升型
缓升型
下降型
2.溶解度
要使氯化钠从溶液中结晶析出,宜采用蒸发溶剂的方法,不宜采用降低温度的方法,为什么?
讨论:
P
N
因为氯化钠的溶解度受温度影响较小,采用冷却氯化钠热饱和溶液的方法只有少量氯化钠晶体从溶液中析出。
2.溶解度
P
N
根据物质的溶解度变化规律确定物质的结晶方法
KNO3从溶液中析出
NaCl从溶液中析出
溶解度随温度升高增大较多,降温结晶
溶解度随温度变化不明显,恒温蒸发溶剂
Ca(OH)2从溶液中析出
溶解度随温度升高反而减小,升温结晶
缓升型
陡升型
下降型
曲线的坡度越陡,如_______,该物质的溶解度受温度影响越___,适合用_______结晶法从溶液中得到晶体;曲线坡度越小,如________,该物质的溶解度受温度影响越___,适合用__________法得到晶体。
大
降温
小
蒸发结晶
KNO3
NaCl
2.溶解度
P
N
根据物质的溶解度变化规律确定混合物的分离、提纯方法
KNO3中含有少量杂质NaCl
NaCl中含有少量杂质KNO3
降温结晶
蒸发结晶
Ca(OH)2
Ca(OH)2中含有少量杂质KNO3
升温结晶
提纯A,就让A结晶
总结:
命题角度1 溶解度大小的判断及比较
(1)如图所示,t1 ℃时,三种物质溶解度由大到小的顺序为______________;甲和乙溶解度相等时的温度为________℃。
(2)________(填“能”或“不能”)说甲的溶解度大于乙的溶解度。
(3)由图可知,甲、乙两种物质的溶解度受温度影响较大的是______。
丙>乙>甲
t3
不能
甲
指明温度
命题角度2 饱和溶液与不饱和溶液的判断及转化
(1)t1 ℃时,100 g水中溶解____g丙恰好形成饱和溶液。
(2)t2 ℃时,将15 g甲加入到50 g水中,充分溶解,得到的溶液是________(填“饱和”或“不饱和”)溶液。
(3)t1 ℃时,配制相同质量的甲、乙的饱和溶液,所需溶剂的质量关系为________。
找S
50
饱和
甲>乙
命题角度2 饱和溶液与不饱和溶液的判断及转化
(4)饱和溶液与不饱和溶液的转化
①将接近饱和的甲溶液转化为饱和溶液的方法___________________________________;
②将接近饱和的乙溶液转化为饱和溶液的方法有_________________________________;
③将接近饱和的丙溶液转化为饱和溶液的方法有__________________________________;
④t1 ℃时,将甲的饱和溶液转化为不饱和溶液的方法有_________________________。
降低温度、增加溶质或恒温蒸发溶剂
降低温度、增加溶质或恒温蒸发溶剂
升高温度、增加溶质或恒温蒸发溶剂
增加溶剂、升高温度
标答
命题角度3 转化方法和提纯方法的比较
(1)若甲中混有少量丙,可采用__________________________法提纯甲。
(2)若乙中混有少量甲,可采用__________________________法提纯乙。
(3)若丙中混有少量甲,可采用__________________________法提纯丙。
(4)若甲中混有少量乙,可采用__________________________法提纯甲。
①提纯A,就让A结晶 ②标准做答
降温结晶或冷却热饱和溶液
蒸发结晶
升温结晶
降温结晶或冷却热饱和溶液
(1)t2 ℃时,分别用100 g水配制甲、乙的饱和溶液,所需溶质的质量关系为__________。
(2)t2 ℃时,分别将20 g甲、乙配制成饱和溶液,所需溶剂的质量关系为________。
(2)t2 ℃时,分别将20 g甲、乙配制成饱和溶液,所得溶液的质量关系为________。
(3)t3 ℃时,分别将50 g甲、丙配制成饱和溶液,所得溶液的质量关系为________。
乙>甲
甲>乙
命题角度4 在一定温度下配制不同物质的饱和溶液时,溶质、溶剂、溶液质量大小的比较
找S、 = 、 =
丙>甲
甲>乙
(1)分别将100 g甲、乙的饱和溶液由t4 ℃降温到t3 ℃,析出晶体较多的是________。
(2)若将t2 ℃时X、Y两种物质的饱和溶液降温至t1 ℃,只有Y析出晶体,则X表示的物质是________(填“甲”或“丙”)。
(3)t3 ℃时,将40 g甲物质加入到100 g水中,然后将温度降低至t2 ℃,则析出晶体的质量是________g。
甲
丙
15
命题角度4 在一定温度下配制不同物质的饱和溶液时,溶质、溶剂、溶液质量大小的比较
找S、 = 、 =
(1)点P表示_____________________。
(2)当温度为t2℃时,A、B、C三种
物质的溶解度由小到大的顺序是__________。
(3)要使接近饱和的C物质溶液变为饱和的溶液,可采取的一种措施是_____温度。
(4)t2℃时,A物质的饱和溶液150g降温到t1℃析出A____g。
(5)t2℃时,将等质量A、B、C三种物质的饱和溶液降温到t1℃时,析出晶体的质量由大到小的顺序是__________。
(6)当A中含有少量B时,提纯A,可采用____________方法。
当B中含有少量A时,提纯B,可采用____________方法.
如图是A、B、C三种固体物质的溶解度曲线,请回答下列问题:
P
t1时,A、C的溶解度相同
C<B<A
升高
30
A>B>C
降温结晶
蒸发结晶
2.溶解度
提纯A,就让A结晶
总结:
物质溶解性顺口溜
P114附录一 部分
2.溶解度
2.固态物质的溶解度
钾钠铵盐都可溶
氯化物不溶氯化银
硫酸盐钙银微溶钡不溶
硝酸盐遇水无踪影
氢氧化钙是微溶
钾钠钡碱都可溶
红褐铁,蓝絮铜
其它沉淀是白色
课题2 溶解度
U9 溶液
1.掌握饱和溶液、不饱和溶液的含义及相互转化的方法。
2.能举例说明结晶现象。掌握常用的两种结晶方法(降温结晶、蒸发结晶),认识海水晒盐的原理。
3. 掌握溶解度的含义和影响因素(固体、气体)。
4.掌握溶解度曲线的含义(点、面、变化趋势等)。
5.掌握溶解度曲线的应用。
6.了解气体溶解度概念及影响因素。
溶解度的表示方法:
温度( ℃) 0 10 20 30 40 50 60 70 80 90 100
氯化钠 35.7 35.8 36.0 36.3 36.6 37.0 37.3 37.8 38.4 39.0 39.8
硝酸钾 13.3 20.9 31.6 45.8 63.9 85.5 110.0 138 169 202 246
氢氧化钙 0.185 0.176 0.165 0.153 0.141 0.128 0.116 0.106 0.094 0.085 0.077
3.氯化钠和硝酸钾溶解度相同的温度范围 ?
1.KNO3溶解度随温度的变化如何变化?
20℃ 30℃之间
温度升高,溶解度增大
2.Ca(OH)2溶解度随温度的变化如何变化?
温度升高,溶解度降低
2.溶解度
思考:
①列表法②作图法
2.固态物质的溶解度
固体溶解度曲线
1.用纵坐标表示_______,用横坐标表示_____。来表示固体物质的溶解度受_____变化影响。
溶解度
温度
温度
2.溶解度
2.固态物质的溶解度
P
N
点的位置 溶液状态 意 义
在曲线上 表示该温度下该物质的_______
交点
曲线下方
该温度下两种物质的溶解度相同
溶解度
饱和
不饱和
Ca(OH)2的溶解度曲线
①点 ②线(变化趋势)
固体溶解度曲线
大多数固体物质的溶解度随温度升高而 ,如 ;
少数固体物质的溶解度受温度影响 ,如 ;
极少数固体物质的溶解度随温度升高而 ,如 。
增大
KNO3
不大
NaCl
减小
Ca(OH)2
2.溶解度
①点②线(变化趋势)
Pg37-3(1):
固体物质溶解度受温度变化有什么规律?
讨论:
P
N
Ca(OH)2的溶解度曲线
陡升型
缓升型
下降型
2.溶解度
要使氯化钠从溶液中结晶析出,宜采用蒸发溶剂的方法,不宜采用降低温度的方法,为什么?
讨论:
P
N
因为氯化钠的溶解度受温度影响较小,采用冷却氯化钠热饱和溶液的方法只有少量氯化钠晶体从溶液中析出。
2.溶解度
P
N
根据物质的溶解度变化规律确定物质的结晶方法
KNO3从溶液中析出
NaCl从溶液中析出
溶解度随温度升高增大较多,降温结晶
溶解度随温度变化不明显,恒温蒸发溶剂
Ca(OH)2从溶液中析出
溶解度随温度升高反而减小,升温结晶
缓升型
陡升型
下降型
曲线的坡度越陡,如_______,该物质的溶解度受温度影响越___,适合用_______结晶法从溶液中得到晶体;曲线坡度越小,如________,该物质的溶解度受温度影响越___,适合用__________法得到晶体。
大
降温
小
蒸发结晶
KNO3
NaCl
2.溶解度
P
N
根据物质的溶解度变化规律确定混合物的分离、提纯方法
KNO3中含有少量杂质NaCl
NaCl中含有少量杂质KNO3
降温结晶
蒸发结晶
Ca(OH)2
Ca(OH)2中含有少量杂质KNO3
升温结晶
提纯A,就让A结晶
总结:
命题角度1 溶解度大小的判断及比较
(1)如图所示,t1 ℃时,三种物质溶解度由大到小的顺序为______________;甲和乙溶解度相等时的温度为________℃。
(2)________(填“能”或“不能”)说甲的溶解度大于乙的溶解度。
(3)由图可知,甲、乙两种物质的溶解度受温度影响较大的是______。
丙>乙>甲
t3
不能
甲
指明温度
命题角度2 饱和溶液与不饱和溶液的判断及转化
(1)t1 ℃时,100 g水中溶解____g丙恰好形成饱和溶液。
(2)t2 ℃时,将15 g甲加入到50 g水中,充分溶解,得到的溶液是________(填“饱和”或“不饱和”)溶液。
(3)t1 ℃时,配制相同质量的甲、乙的饱和溶液,所需溶剂的质量关系为________。
找S
50
饱和
甲>乙
命题角度2 饱和溶液与不饱和溶液的判断及转化
(4)饱和溶液与不饱和溶液的转化
①将接近饱和的甲溶液转化为饱和溶液的方法___________________________________;
②将接近饱和的乙溶液转化为饱和溶液的方法有_________________________________;
③将接近饱和的丙溶液转化为饱和溶液的方法有__________________________________;
④t1 ℃时,将甲的饱和溶液转化为不饱和溶液的方法有_________________________。
降低温度、增加溶质或恒温蒸发溶剂
降低温度、增加溶质或恒温蒸发溶剂
升高温度、增加溶质或恒温蒸发溶剂
增加溶剂、升高温度
标答
命题角度3 转化方法和提纯方法的比较
(1)若甲中混有少量丙,可采用__________________________法提纯甲。
(2)若乙中混有少量甲,可采用__________________________法提纯乙。
(3)若丙中混有少量甲,可采用__________________________法提纯丙。
(4)若甲中混有少量乙,可采用__________________________法提纯甲。
①提纯A,就让A结晶 ②标准做答
降温结晶或冷却热饱和溶液
蒸发结晶
升温结晶
降温结晶或冷却热饱和溶液
(1)t2 ℃时,分别用100 g水配制甲、乙的饱和溶液,所需溶质的质量关系为__________。
(2)t2 ℃时,分别将20 g甲、乙配制成饱和溶液,所需溶剂的质量关系为________。
(2)t2 ℃时,分别将20 g甲、乙配制成饱和溶液,所得溶液的质量关系为________。
(3)t3 ℃时,分别将50 g甲、丙配制成饱和溶液,所得溶液的质量关系为________。
乙>甲
甲>乙
命题角度4 在一定温度下配制不同物质的饱和溶液时,溶质、溶剂、溶液质量大小的比较
找S、 = 、 =
丙>甲
甲>乙
(1)分别将100 g甲、乙的饱和溶液由t4 ℃降温到t3 ℃,析出晶体较多的是________。
(2)若将t2 ℃时X、Y两种物质的饱和溶液降温至t1 ℃,只有Y析出晶体,则X表示的物质是________(填“甲”或“丙”)。
(3)t3 ℃时,将40 g甲物质加入到100 g水中,然后将温度降低至t2 ℃,则析出晶体的质量是________g。
甲
丙
15
命题角度4 在一定温度下配制不同物质的饱和溶液时,溶质、溶剂、溶液质量大小的比较
找S、 = 、 =
(1)点P表示_____________________。
(2)当温度为t2℃时,A、B、C三种
物质的溶解度由小到大的顺序是__________。
(3)要使接近饱和的C物质溶液变为饱和的溶液,可采取的一种措施是_____温度。
(4)t2℃时,A物质的饱和溶液150g降温到t1℃析出A____g。
(5)t2℃时,将等质量A、B、C三种物质的饱和溶液降温到t1℃时,析出晶体的质量由大到小的顺序是__________。
(6)当A中含有少量B时,提纯A,可采用____________方法。
当B中含有少量A时,提纯B,可采用____________方法.
如图是A、B、C三种固体物质的溶解度曲线,请回答下列问题:
P
t1时,A、C的溶解度相同
C<B<A
升高
30
A>B>C
降温结晶
蒸发结晶
2.溶解度
提纯A,就让A结晶
总结:
物质溶解性顺口溜
P114附录一 部分
2.溶解度
2.固态物质的溶解度
钾钠铵盐都可溶
氯化物不溶氯化银
硫酸盐钙银微溶钡不溶
硝酸盐遇水无踪影
氢氧化钙是微溶
钾钠钡碱都可溶
红褐铁,蓝絮铜
其它沉淀是白色
同课章节目录
