8.3金属资源的利用和防护 同步精练2022-2023学年九年级化学人教版下册(含答案)
文档属性
| 名称 | 8.3金属资源的利用和防护 同步精练2022-2023学年九年级化学人教版下册(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 326.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-27 19:38:09 | ||
图片预览



文档简介
8.3金属资源的利用和防护 同步精练
一、单选题
1.大自然向人类提供了丰富的金属矿物资源,在以下四种矿石中,可用于炼铁的是
A.赤铁矿(主要成分是Fe2O3) B.炉甘石(主要成分是ZnCO3)
C.铝土矿(主要成分是A12O3) D.赤铜矿(主要成分是Cu2O)
2.下列环境中,铁钉表面最容易生锈的是( )
A.在稀盐酸中B.在潮湿空气中
C.在干燥空气中D.浸没在植物油中
3.绿水青山就是金山银山。为了使南宁变得天更蓝、水更清、景更美,下列做法应该禁止的是
A.植树造林低碳生活 B.加强对烟花爆竹燃放管理
C.生产、生活垃圾分类放置 D.工业废水直接排入河流
4.冶铁的原料中,除铁矿石、焦炭、空气,还应添加的是
A.一氧化碳 B.石灰石 C.二氧化锰 D.氧化铁
5.下列关于金属及金属资源的利用和保护的说法合理的是
A.在菜刀上涂上盐水可以减缓菜刀生锈的速率
B.生铁和钢性能差异的原因是生铁含碳量比钢低
C.黄铜的硬度比纯铜的硬度小
D.金属资源的回收利用既保护了环境,又节约了金属资源
6.下列金属矿物中,它们的主要成分从物质的分类来看,与其他三种不同的是
A.赤铁矿(主要成分是Fe2O3) B.黄铁矿(主要成分是Fe2S)
C.磁铁矿(主要成分是Fe3O4) D.赤铜矿(主要成分是Cu2O)
7.铁在海水中容易被锈蚀、通常在轮船的吃水线以下焊接比铁更活泼的金属块,用于保护铁质船壳。该金属块的材料可以是
A.金 B.银 C.铜 D.锌
8.下列叙述、对应的化学方程式都正确的是
A.用木炭还原氧化铜:
B.在高炉中用赤铁矿炼铁:
C.验证铜和铝的活动性
D.工业制取氧气:
9.某同学的下列生活行为不符合环保理念的是
A.用洗菜的水冲厕所 B.将废弃易拉罐丢入“可回收垃圾”桶
C.夏季使用空调时,将温度调至最低 D.骑自行车上学
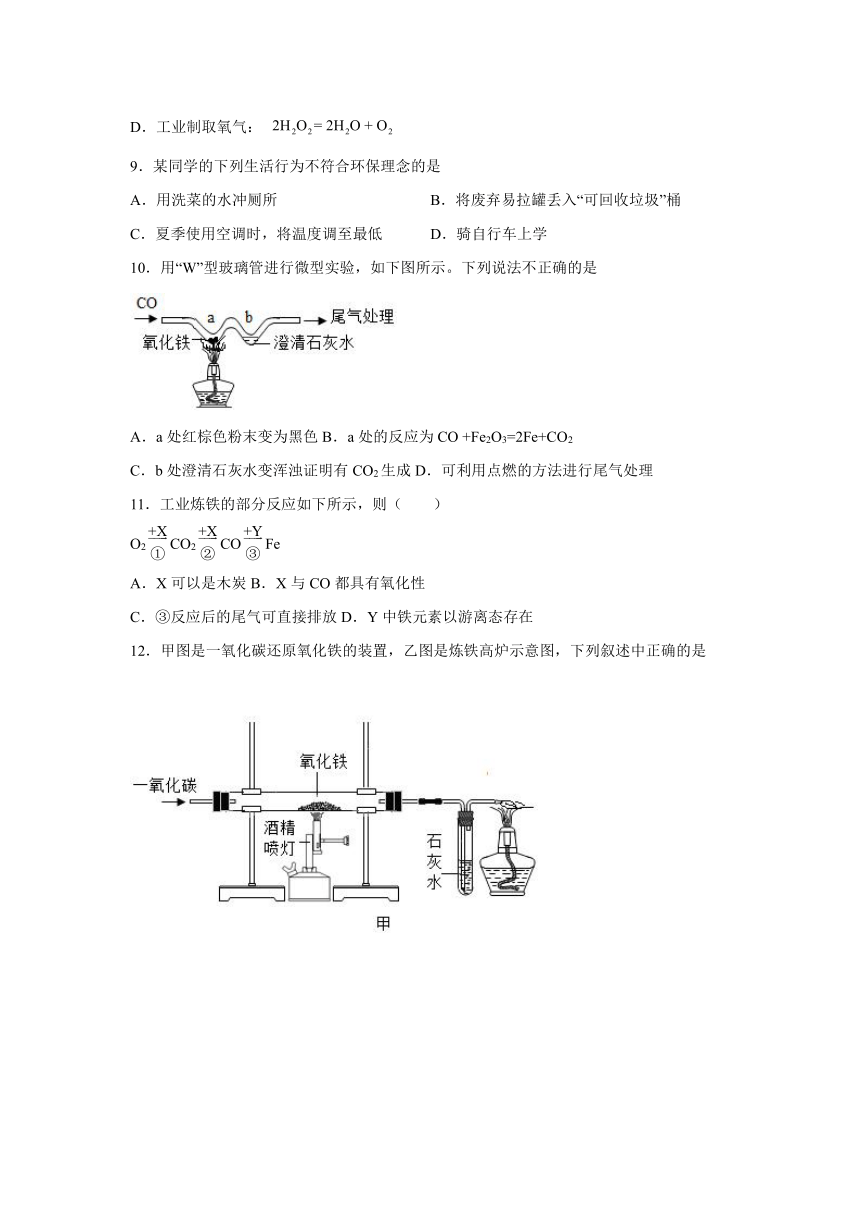
10.用“W”型玻璃管进行微型实验,如下图所示。下列说法不正确的是
A.a处红棕色粉末变为黑色B.a处的反应为CO +Fe2O3=2Fe+CO2
C.b处澄清石灰水变浑浊证明有CO2生成D.可利用点燃的方法进行尾气处理
11.工业炼铁的部分反应如下所示,则( )
O2CO2COFe
A.X可以是木炭B.X与CO都具有氧化性
C.③反应后的尾气可直接排放D.Y中铁元素以游离态存在
12.甲图是一氧化碳还原氧化铁的装置,乙图是炼铁高炉示意图,下列叙述中正确的是
A.甲图中实验开始时应先点燃加热氧化铁的酒精喷灯,再通CO
B.乙图炼铁中原料焦炭的作用只是提供热量
C.高炉炼制出的生铁是铁合金的一种,属于合成材料
D.一氧化碳还原氧化铁的反应中,一氧化碳是还原剂,一氧化碳发生了氧化反应
13.保护资源、合理利用资源是每个公民不可推卸的责任,下列做法不利于保护金属资源的是
A.有计划、合理开采矿物资源B.用油漆、搪瓷等涂覆在金属表面形成保护层
C.用塑料等代替金属制造管道D.铝制品经常用砂纸擦拭,保持光亮
14.Fe2O3、ZnO、CuO的固体混合粉末a g,在加热条件下用足量CO还原,得到金属混合物2.41 g,将生成的CO2气体用足量的澄清石灰水吸收后,产生5.00 g白色沉淀,则a的数值为
A.4.41 B.3.21 C.3.09 D.2.41
15.某工厂要用赤铁矿石(主要成分是氧化铁,假设杂质不含铁元素)来炼制钢。首先通过高炉炼铁得到生铁,其过程中损失 20%铁元素,然后将生铁经过炼钢炉中,通入纯氧,其过程损失 2%铁元素,最终得到含铁 98%的钢 100t,则理论上需要含杂质 20%的赤铁矿石的质量是
A.223t B.143t C.179t D.120t
16.将 40g 木炭粉和氧化铁的混合物加热至不再产生气体,将所得气体通入到 300g 过量澄清石水中,所得溶液为 283.2g,参加反应的氧化铁中的氧元素占原混合物的质量分数
A.32% B.56% C.24% D.64%
二、填空题
17.化学来源于生活,又服务于生活,请用所学化学知识回答下列问题。
(1)日常生活中,切菜刀采用的防锈措施是___________。
(2)古人在野外生火时常“钻木取火”。“钻木取火”满足的燃烧的条件是___________(填序号)。
A.提供可燃物 B.与氧气接触 C.达到燃烧所需的最低温度
(3)下图金属应用的实例,主要利用金属的导热性的是___________(填序号);
A.电缆 B.电热壶C.金属丝 D.金属乐器
18.金属与人类息息相关,回答有关金属的问题:
(1)生铁和钢性能上有很大的区别的原因______;
(2)保护环境将垃圾分类回收,其中将废铜导线、废旧钢铁放在一起因为他们都属于______(选填“金属材料”、“合成材料”);
(3)将黄铜片和纯铜片相互刻画,在纯铜上留下痕迹说明______;
(4)用铁锅炒菜利用了铁的______性。
19.铝、铜、铁是生活中常见的金属。
(1)铝在空气中具有很好的抗腐蚀性能的原因是___________。
(2)用铜制电线主要是利用铜具有良好的___________性。
(3)铁制品锈蚀,实际上是铁跟空气中的___________发生了化学反应。焊接铁制品时,通常先用稀盐酸除去其表面的铁锈,但稀盐酸不能过量,原因是(用化学方程式表示)为___________。防止铁制栏杆锈蚀的一种方法是___________。
三、实验题
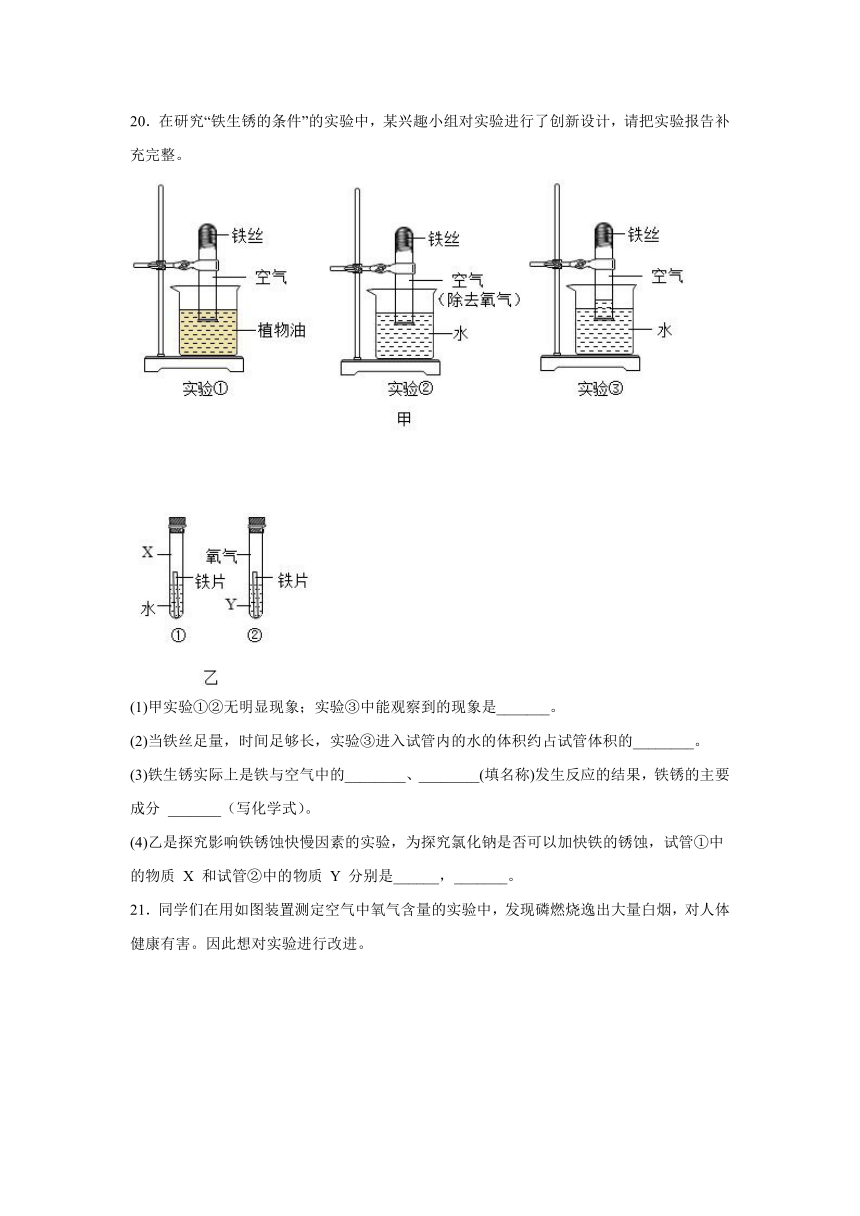
20.在研究“铁生锈的条件”的实验中,某兴趣小组对实验进行了创新设计,请把实验报告补充完整。
(1)甲实验①②无明显现象;实验③中能观察到的现象是_______。
(2)当铁丝足量,时间足够长,实验③进入试管内的水的体积约占试管体积的________。
(3)铁生锈实际上是铁与空气中的________、________(填名称)发生反应的结果,铁锈的主要成分 _______(写化学式)。
(4)乙是探究影响铁锈蚀快慢因素的实验,为探究氯化钠是否可以加快铁的锈蚀,试管①中的物质 X 和试管②中的物质 Y 分别是______,_______。
21.同学们在用如图装置测定空气中氧气含量的实验中,发现磷燃烧逸出大量白烟,对人体健康有害。因此想对实验进行改进。
(1)磷燃烧的化学方程式为________。
查阅资料:
①钢丝绒生锈可以缓慢消耗空气中的氧气,不消耗其他气体。
②醋酸溶液润洗钢丝绒,会加快钢丝绒生锈速率。
实验目的:探究钢丝绒生锈法测定空气中氧气含量的最佳条件。
实验装置如图:
实验Ⅰ:探究钢丝绒质量对实验效果的影响。
将 不同质量的 2 号钢丝绒浸泡在1.2%的醋酸溶液中,约 1 min后取出。挤出钢丝绒吸收的醋酸溶液,快速地将其放入 150mL 锥形瓶中,塞上橡皮塞。测量及计算数据如下:
表1 不同钢丝绒质量的实验效果
2号钢丝绒质量/g 1.5 2.0 2.5 3.0 3.5 4.0 4.5
耗尽氧气时间/s 2500 1800 1700 1200 1200 1200 1200
实验Ⅱ:探究钢丝绒型号对实验效果的影响。
将3种不同型号的钢丝绒各3.0g,浸泡在1.2%的醋酸溶液中,约 1 min后取出。挤出钢丝绒吸收的醋酸溶液,快速地将其放入 150mL 锥形瓶中,塞上橡皮塞。测量及计算数据如下:
表2 不同钢丝绒型号的实验效果
钢丝绒型号 1 2 3
耗尽氧气时间/s 1000 1200 2000
实验Ⅲ:探究醋酸溶液的浓度对实验效果的影响
将3.0g 2 号钢丝绒浸泡不同浓度的醋酸溶液中,约 1 min后取出。挤干钢丝绒吸收的醋酸溶液,快速地将其放入 150mL 锥形瓶中,塞上橡皮塞。
表3 不同浓度醋酸溶液的实验效果
醋酸溶液浓度/% 0.6 1.2 1.8 2.4 3
耗尽氧气时间/s 2000 1200 1200 1200 1200
分析与讨论:
(2)钢和生铁都是铁的合金,铁生锈的条件是________。
(3)实验Ⅰ的目的是________。
(4)实验Ⅱ可得到的结论是________。
(5)若要采用钢丝绒生锈法测定空气中氧气的含量,达到最快的效果,所用钢丝绒质量最小、醋酸浓度最小的数值是________。
反思与评价:
(6)钢丝绒生锈法与磷燃烧实验相比较,实验所需时间较长,如果要加快反应速率,可采用的方法是________(写出一点即可)
四、综合应用题
22.金属是人类生活中的常用的材料。
(1)金属元素在自然界中分布很广,地壳中含量最多的金属元素是______。
(2)还原铁粉常用作食品干燥剂,又称“双吸剂”。它能够吸收空气中的______。
(3)在实验室中,金属及其化合物可用于制备常见的气体,下图为制备气体的几种装置。
①实验室用高锰酸钾制取氧气应选择的装置组合是______(填字母)。
②在浓硫酸作催化剂的条件下,加热甲酸(HCOOH)能够制取一氧化碳,同时生成水,反应的化学方程式为______,利用E装置收集一氧化碳的理由是______。
(4)在实验室中,老师用下面所示的装置进行实验(图中固定试管的仪器已略去):加热一段时间后,观察到木炭粉的质量明显减少;氧化铜粉处出现了一层红亮的物质;澄清石灰水变浑浊。停止加热并冷却到室温。
①B装置的作用是______。
②实验后要从硬质大试管的剩余固体中回收金属铜,写出操作步骤______(要求过程中要用到“湿法冶金”的原理)。
(5)某钢铁厂采用赤铁矿(主要成分为Fe2O3)炼铁,日产含铁2.1×104t的生铁,至少需要含Fe2O375%的赤铁矿的质量是多少?
五、科学探究题
23.金属防腐是科学研究的重大课题。某学习小组以铁的腐蚀为项目进行如下研究。
【认识铁的腐蚀】
(1)下列环境中的铁制品最容易生锈的是______(填字母序号)。
A.未擦干的铁锅 B.涂油漆的栏杆 C.盛水的不锈钢水杯
(2)铁锈的主要成分是______。(填化学式)
【探究铁的腐蚀】
(3)该小组用下图甲装置进行实验,起始时量简内水面处于50mL刻度处,之后水面缓慢上升。几天后水面最终处于约______(填“40”或“10”) mL刻度处,原因是______。
【拓展探究】
(4)小强同学进行如下实验:取铁钉用砂纸打磨,称其质量,按上图乙安装装置,放置3天,再取出铁钉称量。在不同温度下重复上述实验,得到铁钉质量增加情况如下表。
温度/ ℃ 10 20 30 40 50 60 70
铁钉质量增加/g 0.02 0.04 0.08 0.16 0.18 0.18 0.18
小强同学的实验是探究______因素对铁钉腐蚀快慢的影响,结论是10℃到40℃______。
(5)有同学认为小强的实验未能真实反映50℃以后铁钉腐蚀的快慢,理由是50℃以后铁钉质量没有变化。请分析铁钉质量没有变化的原因:______;改进实验方案证明你的分析:______。
六、计算题
24.现有Fe和Fe2O3的固体混合物,东东同学为了分析混合物中Fe和Fe2O3的含量,设计了如下实验方案:(注意:100g是Fe与Fe2O3两种物质的总质量)
【实验数据】实验共记录了两组实验数据:
第I组,完全吸收气体后,NaOH溶液质量增加了66g;
第II组,完全反应,冷却后称量剩余固体的质量为Wg。
根据实验设计及有关数据进行分析与计算。
(1)根据第I组数据,CO与Fe2O3,反应产生CO2 __________g。
(2)混合物中Fe2O3的质量为多少_______
(3)第II组数据W是________g。
参考答案
1--10ABDBD BDCCB 11--16ADDBA C
17.(1)保持干燥等
(2)C
(3)B
18.(1)含碳量不同
(2)金属材料
(3)黄铜比纯铜硬
(4)导热
19.(1)铝和氧气反应生成氧化铝薄膜覆盖在铝的表面阻止内部的铝进一步氧化
(2)导电
(3) 水和氧气 保持铁的表面干燥和清洁
20.(1)铁丝生锈,试管中液面上升
(2)五分之一
(3) 水 氧气 Fe2O3
(4) 氧气 氯化钠溶液
21. 与氧气和水接触 探究钢丝绒质量对钢丝绒生锈法测定空气中氧气消耗的影响 其他条件相同时,1号钢丝绒进行测定空气中氧气消耗最快 3.0g、用1.2%醋酸溶液 加入其他催化剂(提高温度、增加醋酸溶液浸泡钢丝绒的时间等)
22.(1)铝元素
(2)氧气和水蒸气
(3) AE 一氧化碳难溶于水且不与水反应
(4) 防止反应后冷却到室温时,C装置的溶液倒流 将铜和氧化铜混合物加稍过量稀硫酸,黑色固体全部溶解后,加足量铁粉,充分反应后,过滤洗涤,干燥,用磁铁吸出过量的铁粉即可
(5)解:设至少需要含Fe2O375%的赤铁矿的质量是x
x=4.0×104t
答:至少需要含Fe2O375%的赤铁矿的质量是4.0×104t。
23. A Fe2O3 40 铁锈蚀消耗氧气,且氧气约占空气总体积的1/5 温度 温度在10~40℃的范围内,温度越高,铁钉腐蚀的速度越快 试管内的氧气已耗尽 向乙装置的试管中充入氧气,并在50℃的环境中放置3天;若铁钉增加的质量大于0.18g,则分析成立
24. 66 解:设混合物中Fe2O3的质量为x。
x=80g
答:混合物中Fe2O3的质量为80g。 根据题意知,减少固体质量即为氧化铁中氧元素质量。
,W=76g
答:第II组数据W是76g。
一、单选题
1.大自然向人类提供了丰富的金属矿物资源,在以下四种矿石中,可用于炼铁的是
A.赤铁矿(主要成分是Fe2O3) B.炉甘石(主要成分是ZnCO3)
C.铝土矿(主要成分是A12O3) D.赤铜矿(主要成分是Cu2O)
2.下列环境中,铁钉表面最容易生锈的是( )
A.在稀盐酸中B.在潮湿空气中
C.在干燥空气中D.浸没在植物油中
3.绿水青山就是金山银山。为了使南宁变得天更蓝、水更清、景更美,下列做法应该禁止的是
A.植树造林低碳生活 B.加强对烟花爆竹燃放管理
C.生产、生活垃圾分类放置 D.工业废水直接排入河流
4.冶铁的原料中,除铁矿石、焦炭、空气,还应添加的是
A.一氧化碳 B.石灰石 C.二氧化锰 D.氧化铁
5.下列关于金属及金属资源的利用和保护的说法合理的是
A.在菜刀上涂上盐水可以减缓菜刀生锈的速率
B.生铁和钢性能差异的原因是生铁含碳量比钢低
C.黄铜的硬度比纯铜的硬度小
D.金属资源的回收利用既保护了环境,又节约了金属资源
6.下列金属矿物中,它们的主要成分从物质的分类来看,与其他三种不同的是
A.赤铁矿(主要成分是Fe2O3) B.黄铁矿(主要成分是Fe2S)
C.磁铁矿(主要成分是Fe3O4) D.赤铜矿(主要成分是Cu2O)
7.铁在海水中容易被锈蚀、通常在轮船的吃水线以下焊接比铁更活泼的金属块,用于保护铁质船壳。该金属块的材料可以是
A.金 B.银 C.铜 D.锌
8.下列叙述、对应的化学方程式都正确的是
A.用木炭还原氧化铜:
B.在高炉中用赤铁矿炼铁:
C.验证铜和铝的活动性
D.工业制取氧气:
9.某同学的下列生活行为不符合环保理念的是
A.用洗菜的水冲厕所 B.将废弃易拉罐丢入“可回收垃圾”桶
C.夏季使用空调时,将温度调至最低 D.骑自行车上学
10.用“W”型玻璃管进行微型实验,如下图所示。下列说法不正确的是
A.a处红棕色粉末变为黑色B.a处的反应为CO +Fe2O3=2Fe+CO2
C.b处澄清石灰水变浑浊证明有CO2生成D.可利用点燃的方法进行尾气处理
11.工业炼铁的部分反应如下所示,则( )
O2CO2COFe
A.X可以是木炭B.X与CO都具有氧化性
C.③反应后的尾气可直接排放D.Y中铁元素以游离态存在
12.甲图是一氧化碳还原氧化铁的装置,乙图是炼铁高炉示意图,下列叙述中正确的是
A.甲图中实验开始时应先点燃加热氧化铁的酒精喷灯,再通CO
B.乙图炼铁中原料焦炭的作用只是提供热量
C.高炉炼制出的生铁是铁合金的一种,属于合成材料
D.一氧化碳还原氧化铁的反应中,一氧化碳是还原剂,一氧化碳发生了氧化反应
13.保护资源、合理利用资源是每个公民不可推卸的责任,下列做法不利于保护金属资源的是
A.有计划、合理开采矿物资源B.用油漆、搪瓷等涂覆在金属表面形成保护层
C.用塑料等代替金属制造管道D.铝制品经常用砂纸擦拭,保持光亮
14.Fe2O3、ZnO、CuO的固体混合粉末a g,在加热条件下用足量CO还原,得到金属混合物2.41 g,将生成的CO2气体用足量的澄清石灰水吸收后,产生5.00 g白色沉淀,则a的数值为
A.4.41 B.3.21 C.3.09 D.2.41
15.某工厂要用赤铁矿石(主要成分是氧化铁,假设杂质不含铁元素)来炼制钢。首先通过高炉炼铁得到生铁,其过程中损失 20%铁元素,然后将生铁经过炼钢炉中,通入纯氧,其过程损失 2%铁元素,最终得到含铁 98%的钢 100t,则理论上需要含杂质 20%的赤铁矿石的质量是
A.223t B.143t C.179t D.120t
16.将 40g 木炭粉和氧化铁的混合物加热至不再产生气体,将所得气体通入到 300g 过量澄清石水中,所得溶液为 283.2g,参加反应的氧化铁中的氧元素占原混合物的质量分数
A.32% B.56% C.24% D.64%
二、填空题
17.化学来源于生活,又服务于生活,请用所学化学知识回答下列问题。
(1)日常生活中,切菜刀采用的防锈措施是___________。
(2)古人在野外生火时常“钻木取火”。“钻木取火”满足的燃烧的条件是___________(填序号)。
A.提供可燃物 B.与氧气接触 C.达到燃烧所需的最低温度
(3)下图金属应用的实例,主要利用金属的导热性的是___________(填序号);
A.电缆 B.电热壶C.金属丝 D.金属乐器
18.金属与人类息息相关,回答有关金属的问题:
(1)生铁和钢性能上有很大的区别的原因______;
(2)保护环境将垃圾分类回收,其中将废铜导线、废旧钢铁放在一起因为他们都属于______(选填“金属材料”、“合成材料”);
(3)将黄铜片和纯铜片相互刻画,在纯铜上留下痕迹说明______;
(4)用铁锅炒菜利用了铁的______性。
19.铝、铜、铁是生活中常见的金属。
(1)铝在空气中具有很好的抗腐蚀性能的原因是___________。
(2)用铜制电线主要是利用铜具有良好的___________性。
(3)铁制品锈蚀,实际上是铁跟空气中的___________发生了化学反应。焊接铁制品时,通常先用稀盐酸除去其表面的铁锈,但稀盐酸不能过量,原因是(用化学方程式表示)为___________。防止铁制栏杆锈蚀的一种方法是___________。
三、实验题
20.在研究“铁生锈的条件”的实验中,某兴趣小组对实验进行了创新设计,请把实验报告补充完整。
(1)甲实验①②无明显现象;实验③中能观察到的现象是_______。
(2)当铁丝足量,时间足够长,实验③进入试管内的水的体积约占试管体积的________。
(3)铁生锈实际上是铁与空气中的________、________(填名称)发生反应的结果,铁锈的主要成分 _______(写化学式)。
(4)乙是探究影响铁锈蚀快慢因素的实验,为探究氯化钠是否可以加快铁的锈蚀,试管①中的物质 X 和试管②中的物质 Y 分别是______,_______。
21.同学们在用如图装置测定空气中氧气含量的实验中,发现磷燃烧逸出大量白烟,对人体健康有害。因此想对实验进行改进。
(1)磷燃烧的化学方程式为________。
查阅资料:
①钢丝绒生锈可以缓慢消耗空气中的氧气,不消耗其他气体。
②醋酸溶液润洗钢丝绒,会加快钢丝绒生锈速率。
实验目的:探究钢丝绒生锈法测定空气中氧气含量的最佳条件。
实验装置如图:
实验Ⅰ:探究钢丝绒质量对实验效果的影响。
将 不同质量的 2 号钢丝绒浸泡在1.2%的醋酸溶液中,约 1 min后取出。挤出钢丝绒吸收的醋酸溶液,快速地将其放入 150mL 锥形瓶中,塞上橡皮塞。测量及计算数据如下:
表1 不同钢丝绒质量的实验效果
2号钢丝绒质量/g 1.5 2.0 2.5 3.0 3.5 4.0 4.5
耗尽氧气时间/s 2500 1800 1700 1200 1200 1200 1200
实验Ⅱ:探究钢丝绒型号对实验效果的影响。
将3种不同型号的钢丝绒各3.0g,浸泡在1.2%的醋酸溶液中,约 1 min后取出。挤出钢丝绒吸收的醋酸溶液,快速地将其放入 150mL 锥形瓶中,塞上橡皮塞。测量及计算数据如下:
表2 不同钢丝绒型号的实验效果
钢丝绒型号 1 2 3
耗尽氧气时间/s 1000 1200 2000
实验Ⅲ:探究醋酸溶液的浓度对实验效果的影响
将3.0g 2 号钢丝绒浸泡不同浓度的醋酸溶液中,约 1 min后取出。挤干钢丝绒吸收的醋酸溶液,快速地将其放入 150mL 锥形瓶中,塞上橡皮塞。
表3 不同浓度醋酸溶液的实验效果
醋酸溶液浓度/% 0.6 1.2 1.8 2.4 3
耗尽氧气时间/s 2000 1200 1200 1200 1200
分析与讨论:
(2)钢和生铁都是铁的合金,铁生锈的条件是________。
(3)实验Ⅰ的目的是________。
(4)实验Ⅱ可得到的结论是________。
(5)若要采用钢丝绒生锈法测定空气中氧气的含量,达到最快的效果,所用钢丝绒质量最小、醋酸浓度最小的数值是________。
反思与评价:
(6)钢丝绒生锈法与磷燃烧实验相比较,实验所需时间较长,如果要加快反应速率,可采用的方法是________(写出一点即可)
四、综合应用题
22.金属是人类生活中的常用的材料。
(1)金属元素在自然界中分布很广,地壳中含量最多的金属元素是______。
(2)还原铁粉常用作食品干燥剂,又称“双吸剂”。它能够吸收空气中的______。
(3)在实验室中,金属及其化合物可用于制备常见的气体,下图为制备气体的几种装置。
①实验室用高锰酸钾制取氧气应选择的装置组合是______(填字母)。
②在浓硫酸作催化剂的条件下,加热甲酸(HCOOH)能够制取一氧化碳,同时生成水,反应的化学方程式为______,利用E装置收集一氧化碳的理由是______。
(4)在实验室中,老师用下面所示的装置进行实验(图中固定试管的仪器已略去):加热一段时间后,观察到木炭粉的质量明显减少;氧化铜粉处出现了一层红亮的物质;澄清石灰水变浑浊。停止加热并冷却到室温。
①B装置的作用是______。
②实验后要从硬质大试管的剩余固体中回收金属铜,写出操作步骤______(要求过程中要用到“湿法冶金”的原理)。
(5)某钢铁厂采用赤铁矿(主要成分为Fe2O3)炼铁,日产含铁2.1×104t的生铁,至少需要含Fe2O375%的赤铁矿的质量是多少?
五、科学探究题
23.金属防腐是科学研究的重大课题。某学习小组以铁的腐蚀为项目进行如下研究。
【认识铁的腐蚀】
(1)下列环境中的铁制品最容易生锈的是______(填字母序号)。
A.未擦干的铁锅 B.涂油漆的栏杆 C.盛水的不锈钢水杯
(2)铁锈的主要成分是______。(填化学式)
【探究铁的腐蚀】
(3)该小组用下图甲装置进行实验,起始时量简内水面处于50mL刻度处,之后水面缓慢上升。几天后水面最终处于约______(填“40”或“10”) mL刻度处,原因是______。
【拓展探究】
(4)小强同学进行如下实验:取铁钉用砂纸打磨,称其质量,按上图乙安装装置,放置3天,再取出铁钉称量。在不同温度下重复上述实验,得到铁钉质量增加情况如下表。
温度/ ℃ 10 20 30 40 50 60 70
铁钉质量增加/g 0.02 0.04 0.08 0.16 0.18 0.18 0.18
小强同学的实验是探究______因素对铁钉腐蚀快慢的影响,结论是10℃到40℃______。
(5)有同学认为小强的实验未能真实反映50℃以后铁钉腐蚀的快慢,理由是50℃以后铁钉质量没有变化。请分析铁钉质量没有变化的原因:______;改进实验方案证明你的分析:______。
六、计算题
24.现有Fe和Fe2O3的固体混合物,东东同学为了分析混合物中Fe和Fe2O3的含量,设计了如下实验方案:(注意:100g是Fe与Fe2O3两种物质的总质量)
【实验数据】实验共记录了两组实验数据:
第I组,完全吸收气体后,NaOH溶液质量增加了66g;
第II组,完全反应,冷却后称量剩余固体的质量为Wg。
根据实验设计及有关数据进行分析与计算。
(1)根据第I组数据,CO与Fe2O3,反应产生CO2 __________g。
(2)混合物中Fe2O3的质量为多少_______
(3)第II组数据W是________g。
参考答案
1--10ABDBD BDCCB 11--16ADDBA C
17.(1)保持干燥等
(2)C
(3)B
18.(1)含碳量不同
(2)金属材料
(3)黄铜比纯铜硬
(4)导热
19.(1)铝和氧气反应生成氧化铝薄膜覆盖在铝的表面阻止内部的铝进一步氧化
(2)导电
(3) 水和氧气 保持铁的表面干燥和清洁
20.(1)铁丝生锈,试管中液面上升
(2)五分之一
(3) 水 氧气 Fe2O3
(4) 氧气 氯化钠溶液
21. 与氧气和水接触 探究钢丝绒质量对钢丝绒生锈法测定空气中氧气消耗的影响 其他条件相同时,1号钢丝绒进行测定空气中氧气消耗最快 3.0g、用1.2%醋酸溶液 加入其他催化剂(提高温度、增加醋酸溶液浸泡钢丝绒的时间等)
22.(1)铝元素
(2)氧气和水蒸气
(3) AE 一氧化碳难溶于水且不与水反应
(4) 防止反应后冷却到室温时,C装置的溶液倒流 将铜和氧化铜混合物加稍过量稀硫酸,黑色固体全部溶解后,加足量铁粉,充分反应后,过滤洗涤,干燥,用磁铁吸出过量的铁粉即可
(5)解:设至少需要含Fe2O375%的赤铁矿的质量是x
x=4.0×104t
答:至少需要含Fe2O375%的赤铁矿的质量是4.0×104t。
23. A Fe2O3 40 铁锈蚀消耗氧气,且氧气约占空气总体积的1/5 温度 温度在10~40℃的范围内,温度越高,铁钉腐蚀的速度越快 试管内的氧气已耗尽 向乙装置的试管中充入氧气,并在50℃的环境中放置3天;若铁钉增加的质量大于0.18g,则分析成立
24. 66 解:设混合物中Fe2O3的质量为x。
x=80g
答:混合物中Fe2O3的质量为80g。 根据题意知,减少固体质量即为氧化铁中氧元素质量。
,W=76g
答:第II组数据W是76g。
同课章节目录
