2022-2023学年 苏教版选择性必修1专题1第二单元 化学能与电能的转化 第2课时 化学电源 课时练 (含答案)
文档属性
| 名称 | 2022-2023学年 苏教版选择性必修1专题1第二单元 化学能与电能的转化 第2课时 化学电源 课时练 (含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 606.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-27 21:07:09 | ||
图片预览


文档简介
第2课时 化学电源
1. 下列有关电池的说法不正确的是( )
A. 手机上用的锂离子电池属于二次电池
B. 锌铜原电池工作时,电子沿外电路从铜电极流向锌电极
C. 甲醇燃料电池可把化学能转化为电能
D. 锌锰干电池中,锌电极是负极
2. (2021·盐城中学期中)某干电池原理如图所示,电池总反应为Zn+2NH===Zn2++2NH3↑+H2↑。下列有关该电池的说法错误的是( )
A. 锌片上发生氧化反应
B. 碳棒上反应为2NH+2e-===2NH3↑+H2↑
C. 该电池工作时,Zn逐渐被消耗
D. 断开导线,图示装置中不再发生任何反应
3. (2021·南通中学期中)某燃料电池可实现NO和CO的无害转化,其结构如图所示。下列说法正确的是( )
A. 石墨Ⅰ电极上发生氧化反应
B. 电池工作时,Na+向石墨Ⅱ电极处移动
C. 石墨 Ⅱ 电极上的反应式为CO-2e-+O2-===CO2
D. 电路中每通过6 mol电子,生成1 mol N2
4. (2022·沭阳期中)锂离子蓄电池放电时的反应如下:LixC6+Li(1-x)CoO2===LiCoO2+6C(x<1)。下列说法正确的是( )
A. 放电时,Li+在电解质中由正极向负极迁移
B. 放电时,Li(1-x)CoO2中Co元素的化合价不发生变化
C. 充电时,阴极电极反应式为xLi++6C+xe-===LixC6
D. 充电时,阳极发生还原反应
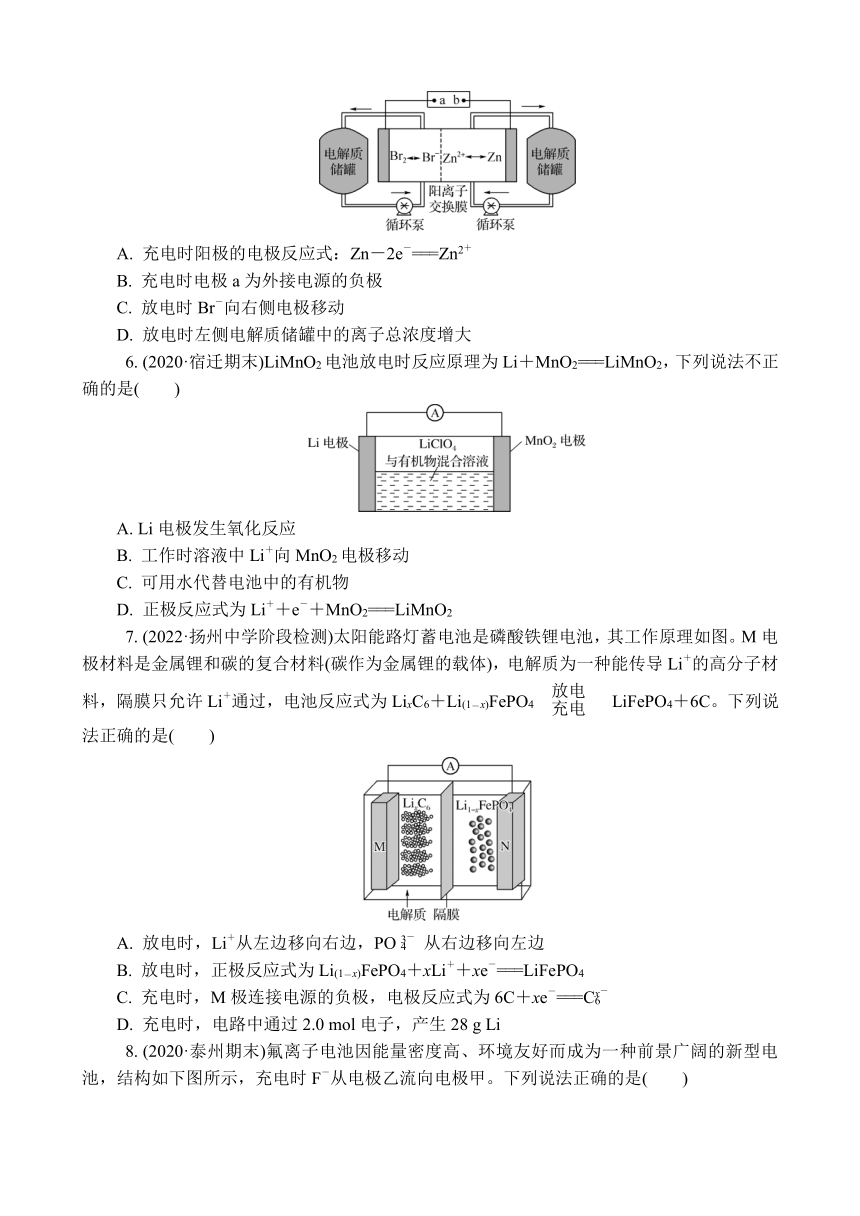
5. (2022·扬州中学阶段检测)液流电池是一种新的蓄电池,是利用正负极电解液分开,各自循环的一种高性能蓄电池,具有容量高、使用领域(环境)广、循环使用寿命长的特点。如图是一种锌溴液流电池,电解液为溴化锌的水溶液。下列说法正确的是( )
A. 充电时阳极的电极反应式:Zn-2e-===Zn2+
B. 充电时电极a为外接电源的负极
C. 放电时Br-向右侧电极移动
D. 放电时左侧电解质储罐中的离子总浓度增大
6. (2020·宿迁期末)LiMnO2电池放电时反应原理为Li+MnO2===LiMnO2,下列说法不正确的是( )
A. Li电极发生氧化反应
B. 工作时溶液中Li+向MnO2电极移动
C. 可用水代替电池中的有机物
D. 正极反应式为Li++e-+MnO2===LiMnO2
7. (2022·扬州中学阶段检测)太阳能路灯蓄电池是磷酸铁锂电池,其工作原理如图。M电极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许Li+通过,电池反应式为LixC6+Li(1-x)FePO4LiFePO4+6C。下列说法正确的是( )
A. 放电时,Li+从左边移向右边,PO从右边移向左边
B. 放电时,正极反应式为Li(1-x)FePO4+xLi++xe-===LiFePO4
C. 充电时,M极连接电源的负极,电极反应式为6C+xe-===C
D. 充电时,电路中通过2.0 mol电子,产生28 g Li
8. (2020·泰州期末)氟离子电池因能量密度高、环境友好而成为一种前景广阔的新型电池,结构如下图所示,充电时F-从电极乙流向电极甲。下列说法正确的是( )
A. 放电时,电极乙为正极,发生还原反应
B. 放电时,电极甲发生反应:Bi-3e-+3F-===BiF3
C. 充电时,电极甲与外加电源的正极相连
D. 充电时,导线上每通过2 mol e-,乙电极质量减少19 g
9. (2020·徐州期中)某华人科学家和他的团队研发出“纸电池”。这种一面镀锌、一面镀二氧化锰的超薄电池在使用印刷与压层技术后,变成一张可任意裁剪大小的“电纸”,厚度仅为0.5毫米,可以任意弯曲和裁剪。纸内的离子“流过”水和氧化锌组成电解液,电池总反应式为Zn+2MnO2+H2O===ZnO+2MnOOH。下列说法正确的是( )
A. 该电池的正极材料为锌
B. 该电池反应中二氧化锰发生了氧化反应
C. 电池的正极反应式为MnO2+H2O+e-===MnOOH+OH-
D. 当有0.1 mol锌溶解时,转移的电子数为0.4×6.02×1023
10. (2020·启东中学期末)镍镉(NiCd)可充电电池在现代生活中有广泛应用。电解质溶液为KOH溶液,电池反应为Cd+2NiO(OH)+2H2OCd(OH)2+2Ni(OH)2。下列有关镍镉电池的说法正确的是( )
A. 充电过程是化学能转化为电能的过程
B. 充电时阳极反应为Cd(OH)2+2e-===Cd+2OH-
C. 放电时电池内部OH-向正极移动
D. 充电时与直流电源正极相连的电极上Ni(OH)2转化为NiO(OH)
11. (2020·苏州期末)可充电NaCO2电池示意图如下,放电时电池总反应为4Na+3CO2===2Na2CO3+C。下列说法正确的是( )
A. 该电池也可用水作为溶剂
B. 放电时,正极的电极反应为4Na++3CO2+4e-===2Na2CO3+C
C. 充电时,钠箔与外接电源的正极相连
D. 每吸收1 mol CO2,理论上电路中转移4 mol e-
12. (1) 二氧化硫空气质子交换膜燃料电池可以利用大气所含SO2快速启动,其装置示意图如图:
①质子的流动方向为______________________________________________
(填“从A到B”或“从B到A”)。
②负极的电极反应式为______________________________________________。
(2) NH3O2燃料电池的结构如图所示:
①a极为电池的________(填“正”或“负”)极。
②当生成1 mol N2时,电路中流过电子的物质的量为________。
13. (2022·扬州邗江区期中)肼(N2H4)是一种应用广泛的化工原料。
(1) 发射火箭时用肼为燃料,NO2(g)作氧化剂,两者反应生成氮气和气态水。已知16 g N2H4(g)在上述反应中放出284 kJ的热量,写出该反应的热化学方程式____________________________________________________。
(2) 一种以N2H4(g)为燃料的电池装置如图所示。该燃料电池的电极材料采用多孔导电材料,以提高电极反应物在电极表面的吸附量,并使它们与电解质溶液充分接触,以空气中的氧气作为氧化剂,KOH溶液作为电解质。
①负极的电极反应式为_________________________________________。
②电池工作时电子从________(填“左侧”或“右侧”,下同)电极经过负载后流向________电极。
③电池工作时消耗标准状况下2.24 L 空气时,产生N2的质量约为________g。
14. 经过长时间的研发和多次展示后,科技工作者开发出了甲醇燃料电池,该电池反应为2CH3OH+3O2+4KOH===2K2CO3+6H2O。请回答下列问题:
(1) 该燃料电池的电解质是_________________________________________。
(2) 由电池反应可知,放电时该电池的负极反应物为________,该物质发生________反应,负极的电极反应式为_______________________________________。
(3) 电池使用过程中,当有0.5 mol电子转移时,消耗甲醇的质量是________g(结果保留两位小数)。
(4) 放电一段时间后,通入O2的电极附近溶液的pH________(填“升高”“不变”或“降低”)。
15. 锂二次电池新正极材料的探索和研究对锂电池的发展非常关键。
(1) 锂硒电池具有优异的循环稳定性。
①正极材料Se可由SO2通入亚硒酸(H2SeO3)溶液反应制得,则该反应的化学方程式为_______________________________________________________。
②一种锂硒电池放电时的工作原理如图1所示,写出正极的电极反应式:________________________________________________________________。
充电时Li+向________(填“Se”或“Li”)极迁移。
③Li2Sex与正极碳基体结合时的能量变化如图2所示,图中3种Li2Sex与碳基体的结合能力由大到小的顺序是___________________________________。
图1 图2 图3
(2) Li2S电池的理论能量密度高,其正极材料为碳包裹的硫化锂(Li2S)。
①Li2S可由硫酸锂与壳聚糖高温下制得,其中壳聚糖的作用是_____________________________________________________________________。
②取一定量Li2S样品在空气中加热,测得样品固体残留率随温度的变化如图3所示。(固体残留率=×100%)分析300 ℃后,固体残留率变化的原因是__________________________________________________________。
第2课时 化学电源
1. B 2. D
3. C 解析:电极石墨Ⅰ上NO发生还原反应生成N2,A错误;电池工作时,Na+向正极石墨Ⅰ移动,B错误;石墨Ⅱ为负极,发生氧化反应,电极反应式为CO-2e-+O2-===CO2,C正确;氮元素化合价由+2价降低为0价,每生成1 mol N2 得到4 mol电子,则电路中每通过6 mol电子时,生成1.5 mol N2,D错误。
4. C 解析:根据原电池工作原理,放电时,Li+从负极向正极迁移,A错误;根据放电时的反应分析,Co得电子,化合价降低,B错误;充电时,电池的负极接电源的负极,充电时,阴极反应式为放电时负极反应式的逆过程,即阴极反应式为xLi++6C+xe-===LixC6,C正确;充电时,电池正极接电源的正极,阳极上失电子,化合价升高,发生氧化反应,D错误。
5. D 解析:图示电池是锌溴液流电池,电解液为溴化锌的水溶液,放电时:电池的负极为锌,溴所在的电极为电池的正极;充电时阳极的电极反应式与放电时正极的电极反应式相反,所以充电时阳极的电极反应式为2Br--2e-===Br2,A错误;在充电时,原电池的正极连接电源的正极,是电解池的阳极,而原电池的负极连接电源的负极,所以充电时电极a为外接电源的正极,B错误;放电时为原电池,在原电池中间隔着一个阳离子交换膜,所以Br-不能向右侧电极移动,C错误;D正确且符合题意,故选D。
6. C 解析:负极Li工作时失电子发生氧化反应,A正确;MnO2作为正极,溶液中阳离子向正极移动,B正确;锂是活泼金属,能与水反应,因此不能用水代替电池中的有机物,C错误;负极反应式为Li-e-===Li+,正极反应式为Li++e-+MnO2===LiMnO2,D正确。
7. B 解析:M电极材料是金属锂和碳的复合材料(碳作为金属锂的载体),含有Li单质。放电时,电极M为负极,阳离子向正极移动,Li+从左向右移动,隔膜只允许Li+通过,PO不能通过,A错误;放电时,正极得到电子,Li(1-x)FePO4变成LiFePO4,根据电子守恒,正极反应式为Li(1-x)FePO4+xLi++xe-===LiFePO4,B正确;放电时,M为负极,充电时M为阴极,连接电源的负极,生成LixC6,电极反应为 6C+xLi++xe-===LixC6,C错误;C是锂的载体,根据6C+xLi++xe-===LixC6,转移 x mol e-得到x mol Li,则转移2 mol e-,生成2 mol Li单质,为14 g,D错误。
8. C 解析:充电时,F-从乙电极流向甲电极,则充电时,甲电极为电解池的阳极,乙电极为阴极。所以放电时,乙电极为负极,Mg发生氧化反应失去电子结合F-生成MgF2;甲电极为正极,发生还原反应,A错误;充电时,电极甲发生氧化反应:Bi-3e-+3F-===BiF3,放电时,甲电极是正极,发生还原反应:BiF3+3e-===Bi+3F-,B错误;充电时,F-从乙电极流向甲电极,则甲电极是阳极,与外加电源的正极相连,C正确;充电时,乙电极是阴极,由氟化镁转变为镁和F-,电极反应为MgF2+2e-===Mg+2F-,当导线上通过2 mol e-,乙电极减重2 mol×19 g·mol-1=38 g,D错误。
9. C 解析:该原电池中,锌元素化合价由0价变为+2价,锌失电子作负极,A错误;该原电池中,锰元素化合价由+4价变为+3价,二氧化锰发生了还原反应,B错误;正极上二氧化锰得电子发生还原反应,电极反应式为MnO2+e-+H2O===MnOOH+OH-,C正确;当有0.1 mol锌溶解时,转移的电子数为0.2×6.02×1023,D错误。
10. D 解析:充电过程是将电能转化为化学能的过程,A错误;充电时,该装置是电解池,阳极上电极反应式为Ni(OH)2-e-+OH-===NiO(OH)+H2O,B错误;放电时,电解质溶液中OH-向负极移动,C错误;D正确且符合题意,故选D。
11. B 解析:由于钠会与水反应生成氢氧化钠和氢气,因此该电池不能用水作为溶剂,应选择有机溶剂,A错误;放电时,多壁碳纳米管为原电池的正极,二氧化碳在正极上得到电子生成碳和碳酸钠,电极反应式为4Na++3CO2+4e-===2Na2CO3+C,B正确;放电时,钠箔为原电池的负极,则充电时,钠箔与外接电源的负极相连,C错误;由电池总方程式可知,每吸收3 mol CO2,理论上电路中转移4 mol e-,D错误。
12. (1) ①从A到B
②SO2-2e-+2H2O===SO+4H+
(2) ①负 ②6 mol
13. (1) 2N2H4(g)+2NO2(g)===3N2(g)+4H2O(g) ΔH=-1 136 kJ·mol-1
(2) ①N2H4+4OH--4e-===N2+4H2O ②左侧 右侧 ③0.56
14. (1) KOH
(2) CH3OH(或甲醇) 氧化 CH3OH+8OH--6e-===CO+6H2O
(3) 2.67 (4) 升高
15. (1) ①H2SeO3+2SO2+H2O===Se+2H2SO4 ②2Li++xSe+2e-===Li2Sex Li ③Li2Se6>Li2Se4>Li2Se
(2) ①提供碳源,将硫酸锂还原(作还原剂)
②300 ℃后,样品主要发生两个反应过程:反应1为Li2S被O2氧化生成Li2SO4,反应2为C被O2氧化生成CO2;前期固体残留率增加的原因是反应1为主,后期固体残留率减少的原因反应2为主。
1. 下列有关电池的说法不正确的是( )
A. 手机上用的锂离子电池属于二次电池
B. 锌铜原电池工作时,电子沿外电路从铜电极流向锌电极
C. 甲醇燃料电池可把化学能转化为电能
D. 锌锰干电池中,锌电极是负极
2. (2021·盐城中学期中)某干电池原理如图所示,电池总反应为Zn+2NH===Zn2++2NH3↑+H2↑。下列有关该电池的说法错误的是( )
A. 锌片上发生氧化反应
B. 碳棒上反应为2NH+2e-===2NH3↑+H2↑
C. 该电池工作时,Zn逐渐被消耗
D. 断开导线,图示装置中不再发生任何反应
3. (2021·南通中学期中)某燃料电池可实现NO和CO的无害转化,其结构如图所示。下列说法正确的是( )
A. 石墨Ⅰ电极上发生氧化反应
B. 电池工作时,Na+向石墨Ⅱ电极处移动
C. 石墨 Ⅱ 电极上的反应式为CO-2e-+O2-===CO2
D. 电路中每通过6 mol电子,生成1 mol N2
4. (2022·沭阳期中)锂离子蓄电池放电时的反应如下:LixC6+Li(1-x)CoO2===LiCoO2+6C(x<1)。下列说法正确的是( )
A. 放电时,Li+在电解质中由正极向负极迁移
B. 放电时,Li(1-x)CoO2中Co元素的化合价不发生变化
C. 充电时,阴极电极反应式为xLi++6C+xe-===LixC6
D. 充电时,阳极发生还原反应
5. (2022·扬州中学阶段检测)液流电池是一种新的蓄电池,是利用正负极电解液分开,各自循环的一种高性能蓄电池,具有容量高、使用领域(环境)广、循环使用寿命长的特点。如图是一种锌溴液流电池,电解液为溴化锌的水溶液。下列说法正确的是( )
A. 充电时阳极的电极反应式:Zn-2e-===Zn2+
B. 充电时电极a为外接电源的负极
C. 放电时Br-向右侧电极移动
D. 放电时左侧电解质储罐中的离子总浓度增大
6. (2020·宿迁期末)LiMnO2电池放电时反应原理为Li+MnO2===LiMnO2,下列说法不正确的是( )
A. Li电极发生氧化反应
B. 工作时溶液中Li+向MnO2电极移动
C. 可用水代替电池中的有机物
D. 正极反应式为Li++e-+MnO2===LiMnO2
7. (2022·扬州中学阶段检测)太阳能路灯蓄电池是磷酸铁锂电池,其工作原理如图。M电极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许Li+通过,电池反应式为LixC6+Li(1-x)FePO4LiFePO4+6C。下列说法正确的是( )
A. 放电时,Li+从左边移向右边,PO从右边移向左边
B. 放电时,正极反应式为Li(1-x)FePO4+xLi++xe-===LiFePO4
C. 充电时,M极连接电源的负极,电极反应式为6C+xe-===C
D. 充电时,电路中通过2.0 mol电子,产生28 g Li
8. (2020·泰州期末)氟离子电池因能量密度高、环境友好而成为一种前景广阔的新型电池,结构如下图所示,充电时F-从电极乙流向电极甲。下列说法正确的是( )
A. 放电时,电极乙为正极,发生还原反应
B. 放电时,电极甲发生反应:Bi-3e-+3F-===BiF3
C. 充电时,电极甲与外加电源的正极相连
D. 充电时,导线上每通过2 mol e-,乙电极质量减少19 g
9. (2020·徐州期中)某华人科学家和他的团队研发出“纸电池”。这种一面镀锌、一面镀二氧化锰的超薄电池在使用印刷与压层技术后,变成一张可任意裁剪大小的“电纸”,厚度仅为0.5毫米,可以任意弯曲和裁剪。纸内的离子“流过”水和氧化锌组成电解液,电池总反应式为Zn+2MnO2+H2O===ZnO+2MnOOH。下列说法正确的是( )
A. 该电池的正极材料为锌
B. 该电池反应中二氧化锰发生了氧化反应
C. 电池的正极反应式为MnO2+H2O+e-===MnOOH+OH-
D. 当有0.1 mol锌溶解时,转移的电子数为0.4×6.02×1023
10. (2020·启东中学期末)镍镉(NiCd)可充电电池在现代生活中有广泛应用。电解质溶液为KOH溶液,电池反应为Cd+2NiO(OH)+2H2OCd(OH)2+2Ni(OH)2。下列有关镍镉电池的说法正确的是( )
A. 充电过程是化学能转化为电能的过程
B. 充电时阳极反应为Cd(OH)2+2e-===Cd+2OH-
C. 放电时电池内部OH-向正极移动
D. 充电时与直流电源正极相连的电极上Ni(OH)2转化为NiO(OH)
11. (2020·苏州期末)可充电NaCO2电池示意图如下,放电时电池总反应为4Na+3CO2===2Na2CO3+C。下列说法正确的是( )
A. 该电池也可用水作为溶剂
B. 放电时,正极的电极反应为4Na++3CO2+4e-===2Na2CO3+C
C. 充电时,钠箔与外接电源的正极相连
D. 每吸收1 mol CO2,理论上电路中转移4 mol e-
12. (1) 二氧化硫空气质子交换膜燃料电池可以利用大气所含SO2快速启动,其装置示意图如图:
①质子的流动方向为______________________________________________
(填“从A到B”或“从B到A”)。
②负极的电极反应式为______________________________________________。
(2) NH3O2燃料电池的结构如图所示:
①a极为电池的________(填“正”或“负”)极。
②当生成1 mol N2时,电路中流过电子的物质的量为________。
13. (2022·扬州邗江区期中)肼(N2H4)是一种应用广泛的化工原料。
(1) 发射火箭时用肼为燃料,NO2(g)作氧化剂,两者反应生成氮气和气态水。已知16 g N2H4(g)在上述反应中放出284 kJ的热量,写出该反应的热化学方程式____________________________________________________。
(2) 一种以N2H4(g)为燃料的电池装置如图所示。该燃料电池的电极材料采用多孔导电材料,以提高电极反应物在电极表面的吸附量,并使它们与电解质溶液充分接触,以空气中的氧气作为氧化剂,KOH溶液作为电解质。
①负极的电极反应式为_________________________________________。
②电池工作时电子从________(填“左侧”或“右侧”,下同)电极经过负载后流向________电极。
③电池工作时消耗标准状况下2.24 L 空气时,产生N2的质量约为________g。
14. 经过长时间的研发和多次展示后,科技工作者开发出了甲醇燃料电池,该电池反应为2CH3OH+3O2+4KOH===2K2CO3+6H2O。请回答下列问题:
(1) 该燃料电池的电解质是_________________________________________。
(2) 由电池反应可知,放电时该电池的负极反应物为________,该物质发生________反应,负极的电极反应式为_______________________________________。
(3) 电池使用过程中,当有0.5 mol电子转移时,消耗甲醇的质量是________g(结果保留两位小数)。
(4) 放电一段时间后,通入O2的电极附近溶液的pH________(填“升高”“不变”或“降低”)。
15. 锂二次电池新正极材料的探索和研究对锂电池的发展非常关键。
(1) 锂硒电池具有优异的循环稳定性。
①正极材料Se可由SO2通入亚硒酸(H2SeO3)溶液反应制得,则该反应的化学方程式为_______________________________________________________。
②一种锂硒电池放电时的工作原理如图1所示,写出正极的电极反应式:________________________________________________________________。
充电时Li+向________(填“Se”或“Li”)极迁移。
③Li2Sex与正极碳基体结合时的能量变化如图2所示,图中3种Li2Sex与碳基体的结合能力由大到小的顺序是___________________________________。
图1 图2 图3
(2) Li2S电池的理论能量密度高,其正极材料为碳包裹的硫化锂(Li2S)。
①Li2S可由硫酸锂与壳聚糖高温下制得,其中壳聚糖的作用是_____________________________________________________________________。
②取一定量Li2S样品在空气中加热,测得样品固体残留率随温度的变化如图3所示。(固体残留率=×100%)分析300 ℃后,固体残留率变化的原因是__________________________________________________________。
第2课时 化学电源
1. B 2. D
3. C 解析:电极石墨Ⅰ上NO发生还原反应生成N2,A错误;电池工作时,Na+向正极石墨Ⅰ移动,B错误;石墨Ⅱ为负极,发生氧化反应,电极反应式为CO-2e-+O2-===CO2,C正确;氮元素化合价由+2价降低为0价,每生成1 mol N2 得到4 mol电子,则电路中每通过6 mol电子时,生成1.5 mol N2,D错误。
4. C 解析:根据原电池工作原理,放电时,Li+从负极向正极迁移,A错误;根据放电时的反应分析,Co得电子,化合价降低,B错误;充电时,电池的负极接电源的负极,充电时,阴极反应式为放电时负极反应式的逆过程,即阴极反应式为xLi++6C+xe-===LixC6,C正确;充电时,电池正极接电源的正极,阳极上失电子,化合价升高,发生氧化反应,D错误。
5. D 解析:图示电池是锌溴液流电池,电解液为溴化锌的水溶液,放电时:电池的负极为锌,溴所在的电极为电池的正极;充电时阳极的电极反应式与放电时正极的电极反应式相反,所以充电时阳极的电极反应式为2Br--2e-===Br2,A错误;在充电时,原电池的正极连接电源的正极,是电解池的阳极,而原电池的负极连接电源的负极,所以充电时电极a为外接电源的正极,B错误;放电时为原电池,在原电池中间隔着一个阳离子交换膜,所以Br-不能向右侧电极移动,C错误;D正确且符合题意,故选D。
6. C 解析:负极Li工作时失电子发生氧化反应,A正确;MnO2作为正极,溶液中阳离子向正极移动,B正确;锂是活泼金属,能与水反应,因此不能用水代替电池中的有机物,C错误;负极反应式为Li-e-===Li+,正极反应式为Li++e-+MnO2===LiMnO2,D正确。
7. B 解析:M电极材料是金属锂和碳的复合材料(碳作为金属锂的载体),含有Li单质。放电时,电极M为负极,阳离子向正极移动,Li+从左向右移动,隔膜只允许Li+通过,PO不能通过,A错误;放电时,正极得到电子,Li(1-x)FePO4变成LiFePO4,根据电子守恒,正极反应式为Li(1-x)FePO4+xLi++xe-===LiFePO4,B正确;放电时,M为负极,充电时M为阴极,连接电源的负极,生成LixC6,电极反应为 6C+xLi++xe-===LixC6,C错误;C是锂的载体,根据6C+xLi++xe-===LixC6,转移 x mol e-得到x mol Li,则转移2 mol e-,生成2 mol Li单质,为14 g,D错误。
8. C 解析:充电时,F-从乙电极流向甲电极,则充电时,甲电极为电解池的阳极,乙电极为阴极。所以放电时,乙电极为负极,Mg发生氧化反应失去电子结合F-生成MgF2;甲电极为正极,发生还原反应,A错误;充电时,电极甲发生氧化反应:Bi-3e-+3F-===BiF3,放电时,甲电极是正极,发生还原反应:BiF3+3e-===Bi+3F-,B错误;充电时,F-从乙电极流向甲电极,则甲电极是阳极,与外加电源的正极相连,C正确;充电时,乙电极是阴极,由氟化镁转变为镁和F-,电极反应为MgF2+2e-===Mg+2F-,当导线上通过2 mol e-,乙电极减重2 mol×19 g·mol-1=38 g,D错误。
9. C 解析:该原电池中,锌元素化合价由0价变为+2价,锌失电子作负极,A错误;该原电池中,锰元素化合价由+4价变为+3价,二氧化锰发生了还原反应,B错误;正极上二氧化锰得电子发生还原反应,电极反应式为MnO2+e-+H2O===MnOOH+OH-,C正确;当有0.1 mol锌溶解时,转移的电子数为0.2×6.02×1023,D错误。
10. D 解析:充电过程是将电能转化为化学能的过程,A错误;充电时,该装置是电解池,阳极上电极反应式为Ni(OH)2-e-+OH-===NiO(OH)+H2O,B错误;放电时,电解质溶液中OH-向负极移动,C错误;D正确且符合题意,故选D。
11. B 解析:由于钠会与水反应生成氢氧化钠和氢气,因此该电池不能用水作为溶剂,应选择有机溶剂,A错误;放电时,多壁碳纳米管为原电池的正极,二氧化碳在正极上得到电子生成碳和碳酸钠,电极反应式为4Na++3CO2+4e-===2Na2CO3+C,B正确;放电时,钠箔为原电池的负极,则充电时,钠箔与外接电源的负极相连,C错误;由电池总方程式可知,每吸收3 mol CO2,理论上电路中转移4 mol e-,D错误。
12. (1) ①从A到B
②SO2-2e-+2H2O===SO+4H+
(2) ①负 ②6 mol
13. (1) 2N2H4(g)+2NO2(g)===3N2(g)+4H2O(g) ΔH=-1 136 kJ·mol-1
(2) ①N2H4+4OH--4e-===N2+4H2O ②左侧 右侧 ③0.56
14. (1) KOH
(2) CH3OH(或甲醇) 氧化 CH3OH+8OH--6e-===CO+6H2O
(3) 2.67 (4) 升高
15. (1) ①H2SeO3+2SO2+H2O===Se+2H2SO4 ②2Li++xSe+2e-===Li2Sex Li ③Li2Se6>Li2Se4>Li2Se
(2) ①提供碳源,将硫酸锂还原(作还原剂)
②300 ℃后,样品主要发生两个反应过程:反应1为Li2S被O2氧化生成Li2SO4,反应2为C被O2氧化生成CO2;前期固体残留率增加的原因是反应1为主,后期固体残留率减少的原因反应2为主。
