2022-2023学年 苏教版选择性必修1专题1第三单元 金属的腐蚀与防护 课时练 (含答案)
文档属性
| 名称 | 2022-2023学年 苏教版选择性必修1专题1第三单元 金属的腐蚀与防护 课时练 (含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 802.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-27 21:15:56 | ||
图片预览


文档简介
第三单元 金属的腐蚀与防护
1. 下列防止金属腐蚀的方法属于电化学防护的是( )
A. 船体表面刷漆
B. 水中的钢闸门连接电源的负极
C. 自行车链条涂油
D. 加入铬、锰、硅等制成不锈钢
2. 为防止钢铁锈蚀,下列防护方法正确的是( )
A. 在精密机床的铁床上安装铜螺钉
B. 在排放海水的钢铁阀门上用导线连接一块石墨,一同浸入海水中
C. 在海轮舷上用铁丝系住锌板浸在海水里
D. 在电动输油管的铸铁管上接直流电源的正极
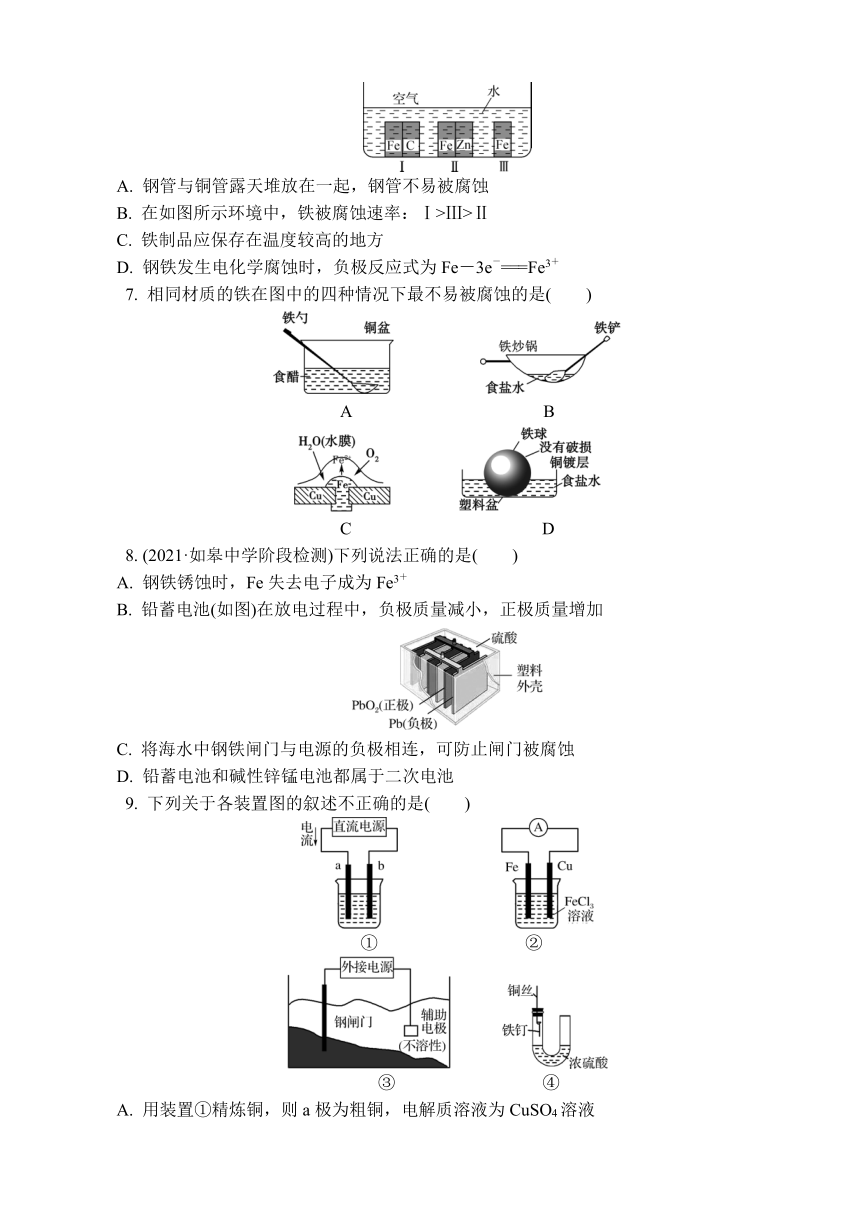
3. 研究电化学腐蚀及防护的装置如图所示。下列有关说法错误的是( )
A. 若d为石墨,则铁片腐蚀加快
B. 若d为石墨,则石墨上电极反应式为O2+2H2O+4e-===4OH-
C. 若d为锌块,则铁片不易被腐蚀
D. 若d为锌块,则铁片上电极反应式为2H++2e-===H2↑
4. 下列叙述正确的是( )
A. 金属腐蚀就是金属失去电子被还原的过程
B. 将水库中的水闸(钢板)与外加直流电源的负极相连,正极连接到一块废铁上可防止水闸被腐蚀
C. 纯银质物品久置表面变暗,是银发生吸氧腐蚀的结果
D. 铜板上的铁铆钉处在潮湿的空气中直接发生反应:Fe-3e-===Fe3+,继而形成铁锈
5. 青铜器发生电化学腐蚀的原理如图所示,下列说法正确的是( )
A. 腐蚀过程中,青铜基体是正极
B. 为防止腐蚀,可通过导线将铜器与直流电源负极相连
C. 多孔催化层加速了青铜器的腐蚀,因为改变了反应的焓变
D. 若有64 g Cu腐蚀,理论上耗氧体积为22.4 L(标准状况)
6. 下列有关钢铁腐蚀与防护的说法正确的是( )
A. 钢管与铜管露天堆放在一起,钢管不易被腐蚀
B. 在如图所示环境中,铁被腐蚀速率:Ⅰ>Ⅲ>Ⅱ
C. 铁制品应保存在温度较高的地方
D. 钢铁发生电化学腐蚀时,负极反应式为Fe-3e-===Fe3+
7. 相同材质的铁在图中的四种情况下最不易被腐蚀的是( )
A B
C D
8. (2021·如皋中学阶段检测)下列说法正确的是( )
A. 钢铁锈蚀时,Fe失去电子成为Fe3+
B. 铅蓄电池(如图)在放电过程中,负极质量减小,正极质量增加
C. 将海水中钢铁闸门与电源的负极相连,可防止闸门被腐蚀
D. 铅蓄电池和碱性锌锰电池都属于二次电池
9. 下列关于各装置图的叙述不正确的是( )
① ②
③ ④
A. 用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液
B. 装置②的总反应式为Cu+2Fe3+===Cu2++2Fe2+
C. 装置③中钢闸门应与外接电源的负极相连
D. 装置④中的铁钉几乎未被腐蚀
10. 探究铁发生腐蚀的装置图如图所示,下列说法正确的是( )
A. 若B处液面上升,A溶液可能是酸性溶液
B. 若A为NaCl溶液,B、C液面始终保持不变
C. 可能产生Fe2O3·nH2O
D. 腐蚀的总反应式为2Fe+O2+2H2O===2Fe(OH)2
11. 港珠澳大桥设计寿命120年,对桥体钢构件采用多种方法防腐。下列分析错误的是( )
A. 防腐原理主要是避免发生反应:2Fe+O2+2H2O===2Fe(OH)2
B. 钢构件表面喷涂环氧树脂涂层,是为了隔绝空气、水等,防止形成原电池
C. 采用外加电流法需直接在钢构件上绑上锌块
D. 钢构件可采用不锈钢材料以减缓电化学腐蚀
12. 利用如图装置可以模拟铁的电化学防护。下列说法错误的是( )
A. 若X为锌棒,开关K置于M处,可减缓铁的腐蚀
B. 若X为锌棒,开关K置于M处,铁极发生氧化反应
C. 若X为碳棒,开关K置于N处,可减缓铁的腐蚀
D. 若X为碳棒,开关K置于N处,X极发生氧化反应
13. (1) 对金属制品进行抗腐蚀处理,可延长其使用寿命。
①碱洗的目的是除去铝材表面的自然氧化膜,碱洗时常有气泡冒出,原因是________________________________(用离子方程式表示)。为将碱洗槽液中的铝以沉淀的形式回收,最好向槽液中加入下列试剂中的________(填字母)。
a. NH3 b. CO2
c. NaOH d. HNO3
②以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极电极反应式为__________________________________________________________。
(2) 镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨作阳极材料的原因是_____________________________________________________________________。
14. 金属腐蚀现象在生产生活中普遍存在,依据下列两种腐蚀现象回答问题:
图1 图2
(1) 图1被腐蚀的金属为________,其腐蚀类型属于________(填字母,下同)。图2金属腐蚀类型属于________。
A. 化学腐蚀 B. 电化学腐蚀
C. 析氢腐蚀 D. 吸氧腐蚀
(2) 图1中Cu的作用是______________________________,
结合电极反应、电子移动、离子移动等,分析金属被腐蚀的原理:_____________________________________________________________________。
(3) 图2中铁的生锈过程:Fe→Fe(OH)2→Fe(OH)3→Fe2O3·nH2O,将Fe转变为Fe(OH)2的反应补充完整:正极反应为___________________________,负极反应为______________________,总反应为______________________________。
(4) 下列防止铁制品生锈的措施合理的是________(填字母)。
A. 在铁闸门表面涂油漆
B. 在地下铁管道上安装若干镁合金
C. 将铁罐与浓硫酸等强氧化剂接触,使之发生钝化
15. 回答下列问题:
(1) 实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图如下。
①该电化腐蚀称为________。
②图中A、B、C、D四个区域,生成铁锈最多的是________(填字母)。
③以锌为负极,采用牺牲阳极的阴极保护法防止铁闸的腐蚀,图中锌块的固定位置最好应在________处(填字母)。
(2) 石墨可用于自然水体中铜件的电化学防腐,完成如图防腐示意图,并作相应标注:
(3) 下图所示的各容器中盛有海水,铁在其中被腐蚀时由快到慢的顺序是________________(填序号)。
① ② ③ ④
(4) 如图,将铁棒和石墨棒插入盛有饱和NaCl溶液的U形管中,下列分析正确的是________(填字母)。
A. K1闭合,铁棒上发生的反应为2H++2e-===H2↑
B. K1闭合,石墨棒周围溶液pH逐渐升高
C. K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法
D. K2闭合,电路中通过0.002 NA个电子时,两极共产生0.001 mol气体
16. 某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图1)。从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化。
(1) 请完成以下实验设计表(表中不要留空格): 图1
编号 实验目的 碳粉/g 铁粉/g 醋酸/%
① 为以下实验作参照 0.5 2.0 90.0
② 醋酸浓度的影响 0.5 36.0
③ 0.2 2.0 90.0
(2) 编号①实验测得容器中压强随时间变化如图2。t2时,容器中压强明显小于起始压强,其原因是铁发生了________腐蚀,请在图3中用箭头标出发生该腐蚀时电子流动方向;此时,碳粉表面发生了________(填“氧化”或“还原”)反应,其电极反应式为___________________________________________________。
图2 图3
(3) 该小组对图2中O~t1时压强变大的原因提出了如下假设,请你完成假设二。
假设一:发生析氢腐蚀产生了气体;
假设二:______________________________________。
第三单元 金属的腐蚀与防护
1. B 2. C 3. D
4. B 解析:金属腐蚀就是金属失去电子被氧化的过程,A错误;将水库中的水闸(钢板)与外加直流电源的负极相连接,作电解池的阴极,被保护,可防止水闸被腐蚀,B正确;纯银质物品久置变暗是因为银与空气中的硫化氢反应生成了硫化银,与吸氧腐蚀无关,C错误;铜板上的铁铆钉处在潮湿的空气中形成原电池,发生吸氧腐蚀,负极电极反应式为Fe-2e-===Fe2+,D错误。
5. B 解析:由图可知,青铜基体电极有Cu2+产生,Cu化合价升高,发生氧化反应,为负极,A错误;将铜器与直流电源负极相连,则铜器作阴极,采用外加电流的阴极保护法防止腐蚀,B正确;反应的焓变只与反应物、生成物的状态有关,与反应过程无关,因此反应焓变不会改变,C错误;在该反应中,Cu失去电子变成Cu2+,64 g Cu的物质的量==1 mol,转移电子物质的量为2 mol,消耗1分子O2转移4个电子,根据得失电子守恒,消耗O2的物质的量==0.5 mol,在标准状况下,理论上耗氧体积=0.5 mol×22.4 L·mol-1=11.2 L,D错误。
6. B 解析:钢管与铜管露天堆放在一起,金属铁和金属铜形成原电池,铁为负极,易被腐蚀,A错误;金属腐蚀速率顺序:电化学腐蚀>化学腐蚀>有保护措施的腐蚀,Ⅰ中金属铁作原电池的负极,Ⅱ中金属铁作原电池的正极,所以腐蚀速率:Ⅰ>Ⅲ>Ⅱ,B正确;高温下金属铁和氧气的反应速率会增大,铁制品应该放在低温干燥环境中保存,C错误;在钢铁发生电化学腐蚀时,负极反应式为Fe-2e-===Fe2+,D错误。
7. D 解析:食醋提供电解质溶液环境,铁勺和铜盆是相互接触的两个金属电极,形成原电池,铁是活泼金属作负极,易被腐蚀,A错误;食盐水提供电解质溶液环境,铁炒锅和铁铲都是铁碳合金,铁是活泼金属作负极,碳作正极,铁易被腐蚀,B错误;铁、铜形成原电池,铁是活泼金属作负极,易被腐蚀,C错误;D正确且符合题意,故选D。
8. C 解析:钢铁锈蚀时,Fe作为负极,Fe失去电子生成Fe2+,A错误;铅蓄电池在放电过程中,负极Pb失电子后与电解质溶液中的SO结合生成PbSO4,质量增大,B错误;将海水中钢铁闸门与电源的负极相连,此时钢铁闸门作为阴极,可阻止钢铁闸门中的铁失电子,从而防止闸门被腐蚀,C正确;碱性锌锰电池属于一次电池,D错误。
9. B 解析:装置①中a电极和电源的正极相连,作阳极,b是阴极,粗铜精炼时,粗铜是阳极,纯铜是阴极,A正确;装置②是原电池,铁的金属性强于铜,所以铁是负极,失去电子,铜是正极,溶液中的铁离子得到电子,B错误;钢闸门应与外接电源的负极相连,作阴极被保护,C正确;装置④中铁钉处在极其干燥的环境中,不易腐蚀,D正确。
10. C 解析:析氢腐蚀的总反应为Fe+2H+===Fe2++H2↑,使B处液面下降,则A溶液不可能是酸性溶液,A错误;若A为NaCl溶液,则发生吸氧腐蚀,B处液面上升,B错误;发生吸氧腐蚀,2Fe+O2+2H2O===2Fe(OH)2,4Fe(OH)2+O2+2H2O===4Fe(OH)3,Fe(OH)3部分脱水,产物变为Fe2O3·nH2O,C正确;如果是析氢腐蚀,总反应式为Fe+2H+===Fe2++H2↑,D错误。
11. C 解析:A、B、D均正确。外加电流法中,钢铁作为阴极被保护,阳极可以采用惰性电极,C错误。
12. B 解析:若X为锌棒,开关K置于M处时,锌作负极,铁作正极被保护,A正确、B错误;若X为碳棒,开关K置于N处,铁连接电源负极作阴极被保护,C正确;X连接电源正极作阳极被氧化,D正确。
13. (1) ①2Al+2OH-+2H2O===2AlO+3H2↑ b ②2Al+3H2O-6e-===Al2O3+6H+
(2) 阳极Cu可以发生氧化反应生成Cu2+,使电解质溶液中的Cu2+保持不变。
14. (1) 铁或Fe BC BD
(2) 作正极,导电 铜为正极,氢离子在内电路移向正极,得到电子,生成氢气;铁为负极,在外电路失去电子,电子从负极移向正极,金属铁被腐蚀成亚铁离子
(3) O2+4e-+2H2O===4OH- 2Fe-4e-===2Fe2+ 2Fe+O2+2H2O===2Fe(OH)2
(4) ABC
15. (1) ①吸氧腐蚀 ②B ③C
(2)
(3) ④>②>①>③
(4) B
16. (1)
编号 实验目的 碳粉/g 铁粉/g 醋酸/%
② 2.0
③ 碳粉含量的影响
(2) 吸氧 如图
还原 2H2O+O2+4e-===4OH-
(3) 反应放热,温度升高
1. 下列防止金属腐蚀的方法属于电化学防护的是( )
A. 船体表面刷漆
B. 水中的钢闸门连接电源的负极
C. 自行车链条涂油
D. 加入铬、锰、硅等制成不锈钢
2. 为防止钢铁锈蚀,下列防护方法正确的是( )
A. 在精密机床的铁床上安装铜螺钉
B. 在排放海水的钢铁阀门上用导线连接一块石墨,一同浸入海水中
C. 在海轮舷上用铁丝系住锌板浸在海水里
D. 在电动输油管的铸铁管上接直流电源的正极
3. 研究电化学腐蚀及防护的装置如图所示。下列有关说法错误的是( )
A. 若d为石墨,则铁片腐蚀加快
B. 若d为石墨,则石墨上电极反应式为O2+2H2O+4e-===4OH-
C. 若d为锌块,则铁片不易被腐蚀
D. 若d为锌块,则铁片上电极反应式为2H++2e-===H2↑
4. 下列叙述正确的是( )
A. 金属腐蚀就是金属失去电子被还原的过程
B. 将水库中的水闸(钢板)与外加直流电源的负极相连,正极连接到一块废铁上可防止水闸被腐蚀
C. 纯银质物品久置表面变暗,是银发生吸氧腐蚀的结果
D. 铜板上的铁铆钉处在潮湿的空气中直接发生反应:Fe-3e-===Fe3+,继而形成铁锈
5. 青铜器发生电化学腐蚀的原理如图所示,下列说法正确的是( )
A. 腐蚀过程中,青铜基体是正极
B. 为防止腐蚀,可通过导线将铜器与直流电源负极相连
C. 多孔催化层加速了青铜器的腐蚀,因为改变了反应的焓变
D. 若有64 g Cu腐蚀,理论上耗氧体积为22.4 L(标准状况)
6. 下列有关钢铁腐蚀与防护的说法正确的是( )
A. 钢管与铜管露天堆放在一起,钢管不易被腐蚀
B. 在如图所示环境中,铁被腐蚀速率:Ⅰ>Ⅲ>Ⅱ
C. 铁制品应保存在温度较高的地方
D. 钢铁发生电化学腐蚀时,负极反应式为Fe-3e-===Fe3+
7. 相同材质的铁在图中的四种情况下最不易被腐蚀的是( )
A B
C D
8. (2021·如皋中学阶段检测)下列说法正确的是( )
A. 钢铁锈蚀时,Fe失去电子成为Fe3+
B. 铅蓄电池(如图)在放电过程中,负极质量减小,正极质量增加
C. 将海水中钢铁闸门与电源的负极相连,可防止闸门被腐蚀
D. 铅蓄电池和碱性锌锰电池都属于二次电池
9. 下列关于各装置图的叙述不正确的是( )
① ②
③ ④
A. 用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液
B. 装置②的总反应式为Cu+2Fe3+===Cu2++2Fe2+
C. 装置③中钢闸门应与外接电源的负极相连
D. 装置④中的铁钉几乎未被腐蚀
10. 探究铁发生腐蚀的装置图如图所示,下列说法正确的是( )
A. 若B处液面上升,A溶液可能是酸性溶液
B. 若A为NaCl溶液,B、C液面始终保持不变
C. 可能产生Fe2O3·nH2O
D. 腐蚀的总反应式为2Fe+O2+2H2O===2Fe(OH)2
11. 港珠澳大桥设计寿命120年,对桥体钢构件采用多种方法防腐。下列分析错误的是( )
A. 防腐原理主要是避免发生反应:2Fe+O2+2H2O===2Fe(OH)2
B. 钢构件表面喷涂环氧树脂涂层,是为了隔绝空气、水等,防止形成原电池
C. 采用外加电流法需直接在钢构件上绑上锌块
D. 钢构件可采用不锈钢材料以减缓电化学腐蚀
12. 利用如图装置可以模拟铁的电化学防护。下列说法错误的是( )
A. 若X为锌棒,开关K置于M处,可减缓铁的腐蚀
B. 若X为锌棒,开关K置于M处,铁极发生氧化反应
C. 若X为碳棒,开关K置于N处,可减缓铁的腐蚀
D. 若X为碳棒,开关K置于N处,X极发生氧化反应
13. (1) 对金属制品进行抗腐蚀处理,可延长其使用寿命。
①碱洗的目的是除去铝材表面的自然氧化膜,碱洗时常有气泡冒出,原因是________________________________(用离子方程式表示)。为将碱洗槽液中的铝以沉淀的形式回收,最好向槽液中加入下列试剂中的________(填字母)。
a. NH3 b. CO2
c. NaOH d. HNO3
②以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极电极反应式为__________________________________________________________。
(2) 镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨作阳极材料的原因是_____________________________________________________________________。
14. 金属腐蚀现象在生产生活中普遍存在,依据下列两种腐蚀现象回答问题:
图1 图2
(1) 图1被腐蚀的金属为________,其腐蚀类型属于________(填字母,下同)。图2金属腐蚀类型属于________。
A. 化学腐蚀 B. 电化学腐蚀
C. 析氢腐蚀 D. 吸氧腐蚀
(2) 图1中Cu的作用是______________________________,
结合电极反应、电子移动、离子移动等,分析金属被腐蚀的原理:_____________________________________________________________________。
(3) 图2中铁的生锈过程:Fe→Fe(OH)2→Fe(OH)3→Fe2O3·nH2O,将Fe转变为Fe(OH)2的反应补充完整:正极反应为___________________________,负极反应为______________________,总反应为______________________________。
(4) 下列防止铁制品生锈的措施合理的是________(填字母)。
A. 在铁闸门表面涂油漆
B. 在地下铁管道上安装若干镁合金
C. 将铁罐与浓硫酸等强氧化剂接触,使之发生钝化
15. 回答下列问题:
(1) 实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图如下。
①该电化腐蚀称为________。
②图中A、B、C、D四个区域,生成铁锈最多的是________(填字母)。
③以锌为负极,采用牺牲阳极的阴极保护法防止铁闸的腐蚀,图中锌块的固定位置最好应在________处(填字母)。
(2) 石墨可用于自然水体中铜件的电化学防腐,完成如图防腐示意图,并作相应标注:
(3) 下图所示的各容器中盛有海水,铁在其中被腐蚀时由快到慢的顺序是________________(填序号)。
① ② ③ ④
(4) 如图,将铁棒和石墨棒插入盛有饱和NaCl溶液的U形管中,下列分析正确的是________(填字母)。
A. K1闭合,铁棒上发生的反应为2H++2e-===H2↑
B. K1闭合,石墨棒周围溶液pH逐渐升高
C. K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法
D. K2闭合,电路中通过0.002 NA个电子时,两极共产生0.001 mol气体
16. 某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图1)。从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化。
(1) 请完成以下实验设计表(表中不要留空格): 图1
编号 实验目的 碳粉/g 铁粉/g 醋酸/%
① 为以下实验作参照 0.5 2.0 90.0
② 醋酸浓度的影响 0.5 36.0
③ 0.2 2.0 90.0
(2) 编号①实验测得容器中压强随时间变化如图2。t2时,容器中压强明显小于起始压强,其原因是铁发生了________腐蚀,请在图3中用箭头标出发生该腐蚀时电子流动方向;此时,碳粉表面发生了________(填“氧化”或“还原”)反应,其电极反应式为___________________________________________________。
图2 图3
(3) 该小组对图2中O~t1时压强变大的原因提出了如下假设,请你完成假设二。
假设一:发生析氢腐蚀产生了气体;
假设二:______________________________________。
第三单元 金属的腐蚀与防护
1. B 2. C 3. D
4. B 解析:金属腐蚀就是金属失去电子被氧化的过程,A错误;将水库中的水闸(钢板)与外加直流电源的负极相连接,作电解池的阴极,被保护,可防止水闸被腐蚀,B正确;纯银质物品久置变暗是因为银与空气中的硫化氢反应生成了硫化银,与吸氧腐蚀无关,C错误;铜板上的铁铆钉处在潮湿的空气中形成原电池,发生吸氧腐蚀,负极电极反应式为Fe-2e-===Fe2+,D错误。
5. B 解析:由图可知,青铜基体电极有Cu2+产生,Cu化合价升高,发生氧化反应,为负极,A错误;将铜器与直流电源负极相连,则铜器作阴极,采用外加电流的阴极保护法防止腐蚀,B正确;反应的焓变只与反应物、生成物的状态有关,与反应过程无关,因此反应焓变不会改变,C错误;在该反应中,Cu失去电子变成Cu2+,64 g Cu的物质的量==1 mol,转移电子物质的量为2 mol,消耗1分子O2转移4个电子,根据得失电子守恒,消耗O2的物质的量==0.5 mol,在标准状况下,理论上耗氧体积=0.5 mol×22.4 L·mol-1=11.2 L,D错误。
6. B 解析:钢管与铜管露天堆放在一起,金属铁和金属铜形成原电池,铁为负极,易被腐蚀,A错误;金属腐蚀速率顺序:电化学腐蚀>化学腐蚀>有保护措施的腐蚀,Ⅰ中金属铁作原电池的负极,Ⅱ中金属铁作原电池的正极,所以腐蚀速率:Ⅰ>Ⅲ>Ⅱ,B正确;高温下金属铁和氧气的反应速率会增大,铁制品应该放在低温干燥环境中保存,C错误;在钢铁发生电化学腐蚀时,负极反应式为Fe-2e-===Fe2+,D错误。
7. D 解析:食醋提供电解质溶液环境,铁勺和铜盆是相互接触的两个金属电极,形成原电池,铁是活泼金属作负极,易被腐蚀,A错误;食盐水提供电解质溶液环境,铁炒锅和铁铲都是铁碳合金,铁是活泼金属作负极,碳作正极,铁易被腐蚀,B错误;铁、铜形成原电池,铁是活泼金属作负极,易被腐蚀,C错误;D正确且符合题意,故选D。
8. C 解析:钢铁锈蚀时,Fe作为负极,Fe失去电子生成Fe2+,A错误;铅蓄电池在放电过程中,负极Pb失电子后与电解质溶液中的SO结合生成PbSO4,质量增大,B错误;将海水中钢铁闸门与电源的负极相连,此时钢铁闸门作为阴极,可阻止钢铁闸门中的铁失电子,从而防止闸门被腐蚀,C正确;碱性锌锰电池属于一次电池,D错误。
9. B 解析:装置①中a电极和电源的正极相连,作阳极,b是阴极,粗铜精炼时,粗铜是阳极,纯铜是阴极,A正确;装置②是原电池,铁的金属性强于铜,所以铁是负极,失去电子,铜是正极,溶液中的铁离子得到电子,B错误;钢闸门应与外接电源的负极相连,作阴极被保护,C正确;装置④中铁钉处在极其干燥的环境中,不易腐蚀,D正确。
10. C 解析:析氢腐蚀的总反应为Fe+2H+===Fe2++H2↑,使B处液面下降,则A溶液不可能是酸性溶液,A错误;若A为NaCl溶液,则发生吸氧腐蚀,B处液面上升,B错误;发生吸氧腐蚀,2Fe+O2+2H2O===2Fe(OH)2,4Fe(OH)2+O2+2H2O===4Fe(OH)3,Fe(OH)3部分脱水,产物变为Fe2O3·nH2O,C正确;如果是析氢腐蚀,总反应式为Fe+2H+===Fe2++H2↑,D错误。
11. C 解析:A、B、D均正确。外加电流法中,钢铁作为阴极被保护,阳极可以采用惰性电极,C错误。
12. B 解析:若X为锌棒,开关K置于M处时,锌作负极,铁作正极被保护,A正确、B错误;若X为碳棒,开关K置于N处,铁连接电源负极作阴极被保护,C正确;X连接电源正极作阳极被氧化,D正确。
13. (1) ①2Al+2OH-+2H2O===2AlO+3H2↑ b ②2Al+3H2O-6e-===Al2O3+6H+
(2) 阳极Cu可以发生氧化反应生成Cu2+,使电解质溶液中的Cu2+保持不变。
14. (1) 铁或Fe BC BD
(2) 作正极,导电 铜为正极,氢离子在内电路移向正极,得到电子,生成氢气;铁为负极,在外电路失去电子,电子从负极移向正极,金属铁被腐蚀成亚铁离子
(3) O2+4e-+2H2O===4OH- 2Fe-4e-===2Fe2+ 2Fe+O2+2H2O===2Fe(OH)2
(4) ABC
15. (1) ①吸氧腐蚀 ②B ③C
(2)
(3) ④>②>①>③
(4) B
16. (1)
编号 实验目的 碳粉/g 铁粉/g 醋酸/%
② 2.0
③ 碳粉含量的影响
(2) 吸氧 如图
还原 2H2O+O2+4e-===4OH-
(3) 反应放热,温度升高
