2022-2023学年 苏教版选择性必修1专题2第三单元 化学平衡的移动 第2课时 压强变化、温度变化对化学平衡的影响 化学平衡移动原理 课时练 (含答案)
文档属性
| 名称 | 2022-2023学年 苏教版选择性必修1专题2第三单元 化学平衡的移动 第2课时 压强变化、温度变化对化学平衡的影响 化学平衡移动原理 课时练 (含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 513.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-27 22:16:10 | ||
图片预览



文档简介
第2课时 压强变化、温度变化对化学平衡的影响
化学平衡移动原理
1. (2022·扬州邗江区期中)下列事实中,能用勒夏特列原理解释的是( )
A. H2(g)、I2(g)、HI(g)平衡混合气加压后颜色变深
B. 使用催化剂可增大SO2转化为SO3的速率
C. 500 ℃左右比室温更有利于氨的合成
D. 工业合成氨时,采用迅速冷却的方法,将气态氨变为液氨后及时从混合物中分离出去,以提高NH3的产量
2. 已知:2X(g)+Y(g) 2Z(g),反应中w(Z的物质的量分数)随温度T的变化如图所示。下列判断正确的是( )
A. T1时,v正>v逆
B. 正反应的ΔH<0
C. a、b两点的反应速率v(a)=v(b)
D. 当温度低于T1时,w增大的原因是平衡向正反应方向移动
3. (2021·启东中学期初)已知某密闭容器中发生反应:X(g)+Y(g) 2W(g)+Z(g) ΔH<0(Z物质易被液化)。下列有关说法一定正确的是( )
A. 若W为有颜色的物质,达平衡后,缩小容器体积,体系颜色变浅
B. 改变压强,平衡一定发生移动
C. 平衡时,其他条件不变,升高温度,正反应速率增大程度比逆反应速率增大程度小
D. 平衡时,其他条件不变,分离出Z,正反应速率增大
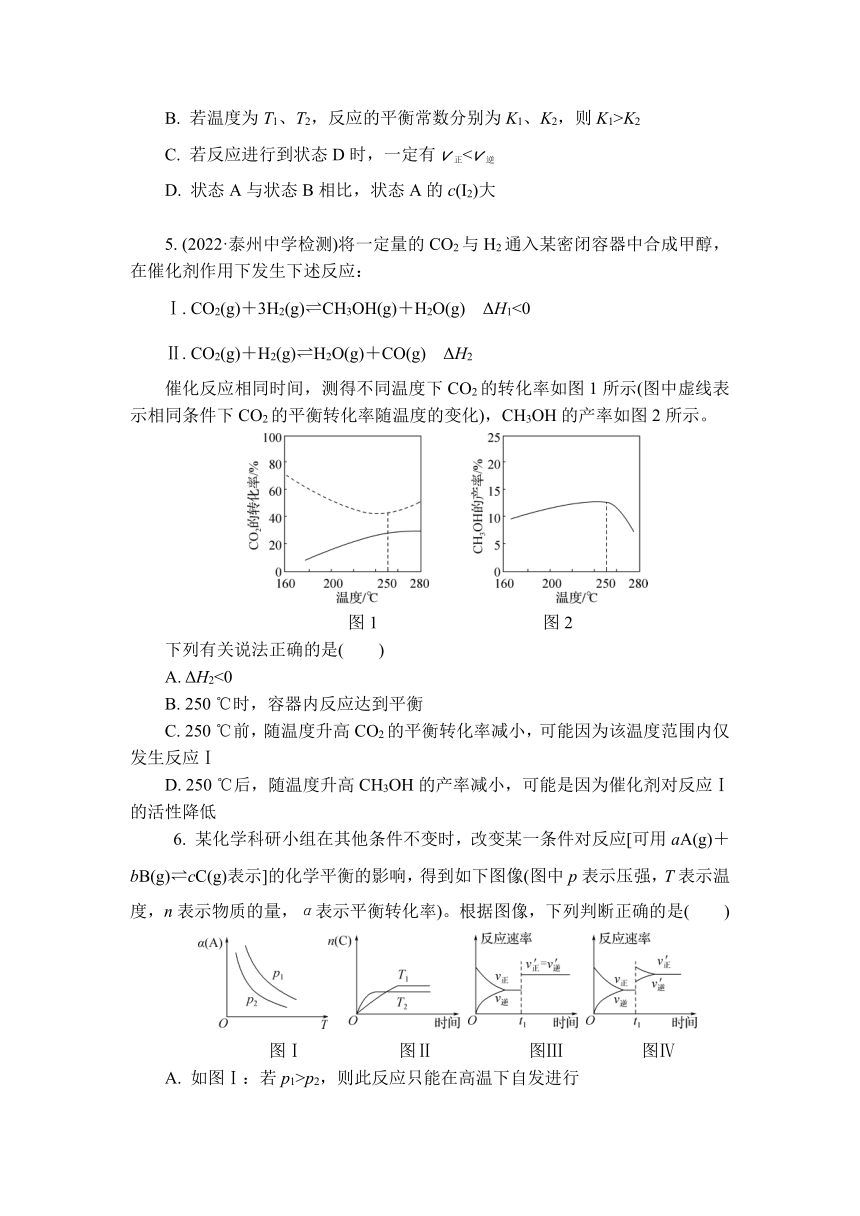
4. I2在KI溶液中存在下列平衡:I2(aq)+I-(aq) I(aq)。某I2、KI混合溶液中,I的物质的量浓度[c(I)]与温度(T)的关系如图所示(曲线上任何一点都表示平衡状态)。下列判断正确的是( )
A. 反应I2(aq)+I-(aq)===I(aq)的ΔH>0
B. 若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1>K2
C. 若反应进行到状态D时,一定有v正D. 状态A与状态B相比,状态A的c(I2)大
5. (2022·泰州中学检测)将一定量的CO2与H2通入某密闭容器中合成甲醇,在催化剂作用下发生下述反应:
Ⅰ. CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1<0
Ⅱ. CO2(g)+H2(g) H2O(g)+CO(g) ΔH2
催化反应相同时间,测得不同温度下CO2的转化率如图1所示(图中虚线表示相同条件下CO2的平衡转化率随温度的变化),CH3OH的产率如图2所示。
图1 图2
下列有关说法正确的是( )
A. ΔH2<0
B. 250 ℃时,容器内反应达到平衡
C. 250 ℃前,随温度升高CO2的平衡转化率减小,可能因为该温度范围内仅发生反应Ⅰ
D. 250 ℃后,随温度升高CH3OH的产率减小,可能是因为催化剂对反应Ⅰ的活性降低
6. 某化学科研小组在其他条件不变时,改变某一条件对反应[可用aA(g)+bB(g) cC(g)表示]的化学平衡的影响,得到如下图像(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率)。根据图像,下列判断正确的是( )
图Ⅰ 图Ⅱ 图Ⅲ 图Ⅳ
A. 如图Ⅰ:若p1>p2,则此反应只能在高温下自发进行
B. 如图 Ⅱ:此反应的ΔH<0,且T1C. 如图Ⅲ:表示t1时刻一定是使用催化剂对反应速率的影响
D. 如图Ⅳ:表示t1时刻增大B的浓度对反应速率的影响
7. 一定温度下,将1 mol A(g)和1 mol B(g)充入2 L密闭容器中发生反应:A(g)+B(g) xC(g)+D(s) ΔH<0,在t1时达到平衡。在t2、t3时刻分别改变反应的一个条件,测得容器中C(g)的浓度随时间变化如图所示。下列有关说法正确的是( )
A. x=1
B. t2时刻改变的条件是使用催化剂
C. t3时刻改变的条件是增大反应物的浓度或压缩容器体积
D. t1~t2、t2~t3平衡常数相等,且K=4
8. (2022·扬州邗江区期中)温度为T K时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g) PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s 0 50 150 250 350
n(PCl3)/mol 0 0.16 0.19 0.20 0.20
下列说法正确的是( )
A. 反应在前50 s的平均速率v(Cl2)=0.0 032 mol·L-1·s-1
B. 保持其他条件不变,升高温度,平衡时c(PCl3)=0.12 mol·L-1,则反应的ΔH>0
C. 相同温度下,起始时向容器中充入1.80 mol PCl5、0.20 mol PCl3和0.20 mol Cl2,反应达到平衡前v(正)<v(逆)
D. 平衡后,减小压强不利于提高PCl5的平衡转化率
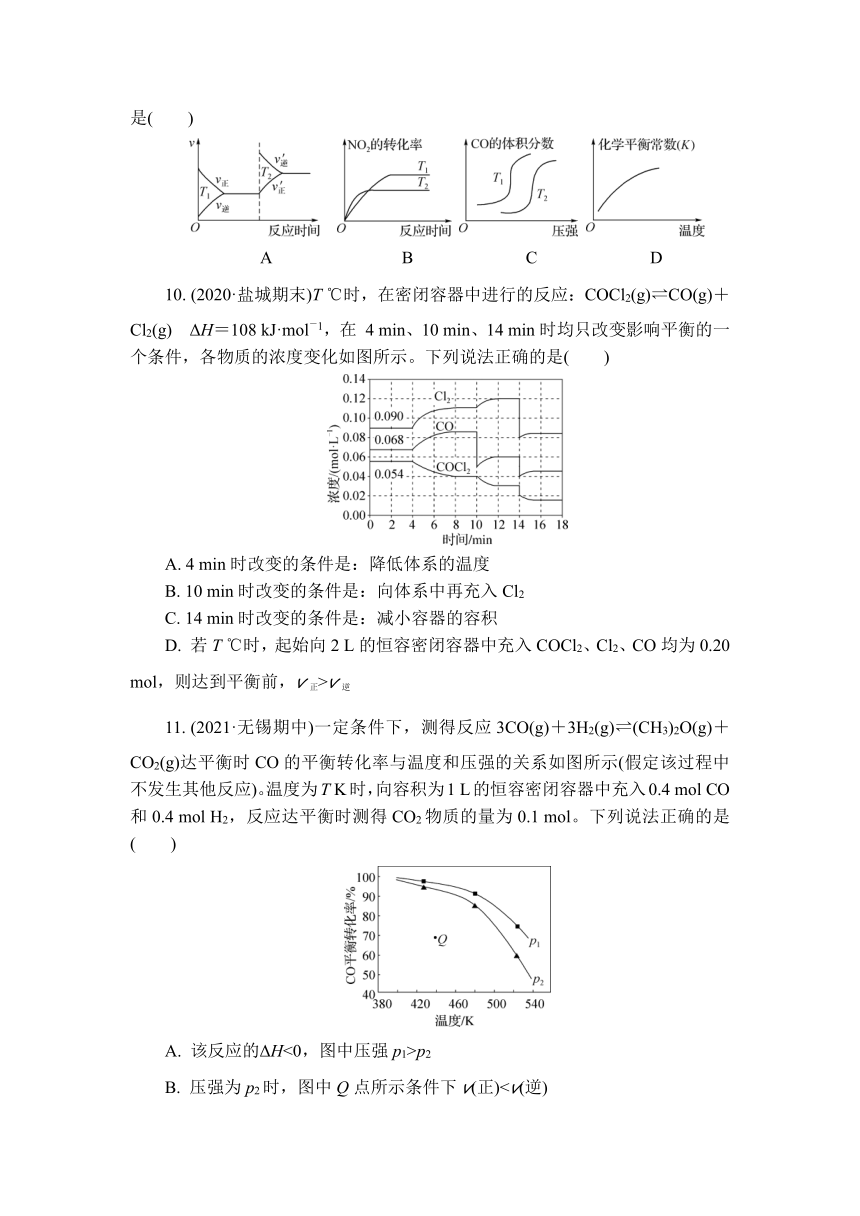
9. 近年来,我国多地出现严重雾霾天气,据研究,雾霾的形成与汽车排放的CO、NO2等有毒气体有关,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体,反应方程式为4CO(g)+2NO2(g) 4CO2(g)+N2(g) ΔH=-1 200 kJ·mol-1。对于该反应,温度不同(T2>T1)其他条件相同时,下列图像正确的是( )
A B C D
10. (2020·盐城期末)T ℃时,在密闭容器中进行的反应:COCl2(g) CO(g)+Cl2(g) ΔH=108 kJ·mol-1,在 4 min、10 min、14 min时均只改变影响平衡的一个条件,各物质的浓度变化如图所示。下列说法正确的是( )
A. 4 min时改变的条件是:降低体系的温度
B. 10 min时改变的条件是:向体系中再充入Cl2
C. 14 min时改变的条件是:减小容器的容积
D. 若T ℃时,起始向2 L的恒容密闭容器中充入COCl2、Cl2、CO均为0.20 mol,则达到平衡前,v正>v逆
11. (2021·无锡期中)一定条件下,测得反应3CO(g)+3H2(g) (CH3)2O(g)+CO2(g)达平衡时CO的平衡转化率与温度和压强的关系如图所示(假定该过程中不发生其他反应)。温度为T K时,向容积为1 L的恒容密闭容器中充入0.4 mol CO和0.4 mol H2,反应达平衡时测得CO2物质的量为0.1 mol。下列说法正确的是( )
A. 该反应的ΔH<0,图中压强p1>p2
B. 压强为p2时,图中Q点所示条件下v(正)C. 温度为T K时,若将题述1 L恒容容器改为恒压容器,再向其中充入0.4 mol CO和0.4 mol H2,达平衡时CO的转化率小于75%
D. 温度为T K时,若向原容器中充入0.1 mol CO、0.2 mol(CH3)2O和0.2 mol CO2,则该反应的平衡常数大于104
12. (2020·启东中学期末)相同温度、相同容积的四个密闭容器中进行同样的可逆反应:2X(g)+Y(g) 3W(g)+2Z(g)
ΔH=-Q kJ·mol-1,起始时充入气体的物质的量及平衡时体系能量变化数据如表所示。下列说法正确的是( )
X Y W Z 反应体系能量变化
甲 2 mol 1 mol 放出a kJ·mol-1
乙 1 mol 1 mol 放出b kJ·mol-1
丙 2 mol 2 mol 放出c kJ·mol-1
丁 3 mol 2 mol 吸收d kJ·mol-1
A. X的转化率大小:甲<乙<丙
B. c+dC. 平衡时,甲容器中的反应速率比丁容器中的小
D. 平衡时丙容器中Z的物质的量浓度最大
13. 在一固定容积的密闭容器中进行如下反应:CO2(g)+H2(g) CO(g)+H2O(g),其平衡常数K和温度T的关系如下。
T ℃ 700 800 850 1 000 1 200
K 2.6 1.7 1.0 0.9 0.6
(1) 写出该反应的平衡常数K的表达式:______________________________。
(2) 该反应的正反应为________(“吸热”或“放热”)反应。
(3) 能判断该反应在800 ℃是否已经达到化学平衡状态的是________(填字母)。
A. 容器中压强不再变化
B. 混合气体中CO浓度不再变化
C. 混合气体的密度不再变化
D. c(CO2)=c(CO)=c(H2)=c(H2O)
(4) 700 ℃时,通过压缩体积增大气体压强,则该反应中H2(g)的转化率________(“增大”“减小”或“不变”)。
14. 工业废气、汽车尾气排出的SO2、NOx等是形成雾霾的重要因素。霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾。
(1) NOx和SO2在空气中存在下列平衡:2NO(g)+O2(g) 2NO2(g)
ΔH=-113.0 kJ·mol-1,2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1;SO2通常在二氧化氮的存在下,进一步被氧化,生成SO3。
①写出NO2和SO2反应的热化学方程式:__________________________。
②随温度升高,该反应化学平衡常数变化趋势是________。
(2) 提高2SO2+O2 2SO3反应中SO2的转化率,是减少SO2排放的有效措施。
①T K温度时,在1 L的密闭容器中加入2.0 mol SO2和1.0 mol O2,5 min后反应达到平衡,二氧化硫的转化率为50%,该反应的平衡常数是________。
②在①中条件下,反应达到平衡后,改变下列条件,能使SO2的转化率提高的是________(填字母)。
a. 温度和容器体积不变,充入1.0 mol He
b. 温度和容器体积不变,充入1.0 mol O2
c. 在其他条件不变时,减小容器的体积
d. 在其他条件不变时,改用高效催化剂
e. 在其他条件不变时,升高体系温度
15. (2021·如皋中学检测)反应aA(g)+bB(g) cC(g) ΔH<0在容积一定的容器中进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图所示。
(1) 上述化学方程式中化学计量数b为________。
(2) 用A的浓度变化表示三个阶段的平均反应速率,则vⅠ(A)、vⅡ(A)、vⅢ(A)中最小的是________。
(3) 三个阶段中B的转化率依次为αⅠ(B)、αⅡ(B)、αⅢ(B),它们由大到小的顺序为_____________________________________________________________。
(4) 由第一次平衡到第二次平衡,采取的措施是_________________________。
(5) 比较第Ⅱ阶段反应温度(T2)和第Ⅲ阶段反应温度(T3)的高低并说明理由:_____________________________________________________________________。
16. (2022·扬州中学期中)CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标。请回答下列问题:
Ⅰ. 工业上可以利用CO2和H2合成CH3OH:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH<0。该反应在起始温度和体积均相同(T ℃、1 L)的两个密闭容器中分别进行,反应物起始物质的量见下表:
CO2/ mol H2/ mol CH3OH/ mol H2O/ mol
反应a (恒温恒容) 1 3 0 0
反应b (绝热恒容) 0 0 1 1
(1) 达到平衡时,反应a、b对比:CO2的体积分数φ(a)________(填“>”“<”或“=”)φ(b)。
(2) 下列能说明反应a达到平衡状态的是________(填字母)。
A. v正(CO2)=3v逆(H2)
B. 混合气体的平均摩尔质量不再改变
C. c(CH3OH)=c(H2O)
D. 容器内压强不再改变
Ⅱ. 我国科学家研究了不同反应温度对含碳产物组成的影响。
反应1:CO2(g)+4H2(g) CH4(g)+2H2O(g) ΔH<0
反应2:CO2(g)+H2(g) CO(g)+H2O(g) ΔH>0
在密闭容器中通入3 mol的H2和1 mol的CO2,分别在1 MPa和10 MPa下进行反应。实验中对平衡体系组成的三种物质(CO2、CO、CH4)进行分析,其中温度对CO和CH4的影响如图所示。
(3) 1 MPa时,表示CH4和CO平衡组成随温度变化关系的曲线分别是________和________。M点平衡组成含量高于N点的原因是______________________________________________________________________。
(4) 图中当CH4和CO平衡组成均为40%时,若容器的体积为1 L,该温度下反应1的平衡常数K的值为________。
Ⅲ. 在T1时,向体积为2 L的恒容容器中充入物质的量之和为3 mol的CO和H2,发生反应CO(g)+2H2(g) CH3OH(g),反应达到平衡时CH3OH(g)的体积分数(φ)与的关系如图所示。
(5) 当=3.5时,达到平衡后,CH3OH的体积分数可能是图像中的________(填“D”“E”或“F”)点。
(6) =________时,CH3OH的体积分数最大。
第2课时 压强变化、温度变化对化学平衡的影响 化学平衡移动原理
1. D 解析:H2(g)、I2(g)、HI(g)平衡混合气加压后,浓度变大,颜色变深,但平衡没有移动,因此不能用勒夏特列原理解释,A不符合题意;使用催化剂可增大SO2转化为SO3的速率,平衡没有移动,因此不能用勒夏特列原理解释,B不符合题意;合成氨反应是放热反应,升高温度,平衡逆向移动,因此室温比500 ℃左右更有利于氨的合成,C不符合题意;D符合题意,故选D。
2. B 解析:T1时,化学反应达到了平衡状态,v正=v逆,A错误;当温度高于T1时,Z的物质的量分数逐渐减小,所以化学平衡逆向移动,即逆反应方向是吸热的,所以正反应是一个放热反应,即ΔH<0,B正确;温度越高,化学反应速率越大,b点温度高于a点,所以b的速率高于a点的速率,即v(a)3. C 解析:容器的容积缩小,压强增大,W浓度增大,体系颜色变深,A错误;若通入He改变压强,反应物与生成物浓度不变,反应不移动,B错误;升温时平衡逆向移动,正、逆反应速率都会增大,但此时逆反应速率大于正反应速率,C正确;正反应速率在分离出Z这一瞬间不变后逐渐减小,D错误。
4. B 解析:随温度升高,c(I)减小,平衡逆向移动,说明正反应放热,即ΔH<0,A错误;该反应为放热反应,升高温度,平衡逆向移动,平衡常数K值减小,则K1>K2,B正确;D点没有达到平衡,c(I)比平衡时要小(要向A点移动),即反应要向右进行,所以此时v正>v逆,C错误;c(I):状态A>状态B,则c(I2):状态A<状态B,D错误。
5. D 解析:温度高于250 ℃时,CO2的平衡转化率随温度的升高继续增加,而CH3OH的产率却反而下降,说明温度升高不利于CO2转化为甲醇,温度升高有利CO2转化为CO,反应Ⅱ是吸热反应,ΔH2>0,A错误;由图1可知250 ℃时CO2的转化率不是最大值,温度高于250 ℃时,CO2的转化率继续增加,说明容器内反应还没有达到平衡,B错误;250 ℃前,随着温度升高,CO2的平衡转化率减小,原因是升高温度对反应Ⅰ的抑制效果大于对反应Ⅱ的促进效果,不是因为该温度范围内仅发生反应Ⅰ,C错误;D正确且符合题意,故选D。
6. B 解析:若p1>p2由图Ⅰ可知,增大压强,A的平衡转化率增大,平衡正向移动,说明正反应是熵减的反应,升温,A的平衡转化率下降,即升温平衡逆向移动,故该反应的正反应是放热反应,根据ΔG=ΔH-TΔS可知,该反应在较低温时更容易自发进行,A错误;由图Ⅱ可知T17. D 解析:t2时刻瞬间C的浓度增大,t2~t3阶段C的浓度不变,说明平衡不移动,应是增大压强造成的,压强不影响该平衡,所以有x=1+1=2,A错误;加入催化剂后C的浓度应该瞬间不发生变化,不符合图示变化规律,B错误;由A、B两项的分析可知,t2时刻是增大压强,若t3改变的条件是增大反应物A(或B)的物质的量,平衡均正向移动,C的浓度随时间而增大,但反应速率减小,与图中所示信息不一样,所以t3时刻改变的一个条件可能是降低温度,C错误;t1~t3间温度相同,平衡常数相同,可计算t1~t2平衡常数K,反应三段式:
A(g)+B(g) 2C(g)+D(s)
0.5 0.5 0
0.25 0.25 0.5
0.25 0.25 0.5
t1~t2平衡常数K==4,D正确。
8. B 解析:由表中数据可知50 s内,Δn(PCl3)=0.16mol,Δc(PCl3)==0.08 mol·L-1,v(PCl3)==0.001 6 mol·L-1·s-1,v(Cl2)=v(PCl3)=0.001 6 mol·L-1·s-1,A错误;由表中数据可知,平衡时n(PCl3)=0.2 mol,保持其他条件不变,升高温度,平衡时,c(PCl3)=0.12 mol·L-1,则n(PCl3)=0.12 mol·L-1×2 L=0.24 mol,说明升高温度平衡正向移动,正反应为吸热反应,ΔH>0,B正确;根据表格数据可列出三段式,
PCl5(g) PCl3(g)+Cl2(g)
c(开始)/(mol·L-1) 0.5 0 0
c(变化)/(mol·L-1) 0.1 0.1 0.1
c(平衡)/(mol·L-1) 0.4 0.1 0.1
平衡常数K==0.025,起始时向容器中充入1.80 mol PCl5、0.20 mol PCl3和0.20 mol Cl2,起始时PCl5的浓度为0.9 mol·L-1、PCl3的浓度为0.1 mol·L-1、Cl2的浓度为0.1 mol·L-1,浓度商Qc=≈0.011,Qc<K,说明平衡向正反应方向移动,反应达平衡前v(正)>v(逆),C错误;平衡后减小压强,根据勒夏特列原理,平衡正向移动,有利于PCl5平衡转化率的提高,D错误。
9. B 解析:升高温度,化学平衡逆向移动,正、逆反应速率都会迅速增大,会离开原来的速率点,A错误。升高温度,化学反应速率会迅速增大,所以T2时先达到化学平衡状态,并且化学平衡逆向移动,二氧化氮的转化率减小,B正确。对于反应:4CO(g)+2NO2(g) 4CO2(g)+N2(g) ΔH<0,T不变,增大压强,平衡正向移动,一氧化碳的体积分数会减小;压强不变,升高温度,平衡逆向移动,一氧化碳的体积分数会增大,C错误。正反应是放热反应,温度升高,化学平衡常数减小,而不是增大,D错误。
10. D 解析:由图可知,4 min瞬间浓度不变,不可能是改变压强、浓度,应是改变温度,此时反应物的浓度减小,产物浓度增加,说明平衡正向移动,而正反应为吸热反应,则应该是升高温度, A错误;10 min 瞬间氯气浓度不变,CO的浓度降低,故改变条件为分离出CO, B错误;14 min瞬间各物质的浓度同时减小,且平衡正向移动,应为增大容器的体积,减小压强, C错误; 由图像起点可得平衡常数为0.113,若起始向2 L的恒容密闭容器中充入COCl2、Cl2CO均为0.20 mol,则Qc=0.1v逆, D正确。
11. A 解析:由图可知,在压强不变的条件下,升高温度一氧化碳的平衡转化率降低,说明升温平衡向逆反应方向移动,故正反应是放热反应,即该反应的ΔH<0,该反应的正反应是气体体积减小的反应,增大压强一氧化碳的平衡转化率增大,所以图中压强p1>p2,A正确;压强为p2时,图中Q点在该温度下未达到平衡状态,平衡向正反应方向进行,所以v(正)>v(逆),B错误;温度为T K时,向容积为1 L的恒容密闭容器中充入0.4 mol CO和0.4 mol H2,反应达到平衡时测得CO2物质的量为0.1 mol,即消耗0.3 mol CO,一氧化碳的转化率是75%,若向恒温恒压的容器中加入0.4 mol CO和0.4 mol H2,由于该反应的正反应是气体体积减小的反应,所以压强增大,平衡正向进行,达到平衡时CO的转化率大于75%,C错误;温度为T K时,化学平衡常数K===104,向原容器中充入0.1 mol CO、0.2 mol (CH3)2O和0.2 mol CO2,温度不变,则该反应的平衡常数等于104,D错误。
12. D 解析:丙容器中各反应物的物质的量为乙容器中各反应物的物质的量的2倍,物质的量增大,压强增大,转化率减小,则转化率乙>丙;甲乙相比,甲中增大了X的物质的量,则X的转化率减小,则转化率甲<乙;丙的物质的量相当于在甲的基础上增加了Y,则X转化率增大,甲<丙,所以X的转化率:乙>丙>甲,A错误。甲、丁互为等效平衡,二者反应方向相反,二者的转化率之和为100%,则a kJ·mol-1+d kJ·mol-1=Q kJ·mol-1,丙中加入Y的量大于甲,反应向正向进行的程度大,所以丙放出的热量大于甲,则丙、丁热量之和大于Q,即c+d>Q,B错误。甲、丁容器中的两个平衡互为等效平衡,平衡时各组分浓度相等,所以平衡时甲、丁容器中的反应速率相等,C错误。D正确且符合题意,故选D。
13. (1) (2) 放热
(3) B (4) 不变
14. (1) ①NO2(g)+SO2(g)===SO3(g)+NO(g) ΔH=-41.8 kJ· mol-1 ②减小
(2) ①2 ②bc
15. (1) 3 (2) vⅢ(A)
(3) αⅠ(B)>αⅡ(B)>αⅢ(B)
(4) 从平衡混合物中分离出了C
(5) T2>T3,Ⅱ→Ⅲ平衡正向移动,该反应的正反应为放热反应,降温才能达到此目的
16. Ⅰ. (1) > (2) BD
Ⅱ. (3) b c 温度相同时,增大压强使反应1平衡正移,H2O的百分含量增大,使反应2逆向移动,CO百分含量降低
(4) 2.88
Ⅲ. (5) F (6) 2
化学平衡移动原理
1. (2022·扬州邗江区期中)下列事实中,能用勒夏特列原理解释的是( )
A. H2(g)、I2(g)、HI(g)平衡混合气加压后颜色变深
B. 使用催化剂可增大SO2转化为SO3的速率
C. 500 ℃左右比室温更有利于氨的合成
D. 工业合成氨时,采用迅速冷却的方法,将气态氨变为液氨后及时从混合物中分离出去,以提高NH3的产量
2. 已知:2X(g)+Y(g) 2Z(g),反应中w(Z的物质的量分数)随温度T的变化如图所示。下列判断正确的是( )
A. T1时,v正>v逆
B. 正反应的ΔH<0
C. a、b两点的反应速率v(a)=v(b)
D. 当温度低于T1时,w增大的原因是平衡向正反应方向移动
3. (2021·启东中学期初)已知某密闭容器中发生反应:X(g)+Y(g) 2W(g)+Z(g) ΔH<0(Z物质易被液化)。下列有关说法一定正确的是( )
A. 若W为有颜色的物质,达平衡后,缩小容器体积,体系颜色变浅
B. 改变压强,平衡一定发生移动
C. 平衡时,其他条件不变,升高温度,正反应速率增大程度比逆反应速率增大程度小
D. 平衡时,其他条件不变,分离出Z,正反应速率增大
4. I2在KI溶液中存在下列平衡:I2(aq)+I-(aq) I(aq)。某I2、KI混合溶液中,I的物质的量浓度[c(I)]与温度(T)的关系如图所示(曲线上任何一点都表示平衡状态)。下列判断正确的是( )
A. 反应I2(aq)+I-(aq)===I(aq)的ΔH>0
B. 若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1>K2
C. 若反应进行到状态D时,一定有v正
5. (2022·泰州中学检测)将一定量的CO2与H2通入某密闭容器中合成甲醇,在催化剂作用下发生下述反应:
Ⅰ. CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1<0
Ⅱ. CO2(g)+H2(g) H2O(g)+CO(g) ΔH2
催化反应相同时间,测得不同温度下CO2的转化率如图1所示(图中虚线表示相同条件下CO2的平衡转化率随温度的变化),CH3OH的产率如图2所示。
图1 图2
下列有关说法正确的是( )
A. ΔH2<0
B. 250 ℃时,容器内反应达到平衡
C. 250 ℃前,随温度升高CO2的平衡转化率减小,可能因为该温度范围内仅发生反应Ⅰ
D. 250 ℃后,随温度升高CH3OH的产率减小,可能是因为催化剂对反应Ⅰ的活性降低
6. 某化学科研小组在其他条件不变时,改变某一条件对反应[可用aA(g)+bB(g) cC(g)表示]的化学平衡的影响,得到如下图像(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率)。根据图像,下列判断正确的是( )
图Ⅰ 图Ⅱ 图Ⅲ 图Ⅳ
A. 如图Ⅰ:若p1>p2,则此反应只能在高温下自发进行
B. 如图 Ⅱ:此反应的ΔH<0,且T1
D. 如图Ⅳ:表示t1时刻增大B的浓度对反应速率的影响
7. 一定温度下,将1 mol A(g)和1 mol B(g)充入2 L密闭容器中发生反应:A(g)+B(g) xC(g)+D(s) ΔH<0,在t1时达到平衡。在t2、t3时刻分别改变反应的一个条件,测得容器中C(g)的浓度随时间变化如图所示。下列有关说法正确的是( )
A. x=1
B. t2时刻改变的条件是使用催化剂
C. t3时刻改变的条件是增大反应物的浓度或压缩容器体积
D. t1~t2、t2~t3平衡常数相等,且K=4
8. (2022·扬州邗江区期中)温度为T K时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g) PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s 0 50 150 250 350
n(PCl3)/mol 0 0.16 0.19 0.20 0.20
下列说法正确的是( )
A. 反应在前50 s的平均速率v(Cl2)=0.0 032 mol·L-1·s-1
B. 保持其他条件不变,升高温度,平衡时c(PCl3)=0.12 mol·L-1,则反应的ΔH>0
C. 相同温度下,起始时向容器中充入1.80 mol PCl5、0.20 mol PCl3和0.20 mol Cl2,反应达到平衡前v(正)<v(逆)
D. 平衡后,减小压强不利于提高PCl5的平衡转化率
9. 近年来,我国多地出现严重雾霾天气,据研究,雾霾的形成与汽车排放的CO、NO2等有毒气体有关,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体,反应方程式为4CO(g)+2NO2(g) 4CO2(g)+N2(g) ΔH=-1 200 kJ·mol-1。对于该反应,温度不同(T2>T1)其他条件相同时,下列图像正确的是( )
A B C D
10. (2020·盐城期末)T ℃时,在密闭容器中进行的反应:COCl2(g) CO(g)+Cl2(g) ΔH=108 kJ·mol-1,在 4 min、10 min、14 min时均只改变影响平衡的一个条件,各物质的浓度变化如图所示。下列说法正确的是( )
A. 4 min时改变的条件是:降低体系的温度
B. 10 min时改变的条件是:向体系中再充入Cl2
C. 14 min时改变的条件是:减小容器的容积
D. 若T ℃时,起始向2 L的恒容密闭容器中充入COCl2、Cl2、CO均为0.20 mol,则达到平衡前,v正>v逆
11. (2021·无锡期中)一定条件下,测得反应3CO(g)+3H2(g) (CH3)2O(g)+CO2(g)达平衡时CO的平衡转化率与温度和压强的关系如图所示(假定该过程中不发生其他反应)。温度为T K时,向容积为1 L的恒容密闭容器中充入0.4 mol CO和0.4 mol H2,反应达平衡时测得CO2物质的量为0.1 mol。下列说法正确的是( )
A. 该反应的ΔH<0,图中压强p1>p2
B. 压强为p2时,图中Q点所示条件下v(正)
D. 温度为T K时,若向原容器中充入0.1 mol CO、0.2 mol(CH3)2O和0.2 mol CO2,则该反应的平衡常数大于104
12. (2020·启东中学期末)相同温度、相同容积的四个密闭容器中进行同样的可逆反应:2X(g)+Y(g) 3W(g)+2Z(g)
ΔH=-Q kJ·mol-1,起始时充入气体的物质的量及平衡时体系能量变化数据如表所示。下列说法正确的是( )
X Y W Z 反应体系能量变化
甲 2 mol 1 mol 放出a kJ·mol-1
乙 1 mol 1 mol 放出b kJ·mol-1
丙 2 mol 2 mol 放出c kJ·mol-1
丁 3 mol 2 mol 吸收d kJ·mol-1
A. X的转化率大小:甲<乙<丙
B. c+d
D. 平衡时丙容器中Z的物质的量浓度最大
13. 在一固定容积的密闭容器中进行如下反应:CO2(g)+H2(g) CO(g)+H2O(g),其平衡常数K和温度T的关系如下。
T ℃ 700 800 850 1 000 1 200
K 2.6 1.7 1.0 0.9 0.6
(1) 写出该反应的平衡常数K的表达式:______________________________。
(2) 该反应的正反应为________(“吸热”或“放热”)反应。
(3) 能判断该反应在800 ℃是否已经达到化学平衡状态的是________(填字母)。
A. 容器中压强不再变化
B. 混合气体中CO浓度不再变化
C. 混合气体的密度不再变化
D. c(CO2)=c(CO)=c(H2)=c(H2O)
(4) 700 ℃时,通过压缩体积增大气体压强,则该反应中H2(g)的转化率________(“增大”“减小”或“不变”)。
14. 工业废气、汽车尾气排出的SO2、NOx等是形成雾霾的重要因素。霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾。
(1) NOx和SO2在空气中存在下列平衡:2NO(g)+O2(g) 2NO2(g)
ΔH=-113.0 kJ·mol-1,2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1;SO2通常在二氧化氮的存在下,进一步被氧化,生成SO3。
①写出NO2和SO2反应的热化学方程式:__________________________。
②随温度升高,该反应化学平衡常数变化趋势是________。
(2) 提高2SO2+O2 2SO3反应中SO2的转化率,是减少SO2排放的有效措施。
①T K温度时,在1 L的密闭容器中加入2.0 mol SO2和1.0 mol O2,5 min后反应达到平衡,二氧化硫的转化率为50%,该反应的平衡常数是________。
②在①中条件下,反应达到平衡后,改变下列条件,能使SO2的转化率提高的是________(填字母)。
a. 温度和容器体积不变,充入1.0 mol He
b. 温度和容器体积不变,充入1.0 mol O2
c. 在其他条件不变时,减小容器的体积
d. 在其他条件不变时,改用高效催化剂
e. 在其他条件不变时,升高体系温度
15. (2021·如皋中学检测)反应aA(g)+bB(g) cC(g) ΔH<0在容积一定的容器中进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图所示。
(1) 上述化学方程式中化学计量数b为________。
(2) 用A的浓度变化表示三个阶段的平均反应速率,则vⅠ(A)、vⅡ(A)、vⅢ(A)中最小的是________。
(3) 三个阶段中B的转化率依次为αⅠ(B)、αⅡ(B)、αⅢ(B),它们由大到小的顺序为_____________________________________________________________。
(4) 由第一次平衡到第二次平衡,采取的措施是_________________________。
(5) 比较第Ⅱ阶段反应温度(T2)和第Ⅲ阶段反应温度(T3)的高低并说明理由:_____________________________________________________________________。
16. (2022·扬州中学期中)CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标。请回答下列问题:
Ⅰ. 工业上可以利用CO2和H2合成CH3OH:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH<0。该反应在起始温度和体积均相同(T ℃、1 L)的两个密闭容器中分别进行,反应物起始物质的量见下表:
CO2/ mol H2/ mol CH3OH/ mol H2O/ mol
反应a (恒温恒容) 1 3 0 0
反应b (绝热恒容) 0 0 1 1
(1) 达到平衡时,反应a、b对比:CO2的体积分数φ(a)________(填“>”“<”或“=”)φ(b)。
(2) 下列能说明反应a达到平衡状态的是________(填字母)。
A. v正(CO2)=3v逆(H2)
B. 混合气体的平均摩尔质量不再改变
C. c(CH3OH)=c(H2O)
D. 容器内压强不再改变
Ⅱ. 我国科学家研究了不同反应温度对含碳产物组成的影响。
反应1:CO2(g)+4H2(g) CH4(g)+2H2O(g) ΔH<0
反应2:CO2(g)+H2(g) CO(g)+H2O(g) ΔH>0
在密闭容器中通入3 mol的H2和1 mol的CO2,分别在1 MPa和10 MPa下进行反应。实验中对平衡体系组成的三种物质(CO2、CO、CH4)进行分析,其中温度对CO和CH4的影响如图所示。
(3) 1 MPa时,表示CH4和CO平衡组成随温度变化关系的曲线分别是________和________。M点平衡组成含量高于N点的原因是______________________________________________________________________。
(4) 图中当CH4和CO平衡组成均为40%时,若容器的体积为1 L,该温度下反应1的平衡常数K的值为________。
Ⅲ. 在T1时,向体积为2 L的恒容容器中充入物质的量之和为3 mol的CO和H2,发生反应CO(g)+2H2(g) CH3OH(g),反应达到平衡时CH3OH(g)的体积分数(φ)与的关系如图所示。
(5) 当=3.5时,达到平衡后,CH3OH的体积分数可能是图像中的________(填“D”“E”或“F”)点。
(6) =________时,CH3OH的体积分数最大。
第2课时 压强变化、温度变化对化学平衡的影响 化学平衡移动原理
1. D 解析:H2(g)、I2(g)、HI(g)平衡混合气加压后,浓度变大,颜色变深,但平衡没有移动,因此不能用勒夏特列原理解释,A不符合题意;使用催化剂可增大SO2转化为SO3的速率,平衡没有移动,因此不能用勒夏特列原理解释,B不符合题意;合成氨反应是放热反应,升高温度,平衡逆向移动,因此室温比500 ℃左右更有利于氨的合成,C不符合题意;D符合题意,故选D。
2. B 解析:T1时,化学反应达到了平衡状态,v正=v逆,A错误;当温度高于T1时,Z的物质的量分数逐渐减小,所以化学平衡逆向移动,即逆反应方向是吸热的,所以正反应是一个放热反应,即ΔH<0,B正确;温度越高,化学反应速率越大,b点温度高于a点,所以b的速率高于a点的速率,即v(a)
4. B 解析:随温度升高,c(I)减小,平衡逆向移动,说明正反应放热,即ΔH<0,A错误;该反应为放热反应,升高温度,平衡逆向移动,平衡常数K值减小,则K1>K2,B正确;D点没有达到平衡,c(I)比平衡时要小(要向A点移动),即反应要向右进行,所以此时v正>v逆,C错误;c(I):状态A>状态B,则c(I2):状态A<状态B,D错误。
5. D 解析:温度高于250 ℃时,CO2的平衡转化率随温度的升高继续增加,而CH3OH的产率却反而下降,说明温度升高不利于CO2转化为甲醇,温度升高有利CO2转化为CO,反应Ⅱ是吸热反应,ΔH2>0,A错误;由图1可知250 ℃时CO2的转化率不是最大值,温度高于250 ℃时,CO2的转化率继续增加,说明容器内反应还没有达到平衡,B错误;250 ℃前,随着温度升高,CO2的平衡转化率减小,原因是升高温度对反应Ⅰ的抑制效果大于对反应Ⅱ的促进效果,不是因为该温度范围内仅发生反应Ⅰ,C错误;D正确且符合题意,故选D。
6. B 解析:若p1>p2由图Ⅰ可知,增大压强,A的平衡转化率增大,平衡正向移动,说明正反应是熵减的反应,升温,A的平衡转化率下降,即升温平衡逆向移动,故该反应的正反应是放热反应,根据ΔG=ΔH-TΔS可知,该反应在较低温时更容易自发进行,A错误;由图Ⅱ可知T1
A(g)+B(g) 2C(g)+D(s)
0.5 0.5 0
0.25 0.25 0.5
0.25 0.25 0.5
t1~t2平衡常数K==4,D正确。
8. B 解析:由表中数据可知50 s内,Δn(PCl3)=0.16mol,Δc(PCl3)==0.08 mol·L-1,v(PCl3)==0.001 6 mol·L-1·s-1,v(Cl2)=v(PCl3)=0.001 6 mol·L-1·s-1,A错误;由表中数据可知,平衡时n(PCl3)=0.2 mol,保持其他条件不变,升高温度,平衡时,c(PCl3)=0.12 mol·L-1,则n(PCl3)=0.12 mol·L-1×2 L=0.24 mol,说明升高温度平衡正向移动,正反应为吸热反应,ΔH>0,B正确;根据表格数据可列出三段式,
PCl5(g) PCl3(g)+Cl2(g)
c(开始)/(mol·L-1) 0.5 0 0
c(变化)/(mol·L-1) 0.1 0.1 0.1
c(平衡)/(mol·L-1) 0.4 0.1 0.1
平衡常数K==0.025,起始时向容器中充入1.80 mol PCl5、0.20 mol PCl3和0.20 mol Cl2,起始时PCl5的浓度为0.9 mol·L-1、PCl3的浓度为0.1 mol·L-1、Cl2的浓度为0.1 mol·L-1,浓度商Qc=≈0.011,Qc<K,说明平衡向正反应方向移动,反应达平衡前v(正)>v(逆),C错误;平衡后减小压强,根据勒夏特列原理,平衡正向移动,有利于PCl5平衡转化率的提高,D错误。
9. B 解析:升高温度,化学平衡逆向移动,正、逆反应速率都会迅速增大,会离开原来的速率点,A错误。升高温度,化学反应速率会迅速增大,所以T2时先达到化学平衡状态,并且化学平衡逆向移动,二氧化氮的转化率减小,B正确。对于反应:4CO(g)+2NO2(g) 4CO2(g)+N2(g) ΔH<0,T不变,增大压强,平衡正向移动,一氧化碳的体积分数会减小;压强不变,升高温度,平衡逆向移动,一氧化碳的体积分数会增大,C错误。正反应是放热反应,温度升高,化学平衡常数减小,而不是增大,D错误。
10. D 解析:由图可知,4 min瞬间浓度不变,不可能是改变压强、浓度,应是改变温度,此时反应物的浓度减小,产物浓度增加,说明平衡正向移动,而正反应为吸热反应,则应该是升高温度, A错误;10 min 瞬间氯气浓度不变,CO的浓度降低,故改变条件为分离出CO, B错误;14 min瞬间各物质的浓度同时减小,且平衡正向移动,应为增大容器的体积,减小压强, C错误; 由图像起点可得平衡常数为0.113,若起始向2 L的恒容密闭容器中充入COCl2、Cl2CO均为0.20 mol,则Qc=0.1
11. A 解析:由图可知,在压强不变的条件下,升高温度一氧化碳的平衡转化率降低,说明升温平衡向逆反应方向移动,故正反应是放热反应,即该反应的ΔH<0,该反应的正反应是气体体积减小的反应,增大压强一氧化碳的平衡转化率增大,所以图中压强p1>p2,A正确;压强为p2时,图中Q点在该温度下未达到平衡状态,平衡向正反应方向进行,所以v(正)>v(逆),B错误;温度为T K时,向容积为1 L的恒容密闭容器中充入0.4 mol CO和0.4 mol H2,反应达到平衡时测得CO2物质的量为0.1 mol,即消耗0.3 mol CO,一氧化碳的转化率是75%,若向恒温恒压的容器中加入0.4 mol CO和0.4 mol H2,由于该反应的正反应是气体体积减小的反应,所以压强增大,平衡正向进行,达到平衡时CO的转化率大于75%,C错误;温度为T K时,化学平衡常数K===104,向原容器中充入0.1 mol CO、0.2 mol (CH3)2O和0.2 mol CO2,温度不变,则该反应的平衡常数等于104,D错误。
12. D 解析:丙容器中各反应物的物质的量为乙容器中各反应物的物质的量的2倍,物质的量增大,压强增大,转化率减小,则转化率乙>丙;甲乙相比,甲中增大了X的物质的量,则X的转化率减小,则转化率甲<乙;丙的物质的量相当于在甲的基础上增加了Y,则X转化率增大,甲<丙,所以X的转化率:乙>丙>甲,A错误。甲、丁互为等效平衡,二者反应方向相反,二者的转化率之和为100%,则a kJ·mol-1+d kJ·mol-1=Q kJ·mol-1,丙中加入Y的量大于甲,反应向正向进行的程度大,所以丙放出的热量大于甲,则丙、丁热量之和大于Q,即c+d>Q,B错误。甲、丁容器中的两个平衡互为等效平衡,平衡时各组分浓度相等,所以平衡时甲、丁容器中的反应速率相等,C错误。D正确且符合题意,故选D。
13. (1) (2) 放热
(3) B (4) 不变
14. (1) ①NO2(g)+SO2(g)===SO3(g)+NO(g) ΔH=-41.8 kJ· mol-1 ②减小
(2) ①2 ②bc
15. (1) 3 (2) vⅢ(A)
(3) αⅠ(B)>αⅡ(B)>αⅢ(B)
(4) 从平衡混合物中分离出了C
(5) T2>T3,Ⅱ→Ⅲ平衡正向移动,该反应的正反应为放热反应,降温才能达到此目的
16. Ⅰ. (1) > (2) BD
Ⅱ. (3) b c 温度相同时,增大压强使反应1平衡正移,H2O的百分含量增大,使反应2逆向移动,CO百分含量降低
(4) 2.88
Ⅲ. (5) F (6) 2
