5.3利用化学方程式的简单计算 同步练习 安徽省各地2021-2022(两年)人教版化学九年级上册期末试题选编(含解析)
文档属性
| 名称 | 5.3利用化学方程式的简单计算 同步练习 安徽省各地2021-2022(两年)人教版化学九年级上册期末试题选编(含解析) | 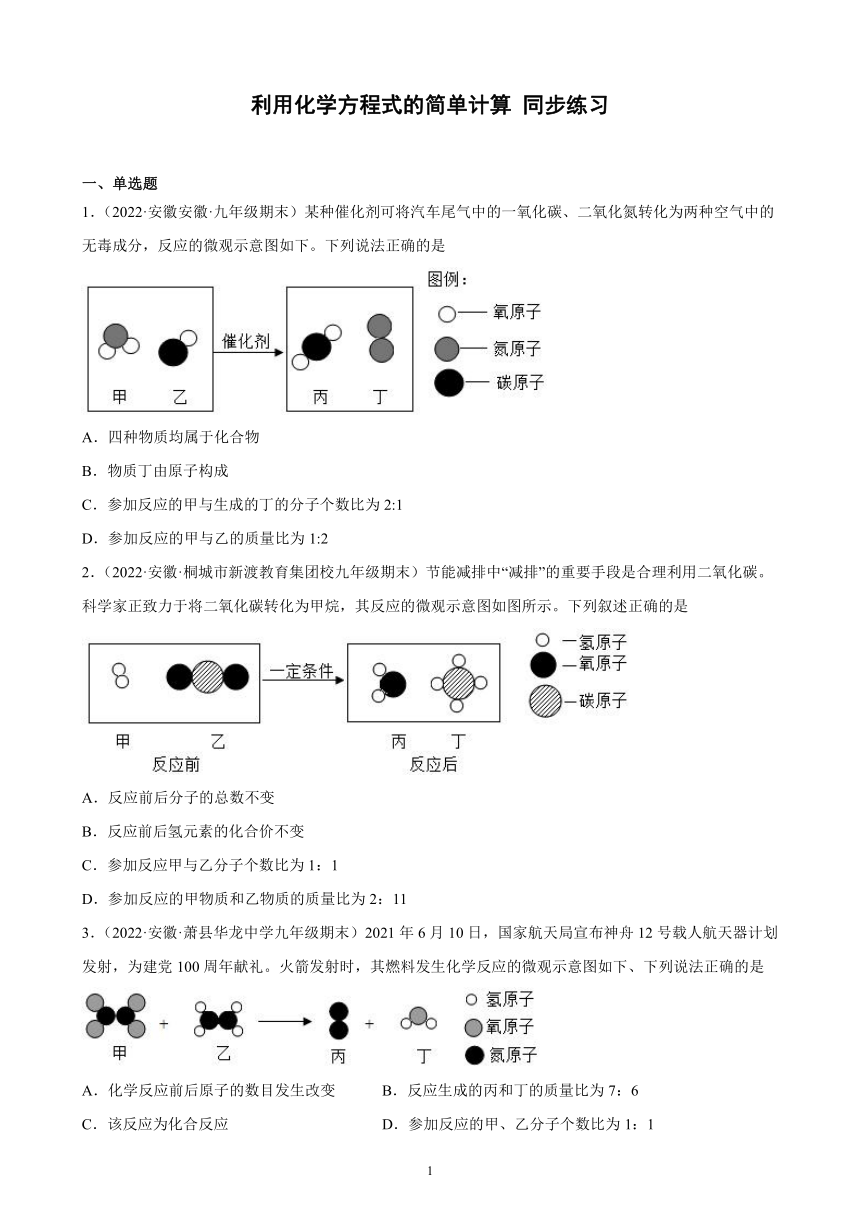 | |
| 格式 | zip | ||
| 文件大小 | 285.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-28 07:36:44 | ||
图片预览





文档简介
利用化学方程式的简单计算 同步练习
一、单选题
1.(2022·安徽安徽·九年级期末)某种催化剂可将汽车尾气中的一氧化碳、二氧化氮转化为两种空气中的无毒成分,反应的微观示意图如下。下列说法正确的是
A.四种物质均属于化合物
B.物质丁由原子构成
C.参加反应的甲与生成的丁的分子个数比为2:1
D.参加反应的甲与乙的质量比为1:2
2.(2022·安徽·桐城市新渡教育集团校九年级期末)节能减排中“减排”的重要手段是合理利用二氧化碳。科学家正致力于将二氧化碳转化为甲烷,其反应的微观示意图如图所示。下列叙述正确的是
A.反应前后分子的总数不变
B.反应前后氢元素的化合价不变
C.参加反应甲与乙分子个数比为1:1
D.参加反应的甲物质和乙物质的质量比为2:11
3.(2022·安徽·萧县华龙中学九年级期末)2021年6月10日,国家航天局宣布神舟12号载人航天器计划发射,为建党100周年献礼。火箭发射时,其燃料发生化学反应的微观示意图如下、下列说法正确的是
A.化学反应前后原子的数目发生改变 B.反应生成的丙和丁的质量比为7:6
C.该反应为化合反应 D.参加反应的甲、乙分子个数比为1:1
4.(2022·安徽·全椒县武岗中学九年级期末)燃煤电厂烟道气中含有大量的二氧化碳,经“捕捉”可用于生产甲醇等产品。反应的微观示意图如图所示:
下列说法正确的是
A.反应前后氢元素的化合价没有改变
B.反应中甲、乙两种物质的分子个数比为1:3
C.反应中乙、丙两种物质的质量比为1:9
D.反应后原子个数增加了
5.(2022·安徽·马鞍山东方实验学校九年级期末)某同学将8克高锰酸钾放在试管中加热,反应后称得剩余固体物质的质量为7.2克,则剩余的固体物质是
A.锰酸钾 B.二氧化锰和锰酸钾
C.高锰酸钾和锰酸钾 D.二氧化锰、锰酸钾、高锰酸钾
6.(2021·安徽宣城·九年级期末)对含 X Y两种未知物的化学方程式: 说法错误的是
A.X中一定含有氢元素,Y中一定含有铜元素
B.若 X为 HNO3,则 Y为 Cu(NO3)2
C.若 Y的相对分子质量为 135,则 X的相对分子质量为 73
D.若有 4克 CuO参加反应,则会有 0.9克水生成
7.(2021·安徽阜阳·九年级期末)在一个密闭容器中放入甲、乙、丙、丁4种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如表,对此反应分析不正确的是
物质 甲 乙 丙 丁
反应前的质量/g 64 32 8 4
反应后的质量/g 32 24 48 x
A.该反应属于化合反应
B.如果继续下去,当甲为16g时,乙为12g
C.反应中甲丙两种物质质量变化的比为4∶5
D.物质丁可能是该反应的催化剂
8.(2021·安徽安庆·九年级期末)如图表示某化学反应的微观示意图,依据图分析判断,下列正确的是( )
A.甲物质是天然气的主要成份 B.参加反应的甲、乙分子个数比为1:1
C.生成的丙和丁的质量比为56:73 D.该反应前后原子种类、个数都不变
9.(2021·安徽淮北·九年级期末)宏观与微观相结合是化学学科的思维特点。某化学反应的微观过程如图,下列有关说法中,不正确的是( )
A.该反应属于氧化反应
B.物质甲的化学式为
C.该反应生成的两种物质均为氧化物
D.参加反应的甲、乙两物质的质量比是2:5
10.(2021·安徽·合肥市第六十八中学九年级期末)在“宏观一微观一符号“之间建立联系是化学学科特有的思维方式,我国科学家在水煤气变换中引入了高效催化体系,使该反应在120℃时进行,反应过程如图所示。下列说法错误的是
A.反应前后原子的总数不变 B.该反应遵循质量守恒定律
C.该过程体现了催化剂吸附微粒的选择性 D.反应每消耗14g甲,可生成44g丙
二、计算题
11.(2022·安徽·巢湖市夏阁中学九年级期末)实验室制取氧气时,某同学取质量为x的氯酸钾与少量二氧化锰加热,记录产生氧气的质量和时间的关系如图所示,请回答下列问题:
(1)t0-t1时段固体的质量不发生变化是因为______;t4-t5时段,固体的质量不发生变化,是因为______。
(2)请根据图中的数据,计算氯酸钾的质量是多少?(写出计算的过程,结果精确到小数点后一位)
12.(2022·安徽·肥东县梁园中学九年级期末)发射通讯卫星的火箭用联氨(N2H4)做燃料,用四氧化二氮 (N2O4)助燃,反应的化 学方程式为:2N2H4 + N2O43N2 + 4H2O 生成物不会对大气造成污染。请计算:
(1)联氨中氮元素的质量分数__________。
(2)3.2Kg N2H4 发生燃烧,需要助燃物 N2O4 的质量。
13.(2022·安徽·合肥市第六十八中学九年级期末)用煤作燃料生成的SO2气体会造成环境污染,产生的SO2用氢氧化钙来完全吸收,其反应的化学方程式为,请计算:
(1)CaSO3中氧元素的质量分数______。
(2)吸收32kgSO2,在理论上需用多少千克的Ca(OH)2?(写出计算过程)
14.(2022·安徽·淮北市烈山区淮选学校九年级期末)“7150灭火剂”以雾状形式喷射到燃着的金属上时,立即发生燃烧反应:。反应能很快耗尽金属物质附近的氧气,生成的玻璃状B2O3覆盖在金属物质表面而隔绝空气,从而有效灭火。
(1)请写出X的化学式:___________。
(2)请计算:若充分燃烧348g“7150灭火剂”,理论上可得到B2O3的质量。
15.(2022·安徽·马鞍山东方实验学校九年级期末)实验室用过氧化氢溶液和二氧化锰制取氧气,实验的相关数据如下表所示:
气体发生装置内物质的总质量
反应前/g 143.5
反应后/g 137.1
(1)制得氧气的质量为_________________g。
(2)参加反应的过氧化氢的质量______(写出必要的计算过程)。
16.(2022·安徽·萧县华龙中学九年级期末)乙醇俗称酒精,属于可再生能源,将乙醇按一定比例和汽油混合制成乙醇汽油可节约大量的化石燃料。请计算:
(1)乙醇中氢元素和氧元素的质量比为___________(写最简整数比);
(2)现有9.2kg乙醇,完全燃烧可生成二氧化碳的质量是多少?
17.(2022·安徽·六安市叶集区姚李镇新星实验学校九年级期末)钢是铁的合金为测定某钢样中铁的质量分数,取20g钢样,向其中加入稀硫酸,产生氢气的质量与加入稀硫酸的质量关系如图所示(不考虑钢样中其它成分与稀硫酸的反应)。
(1)钢是_____(填“纯净物”或“混合物”)。
(2)计算此钢样中铁的质量分数_____。
18.(2022·安徽·肥东县石塘学校九年级期末)某同学为测定实验室里高锰酸钾样品的质量分数,取16.0g该样品进行加热,在加热过程中测定了剩余固体个容器的总质量如表所示。求:
时间 t0 t1 t2 t3 t4 t5
测量质量/g 48.2 48.2 47.8 47.3 46.6 46.6
(1)加热盛放高锰酸钾的容器质量=___________;
(2)该样品中高锰酸钾的质量分数是多少?
19.(2022·安徽·桐城市杨公中学九年级期末)兴趣小组的同学取10克石灰石于烧杯中并慢慢加入盐酸,测得反应过程剩余固体质量与加入盐酸的质量关系如图1所示(石灰石中的杂质不与盐酸反应也不溶于水)。请回答下列问题:
(1)石灰石中所含杂质的质量是_________g。
(2)实验结束时生成二氧化碳的质量是多少?
(3)根据以上数据画出产生的气体与加入的盐酸质量的关系图2。
20.(2022·安徽·桐城市第二中学九年级期末)实验室发现一瓶大理石样品,为了测定该样品纯度,取该大理石12 g加到100g某浓度的盐酸中,恰好反应测得反应后的烧杯中物质总质量变为107.6g(杂质不与酸反应),求:
(1)生成二氧化碳的质量;
(2)该大理石样品的纯度(碳酸钙的质量分数,精确到0.1%)。
21.(2021·安徽安庆·九年级期末)赤铁矿(主要成分为Fe2O3)可用于生产催化剂。
(1)Fe2O3中氧元素的质量分数为______。
(2)赤铁矿经提纯后得到的纯净Fe2O3可用于生产某种工业催化剂(主要成分为FeO和Fe2O3),其反应原理为2Fe2O3+C4FeO+CO2↑。现将焦炭和过量的Fe2O3混合均匀,按上述原理充分反应,如图所示为固体混合物的质量随反应时间的变化曲线。
①由图可知:生成CO2气体的质量为______g。
②计算反应后固体混合物中FeO的质量分数______ (请根据化学方程式写出完整的计算步骤)。
22.(2021·安徽·合肥市小庙中学九年级期末)实验室用48.0g过氧化氢溶液和2.0g二氧化锰制取氧气,实验的相关数据如图所示。
(1)反应中二氧化锰的作用是_____。
(2)反应生成氧气的质量为_____g。
(3)计算参加反应的过氧化氢的质量。(写出必要的计算过程)
23.(2021·安徽·淮北市古饶中学九年级期末)现有如图的氧气发生装置,取50g过氧化氢溶液于分液漏斗A中,向B中加入5g二氧化锰,活塞K保持打开。不同时间电子天平的读数如下表所示(不考虑H2O逸出)。
反应时间/min 0 1 2 3 4 5
装置+过氧化氢溶液+二氧化锰/g 340.00 338.78 335.64 335.20 335.20 335.20
请根据要求回答下列问题:
(1)生成氧气的质量为_________g。
(2)根据生成氧气的质量计算参加反应过氧化氢的质量。(根据化学方程式列式计算)
24.(2021·安徽·安庆市第二中学九年级期末)为测定某种贝壳中碳酸钙的含量,取25g贝壳,逐渐加入稀盐酸,充分反应后,测得剩余固体质量与加入稀盐酸的质量关系如图所示(已知杂质不参与反应,也不溶于水)请计算:
(1)这种贝壳中碳酸钙的质量分数是多少? (碳酸钙的质量分数=)。
(2)25g贝壳与稀盐酸恰好完全反应时,生成二氧化碳的质量多少
25.(2021·安徽·合肥寿春中学九年级期末)甲、乙实验小组分别利用2g铜粉“测定空气中氧气的含量”,实验装置见图。化学反应方程式为。课外兴趣小组为研究实验中铜粉的氧化情况,将玻璃管中的残留固体全部取出,经过一系列实验操作后,得出甲组残留固体中氧化铜的质量为0.08g,乙组残留固体中氧化铜的质量为0.12g。
(1)根据甲组实验数据,计算铜的氧化率(被氧化的铜的质量占原铜粉的百分比)。(写出计算过程)
(2)兴趣小组通过分析数据得出:甲组实验数据更接近实际空气中氧气的含量,乙组差异较大。你认为乙组在“测定空气中氧气的含量”实验中,出现较大差异的原因可能是 。
26.(2021·安徽·无为县实验中学九年级期末)小江同学为了寻找含碳酸钙质量分数超过 85%的石灰石,对一样品进行了如下图所示 的实验(石灰石样品中的杂质不与盐酸反应)。试通过分析计算(结果保留一位小数):
(1)该实验中生成的二氧化碳的质量是_____________克?
(2)该石灰石样品中碳酸钙的质量分数是否符合要求?______________
27.(2021·安徽·合肥市第六十八中学九年级期末)将12.5g混有二氧化锰的氯酸钾固体加热至质量不再减少,冷却后称量固体的质量为7.7g。
(1)反应时生成氧气的质量为 g。
(2)计算反应前固体中氯酸钾的质量分数(要求写出计算过程)
28.(2021·安徽芜湖·九年级期末)据中国国家航天局宣布,携带月球土壤样品的嫦娥五号的返回器已经成功着陆在内蒙古自治区境内。运载“嫦娥五号”火箭长征五号可使用液态四氧化二氮(N2O4)和偏二甲肼(C2H8N2)为推进剂,其完全反应的化学方程式为:,请计算:
(1)偏二甲肼(C2H8N2)中碳元素的质量分数为 。
(2)R的化学式为 。
(3)若燃烧24t偏二甲肼(C2H8N2)则至少需要消耗四氧化二氮(N2O4)的质量为多少?
29.(2021·安徽六安·九年级期末)取氯酸钾和二氧化锰的混合物12克制取氧气,加热一段时间后,测得50%的氯酸钾分解,将剩余的固体冷却后称量,其质量为10.08克,求原混合物中氯酸钾和二氧化锰各多少克?
30.(2021·安徽合肥·九年级期末)硅酸钠(Na2SiO3)是我国优先发展的精细化工产品,工业制备的反应为: 。现以75t石英砂(SiO2质量分数为80%)为原料,与足量的NaOH溶液反应。试计算:理论上得到硅酸钠的质量。
参考答案:
1.C
【分析】由题意可知,某种催化剂可将尾气中的一氧化碳、二氧化氨转化为两种空气中的无毒成分,由质量守恒定律和反应的微观示意图可知,生成物是二氧化碳和氮气;反应的化学方程式是:2NO2+4CO4CO2+N2;
【详解】根据以上分析可知:
A、生成物中的丁是氮气,属于单质,四种物质不均属于化合物,故A错误;
B、物质丁是氮气,氮气由氮气分子构成的,故B错误;
C、由反应的化学方程式可知,参加反应的甲与生成的丁的分子个数比为2:1,故C正确;
D、由反应的化学方程式可知,参加反应的甲与乙的质量比=[2×(14+16×2)]:[4×(12+16)]=92:112≠1:2,故D错误。
故选C。
2.D
【详解】A、由图示可知,该反应的反应物是二氧化碳和氢气,生成物是甲烷和水,反应的化学方程式为。由化学方程式可知,化学反应前后分子的总数发生变化,故A不正确;
B、反应前氢气是单质,氢元素的化合价为0,反应后水中和甲烷中氢元素的化合价为+1价,故B不正确;
C、根据化学方程式可知,甲与乙的分子个数比为4:1,故C不正确;
D、由化学方程式可知,参加反应的甲物质和乙物质的质量比为(4×2):(12+16×2)=2:11,故D正确。
故选:D。
3.B
【详解】A、根据质量守恒定律可知,化学反应前后原子的数目不发生改变,该选项说法不正确;
B、根据反应的微观示意图可知,反应的化学方程式:N2O4+2N2H4 3N2+4H2O,反应生成的丙和丁的质量比为:84:72=7:6,该选项说法正确;
C、根据反应的微观示意图可知,该反应的反应物和生成物都是两种,不符合化合反应多变一的特征,该选项说法不正确;
D、根据选项B中的化学方程式可知,参加反应的甲、乙分子个数比为1:2,该选项说法不正确。
故选:B。
4.B
【详解】A、由图可知,反应物氢气中的氢元素的化合价为0,反应后生成的化合物中氢元素的化合价为+1价,即反应前后氢元素的化合价发生了改变,选项错误;
B、由图可知,该反应的化学方程式为:CO2+3H2CH4O+H2O,则反应中甲、乙两种物质的分子个数比为1:3,选项正确;
C、由化学方程式可知,反应中乙、丙两种物质的质量比为:(2×3):32=3:16,选项错误;
D、由化学方程式可知,反应前后原子数目不变,选项错误。
故选B。
5.D
【详解】解:生成氧气的质量为.
设生成0.8g氧气需要高锰酸钾的质量为.
即8g高锰酸分解了7.9g,还有没分解的为0.1g,故剩余固体中有锰酸钾、二氧化锰和高锰酸钾,故选D。
6.C
【详解】A、依据质量守恒定律:化学反应前后元素的种类不变,CuO中含有铜元素和氧元素,则Y中一定含有铜元素;H2O中含有氢元素,则X中一定含有氢元素,故A项错误;
B、若X为HNO3,依据质量守恒定律,化学反应前后原子的个数和种类不变,
2HNO3+CuO=Y+H2O,反应前2个氢原子,生成物中有2个氢原子,反应前2个氮原子,生成物中没有氮原子,反应前7个氧原子,生成物中1个氧原子,反应前1个铜原子,生成物中没有铜原子,所以生成物Y中含有1个铜原子,2个氮原子,6个氧原子,Y的化学式为Cu(NO3)2,故B项错误;
C、设X的相对分子质量为M,依据质量守恒定律可知:
X的相对分子质量为36.5,故C项正确;
D、设:4g氧化铜参加反应生成水的质量为
答:生成0.9g的水,
故D项错误;
7.B
【详解】根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和;反应后质量增加的是生成物,减少的是反应物,质量不变的可能做催化剂。根据质量守恒定律,x=64+32+8+4-32-24-48=4。
A、反应后甲、乙质量减小,都是反应物,丙质量增大,是生成物,该反应是化合反应,该选项说法正确,不符合题意;
B、反应中甲、乙两种物质质量比为:(64-32):(32-14)=4:1,如果继续反应下去,当甲为16g时,设乙为y,则(32-16g):(24-y)=4:1,解得y=20,该选项说法不正确,符合题意;
C、反应中甲、丙两种物质质量比为:(64-32):(48-8)=4:5,该选项说法正确,不符合题意;
D、反应前后丁质量不变,物质丁可能是该反应的催化剂,该选项说法正确,不符合题意。
故选:B。
8.D
【解析】由微观示意图可知,甲为SiCl4,乙为H2,丙为Si,丁为HCl,化学方程式。
【详解】A. 由分析可知甲为SiCl4,不是天然气的主要成分甲烷(CH4),故A不符合题意;
B. 由分析可知参加反应的甲、乙两种物质的分子个数比为 1∶2,故B不符合题意;
C. 由分析可知生成的丙和丁的质量比为 28:146=14:73,故C不符合题意;
D. 根据质量守恒定律,该反应前后原子种类、个数都不变,故D符合题意。
故选:D。
9.D
【分析】由化学反应的微观示意图和质量守恒定律可知,反应前后原子的种类和数量不变,甲是乙炔,该反应的化学方程式是:
【详解】A、该反应是乙炔和氧气发生了反应,属于氧化反应,故正确;
B、由分析可知甲物质为乙炔,化学式为,故正确;
C、生成物为二氧化碳和水,均属于氧化物,故正确;
D、由方程式可知,参加反应的甲乙的质量比为 ,故错误;
故选D。
10.D
【详解】由反应的微观模型图可知,在高效催化体系使水煤气中的CO和H2O在120℃下发生反应,反应方程式为:CO+H2O CO2+H2;
A、由化学方程式可知,反应前后原子的总数不变,故正确;
B、该反应由新物质生成,属于化学变化,化学变化都遵守质量守恒定律,正确;
C、由微粒的变化可知,该过程能体现了催化剂吸附微粒的选择性,故正确;
D、由方程式可知,甲与丙的质量比是28:44,所以反应每消耗14g甲,可生成22g丙,故错误。
故选:D。
11.(1) 温度未达到反应条件 反应已经结束
(2)设氯酸钾的质量是x
解得:
答:氯酸钾的质量是8.2g。
【分析】氯酸钾在加热的条件下,被二氧化锰催化,分解为氯化钾和氧气。
(1)
氯酸钾在加热的条件下才能分解出氧气,故t0—t1时段固体的质量不发生变化是因为温度未达到反应条件;t4—t5时段,固体的质量不发生变化,是因为反应已经结束;
(2)
见答案。
12.(1)87.5%;(2)4.6kg
【详解】(1)联氨中氮元素的质量分数=;
(2)设需要助燃物 N2O4 的质量为x。
x=4.6kg。
答:(1)联氨中氮元素的质量分数87.5%;
(2)3.2Kg N2H4 发生燃烧,需要助燃物 N2O4 的质量为4.6kg。
13.(1)40%
(2)解:设理论上需用Ca(OH)2的质量为x
答:理论上需用Ca(OH)237kg。
【解析】(1)
CaSO3中氧元素的质量分数=;
(2)
解析见答案。
14.(1)CO2
(2)设理论上可得到B2O3的质量为x
x=210g
答:理论上可得到B2O3的质量为210g。
【解析】(1)
根据质量守恒定律,反应物中共有6个碳原子、18个氢原子、6个硼原子、30个氧原子。生成物中有6个硼原子、18个氧原子、18个氢原子,还应有6个碳原子、12个氧原子。所以X的化学式为CO2。
(2)
按照根据化学方程式的简单计算步骤进行即可。详见答案。
15.(1)6.4
(2)解:设参加反应的过氧化氢的质量为.
答:参加反应的过氧化氢的质量为13.6g。
【解析】(1)
根据质量守恒定律,可求出生成氧气的质量为:;
(2)
见答案。
16.(1)乙醇中氢元素和氧元素的质量比为3:8
(2)设:9.2kg乙醇完全燃烧生成二氧化碳的质量为x。
答:9.2kg乙醇完全燃烧生成二氧化碳的质量为17.6kg。
【解析】(1)
乙醇(C2H5OH)中氢元素和氧元素的质量比=(1×6):16=3:8
(2)
按照根据化学方程式计算步骤进行即可。详见答案。
17.(1)混合物
(2)解:设参与反应的铁的质量为x。
=11.2g
此钢样中铁的质量分数==56%。
答:此钢样中铁的质量分数为56%。
【解析】(1)
钢是铁的合金,合金都是混合物,钢是混合物。
(2)
解:设参与反应的铁的质量为x。
=11.2g
此钢样中铁的质量分数==56%。
答:此钢样中铁的质量分数为56%。
18.(1)加热盛放高锰酸钾的容器质量为48.2g-16.0g=32.2g;
(2)解:反应生成氧气质量为48.2g-46.6g═1.6g
设KMnO4的质量为x
x=15.8g,
答:样品中KMnO4的质量分数为98.75%。
【解析】(1)
见答案。
(2)
高锰酸钾在加热条件下生成锰酸钾和氧气和二氧化锰,氧气逸出,总质量的减少就是生成氧气的质量48.2g-46.6g═1.6g。过程见答案。
19.(1)3
(2)10g石灰石中含碳酸钙的质量为:10g-3g=7g
设生成二氧化碳的质量为x
x=3.08g
答:实验结束时生成二氧化碳的质量是3.08g
(3)
【解析】(1)
石灰石中的杂质不与盐酸反应也不溶于水,当加入盐酸至固体质量不变时,剩余固体即为石灰石中所含的杂质,由图像可知杂质质量为3g。
(2)
见答案
(3)
没有加盐酸时产生二氧化碳质量为0g,由图1可知加入20g稀盐酸时,参加反应碳酸钙的质量为10g-6g=4g,设此时生成二氧化碳的质量为y,则
y=1.76g
即加入20g稀盐酸时,生成二氧化碳1.76g
由(2)可知完全反应时生成二氧化碳的质量为3.08g,
此时消耗稀盐酸质量为
故产生的气体与加入的盐酸质量的关系图为
【点睛】
20.(1)4.4g
(2)解:设大理石样品的纯度为x
答:大理石样品的纯度为83.3%。
【解析】(1)
反应生成二氧化碳气体逸出,总质量的减少就是生成的二氧化碳气体12g+100g-107.6g=4.4g;
(2)
见答案。
21.(1)30%;(2)①1.1g;②36%
【详解】(1)在Fe2O3中,氧元素的质量分数为×100%=30%;
(2)①由图和质量守恒定律可得,生成CO2气体的质量为 21.1g=-20.0g=1.1g;
②设反应后固体混合物中FeO的质量为x,
反应后固体混合物中FeO的质量分数为×100%=36.0%。
22.(1)反应中二氧化锰的作用是加快过氧化氢的分解;(2)1.6g;(3)3.4g
【详解】(1)反应中二氧化锰做催化剂,起催化作用,即加快过氧化氢的分解;
(2)根据质量守恒定律可得,生成的氧气的质量为50.0g﹣48.4g=1.6g
(3)设参加反应的过氧化氢的质量为x,
x=3.4g
故答案为(1)加快过氧化氢的分解。(2)反应生成氧气的质量为 1.6g。(3)参加反应的过氧化氢的质量为3.4g。
23.(1)4.8
(2)解:设参加反应过氧化氢的质量为x。
答:参加反应过氧化氢的质量为10.2g
【分析】(1)
根据质量守恒定律可知,反应前后的减少的质量即为放出氧气的质量,所以生成氧气的质量为:340.0g-335.20g=4.8g。
(2)
见答案。
24.80%;8.8g
【详解】(1)由图可以看出固体减少了20g,即碳酸钙的质量为20g,所以贝壳中碳酸钙的质量分数为×100%=80%。
(2)设恰好反应时产生二氧化碳的质量为x
x=8.8g
答:25g贝壳与稀盐酸恰好完全反应时,生成的二氧化碳质量是8.8g。
故答案为:(1)80%;(2)25g贝壳与稀盐酸恰好完全反应时,生成的二氧化碳质量是8.8g。
25.解法一:
(1)解:根据质量守恒定律,氧化铜中铜元素质量即为被氧化的铜的质量,其质量为:
则铜的氧化率为:
答:铜的氧化率为3.2%。
解法二:
解:设被氧化的铜的质量为。
所以铜的氧化率为:
答:铜的氧化率为3.2%。
(2)乙实验小组实验时装置漏气,导致瓶外空气进入,进入的氧气与铜反应,使实验数值偏大。
【分析】第一题有两种解法,一是根据质量守恒定律,化学反应前后元素质量不变,去求解;另一种方法是根据化学方程式进行计算。
【详解】见详解。
26.(1)据质量守恒定律可知,反应前后物质的总质量不变,该实验中生成的二氧化碳的质量是100g+12g-107.6g=4.4g;
(2)设石灰石样品中碳酸钙的质量为x
100/x=44/4.4g x=10g
石灰石样品中碳酸钙的质量分数:10g÷12g×100%≈83.3%< 85% ,不符合要求。
【详解】(1)据质量守恒定律可知,反应前后物质的总质量不变,该实验中生成的二氧化碳的质量是100g+12g-107.6g=4.4g;
(2)设石灰石样品中碳酸钙的质量为x
CaCO3 + 2HCl == CaCl2 + H2O + CO2↑
100 44
x 4.4g
100/x=44/4.4g x=10g
石灰石样品中碳酸钙的质量分数:10g÷12g×100%≈83.3%< 85% ,不符合要求。
27.(1)4.8
根据质量守恒定律可知,化学反应前后物质质量总和保持不变,则生成氧气的质量为:12.5g-7.7g=4.8g;故填:4.8;
(2)98%
设:氯酸钾的质量为x
氯酸钾的质量分数为:×100%=98%;
答:反应前固体中氯酸钾的质量分数为98%。
【详解】(1)见答案;
(2)见答案。
28.(1)40%
(2)N2
(3)设至少需要四氧化二氮的质量为x,
x=73.6t
答:至少需要四氧化二氮的质量为73.6t。
【详解】(1)碳元素质量分数=;
故答案为:40%。
(2)根据化学方程式可以看出反应前含有2个碳原子,8个氢原子,6个氮原子,8个氧原子,反应后目前有2个碳原子,8个氧原子和8个氢原子,因此还需要有6个氮原子,提出公因数3后,正好组成1个氮气分子,所以R为N2;
故答案为:N2。
(3)见答案。
29.设生成1.92g氧气时参与反应的氯酸钾的质量为x,
解之得:x=4.9g
由于是氯酸钾只是分解了50%,所以原混合物中氯酸钾的质量为:4.9g÷50%=9.8g;
由于反应前的混合物的总质量为12g,所以原混合物中二氧化锰的质量为:12g-9.8g=2.2g.
答:原混合物中氯酸钾有9.8克;二氧化锰有2.2克.
【分析】由于两次称重都是固体的质量,且有差值.而根据质量守恒定律,前后质量一定相等,所以必然过程中生成气体或者液体,由于是氯酸钾和二氧化锰的混合物,所以会生成氧气,所以气体氧气的质量就等于:12g-10.08g=1.92g.
【详解】见答案。
30.解:设理论上得到Na2SiO3质量为x
x=122 t
答:理论上得到Na2SiO3质量122t。
【详解】见答案。
一、单选题
1.(2022·安徽安徽·九年级期末)某种催化剂可将汽车尾气中的一氧化碳、二氧化氮转化为两种空气中的无毒成分,反应的微观示意图如下。下列说法正确的是
A.四种物质均属于化合物
B.物质丁由原子构成
C.参加反应的甲与生成的丁的分子个数比为2:1
D.参加反应的甲与乙的质量比为1:2
2.(2022·安徽·桐城市新渡教育集团校九年级期末)节能减排中“减排”的重要手段是合理利用二氧化碳。科学家正致力于将二氧化碳转化为甲烷,其反应的微观示意图如图所示。下列叙述正确的是
A.反应前后分子的总数不变
B.反应前后氢元素的化合价不变
C.参加反应甲与乙分子个数比为1:1
D.参加反应的甲物质和乙物质的质量比为2:11
3.(2022·安徽·萧县华龙中学九年级期末)2021年6月10日,国家航天局宣布神舟12号载人航天器计划发射,为建党100周年献礼。火箭发射时,其燃料发生化学反应的微观示意图如下、下列说法正确的是
A.化学反应前后原子的数目发生改变 B.反应生成的丙和丁的质量比为7:6
C.该反应为化合反应 D.参加反应的甲、乙分子个数比为1:1
4.(2022·安徽·全椒县武岗中学九年级期末)燃煤电厂烟道气中含有大量的二氧化碳,经“捕捉”可用于生产甲醇等产品。反应的微观示意图如图所示:
下列说法正确的是
A.反应前后氢元素的化合价没有改变
B.反应中甲、乙两种物质的分子个数比为1:3
C.反应中乙、丙两种物质的质量比为1:9
D.反应后原子个数增加了
5.(2022·安徽·马鞍山东方实验学校九年级期末)某同学将8克高锰酸钾放在试管中加热,反应后称得剩余固体物质的质量为7.2克,则剩余的固体物质是
A.锰酸钾 B.二氧化锰和锰酸钾
C.高锰酸钾和锰酸钾 D.二氧化锰、锰酸钾、高锰酸钾
6.(2021·安徽宣城·九年级期末)对含 X Y两种未知物的化学方程式: 说法错误的是
A.X中一定含有氢元素,Y中一定含有铜元素
B.若 X为 HNO3,则 Y为 Cu(NO3)2
C.若 Y的相对分子质量为 135,则 X的相对分子质量为 73
D.若有 4克 CuO参加反应,则会有 0.9克水生成
7.(2021·安徽阜阳·九年级期末)在一个密闭容器中放入甲、乙、丙、丁4种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如表,对此反应分析不正确的是
物质 甲 乙 丙 丁
反应前的质量/g 64 32 8 4
反应后的质量/g 32 24 48 x
A.该反应属于化合反应
B.如果继续下去,当甲为16g时,乙为12g
C.反应中甲丙两种物质质量变化的比为4∶5
D.物质丁可能是该反应的催化剂
8.(2021·安徽安庆·九年级期末)如图表示某化学反应的微观示意图,依据图分析判断,下列正确的是( )
A.甲物质是天然气的主要成份 B.参加反应的甲、乙分子个数比为1:1
C.生成的丙和丁的质量比为56:73 D.该反应前后原子种类、个数都不变
9.(2021·安徽淮北·九年级期末)宏观与微观相结合是化学学科的思维特点。某化学反应的微观过程如图,下列有关说法中,不正确的是( )
A.该反应属于氧化反应
B.物质甲的化学式为
C.该反应生成的两种物质均为氧化物
D.参加反应的甲、乙两物质的质量比是2:5
10.(2021·安徽·合肥市第六十八中学九年级期末)在“宏观一微观一符号“之间建立联系是化学学科特有的思维方式,我国科学家在水煤气变换中引入了高效催化体系,使该反应在120℃时进行,反应过程如图所示。下列说法错误的是
A.反应前后原子的总数不变 B.该反应遵循质量守恒定律
C.该过程体现了催化剂吸附微粒的选择性 D.反应每消耗14g甲,可生成44g丙
二、计算题
11.(2022·安徽·巢湖市夏阁中学九年级期末)实验室制取氧气时,某同学取质量为x的氯酸钾与少量二氧化锰加热,记录产生氧气的质量和时间的关系如图所示,请回答下列问题:
(1)t0-t1时段固体的质量不发生变化是因为______;t4-t5时段,固体的质量不发生变化,是因为______。
(2)请根据图中的数据,计算氯酸钾的质量是多少?(写出计算的过程,结果精确到小数点后一位)
12.(2022·安徽·肥东县梁园中学九年级期末)发射通讯卫星的火箭用联氨(N2H4)做燃料,用四氧化二氮 (N2O4)助燃,反应的化 学方程式为:2N2H4 + N2O43N2 + 4H2O 生成物不会对大气造成污染。请计算:
(1)联氨中氮元素的质量分数__________。
(2)3.2Kg N2H4 发生燃烧,需要助燃物 N2O4 的质量。
13.(2022·安徽·合肥市第六十八中学九年级期末)用煤作燃料生成的SO2气体会造成环境污染,产生的SO2用氢氧化钙来完全吸收,其反应的化学方程式为,请计算:
(1)CaSO3中氧元素的质量分数______。
(2)吸收32kgSO2,在理论上需用多少千克的Ca(OH)2?(写出计算过程)
14.(2022·安徽·淮北市烈山区淮选学校九年级期末)“7150灭火剂”以雾状形式喷射到燃着的金属上时,立即发生燃烧反应:。反应能很快耗尽金属物质附近的氧气,生成的玻璃状B2O3覆盖在金属物质表面而隔绝空气,从而有效灭火。
(1)请写出X的化学式:___________。
(2)请计算:若充分燃烧348g“7150灭火剂”,理论上可得到B2O3的质量。
15.(2022·安徽·马鞍山东方实验学校九年级期末)实验室用过氧化氢溶液和二氧化锰制取氧气,实验的相关数据如下表所示:
气体发生装置内物质的总质量
反应前/g 143.5
反应后/g 137.1
(1)制得氧气的质量为_________________g。
(2)参加反应的过氧化氢的质量______(写出必要的计算过程)。
16.(2022·安徽·萧县华龙中学九年级期末)乙醇俗称酒精,属于可再生能源,将乙醇按一定比例和汽油混合制成乙醇汽油可节约大量的化石燃料。请计算:
(1)乙醇中氢元素和氧元素的质量比为___________(写最简整数比);
(2)现有9.2kg乙醇,完全燃烧可生成二氧化碳的质量是多少?
17.(2022·安徽·六安市叶集区姚李镇新星实验学校九年级期末)钢是铁的合金为测定某钢样中铁的质量分数,取20g钢样,向其中加入稀硫酸,产生氢气的质量与加入稀硫酸的质量关系如图所示(不考虑钢样中其它成分与稀硫酸的反应)。
(1)钢是_____(填“纯净物”或“混合物”)。
(2)计算此钢样中铁的质量分数_____。
18.(2022·安徽·肥东县石塘学校九年级期末)某同学为测定实验室里高锰酸钾样品的质量分数,取16.0g该样品进行加热,在加热过程中测定了剩余固体个容器的总质量如表所示。求:
时间 t0 t1 t2 t3 t4 t5
测量质量/g 48.2 48.2 47.8 47.3 46.6 46.6
(1)加热盛放高锰酸钾的容器质量=___________;
(2)该样品中高锰酸钾的质量分数是多少?
19.(2022·安徽·桐城市杨公中学九年级期末)兴趣小组的同学取10克石灰石于烧杯中并慢慢加入盐酸,测得反应过程剩余固体质量与加入盐酸的质量关系如图1所示(石灰石中的杂质不与盐酸反应也不溶于水)。请回答下列问题:
(1)石灰石中所含杂质的质量是_________g。
(2)实验结束时生成二氧化碳的质量是多少?
(3)根据以上数据画出产生的气体与加入的盐酸质量的关系图2。
20.(2022·安徽·桐城市第二中学九年级期末)实验室发现一瓶大理石样品,为了测定该样品纯度,取该大理石12 g加到100g某浓度的盐酸中,恰好反应测得反应后的烧杯中物质总质量变为107.6g(杂质不与酸反应),求:
(1)生成二氧化碳的质量;
(2)该大理石样品的纯度(碳酸钙的质量分数,精确到0.1%)。
21.(2021·安徽安庆·九年级期末)赤铁矿(主要成分为Fe2O3)可用于生产催化剂。
(1)Fe2O3中氧元素的质量分数为______。
(2)赤铁矿经提纯后得到的纯净Fe2O3可用于生产某种工业催化剂(主要成分为FeO和Fe2O3),其反应原理为2Fe2O3+C4FeO+CO2↑。现将焦炭和过量的Fe2O3混合均匀,按上述原理充分反应,如图所示为固体混合物的质量随反应时间的变化曲线。
①由图可知:生成CO2气体的质量为______g。
②计算反应后固体混合物中FeO的质量分数______ (请根据化学方程式写出完整的计算步骤)。
22.(2021·安徽·合肥市小庙中学九年级期末)实验室用48.0g过氧化氢溶液和2.0g二氧化锰制取氧气,实验的相关数据如图所示。
(1)反应中二氧化锰的作用是_____。
(2)反应生成氧气的质量为_____g。
(3)计算参加反应的过氧化氢的质量。(写出必要的计算过程)
23.(2021·安徽·淮北市古饶中学九年级期末)现有如图的氧气发生装置,取50g过氧化氢溶液于分液漏斗A中,向B中加入5g二氧化锰,活塞K保持打开。不同时间电子天平的读数如下表所示(不考虑H2O逸出)。
反应时间/min 0 1 2 3 4 5
装置+过氧化氢溶液+二氧化锰/g 340.00 338.78 335.64 335.20 335.20 335.20
请根据要求回答下列问题:
(1)生成氧气的质量为_________g。
(2)根据生成氧气的质量计算参加反应过氧化氢的质量。(根据化学方程式列式计算)
24.(2021·安徽·安庆市第二中学九年级期末)为测定某种贝壳中碳酸钙的含量,取25g贝壳,逐渐加入稀盐酸,充分反应后,测得剩余固体质量与加入稀盐酸的质量关系如图所示(已知杂质不参与反应,也不溶于水)请计算:
(1)这种贝壳中碳酸钙的质量分数是多少? (碳酸钙的质量分数=)。
(2)25g贝壳与稀盐酸恰好完全反应时,生成二氧化碳的质量多少
25.(2021·安徽·合肥寿春中学九年级期末)甲、乙实验小组分别利用2g铜粉“测定空气中氧气的含量”,实验装置见图。化学反应方程式为。课外兴趣小组为研究实验中铜粉的氧化情况,将玻璃管中的残留固体全部取出,经过一系列实验操作后,得出甲组残留固体中氧化铜的质量为0.08g,乙组残留固体中氧化铜的质量为0.12g。
(1)根据甲组实验数据,计算铜的氧化率(被氧化的铜的质量占原铜粉的百分比)。(写出计算过程)
(2)兴趣小组通过分析数据得出:甲组实验数据更接近实际空气中氧气的含量,乙组差异较大。你认为乙组在“测定空气中氧气的含量”实验中,出现较大差异的原因可能是 。
26.(2021·安徽·无为县实验中学九年级期末)小江同学为了寻找含碳酸钙质量分数超过 85%的石灰石,对一样品进行了如下图所示 的实验(石灰石样品中的杂质不与盐酸反应)。试通过分析计算(结果保留一位小数):
(1)该实验中生成的二氧化碳的质量是_____________克?
(2)该石灰石样品中碳酸钙的质量分数是否符合要求?______________
27.(2021·安徽·合肥市第六十八中学九年级期末)将12.5g混有二氧化锰的氯酸钾固体加热至质量不再减少,冷却后称量固体的质量为7.7g。
(1)反应时生成氧气的质量为 g。
(2)计算反应前固体中氯酸钾的质量分数(要求写出计算过程)
28.(2021·安徽芜湖·九年级期末)据中国国家航天局宣布,携带月球土壤样品的嫦娥五号的返回器已经成功着陆在内蒙古自治区境内。运载“嫦娥五号”火箭长征五号可使用液态四氧化二氮(N2O4)和偏二甲肼(C2H8N2)为推进剂,其完全反应的化学方程式为:,请计算:
(1)偏二甲肼(C2H8N2)中碳元素的质量分数为 。
(2)R的化学式为 。
(3)若燃烧24t偏二甲肼(C2H8N2)则至少需要消耗四氧化二氮(N2O4)的质量为多少?
29.(2021·安徽六安·九年级期末)取氯酸钾和二氧化锰的混合物12克制取氧气,加热一段时间后,测得50%的氯酸钾分解,将剩余的固体冷却后称量,其质量为10.08克,求原混合物中氯酸钾和二氧化锰各多少克?
30.(2021·安徽合肥·九年级期末)硅酸钠(Na2SiO3)是我国优先发展的精细化工产品,工业制备的反应为: 。现以75t石英砂(SiO2质量分数为80%)为原料,与足量的NaOH溶液反应。试计算:理论上得到硅酸钠的质量。
参考答案:
1.C
【分析】由题意可知,某种催化剂可将尾气中的一氧化碳、二氧化氨转化为两种空气中的无毒成分,由质量守恒定律和反应的微观示意图可知,生成物是二氧化碳和氮气;反应的化学方程式是:2NO2+4CO4CO2+N2;
【详解】根据以上分析可知:
A、生成物中的丁是氮气,属于单质,四种物质不均属于化合物,故A错误;
B、物质丁是氮气,氮气由氮气分子构成的,故B错误;
C、由反应的化学方程式可知,参加反应的甲与生成的丁的分子个数比为2:1,故C正确;
D、由反应的化学方程式可知,参加反应的甲与乙的质量比=[2×(14+16×2)]:[4×(12+16)]=92:112≠1:2,故D错误。
故选C。
2.D
【详解】A、由图示可知,该反应的反应物是二氧化碳和氢气,生成物是甲烷和水,反应的化学方程式为。由化学方程式可知,化学反应前后分子的总数发生变化,故A不正确;
B、反应前氢气是单质,氢元素的化合价为0,反应后水中和甲烷中氢元素的化合价为+1价,故B不正确;
C、根据化学方程式可知,甲与乙的分子个数比为4:1,故C不正确;
D、由化学方程式可知,参加反应的甲物质和乙物质的质量比为(4×2):(12+16×2)=2:11,故D正确。
故选:D。
3.B
【详解】A、根据质量守恒定律可知,化学反应前后原子的数目不发生改变,该选项说法不正确;
B、根据反应的微观示意图可知,反应的化学方程式:N2O4+2N2H4 3N2+4H2O,反应生成的丙和丁的质量比为:84:72=7:6,该选项说法正确;
C、根据反应的微观示意图可知,该反应的反应物和生成物都是两种,不符合化合反应多变一的特征,该选项说法不正确;
D、根据选项B中的化学方程式可知,参加反应的甲、乙分子个数比为1:2,该选项说法不正确。
故选:B。
4.B
【详解】A、由图可知,反应物氢气中的氢元素的化合价为0,反应后生成的化合物中氢元素的化合价为+1价,即反应前后氢元素的化合价发生了改变,选项错误;
B、由图可知,该反应的化学方程式为:CO2+3H2CH4O+H2O,则反应中甲、乙两种物质的分子个数比为1:3,选项正确;
C、由化学方程式可知,反应中乙、丙两种物质的质量比为:(2×3):32=3:16,选项错误;
D、由化学方程式可知,反应前后原子数目不变,选项错误。
故选B。
5.D
【详解】解:生成氧气的质量为.
设生成0.8g氧气需要高锰酸钾的质量为.
即8g高锰酸分解了7.9g,还有没分解的为0.1g,故剩余固体中有锰酸钾、二氧化锰和高锰酸钾,故选D。
6.C
【详解】A、依据质量守恒定律:化学反应前后元素的种类不变,CuO中含有铜元素和氧元素,则Y中一定含有铜元素;H2O中含有氢元素,则X中一定含有氢元素,故A项错误;
B、若X为HNO3,依据质量守恒定律,化学反应前后原子的个数和种类不变,
2HNO3+CuO=Y+H2O,反应前2个氢原子,生成物中有2个氢原子,反应前2个氮原子,生成物中没有氮原子,反应前7个氧原子,生成物中1个氧原子,反应前1个铜原子,生成物中没有铜原子,所以生成物Y中含有1个铜原子,2个氮原子,6个氧原子,Y的化学式为Cu(NO3)2,故B项错误;
C、设X的相对分子质量为M,依据质量守恒定律可知:
X的相对分子质量为36.5,故C项正确;
D、设:4g氧化铜参加反应生成水的质量为
答:生成0.9g的水,
故D项错误;
7.B
【详解】根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和;反应后质量增加的是生成物,减少的是反应物,质量不变的可能做催化剂。根据质量守恒定律,x=64+32+8+4-32-24-48=4。
A、反应后甲、乙质量减小,都是反应物,丙质量增大,是生成物,该反应是化合反应,该选项说法正确,不符合题意;
B、反应中甲、乙两种物质质量比为:(64-32):(32-14)=4:1,如果继续反应下去,当甲为16g时,设乙为y,则(32-16g):(24-y)=4:1,解得y=20,该选项说法不正确,符合题意;
C、反应中甲、丙两种物质质量比为:(64-32):(48-8)=4:5,该选项说法正确,不符合题意;
D、反应前后丁质量不变,物质丁可能是该反应的催化剂,该选项说法正确,不符合题意。
故选:B。
8.D
【解析】由微观示意图可知,甲为SiCl4,乙为H2,丙为Si,丁为HCl,化学方程式。
【详解】A. 由分析可知甲为SiCl4,不是天然气的主要成分甲烷(CH4),故A不符合题意;
B. 由分析可知参加反应的甲、乙两种物质的分子个数比为 1∶2,故B不符合题意;
C. 由分析可知生成的丙和丁的质量比为 28:146=14:73,故C不符合题意;
D. 根据质量守恒定律,该反应前后原子种类、个数都不变,故D符合题意。
故选:D。
9.D
【分析】由化学反应的微观示意图和质量守恒定律可知,反应前后原子的种类和数量不变,甲是乙炔,该反应的化学方程式是:
【详解】A、该反应是乙炔和氧气发生了反应,属于氧化反应,故正确;
B、由分析可知甲物质为乙炔,化学式为,故正确;
C、生成物为二氧化碳和水,均属于氧化物,故正确;
D、由方程式可知,参加反应的甲乙的质量比为 ,故错误;
故选D。
10.D
【详解】由反应的微观模型图可知,在高效催化体系使水煤气中的CO和H2O在120℃下发生反应,反应方程式为:CO+H2O CO2+H2;
A、由化学方程式可知,反应前后原子的总数不变,故正确;
B、该反应由新物质生成,属于化学变化,化学变化都遵守质量守恒定律,正确;
C、由微粒的变化可知,该过程能体现了催化剂吸附微粒的选择性,故正确;
D、由方程式可知,甲与丙的质量比是28:44,所以反应每消耗14g甲,可生成22g丙,故错误。
故选:D。
11.(1) 温度未达到反应条件 反应已经结束
(2)设氯酸钾的质量是x
解得:
答:氯酸钾的质量是8.2g。
【分析】氯酸钾在加热的条件下,被二氧化锰催化,分解为氯化钾和氧气。
(1)
氯酸钾在加热的条件下才能分解出氧气,故t0—t1时段固体的质量不发生变化是因为温度未达到反应条件;t4—t5时段,固体的质量不发生变化,是因为反应已经结束;
(2)
见答案。
12.(1)87.5%;(2)4.6kg
【详解】(1)联氨中氮元素的质量分数=;
(2)设需要助燃物 N2O4 的质量为x。
x=4.6kg。
答:(1)联氨中氮元素的质量分数87.5%;
(2)3.2Kg N2H4 发生燃烧,需要助燃物 N2O4 的质量为4.6kg。
13.(1)40%
(2)解:设理论上需用Ca(OH)2的质量为x
答:理论上需用Ca(OH)237kg。
【解析】(1)
CaSO3中氧元素的质量分数=;
(2)
解析见答案。
14.(1)CO2
(2)设理论上可得到B2O3的质量为x
x=210g
答:理论上可得到B2O3的质量为210g。
【解析】(1)
根据质量守恒定律,反应物中共有6个碳原子、18个氢原子、6个硼原子、30个氧原子。生成物中有6个硼原子、18个氧原子、18个氢原子,还应有6个碳原子、12个氧原子。所以X的化学式为CO2。
(2)
按照根据化学方程式的简单计算步骤进行即可。详见答案。
15.(1)6.4
(2)解:设参加反应的过氧化氢的质量为.
答:参加反应的过氧化氢的质量为13.6g。
【解析】(1)
根据质量守恒定律,可求出生成氧气的质量为:;
(2)
见答案。
16.(1)乙醇中氢元素和氧元素的质量比为3:8
(2)设:9.2kg乙醇完全燃烧生成二氧化碳的质量为x。
答:9.2kg乙醇完全燃烧生成二氧化碳的质量为17.6kg。
【解析】(1)
乙醇(C2H5OH)中氢元素和氧元素的质量比=(1×6):16=3:8
(2)
按照根据化学方程式计算步骤进行即可。详见答案。
17.(1)混合物
(2)解:设参与反应的铁的质量为x。
=11.2g
此钢样中铁的质量分数==56%。
答:此钢样中铁的质量分数为56%。
【解析】(1)
钢是铁的合金,合金都是混合物,钢是混合物。
(2)
解:设参与反应的铁的质量为x。
=11.2g
此钢样中铁的质量分数==56%。
答:此钢样中铁的质量分数为56%。
18.(1)加热盛放高锰酸钾的容器质量为48.2g-16.0g=32.2g;
(2)解:反应生成氧气质量为48.2g-46.6g═1.6g
设KMnO4的质量为x
x=15.8g,
答:样品中KMnO4的质量分数为98.75%。
【解析】(1)
见答案。
(2)
高锰酸钾在加热条件下生成锰酸钾和氧气和二氧化锰,氧气逸出,总质量的减少就是生成氧气的质量48.2g-46.6g═1.6g。过程见答案。
19.(1)3
(2)10g石灰石中含碳酸钙的质量为:10g-3g=7g
设生成二氧化碳的质量为x
x=3.08g
答:实验结束时生成二氧化碳的质量是3.08g
(3)
【解析】(1)
石灰石中的杂质不与盐酸反应也不溶于水,当加入盐酸至固体质量不变时,剩余固体即为石灰石中所含的杂质,由图像可知杂质质量为3g。
(2)
见答案
(3)
没有加盐酸时产生二氧化碳质量为0g,由图1可知加入20g稀盐酸时,参加反应碳酸钙的质量为10g-6g=4g,设此时生成二氧化碳的质量为y,则
y=1.76g
即加入20g稀盐酸时,生成二氧化碳1.76g
由(2)可知完全反应时生成二氧化碳的质量为3.08g,
此时消耗稀盐酸质量为
故产生的气体与加入的盐酸质量的关系图为
【点睛】
20.(1)4.4g
(2)解:设大理石样品的纯度为x
答:大理石样品的纯度为83.3%。
【解析】(1)
反应生成二氧化碳气体逸出,总质量的减少就是生成的二氧化碳气体12g+100g-107.6g=4.4g;
(2)
见答案。
21.(1)30%;(2)①1.1g;②36%
【详解】(1)在Fe2O3中,氧元素的质量分数为×100%=30%;
(2)①由图和质量守恒定律可得,生成CO2气体的质量为 21.1g=-20.0g=1.1g;
②设反应后固体混合物中FeO的质量为x,
反应后固体混合物中FeO的质量分数为×100%=36.0%。
22.(1)反应中二氧化锰的作用是加快过氧化氢的分解;(2)1.6g;(3)3.4g
【详解】(1)反应中二氧化锰做催化剂,起催化作用,即加快过氧化氢的分解;
(2)根据质量守恒定律可得,生成的氧气的质量为50.0g﹣48.4g=1.6g
(3)设参加反应的过氧化氢的质量为x,
x=3.4g
故答案为(1)加快过氧化氢的分解。(2)反应生成氧气的质量为 1.6g。(3)参加反应的过氧化氢的质量为3.4g。
23.(1)4.8
(2)解:设参加反应过氧化氢的质量为x。
答:参加反应过氧化氢的质量为10.2g
【分析】(1)
根据质量守恒定律可知,反应前后的减少的质量即为放出氧气的质量,所以生成氧气的质量为:340.0g-335.20g=4.8g。
(2)
见答案。
24.80%;8.8g
【详解】(1)由图可以看出固体减少了20g,即碳酸钙的质量为20g,所以贝壳中碳酸钙的质量分数为×100%=80%。
(2)设恰好反应时产生二氧化碳的质量为x
x=8.8g
答:25g贝壳与稀盐酸恰好完全反应时,生成的二氧化碳质量是8.8g。
故答案为:(1)80%;(2)25g贝壳与稀盐酸恰好完全反应时,生成的二氧化碳质量是8.8g。
25.解法一:
(1)解:根据质量守恒定律,氧化铜中铜元素质量即为被氧化的铜的质量,其质量为:
则铜的氧化率为:
答:铜的氧化率为3.2%。
解法二:
解:设被氧化的铜的质量为。
所以铜的氧化率为:
答:铜的氧化率为3.2%。
(2)乙实验小组实验时装置漏气,导致瓶外空气进入,进入的氧气与铜反应,使实验数值偏大。
【分析】第一题有两种解法,一是根据质量守恒定律,化学反应前后元素质量不变,去求解;另一种方法是根据化学方程式进行计算。
【详解】见详解。
26.(1)据质量守恒定律可知,反应前后物质的总质量不变,该实验中生成的二氧化碳的质量是100g+12g-107.6g=4.4g;
(2)设石灰石样品中碳酸钙的质量为x
100/x=44/4.4g x=10g
石灰石样品中碳酸钙的质量分数:10g÷12g×100%≈83.3%< 85% ,不符合要求。
【详解】(1)据质量守恒定律可知,反应前后物质的总质量不变,该实验中生成的二氧化碳的质量是100g+12g-107.6g=4.4g;
(2)设石灰石样品中碳酸钙的质量为x
CaCO3 + 2HCl == CaCl2 + H2O + CO2↑
100 44
x 4.4g
100/x=44/4.4g x=10g
石灰石样品中碳酸钙的质量分数:10g÷12g×100%≈83.3%< 85% ,不符合要求。
27.(1)4.8
根据质量守恒定律可知,化学反应前后物质质量总和保持不变,则生成氧气的质量为:12.5g-7.7g=4.8g;故填:4.8;
(2)98%
设:氯酸钾的质量为x
氯酸钾的质量分数为:×100%=98%;
答:反应前固体中氯酸钾的质量分数为98%。
【详解】(1)见答案;
(2)见答案。
28.(1)40%
(2)N2
(3)设至少需要四氧化二氮的质量为x,
x=73.6t
答:至少需要四氧化二氮的质量为73.6t。
【详解】(1)碳元素质量分数=;
故答案为:40%。
(2)根据化学方程式可以看出反应前含有2个碳原子,8个氢原子,6个氮原子,8个氧原子,反应后目前有2个碳原子,8个氧原子和8个氢原子,因此还需要有6个氮原子,提出公因数3后,正好组成1个氮气分子,所以R为N2;
故答案为:N2。
(3)见答案。
29.设生成1.92g氧气时参与反应的氯酸钾的质量为x,
解之得:x=4.9g
由于是氯酸钾只是分解了50%,所以原混合物中氯酸钾的质量为:4.9g÷50%=9.8g;
由于反应前的混合物的总质量为12g,所以原混合物中二氧化锰的质量为:12g-9.8g=2.2g.
答:原混合物中氯酸钾有9.8克;二氧化锰有2.2克.
【分析】由于两次称重都是固体的质量,且有差值.而根据质量守恒定律,前后质量一定相等,所以必然过程中生成气体或者液体,由于是氯酸钾和二氧化锰的混合物,所以会生成氧气,所以气体氧气的质量就等于:12g-10.08g=1.92g.
【详解】见答案。
30.解:设理论上得到Na2SiO3质量为x
x=122 t
答:理论上得到Na2SiO3质量122t。
【详解】见答案。
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
