化学人教版(2019)选择性必修1 3.2.2 酸碱中和滴定(共29张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 3.2.2 酸碱中和滴定(共29张ppt) |
|
|
| 格式 | zip | ||
| 文件大小 | 4.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-29 17:04:48 | ||
图片预览





文档简介
(共29张PPT)
§3.2.2 酸碱中和滴定
第三章 水溶液中的离子反应与平衡
[素养发展目标]
1.通过强酸与强碱反应的定量关系进行分析推理,认识酸碱中和滴定的原理,知道溶液pH的变化是判断滴定终点的依据,培养证据推理与模型认知的学科核心素养。
2.掌握酸碱中和滴定的实验操作、数据处理、误差分析及其在定量测定中的迁移应用,培养科学探究与创新意识的学科核心素养。
现有一瓶标签有损的氢氧化钠溶液,我们不知道它的浓度,有没有办法知道它的PH和浓度呢?
答案是肯定的。我们可以通过用已知浓度的盐酸来测定它的浓度,这种方法我们称为酸碱中和滴定,今天我们就学习这种方法。
1.概念和原理
(1)概念:依据__________,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的方法。
(2)原理:在中和反应中,酸提供的H+与碱提供的OH-的物质的量相等,
中和反应
标准液
待测液
H+ + OH- = H2O
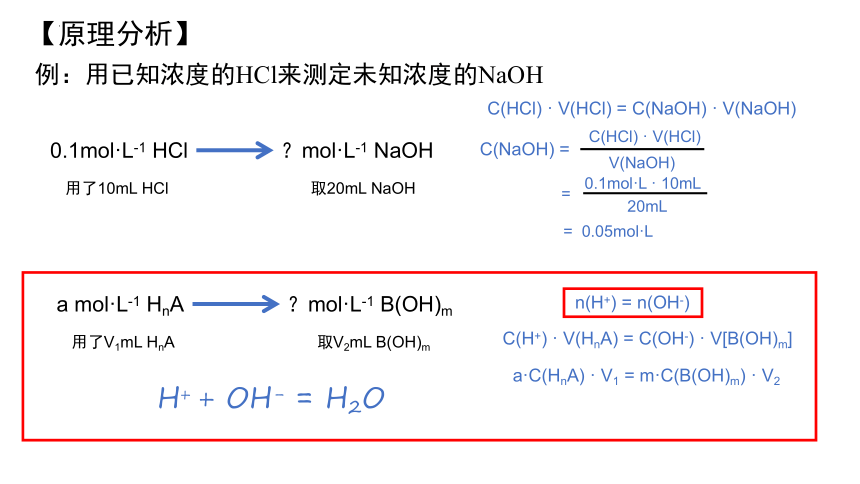
【原理分析】
例:用已知浓度的HCl来测定未知浓度的NaOH
0.1mol·L-1 HCl
?mol·L-1 NaOH
取20mL NaOH
用了10mL HCl
C(HCl) · V(HCl) = C(NaOH) · V(NaOH)
C(NaOH) =
C(HCl) · V(HCl)
V(NaOH)
=
20mL
0.1mol·L · 10mL
= 0.05mol·L
a mol·L-1 HnA
?mol·L-1 B(OH)m
取V2mL B(OH)m
用了V1mL HnA
C(H+) · V(HnA) = C(OH-) · V[B(OH)m]
n(H+) = n(OH-)
H+ + OH- = H2O
a·C(HnA) · V1 = m·C(B(OH)m) · V2
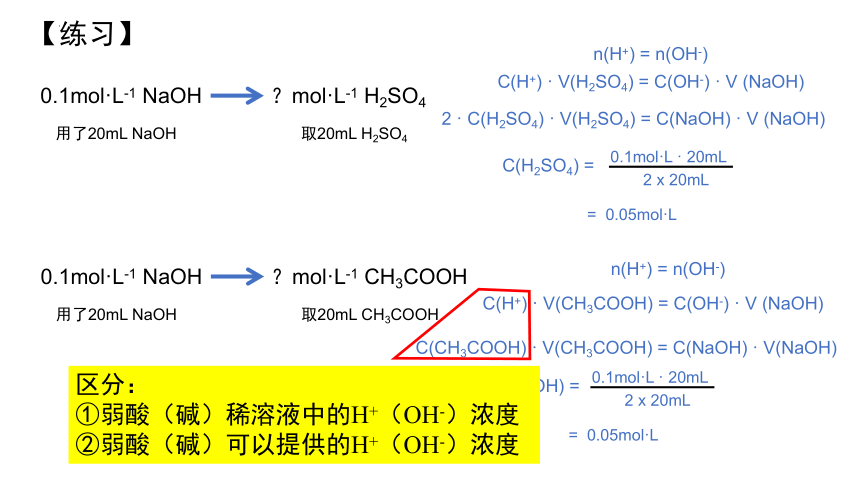
【练习】
0.1mol·L-1 NaOH
?mol·L-1 H2SO4
取20mL H2SO4
用了20mL NaOH
C(H2SO4) =
2 x 20mL
0.1mol·L · 20mL
= 0.05mol·L
C(H+) · V(H2SO4) = C(OH-) · V (NaOH)
n(H+) = n(OH-)
2 · C(H2SO4) · V(H2SO4) = C(NaOH) · V (NaOH)
0.1mol·L-1 NaOH
?mol·L-1 CH3COOH
取20mL CH3COOH
用了20mL NaOH
C(CH3COOH) =
2 x 20mL
0.1mol·L · 20mL
= 0.05mol·L
C(H+) · V(CH3COOH) = C(OH-) · V (NaOH)
n(H+) = n(OH-)
C(CH3COOH) · V(CH3COOH) = C(NaOH) · V(NaOH)
区分:
①弱酸(碱)稀溶液中的H+(OH-)浓度
②弱酸(碱)可以提供的H+(OH-)浓度
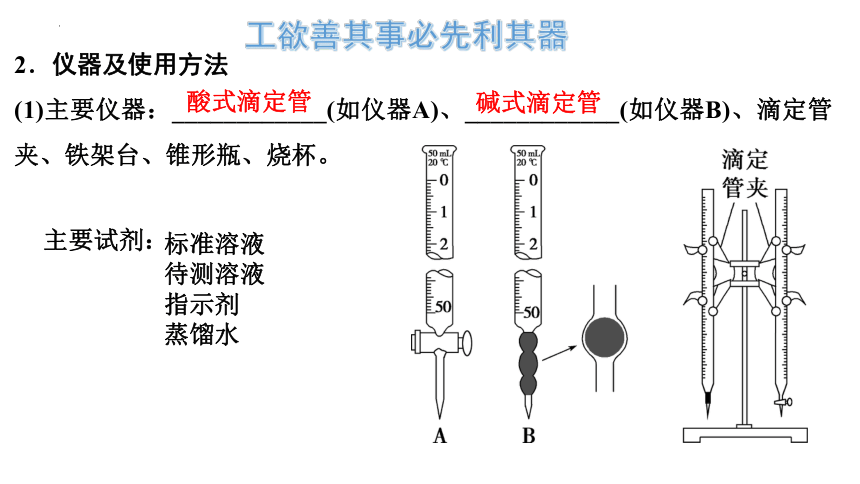
2.仪器及使用方法
(1)主要仪器:____________(如仪器A)、____________(如仪器B)、滴定管夹、铁架台、锥形瓶、烧杯。
酸式滴定管
碱式滴定管
工欲善其事必先利其器
主要试剂:
标准溶液
待测溶液
指示剂
蒸馏水
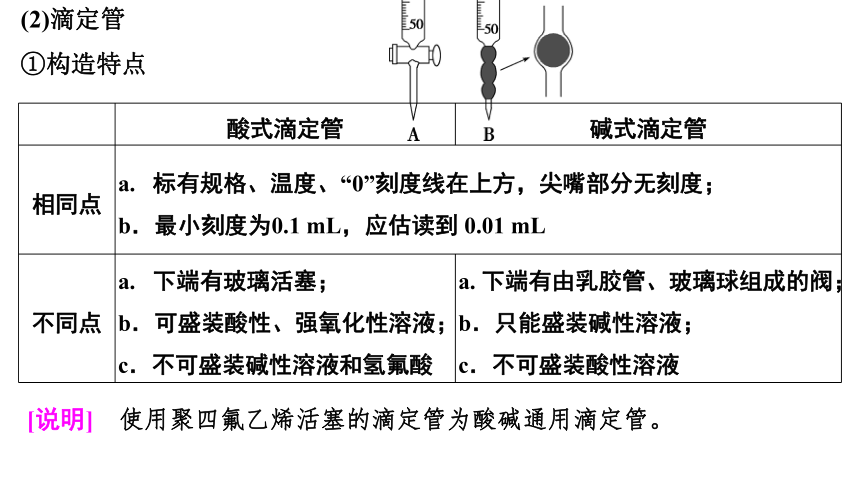
(2)滴定管
①构造特点
酸式滴定管 碱式滴定管
相同点 a. 标有规格、温度、“0”刻度线在上方,尖嘴部分无刻度; b.最小刻度为0.1 mL,应估读到 0.01 mL
不同点 a. 下端有玻璃活塞; b.可盛装酸性、强氧化性溶液; c.不可盛装碱性溶液和氢氟酸 a. 下端有由乳胶管、玻璃球组成的阀;
b.只能盛装碱性溶液;
c.不可盛装酸性溶液
[说明] 使用聚四氟乙烯活塞的滴定管为酸碱通用滴定管。
【例】读出以下液体体积的读数:
7
8
滴定管
10
8
量筒
7.46mL
9.1mL
【练习】
②使用方法
3.酸碱指示剂的变色范围
指示剂 变色范围的pH
甲基橙 <3.1红色 3.1~4.4橙色 >4.4黄色
石蕊 <5红色 5~8紫色 >8蓝色
酚酞 <8.2无色 8.2~10粉红色 >10红色
课本P68
4.实验操作
(1)滴定前的准备
①滴定管:查漏→水洗→润洗→装液→赶气泡→调液面→记录初始读数。(具体操作见滴定管使用方法)
赶气泡方法:如果滴定管内部有气泡,应快速放液以赶出气泡;赶出碱式滴定管乳胶管中气泡的方法如图所示。
②锥形瓶:水洗→装液→加指示剂
③指示剂的选择
指示剂一般不用石蕊,因为其颜色变化不易分辨,
“强酸滴弱碱用甲基橙,强碱滴弱酸用酚酞,强滴强二者皆行”。
要求记住
(2)滴定操作
(3)滴定终点判断
当滴入最后半滴标准液时,__________________________________,即达到滴定终点。读数并记录。
(4)数据处理
为减少实验误差,滴定时,要求重复实验2~3次,计算每次待测液的物质的量浓度,然后取平均值。但要注意某个数值与其他数据相差较大时,应该舍去。
指示剂变色,且半分钟内不恢复原色
5.酸碱中和滴定曲线
(1)以标准液体积为横坐标,以pH为纵坐标,作图(以0.100 0 mol/L NaOH溶液滴定
20.00 mL 0.100 0 mol/L HCl溶液为例):
开始时由于待测液的浓度较大,加入少量的标准液对其pH影响不大。当接近滴定终点时,极少量的标准液就会引起溶液的pH突变。
V(NaOH) 单位:mL 0.00 18.00 19.80 19.96 19.98 20.00 20.02 20.04 20.20 22.00 40.00
pH 1.00 3.28 3.30 4.00 4.30 7.00 9.70 10.00 10.70 11.70 13.00
定量分析
测定物质中元素、离子、官能团等各成分的含量
化学分析法
依特定的化学反应及其计量关系对物质进行分析的方法
仪器分析法
利用特定的仪器对物质进行定量分析的方法
常量分析、微量分析和超微量分析
定性分析
确定物质的成分,包括元素、无机物所含的离子和有机物所含的官能团。
课本P69
1.酸碱恰好完全反应的点与滴定终点是否相同?
提示:不相同。酸碱恰好完全反应指酸与碱按照化学计量数恰好完全反应,酸和碱都不剩余;而滴定终点是指示剂颜色恰好变化的点。酸碱恰好完全反应的点与滴定终点特别接近,在一般科学研究中不会造成大的误差。
2.用标准碘溶液滴定溶有SO2的水溶液,以测定水中SO2的含量,应选取什么溶液作为指示剂?达到滴定终点的现象是什么?
提示:淀粉溶液。当滴入最后半滴标准碘溶液时,溶液由无色变为蓝色,且半分钟内不褪色。
3.用标准酸性KMnO4溶液滴定溶有SO2的水溶液,以测定水中SO2的含量,是否需要选用指示剂?达到滴定终点的现象是什么?
提示:否。当滴入最后半滴标准酸性KMnO4溶液时,溶液由无色变为浅红色,且半分钟内不褪色。
1.一只规格为a mL的滴定管,其尖嘴部分充满溶液,管内液面在m mL处,当液面降到n mL处时,下列判断正确的是( )
A.流出溶液的体积为(m-n)mL
B.流出溶液的体积为(n-m)mL
C.管内溶液体积等于(a-n)mL
D.管内溶液体积大于n mL
√
解析:滴定管刻度值从上到下逐渐增大,流出的液体的体积是(n-m) mL,A错误,B正确;
滴定管的“0”刻度在上端,刻度值从上到下逐渐增大,滴定管尖嘴处有一段空间没有刻度,即a mL滴定管中实际所能盛放液体的体积大于a mL,因此,管内溶液体积大于(a-n) mL,C、D错误。
2.(2022·石家庄高二测试)取20.00 mL 0.50 mol·L-1 NaOH溶液,恰好将未知浓度的H2SO4溶液20.00 mL滴定至终点,下列说法正确的是( )
A.该实验不需要指示剂
B.用量筒量取上述H2SO4溶液
C.H2SO4的浓度为0.50 mol·L-1
D.参加反应的H+和OH-的物质的量相等
√
解析:A.酸碱中和反应无现象,需要指示剂,故错误;
B.量筒的精确度为0.1 mL,应用酸式滴定管量取H2SO4溶液,故错误;
D.酸碱中和滴定中,参加反应的n(H+)=n(OH-),故正确。
3.下列说法正确的是( )
A.用图示仪器Ⅰ准确量取25.00 mL酸性KMnO4溶液
B.装置Ⅱ可用于已知浓度的氢氧化钠溶液测定未知浓度盐酸的实验
C.中和滴定时,滴定管用待装液润洗2~3次
D.中和滴定时,用待测液润洗锥形瓶
√
解析:酸性KMnO4溶液不能用碱式滴定管量取,A项不正确;
NaOH溶液不能盛装在酸式滴定管中,B项不正确;
中和滴定时滴定管需用待装液润洗,而锥形瓶不能用待测液润洗,C项正确,D项不正确。
4. 如图所示是在常温下向20.00 mL的盐酸中逐滴加入0.10 mol·L-1 NaOH溶液时,溶液的pH随NaOH溶液的体积变化的曲线,则下列结论正确的是( )
A.盐酸的初始浓度为0.10 mol·L-1
B.x=2.00
C.溶液pH=12时,V(NaOH溶液)=20.40 mL
D.盐酸的初始浓度为1.00 mol·L-1
√
解析:由题图可知,当V(NaOH溶液)=0 mL时,盐酸的pH=1,因此
c初始(HCl)=0.10 mol·L-1,A项正确,D项错误;
当溶液pH=7时,HCl与NaOH恰好完全反应,此时n(HCl)=n(NaOH),故x=20.00,B项错误;
§3.2.2 酸碱中和滴定
第三章 水溶液中的离子反应与平衡
[素养发展目标]
1.通过强酸与强碱反应的定量关系进行分析推理,认识酸碱中和滴定的原理,知道溶液pH的变化是判断滴定终点的依据,培养证据推理与模型认知的学科核心素养。
2.掌握酸碱中和滴定的实验操作、数据处理、误差分析及其在定量测定中的迁移应用,培养科学探究与创新意识的学科核心素养。
现有一瓶标签有损的氢氧化钠溶液,我们不知道它的浓度,有没有办法知道它的PH和浓度呢?
答案是肯定的。我们可以通过用已知浓度的盐酸来测定它的浓度,这种方法我们称为酸碱中和滴定,今天我们就学习这种方法。
1.概念和原理
(1)概念:依据__________,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的方法。
(2)原理:在中和反应中,酸提供的H+与碱提供的OH-的物质的量相等,
中和反应
标准液
待测液
H+ + OH- = H2O
【原理分析】
例:用已知浓度的HCl来测定未知浓度的NaOH
0.1mol·L-1 HCl
?mol·L-1 NaOH
取20mL NaOH
用了10mL HCl
C(HCl) · V(HCl) = C(NaOH) · V(NaOH)
C(NaOH) =
C(HCl) · V(HCl)
V(NaOH)
=
20mL
0.1mol·L · 10mL
= 0.05mol·L
a mol·L-1 HnA
?mol·L-1 B(OH)m
取V2mL B(OH)m
用了V1mL HnA
C(H+) · V(HnA) = C(OH-) · V[B(OH)m]
n(H+) = n(OH-)
H+ + OH- = H2O
a·C(HnA) · V1 = m·C(B(OH)m) · V2
【练习】
0.1mol·L-1 NaOH
?mol·L-1 H2SO4
取20mL H2SO4
用了20mL NaOH
C(H2SO4) =
2 x 20mL
0.1mol·L · 20mL
= 0.05mol·L
C(H+) · V(H2SO4) = C(OH-) · V (NaOH)
n(H+) = n(OH-)
2 · C(H2SO4) · V(H2SO4) = C(NaOH) · V (NaOH)
0.1mol·L-1 NaOH
?mol·L-1 CH3COOH
取20mL CH3COOH
用了20mL NaOH
C(CH3COOH) =
2 x 20mL
0.1mol·L · 20mL
= 0.05mol·L
C(H+) · V(CH3COOH) = C(OH-) · V (NaOH)
n(H+) = n(OH-)
C(CH3COOH) · V(CH3COOH) = C(NaOH) · V(NaOH)
区分:
①弱酸(碱)稀溶液中的H+(OH-)浓度
②弱酸(碱)可以提供的H+(OH-)浓度
2.仪器及使用方法
(1)主要仪器:____________(如仪器A)、____________(如仪器B)、滴定管夹、铁架台、锥形瓶、烧杯。
酸式滴定管
碱式滴定管
工欲善其事必先利其器
主要试剂:
标准溶液
待测溶液
指示剂
蒸馏水
(2)滴定管
①构造特点
酸式滴定管 碱式滴定管
相同点 a. 标有规格、温度、“0”刻度线在上方,尖嘴部分无刻度; b.最小刻度为0.1 mL,应估读到 0.01 mL
不同点 a. 下端有玻璃活塞; b.可盛装酸性、强氧化性溶液; c.不可盛装碱性溶液和氢氟酸 a. 下端有由乳胶管、玻璃球组成的阀;
b.只能盛装碱性溶液;
c.不可盛装酸性溶液
[说明] 使用聚四氟乙烯活塞的滴定管为酸碱通用滴定管。
【例】读出以下液体体积的读数:
7
8
滴定管
10
8
量筒
7.46mL
9.1mL
【练习】
②使用方法
3.酸碱指示剂的变色范围
指示剂 变色范围的pH
甲基橙 <3.1红色 3.1~4.4橙色 >4.4黄色
石蕊 <5红色 5~8紫色 >8蓝色
酚酞 <8.2无色 8.2~10粉红色 >10红色
课本P68
4.实验操作
(1)滴定前的准备
①滴定管:查漏→水洗→润洗→装液→赶气泡→调液面→记录初始读数。(具体操作见滴定管使用方法)
赶气泡方法:如果滴定管内部有气泡,应快速放液以赶出气泡;赶出碱式滴定管乳胶管中气泡的方法如图所示。
②锥形瓶:水洗→装液→加指示剂
③指示剂的选择
指示剂一般不用石蕊,因为其颜色变化不易分辨,
“强酸滴弱碱用甲基橙,强碱滴弱酸用酚酞,强滴强二者皆行”。
要求记住
(2)滴定操作
(3)滴定终点判断
当滴入最后半滴标准液时,__________________________________,即达到滴定终点。读数并记录。
(4)数据处理
为减少实验误差,滴定时,要求重复实验2~3次,计算每次待测液的物质的量浓度,然后取平均值。但要注意某个数值与其他数据相差较大时,应该舍去。
指示剂变色,且半分钟内不恢复原色
5.酸碱中和滴定曲线
(1)以标准液体积为横坐标,以pH为纵坐标,作图(以0.100 0 mol/L NaOH溶液滴定
20.00 mL 0.100 0 mol/L HCl溶液为例):
开始时由于待测液的浓度较大,加入少量的标准液对其pH影响不大。当接近滴定终点时,极少量的标准液就会引起溶液的pH突变。
V(NaOH) 单位:mL 0.00 18.00 19.80 19.96 19.98 20.00 20.02 20.04 20.20 22.00 40.00
pH 1.00 3.28 3.30 4.00 4.30 7.00 9.70 10.00 10.70 11.70 13.00
定量分析
测定物质中元素、离子、官能团等各成分的含量
化学分析法
依特定的化学反应及其计量关系对物质进行分析的方法
仪器分析法
利用特定的仪器对物质进行定量分析的方法
常量分析、微量分析和超微量分析
定性分析
确定物质的成分,包括元素、无机物所含的离子和有机物所含的官能团。
课本P69
1.酸碱恰好完全反应的点与滴定终点是否相同?
提示:不相同。酸碱恰好完全反应指酸与碱按照化学计量数恰好完全反应,酸和碱都不剩余;而滴定终点是指示剂颜色恰好变化的点。酸碱恰好完全反应的点与滴定终点特别接近,在一般科学研究中不会造成大的误差。
2.用标准碘溶液滴定溶有SO2的水溶液,以测定水中SO2的含量,应选取什么溶液作为指示剂?达到滴定终点的现象是什么?
提示:淀粉溶液。当滴入最后半滴标准碘溶液时,溶液由无色变为蓝色,且半分钟内不褪色。
3.用标准酸性KMnO4溶液滴定溶有SO2的水溶液,以测定水中SO2的含量,是否需要选用指示剂?达到滴定终点的现象是什么?
提示:否。当滴入最后半滴标准酸性KMnO4溶液时,溶液由无色变为浅红色,且半分钟内不褪色。
1.一只规格为a mL的滴定管,其尖嘴部分充满溶液,管内液面在m mL处,当液面降到n mL处时,下列判断正确的是( )
A.流出溶液的体积为(m-n)mL
B.流出溶液的体积为(n-m)mL
C.管内溶液体积等于(a-n)mL
D.管内溶液体积大于n mL
√
解析:滴定管刻度值从上到下逐渐增大,流出的液体的体积是(n-m) mL,A错误,B正确;
滴定管的“0”刻度在上端,刻度值从上到下逐渐增大,滴定管尖嘴处有一段空间没有刻度,即a mL滴定管中实际所能盛放液体的体积大于a mL,因此,管内溶液体积大于(a-n) mL,C、D错误。
2.(2022·石家庄高二测试)取20.00 mL 0.50 mol·L-1 NaOH溶液,恰好将未知浓度的H2SO4溶液20.00 mL滴定至终点,下列说法正确的是( )
A.该实验不需要指示剂
B.用量筒量取上述H2SO4溶液
C.H2SO4的浓度为0.50 mol·L-1
D.参加反应的H+和OH-的物质的量相等
√
解析:A.酸碱中和反应无现象,需要指示剂,故错误;
B.量筒的精确度为0.1 mL,应用酸式滴定管量取H2SO4溶液,故错误;
D.酸碱中和滴定中,参加反应的n(H+)=n(OH-),故正确。
3.下列说法正确的是( )
A.用图示仪器Ⅰ准确量取25.00 mL酸性KMnO4溶液
B.装置Ⅱ可用于已知浓度的氢氧化钠溶液测定未知浓度盐酸的实验
C.中和滴定时,滴定管用待装液润洗2~3次
D.中和滴定时,用待测液润洗锥形瓶
√
解析:酸性KMnO4溶液不能用碱式滴定管量取,A项不正确;
NaOH溶液不能盛装在酸式滴定管中,B项不正确;
中和滴定时滴定管需用待装液润洗,而锥形瓶不能用待测液润洗,C项正确,D项不正确。
4. 如图所示是在常温下向20.00 mL的盐酸中逐滴加入0.10 mol·L-1 NaOH溶液时,溶液的pH随NaOH溶液的体积变化的曲线,则下列结论正确的是( )
A.盐酸的初始浓度为0.10 mol·L-1
B.x=2.00
C.溶液pH=12时,V(NaOH溶液)=20.40 mL
D.盐酸的初始浓度为1.00 mol·L-1
√
解析:由题图可知,当V(NaOH溶液)=0 mL时,盐酸的pH=1,因此
c初始(HCl)=0.10 mol·L-1,A项正确,D项错误;
当溶液pH=7时,HCl与NaOH恰好完全反应,此时n(HCl)=n(NaOH),故x=20.00,B项错误;
