人教版九年级化学下册第八单元《金属的化学性质》第二课时(课件26页)
文档属性
| 名称 | 人教版九年级化学下册第八单元《金属的化学性质》第二课时(课件26页) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-30 11:35:59 | ||
图片预览








文档简介
(共26张PPT)
金属的化学性质
(第二课时)
探究新知
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
1.在金属活动性顺序中,金属的位置越靠前,它的活动性越强。
2.在金属活动性顺序中,位于氢前面的金属能置换出盐酸、稀硫酸中的氢,其他条件相同时,越靠前反应速率越快。
3.在金属活动性顺序中,位于前面的金属能把位于后面的金属从它们化合物的溶液里置换出来。(强置换弱,K、Ca、Na除外)
探究新知
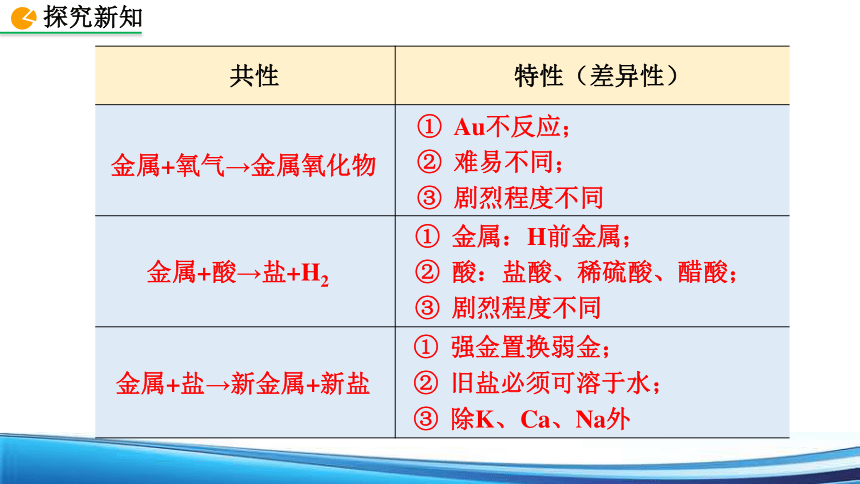
共性 特性(差异性)
Au不反应;
难易不同;
剧烈程度不同
金属+酸→盐+H2
金属+氧气→金属氧化物
金属:H前金属;
酸:盐酸、稀硫酸、醋酸;
剧烈程度不同
金属+盐→新金属+新盐
强金置换弱金;
旧盐必须可溶于水;
除K、Ca、Na外
课后习题
5.判断下列反应能否发生,写出能反应的化学方程式。
(1)Ag与稀盐酸
(2)Zn与CuSO4溶液
(3)Cu和ZnSO4溶液
(4)Al与AgNO3溶液
(5)Cu和AgCl
7.有X、 Y 、Z三种金属,如果把X和Y分别放入稀硫酸中,X溶解并产生氢气,Y不反应;如果把Y和Z分别放入硝酸银溶液中,过一会儿,在Y的表面有银析出,而Z无变化。根据以上事实,判断X、Y、Z的金属活动顺序。
×,在金属活动性顺序中,Ag排在H之后
Zn+ CuSO4 = Cu+ZnSO4
×,在金属活动性顺序中Cu排在Zn之后/Cu的活动性比Zn弱
Al+ 3AgNO3 = 3Ag+Al(NO3)3
×,AgCl不溶于水
X>Y>Z
根据金属活动性判断反应能否发生(T5)
根据反应比较金属活动性(T7)
巩固练习
Fe+酸/盐中,化合物中的铁元素+2价
1.下列物质能否发生反应?说出理由。
(1)锌与稀硫酸
(2)金和硫酸铜溶液 (3)铁和AgCl
(4)铜与硝酸银溶液
(5)铜与稀盐酸
2.废旧手机的某些部件含有Mg、Al、Cu、Ag、Pb、Pt等金属,为了回收贵重金属,把旧手机部件浸入足量的稀硫酸中充分反应、过滤,所得固体中含有的金属是_______________________
3.下列物质中不能由金属单质和盐酸直接反应生成的是( )
A.FeCl3 B.ZnCl2 C.MgCl2 D.FeCl2
根据金属活动性判断反应能否发生(T5)
能,在金属活动性顺序中Zn排在H之前
否,金的活动性比铜弱
否AgCl不溶于水
能,铜的活动性比银强
Cu、Ag、Pt
否,在金属活动性顺序中Cu排在H之后
A
巩固练习
根据反应比较金属活动性(T7)
2.化学兴趣小组在学习了金属的化学性质后,对金属R的活动性进行探究发现:将金属R放入稀盐酸中,观察到有气泡产生(R+2HCl==RCl2+H2↑),将R放入ZnSO4溶液中无任何变化。下列化学方程式书写错误的是( )
A. R + MgSO4 == RSO4 + Mg B. R + CuSO4 == RSO4 + Cu
C. R + H2SO4 == RSO4 + H2↑ D. 2Al+3RSO4 == Al2(SO4)3 + 3R
1.将金属锰(Mn)投入稀盐酸中,有气泡产生。将镁条插入硫酸锰溶液中,如果有锰析出,则Mn、Mg、Cu的金属活动性由强到弱的顺序是____________________
Mg、Mn、Cu
A
探究新知
Q:利用性质2、3,设计实验验证Zn、Fe两种金属的活动性强弱。
设计实验验证金属活动性(2种)
目的 药品 操作 现象 结论
验证Fe、Zn两种金属的活动性
将相同的Zn、Fe分别插入到相同的稀盐酸(或稀硫酸)中。
Zn产生气泡较快;Fe产生气泡较慢,溶液由无色变为浅绿色
活动性:Zn>Fe
控制变量
Zn、氯化亚铁(或硝酸亚铁、硫酸亚铁)溶液
将锌放入氯化亚铁溶液中
锌表面有固体析出,溶液颜色逐渐变浅
Zn、Fe、稀盐酸(或稀硫酸)
活动性:Zn>Fe
Fe、氯化锌(或硝酸锌、硫酸锌)溶液
将铁放入氯化锌溶液中
无明显现象
活动性:Zn>Fe
思路1:金属+酸(能>不能;快>慢)
思路2:金属A+金属B的盐溶液(能反应,A>B;不能反应,A探究新知
Q:利用性质2、3,设计实验验证Fe、Cu、Ag 3种金属的活动性强弱。
设计实验验证金属活动性(3种)
目的 药品 操作 现象 结论
验证Fe、Cu、Ag 3种金属的活动性
将Fe、Ag分别插入氯化铜(或硝酸铜、硫酸铜)溶液中。
Fe表面有红色固体析出,蓝色溶液变浅;Ag中无明显现象。
活动性:
Fe>Cu>Ag
氯化亚铁(或硝酸亚铁、硫酸亚铁)溶液;硝酸银溶液;铜
将铜分别放入氯化亚铁溶液和硝酸银溶液中
氯化亚铁溶液中无明显现象;硝酸银溶液中铜表面有银白色固体析出,溶液由无色变为蓝色
思路1:两金夹一液
思路2:两液夹一金
Fe、Ag、氯化铜(或硝酸铜、硫酸铜)溶液
活动性:
Fe>Cu>Ag
巩固练习
1.验证镁、铜的金属活动性顺序,下列试剂不能选用的是( )
A. MgSO4溶液 B.KCl溶液 C.稀盐酸 D.ZnCl2溶液
2.【2020·乐山】某同学参加实验操作考试,为验证镁、锌、铜三种金属的活动性顺序,他设计了以下四种实验方案,其中能达到目的的是( )
A.将镁片、锌片分别放入Cu(NO3)2溶液中B.将锌片、铜片分别放入Mg(NO3)2溶液中C.将镁片分别放入Zn(NO3)2溶液、Cu(NO3)2溶液中
D.将镁片、锌片、铜片分别放入稀盐酸中
3.某同学为验证铁、铜、银三种金属的活动性顺序,设计了以下四种实验方案,其中能达到目的的是( )
A.将Fe丝、Cu丝分别放入AgNO3溶液中 B.将Fe丝、Cu丝、Ag丝分别放入稀盐酸中C.将Fe丝分别放入CuSO4溶液、AgNO3溶液中
D.将Fe丝、Ag丝分别放入CuSO4溶液中
设计实验验证金属活动性
B
D
D
巩固练习
4.验证Fe、Ag金属的活动性强弱,下列的实际组合实验方案能达到实验目的是( )
A.铁、氯化银 B.铁、硝酸银溶液 C.银、氯化铁
5.验证Zn、Fe、Ag金属的活动性强弱,下列的实际组合实验方案不能达到实验目的是( )
A. FeSO4溶液、Zn、Ag
B. ZnSO4溶液、稀盐酸溶液、Fe、Ag
C. ZnCl2溶液、AgNO3溶液、Fe
D. ZnSO4溶液、FeSO4溶液、Ag
设计实验验证金属活动性
D
B
混合物 除去杂质的化学方程式 主要操作步骤
铜粉(Fe)
FeCl2溶液(CuCl2)
加足量或过量盐酸/稀硫酸/硫酸铜溶液/氯化铜溶液/硝酸铜溶液,过滤,洗涤,干燥
加适量或过量铁粉,过滤
Fe + 2HCl =FeCl2 + H2↑
Fe + CuSO4 = FeSO4 + Cu
Fe + CuCl2= FeCl2 + Cu
Fe + Cu (NO3)2 = Fe (NO3)2 + Cu
Fe + H2SO4=FeSO4 + H2↑
Fe + CuCl2= FeCl2 + Cu
金属活动性顺序在物质除杂中的应用(T6)
除杂原则:主不减、杂不增、易分离。
课后习题
混合物 除去杂质的化学方程式 主要操作步骤
用磁铁吸
铁(铜)
Fe + H2 SO4= FeSO4 + H2↑
Cu (NO3)2溶液(AgNO3)
Cu +2AgNO3=2Ag+ Cu (NO3)2
加足/过量铜,过滤
FeSO4溶液(H2SO4)
加足/过量铁,过滤
金属活动性顺序在物质除杂中的应用(T6)
巩固练习
1.除去下列物质中的少量杂质,所用的方法正确的是( )
C
选项 物质 杂质 试剂或方法
A FeSO4溶液 CuSO4 加入过量的锌粉,过滤
B 铁粉 镁粉 加入足量稀盐酸,过滤
C ZnSO4 FeSO4 加入过量的锌粉,过滤
D 铜粉 炭粉 在空气中灼烧
2. 将铜粉中的铁粉除去的方法有多种,以下方法中不可取的是( )
A.用磁铁来吸引 B.在混合物中滴入足量的稀硫酸,过滤
C.在混合物中滴入足量的硝酸银溶液,过滤
D.在混合物中滴入足量的硫酸铜溶液,过滤
C
金属活动性顺序在物质除杂中的应用(T6)
巩固练均值法
1. 2.3g铁和M的混合物与足量的盐酸反应,生成0.2g氢气,则M可能是( )
A. 镁 B. 铝 C. 碳 D. 钠
2. 某合金由两种金属组成,取30g该合金投入到足量的稀硫酸中,反应完全后,测得生成的氢气的质量为2g,则该合金的组成可能是( )
A. Zn和Fe B. Mg和Al C. Al和Zn D. Fe和Cu
B
C
平均值法
3.(2019安阳二模)2.2 g可能含有Mg、Al、Cu的金属样品,与足量的稀硫酸反应,放出H2的总质量为0.2 g,以下对该样品组成的判断中正确的是( )
A. 一定有铝 B. 一定有镁 C. 一定有铜 D. 一定有镁和铜
A
平均值法
平均值法
平均值法
5.(2018河南备用卷14题1分)某种金属混合物样品由Mg、Al、Fe、Zn四种金属中的两种组成,取5.6 g样品跟足量稀硫酸反应,得到0.2 g氢气,则此合金中一定不含的金属是( )
A. Fe B. Al C. Mg D. Zn
A
6.(2019郑州一检)在某铁的样品中,含有Zn、Mg、Al、Cu等金属杂质中的两种,取56 g样品跟足量稀硫酸反应,得到2 g H2,则此铁的样品中不可能含有的金属杂质是( )
A. Cu和Mg B. Mg和Al C. Zn和Al D. Al和Cu
B
平均值法
4.将镁和金属X的混合物共2.4g加入足量的稀硫酸,充分反应后得到0.22gH2,则金属X可能是( )
A.A1 B.Zn C.Fe D.Cu
A
平均值法
B
难度提升
6.由两种元素组成的某合金6 g与足量的稀硫酸充分反应后,生成0.2 g氢气。现有以下说法:①合金中的元素可能是Fe和Cu;②合金中的元素可能是Zn和Fe;③合金中的元素可能是Zn和Ag;④所得溶液中的溶质可能是硫酸镁和硫酸;⑤所得溶液中的溶质可能是硫酸铝和硫酸;⑥所得溶液中的溶质可能是硫酸镁、硫酸铝和硫酸,其中合理的个数为( )
A. 3个 B. 4个 C. 5个 D. 6个
极值法
1.(2018河南14题1分)有Mg、Al、Zn的混合物共7.2 g,与足量盐酸反应,生成H2的质量可能是( )
A. 0.2 g B. 0.6 g C. 0.8 g D. 0.9 g
B
2.(2019开封一模)将一定量的镁粉、铝粉、锌粉的混合物与足量的稀硫酸完全反应,生成0.4 g氢气,则金属混合物的质量不可能是( )
A. 4.8 g B. 5.4 g C. 9.2 g D. 13.0 g
D
极值法
3.现有Fe2O3、CuO的混合粉末共 8 g,高温下与足量的CO充分反应,得到固体的质量可能为 ( )
A.6 g B.5.6 g C.6.4 g D.8 g
A
极值法
2.金属A和B的相对原子质量之比为8:9,等质量的A和B分别与足量稀盐酸反应,生成氢气质量之比为3:4,则两种金属的化合价之比为________
2:3
产氢公式
1.(2020滨州)现有质量相等的甲、乙、丙三种金属,分别放入三份溶质质量分数相同的足量稀硫酸中,生成氢气的质量与反应时间的关系如图所示(已知甲、乙、丙在生成物中均显+2价)。相对原子质量由大到小:___________
丙>乙>甲
Q1:什么是滤渣、滤液?
滤渣:金属单质
滤液:盐(溶质)、水
Q2:成分分析的一般思路:
(1)判断能否反应,写出方程式。
(2)用量不同,反应程度不同,成分不同。
例1:将一定量的铁加入硫酸铜溶液中。
Fe+CuSO4=== FeSO4+Cu
滤渣
滤液
m(Fe)
Cu
CuSO4
FeSO4
Cu
FeSO4
Cu、Fe
FeSO4
金属+盐:滤渣滤液问题
例2:将一定量的锌加入硝酸银、硝酸铜、硝酸铝的混合溶液中。
①Zn+ 2AgNO3=Zn(NO3)2+2Ag
②Zn+Cu(NO3)2 = Zn (NO3)2 +Cu
滤渣
滤液
m(Zn)
Ag
Al (NO3)3
Zn (NO3)2
Cu(NO3)2
AgNO3
Ag
Al (NO3)3
Zn (NO3)2
Cu(NO3)2
Ag、Cu
Al (NO3)3
Zn (NO3)2
Cu(NO3)2
Ag、Cu
Al (NO3)3
Zn (NO3)2
Ag、Cu、Zn
Al (NO3)3
Zn (NO3)2
活动性最弱的金属一定存在于滤渣中;
活动性最强的金属盐一定存在与滤液中。
远优先
金属+盐:滤渣滤液问题
线索 滤渣成分 滤液中的溶质成分
滤渣+盐酸,有气泡
滤渣+盐酸,无气泡
滤液呈蓝色
滤液呈无色
滤液+盐酸,有沉淀
滤液+盐酸,无沉淀
过量的锌
溶液质量相等
一定有:Cu、Ag
可能有:Zn
一定有:Zn(NO3)2
可能有: Cu(NO3)2
一定有:Zn、Cu、Ag
一定有:Zn(NO3)2
一定有:Ag
可能有:Cu
一定有:Zn(NO3)2
可能有:Cu(NO3)2 、 AgNO3
一定有:Ag
可能有:Cu
一定有:Zn(NO3)2、 Cu(NO3)2
可能有:AgNO3
一定有:Cu、Ag
可能有:Zn
一定有:Zn(NO3)2
一定有:Ag
一定有:Zn(NO3)2、 Cu(NO3)2 、 AgNO3
一定有:Ag
可能有:Zn、Cu
一定有:Zn(NO3)2
可能有:Cu(NO3)2
一定有:Zn、Cu、Ag
一定有:Zn(NO3)2
Q3:所得溶液的质量与加入锌粉的质量关系图。
Q4:一些语言描述题。
AB:Zn+ 2AgNO3=Zn(NO3)2+2Ag
BC:Zn+Cu(NO3)2 = Zn (NO3)2 +Cu
C—:Zn过量
金属+盐:滤渣滤液问题
(1)Zn+ 2AgNO3=Zn(NO3)2+2Ag会导致溶液质量变小的原因:
会导致固体质量变大的原因:
(2)反应后所得溶液的质量与反应前溶液的质量相比,可能保持不变的原因。
(3)反应后所得溶液的质量与反应前溶液的质量相比,可能增大的原因。
(4)反应后所得固体的质量与反应前固体的质量相比,可能保持不变的原因。
(5)小明猜想滤液中溶质为AgNO3、 Zn(NO3)2,请分析该猜想不合理的原因。
(1)Zn+ 2AgNO3=Zn(NO3)2+2Ag会导致溶液质量变小的原因:
会导致固体质量变大的原因:
参加反应的AgNO3的质量大于生成的Zn(NO3)2的质量
参加反应的Zn的质量大于生成的Ag的质量
(2)反应后所得溶液的质量与反应前溶液的质量相比,可能保持不变的原因。
(3)反应后所得溶液的质量与反应前溶液的质量相比,可能增大的原因。
(4)反应后所得固体的质量与反应前固体的质量相比,可能保持不变的原因。
(5)小明猜想滤液中溶质为AgNO3、 Zn(NO3)2,请分析该猜想不合理的原因。
Zn与AgNO3溶液反应,溶液质量减小;Zn与Cu(NO3)2溶液反应,溶液质量增大;当增大量等于减小量时,溶液质量不变。
Zn与AgNO3溶液反应,溶液质量减小;Zn与Cu(NO3)2溶液反应,溶液质量增大;当增大量大于减小量时,溶液质量增大。
Zn与AgNO3溶液反应,固体质量增大;Zn与Cu(NO3)2溶液反应,固体质量减小;当增大量等于减小量时,固体质量不变。
滤液中有AgNO3 时,一定也有Cu(NO3)2,因为Zn先与AgNO3反应,后与Cu(NO3)2反应。
巩固练习
5.金属和盐溶液:溶液质量变化
1.将锌粉加入到一定质量Cu(NO3)2和AgNO3的混合溶液中,充分反应后滤,可以得到溶液和固体。
(1)会导致溶液质量变小的反应:_________________________;溶液质量变小的原因:
(2)会导致固体质量变大的反应:_________________________;固体质量变大的原因:
参加反应的AgNO3的质量大于生成的Zn(NO3)2的质量
Zn+ 2AgNO3=Zn(NO3)2+2Ag
Zn+ 2AgNO3=Zn(NO3)2+2Ag
参加反应的Zn的质量大于生成的Ag的质量
巩固练习
5.金属和盐溶液:溶液质量变化
(3)反应后所得溶液的质量与反应前溶液的质量相比,可能保持不变,为什么?
(4)反应后所得溶液的质量与反应前溶液的质量相比,可能增大,为什么?
(5)反应后所得固体的质量与反应前固体的质量相比,可能保持不变,为什么?
Zn与AgNO3溶液反应,溶液质量减小;Zn与Cu(NO3)2溶液反应,溶液质量增大;当增大量等于减小量时,溶液质量不变。
Zn与AgNO3溶液反应,溶液质量减小;Zn与Cu(NO3)2溶液反应,溶液质量增大;当增大量大于减小量时,溶液质量增大。
Zn与AgNO3溶液反应,固体质量增大;Zn与Cu(NO3)2溶液反应,固体质量减小;当增大量等于减小量时,固体质量不变。
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
兼职招聘:
https://www.21cnjy.com/recruitment/home/admin
金属的化学性质
(第二课时)
探究新知
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
1.在金属活动性顺序中,金属的位置越靠前,它的活动性越强。
2.在金属活动性顺序中,位于氢前面的金属能置换出盐酸、稀硫酸中的氢,其他条件相同时,越靠前反应速率越快。
3.在金属活动性顺序中,位于前面的金属能把位于后面的金属从它们化合物的溶液里置换出来。(强置换弱,K、Ca、Na除外)
探究新知
共性 特性(差异性)
Au不反应;
难易不同;
剧烈程度不同
金属+酸→盐+H2
金属+氧气→金属氧化物
金属:H前金属;
酸:盐酸、稀硫酸、醋酸;
剧烈程度不同
金属+盐→新金属+新盐
强金置换弱金;
旧盐必须可溶于水;
除K、Ca、Na外
课后习题
5.判断下列反应能否发生,写出能反应的化学方程式。
(1)Ag与稀盐酸
(2)Zn与CuSO4溶液
(3)Cu和ZnSO4溶液
(4)Al与AgNO3溶液
(5)Cu和AgCl
7.有X、 Y 、Z三种金属,如果把X和Y分别放入稀硫酸中,X溶解并产生氢气,Y不反应;如果把Y和Z分别放入硝酸银溶液中,过一会儿,在Y的表面有银析出,而Z无变化。根据以上事实,判断X、Y、Z的金属活动顺序。
×,在金属活动性顺序中,Ag排在H之后
Zn+ CuSO4 = Cu+ZnSO4
×,在金属活动性顺序中Cu排在Zn之后/Cu的活动性比Zn弱
Al+ 3AgNO3 = 3Ag+Al(NO3)3
×,AgCl不溶于水
X>Y>Z
根据金属活动性判断反应能否发生(T5)
根据反应比较金属活动性(T7)
巩固练习
Fe+酸/盐中,化合物中的铁元素+2价
1.下列物质能否发生反应?说出理由。
(1)锌与稀硫酸
(2)金和硫酸铜溶液 (3)铁和AgCl
(4)铜与硝酸银溶液
(5)铜与稀盐酸
2.废旧手机的某些部件含有Mg、Al、Cu、Ag、Pb、Pt等金属,为了回收贵重金属,把旧手机部件浸入足量的稀硫酸中充分反应、过滤,所得固体中含有的金属是_______________________
3.下列物质中不能由金属单质和盐酸直接反应生成的是( )
A.FeCl3 B.ZnCl2 C.MgCl2 D.FeCl2
根据金属活动性判断反应能否发生(T5)
能,在金属活动性顺序中Zn排在H之前
否,金的活动性比铜弱
否AgCl不溶于水
能,铜的活动性比银强
Cu、Ag、Pt
否,在金属活动性顺序中Cu排在H之后
A
巩固练习
根据反应比较金属活动性(T7)
2.化学兴趣小组在学习了金属的化学性质后,对金属R的活动性进行探究发现:将金属R放入稀盐酸中,观察到有气泡产生(R+2HCl==RCl2+H2↑),将R放入ZnSO4溶液中无任何变化。下列化学方程式书写错误的是( )
A. R + MgSO4 == RSO4 + Mg B. R + CuSO4 == RSO4 + Cu
C. R + H2SO4 == RSO4 + H2↑ D. 2Al+3RSO4 == Al2(SO4)3 + 3R
1.将金属锰(Mn)投入稀盐酸中,有气泡产生。将镁条插入硫酸锰溶液中,如果有锰析出,则Mn、Mg、Cu的金属活动性由强到弱的顺序是____________________
Mg、Mn、Cu
A
探究新知
Q:利用性质2、3,设计实验验证Zn、Fe两种金属的活动性强弱。
设计实验验证金属活动性(2种)
目的 药品 操作 现象 结论
验证Fe、Zn两种金属的活动性
将相同的Zn、Fe分别插入到相同的稀盐酸(或稀硫酸)中。
Zn产生气泡较快;Fe产生气泡较慢,溶液由无色变为浅绿色
活动性:Zn>Fe
控制变量
Zn、氯化亚铁(或硝酸亚铁、硫酸亚铁)溶液
将锌放入氯化亚铁溶液中
锌表面有固体析出,溶液颜色逐渐变浅
Zn、Fe、稀盐酸(或稀硫酸)
活动性:Zn>Fe
Fe、氯化锌(或硝酸锌、硫酸锌)溶液
将铁放入氯化锌溶液中
无明显现象
活动性:Zn>Fe
思路1:金属+酸(能>不能;快>慢)
思路2:金属A+金属B的盐溶液(能反应,A>B;不能反应,A
Q:利用性质2、3,设计实验验证Fe、Cu、Ag 3种金属的活动性强弱。
设计实验验证金属活动性(3种)
目的 药品 操作 现象 结论
验证Fe、Cu、Ag 3种金属的活动性
将Fe、Ag分别插入氯化铜(或硝酸铜、硫酸铜)溶液中。
Fe表面有红色固体析出,蓝色溶液变浅;Ag中无明显现象。
活动性:
Fe>Cu>Ag
氯化亚铁(或硝酸亚铁、硫酸亚铁)溶液;硝酸银溶液;铜
将铜分别放入氯化亚铁溶液和硝酸银溶液中
氯化亚铁溶液中无明显现象;硝酸银溶液中铜表面有银白色固体析出,溶液由无色变为蓝色
思路1:两金夹一液
思路2:两液夹一金
Fe、Ag、氯化铜(或硝酸铜、硫酸铜)溶液
活动性:
Fe>Cu>Ag
巩固练习
1.验证镁、铜的金属活动性顺序,下列试剂不能选用的是( )
A. MgSO4溶液 B.KCl溶液 C.稀盐酸 D.ZnCl2溶液
2.【2020·乐山】某同学参加实验操作考试,为验证镁、锌、铜三种金属的活动性顺序,他设计了以下四种实验方案,其中能达到目的的是( )
A.将镁片、锌片分别放入Cu(NO3)2溶液中B.将锌片、铜片分别放入Mg(NO3)2溶液中C.将镁片分别放入Zn(NO3)2溶液、Cu(NO3)2溶液中
D.将镁片、锌片、铜片分别放入稀盐酸中
3.某同学为验证铁、铜、银三种金属的活动性顺序,设计了以下四种实验方案,其中能达到目的的是( )
A.将Fe丝、Cu丝分别放入AgNO3溶液中 B.将Fe丝、Cu丝、Ag丝分别放入稀盐酸中C.将Fe丝分别放入CuSO4溶液、AgNO3溶液中
D.将Fe丝、Ag丝分别放入CuSO4溶液中
设计实验验证金属活动性
B
D
D
巩固练习
4.验证Fe、Ag金属的活动性强弱,下列的实际组合实验方案能达到实验目的是( )
A.铁、氯化银 B.铁、硝酸银溶液 C.银、氯化铁
5.验证Zn、Fe、Ag金属的活动性强弱,下列的实际组合实验方案不能达到实验目的是( )
A. FeSO4溶液、Zn、Ag
B. ZnSO4溶液、稀盐酸溶液、Fe、Ag
C. ZnCl2溶液、AgNO3溶液、Fe
D. ZnSO4溶液、FeSO4溶液、Ag
设计实验验证金属活动性
D
B
混合物 除去杂质的化学方程式 主要操作步骤
铜粉(Fe)
FeCl2溶液(CuCl2)
加足量或过量盐酸/稀硫酸/硫酸铜溶液/氯化铜溶液/硝酸铜溶液,过滤,洗涤,干燥
加适量或过量铁粉,过滤
Fe + 2HCl =FeCl2 + H2↑
Fe + CuSO4 = FeSO4 + Cu
Fe + CuCl2= FeCl2 + Cu
Fe + Cu (NO3)2 = Fe (NO3)2 + Cu
Fe + H2SO4=FeSO4 + H2↑
Fe + CuCl2= FeCl2 + Cu
金属活动性顺序在物质除杂中的应用(T6)
除杂原则:主不减、杂不增、易分离。
课后习题
混合物 除去杂质的化学方程式 主要操作步骤
用磁铁吸
铁(铜)
Fe + H2 SO4= FeSO4 + H2↑
Cu (NO3)2溶液(AgNO3)
Cu +2AgNO3=2Ag+ Cu (NO3)2
加足/过量铜,过滤
FeSO4溶液(H2SO4)
加足/过量铁,过滤
金属活动性顺序在物质除杂中的应用(T6)
巩固练习
1.除去下列物质中的少量杂质,所用的方法正确的是( )
C
选项 物质 杂质 试剂或方法
A FeSO4溶液 CuSO4 加入过量的锌粉,过滤
B 铁粉 镁粉 加入足量稀盐酸,过滤
C ZnSO4 FeSO4 加入过量的锌粉,过滤
D 铜粉 炭粉 在空气中灼烧
2. 将铜粉中的铁粉除去的方法有多种,以下方法中不可取的是( )
A.用磁铁来吸引 B.在混合物中滴入足量的稀硫酸,过滤
C.在混合物中滴入足量的硝酸银溶液,过滤
D.在混合物中滴入足量的硫酸铜溶液,过滤
C
金属活动性顺序在物质除杂中的应用(T6)
巩固练均值法
1. 2.3g铁和M的混合物与足量的盐酸反应,生成0.2g氢气,则M可能是( )
A. 镁 B. 铝 C. 碳 D. 钠
2. 某合金由两种金属组成,取30g该合金投入到足量的稀硫酸中,反应完全后,测得生成的氢气的质量为2g,则该合金的组成可能是( )
A. Zn和Fe B. Mg和Al C. Al和Zn D. Fe和Cu
B
C
平均值法
3.(2019安阳二模)2.2 g可能含有Mg、Al、Cu的金属样品,与足量的稀硫酸反应,放出H2的总质量为0.2 g,以下对该样品组成的判断中正确的是( )
A. 一定有铝 B. 一定有镁 C. 一定有铜 D. 一定有镁和铜
A
平均值法
平均值法
平均值法
5.(2018河南备用卷14题1分)某种金属混合物样品由Mg、Al、Fe、Zn四种金属中的两种组成,取5.6 g样品跟足量稀硫酸反应,得到0.2 g氢气,则此合金中一定不含的金属是( )
A. Fe B. Al C. Mg D. Zn
A
6.(2019郑州一检)在某铁的样品中,含有Zn、Mg、Al、Cu等金属杂质中的两种,取56 g样品跟足量稀硫酸反应,得到2 g H2,则此铁的样品中不可能含有的金属杂质是( )
A. Cu和Mg B. Mg和Al C. Zn和Al D. Al和Cu
B
平均值法
4.将镁和金属X的混合物共2.4g加入足量的稀硫酸,充分反应后得到0.22gH2,则金属X可能是( )
A.A1 B.Zn C.Fe D.Cu
A
平均值法
B
难度提升
6.由两种元素组成的某合金6 g与足量的稀硫酸充分反应后,生成0.2 g氢气。现有以下说法:①合金中的元素可能是Fe和Cu;②合金中的元素可能是Zn和Fe;③合金中的元素可能是Zn和Ag;④所得溶液中的溶质可能是硫酸镁和硫酸;⑤所得溶液中的溶质可能是硫酸铝和硫酸;⑥所得溶液中的溶质可能是硫酸镁、硫酸铝和硫酸,其中合理的个数为( )
A. 3个 B. 4个 C. 5个 D. 6个
极值法
1.(2018河南14题1分)有Mg、Al、Zn的混合物共7.2 g,与足量盐酸反应,生成H2的质量可能是( )
A. 0.2 g B. 0.6 g C. 0.8 g D. 0.9 g
B
2.(2019开封一模)将一定量的镁粉、铝粉、锌粉的混合物与足量的稀硫酸完全反应,生成0.4 g氢气,则金属混合物的质量不可能是( )
A. 4.8 g B. 5.4 g C. 9.2 g D. 13.0 g
D
极值法
3.现有Fe2O3、CuO的混合粉末共 8 g,高温下与足量的CO充分反应,得到固体的质量可能为 ( )
A.6 g B.5.6 g C.6.4 g D.8 g
A
极值法
2.金属A和B的相对原子质量之比为8:9,等质量的A和B分别与足量稀盐酸反应,生成氢气质量之比为3:4,则两种金属的化合价之比为________
2:3
产氢公式
1.(2020滨州)现有质量相等的甲、乙、丙三种金属,分别放入三份溶质质量分数相同的足量稀硫酸中,生成氢气的质量与反应时间的关系如图所示(已知甲、乙、丙在生成物中均显+2价)。相对原子质量由大到小:___________
丙>乙>甲
Q1:什么是滤渣、滤液?
滤渣:金属单质
滤液:盐(溶质)、水
Q2:成分分析的一般思路:
(1)判断能否反应,写出方程式。
(2)用量不同,反应程度不同,成分不同。
例1:将一定量的铁加入硫酸铜溶液中。
Fe+CuSO4=== FeSO4+Cu
滤渣
滤液
m(Fe)
Cu
CuSO4
FeSO4
Cu
FeSO4
Cu、Fe
FeSO4
金属+盐:滤渣滤液问题
例2:将一定量的锌加入硝酸银、硝酸铜、硝酸铝的混合溶液中。
①Zn+ 2AgNO3=Zn(NO3)2+2Ag
②Zn+Cu(NO3)2 = Zn (NO3)2 +Cu
滤渣
滤液
m(Zn)
Ag
Al (NO3)3
Zn (NO3)2
Cu(NO3)2
AgNO3
Ag
Al (NO3)3
Zn (NO3)2
Cu(NO3)2
Ag、Cu
Al (NO3)3
Zn (NO3)2
Cu(NO3)2
Ag、Cu
Al (NO3)3
Zn (NO3)2
Ag、Cu、Zn
Al (NO3)3
Zn (NO3)2
活动性最弱的金属一定存在于滤渣中;
活动性最强的金属盐一定存在与滤液中。
远优先
金属+盐:滤渣滤液问题
线索 滤渣成分 滤液中的溶质成分
滤渣+盐酸,有气泡
滤渣+盐酸,无气泡
滤液呈蓝色
滤液呈无色
滤液+盐酸,有沉淀
滤液+盐酸,无沉淀
过量的锌
溶液质量相等
一定有:Cu、Ag
可能有:Zn
一定有:Zn(NO3)2
可能有: Cu(NO3)2
一定有:Zn、Cu、Ag
一定有:Zn(NO3)2
一定有:Ag
可能有:Cu
一定有:Zn(NO3)2
可能有:Cu(NO3)2 、 AgNO3
一定有:Ag
可能有:Cu
一定有:Zn(NO3)2、 Cu(NO3)2
可能有:AgNO3
一定有:Cu、Ag
可能有:Zn
一定有:Zn(NO3)2
一定有:Ag
一定有:Zn(NO3)2、 Cu(NO3)2 、 AgNO3
一定有:Ag
可能有:Zn、Cu
一定有:Zn(NO3)2
可能有:Cu(NO3)2
一定有:Zn、Cu、Ag
一定有:Zn(NO3)2
Q3:所得溶液的质量与加入锌粉的质量关系图。
Q4:一些语言描述题。
AB:Zn+ 2AgNO3=Zn(NO3)2+2Ag
BC:Zn+Cu(NO3)2 = Zn (NO3)2 +Cu
C—:Zn过量
金属+盐:滤渣滤液问题
(1)Zn+ 2AgNO3=Zn(NO3)2+2Ag会导致溶液质量变小的原因:
会导致固体质量变大的原因:
(2)反应后所得溶液的质量与反应前溶液的质量相比,可能保持不变的原因。
(3)反应后所得溶液的质量与反应前溶液的质量相比,可能增大的原因。
(4)反应后所得固体的质量与反应前固体的质量相比,可能保持不变的原因。
(5)小明猜想滤液中溶质为AgNO3、 Zn(NO3)2,请分析该猜想不合理的原因。
(1)Zn+ 2AgNO3=Zn(NO3)2+2Ag会导致溶液质量变小的原因:
会导致固体质量变大的原因:
参加反应的AgNO3的质量大于生成的Zn(NO3)2的质量
参加反应的Zn的质量大于生成的Ag的质量
(2)反应后所得溶液的质量与反应前溶液的质量相比,可能保持不变的原因。
(3)反应后所得溶液的质量与反应前溶液的质量相比,可能增大的原因。
(4)反应后所得固体的质量与反应前固体的质量相比,可能保持不变的原因。
(5)小明猜想滤液中溶质为AgNO3、 Zn(NO3)2,请分析该猜想不合理的原因。
Zn与AgNO3溶液反应,溶液质量减小;Zn与Cu(NO3)2溶液反应,溶液质量增大;当增大量等于减小量时,溶液质量不变。
Zn与AgNO3溶液反应,溶液质量减小;Zn与Cu(NO3)2溶液反应,溶液质量增大;当增大量大于减小量时,溶液质量增大。
Zn与AgNO3溶液反应,固体质量增大;Zn与Cu(NO3)2溶液反应,固体质量减小;当增大量等于减小量时,固体质量不变。
滤液中有AgNO3 时,一定也有Cu(NO3)2,因为Zn先与AgNO3反应,后与Cu(NO3)2反应。
巩固练习
5.金属和盐溶液:溶液质量变化
1.将锌粉加入到一定质量Cu(NO3)2和AgNO3的混合溶液中,充分反应后滤,可以得到溶液和固体。
(1)会导致溶液质量变小的反应:_________________________;溶液质量变小的原因:
(2)会导致固体质量变大的反应:_________________________;固体质量变大的原因:
参加反应的AgNO3的质量大于生成的Zn(NO3)2的质量
Zn+ 2AgNO3=Zn(NO3)2+2Ag
Zn+ 2AgNO3=Zn(NO3)2+2Ag
参加反应的Zn的质量大于生成的Ag的质量
巩固练习
5.金属和盐溶液:溶液质量变化
(3)反应后所得溶液的质量与反应前溶液的质量相比,可能保持不变,为什么?
(4)反应后所得溶液的质量与反应前溶液的质量相比,可能增大,为什么?
(5)反应后所得固体的质量与反应前固体的质量相比,可能保持不变,为什么?
Zn与AgNO3溶液反应,溶液质量减小;Zn与Cu(NO3)2溶液反应,溶液质量增大;当增大量等于减小量时,溶液质量不变。
Zn与AgNO3溶液反应,溶液质量减小;Zn与Cu(NO3)2溶液反应,溶液质量增大;当增大量大于减小量时,溶液质量增大。
Zn与AgNO3溶液反应,固体质量增大;Zn与Cu(NO3)2溶液反应,固体质量减小;当增大量等于减小量时,固体质量不变。
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
兼职招聘:
https://www.21cnjy.com/recruitment/home/admin
同课章节目录
