人教版九年级化学下册第八单元《金属资源的利用和保护》(课件27页)
文档属性
| 名称 | 人教版九年级化学下册第八单元《金属资源的利用和保护》(课件27页) |  | |
| 格式 | pptx | ||
| 文件大小 | 14.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-30 15:11:24 | ||
图片预览






文档简介
(共27张PPT)
课题3 金属资源的利用和保护
学习目标
了解金属元素在自然界中的存在位置、存在形式
认识实验室炼铁和工业炼铁(反应原理、实验步骤、实验现象、注意事项等)的相同点和不同点。
有关化学反应中杂质问题的计算。
实验:铁制品锈蚀的条件(对比实验、控制变量法)
掌握金属锈蚀的条件以及防止金属锈蚀的方法。
知道废旧金属对环境的污染,认识保护金属资源的重要性。
问题索引
阅读课本P14-19,回答下列问题:
金属元素在自然界中的存在位置、存在形式(单质or化合物)?【P14】
赤铁矿、磁铁矿的主要成分?【P15】
实验室炼铁的原理、装置、注意事项?【P16】
工业炼铁的原料、原理、装置、产物?【P16】
铁锈的主要成分?【P18】
实验:铁生锈的条件;防止铁锈蚀的方法?【P18】
怎样保护金属资源?(4条)【P19】
1.金属元素在自然界中的存在
自然界中以单质形式存在的金
自然界中以单质形式存在的银
地球上的金属资源广泛地存在于地壳和浩瀚的海洋中,除少数很不活泼的金属如金、银等有单质形式存在外,其余都以化合物形式存在。
探究新知
赤铁矿(主要成分是Fe2O3 )
菱铁矿(主要成分是FeCO3 )
黄铁矿/硫铁矿(主要成分是FeS2 )
磁铁矿(主要成分是Fe3O4)
红棕色
黑色
铁矿石
二硫化亚铁
1.金属元素在自然界中的存在
探究新知
碳酸亚铁
铝土矿(主要成分Al2O3)
黄铜矿(主要成分是CuFeS2)
铝矿石和铜矿石
二硫化亚铁铜
辉铜矿(主要成分是Cu2S)
硫化亚铜
孔雀石[主要成分是Cu2(OH)2 CO3]
1.金属元素在自然界中的存在
探究新知
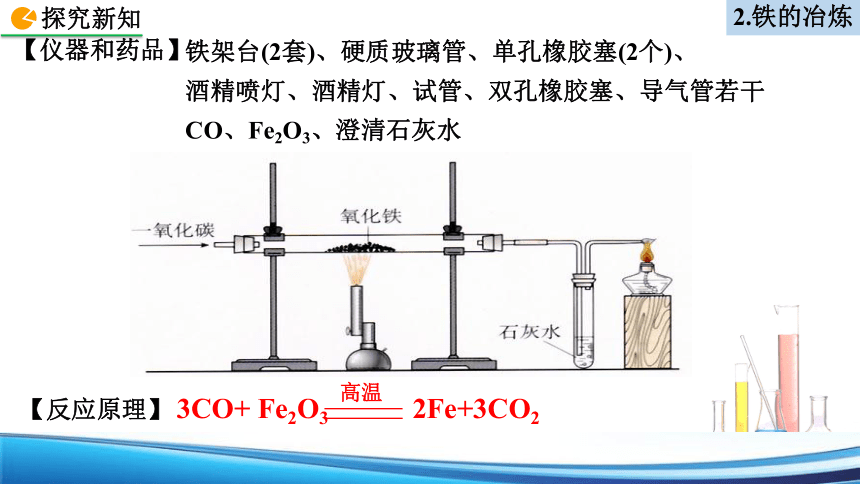
铁架台(2套)、硬质玻璃管、单孔橡胶塞(2个)、
酒精喷灯、酒精灯、试管、双孔橡胶塞、导气管若干
CO、Fe2O3、澄清石灰水
【仪器和药品】
2.铁的冶炼
【反应原理】
3CO+ Fe2O3 2Fe+3CO2
高温
探究新知
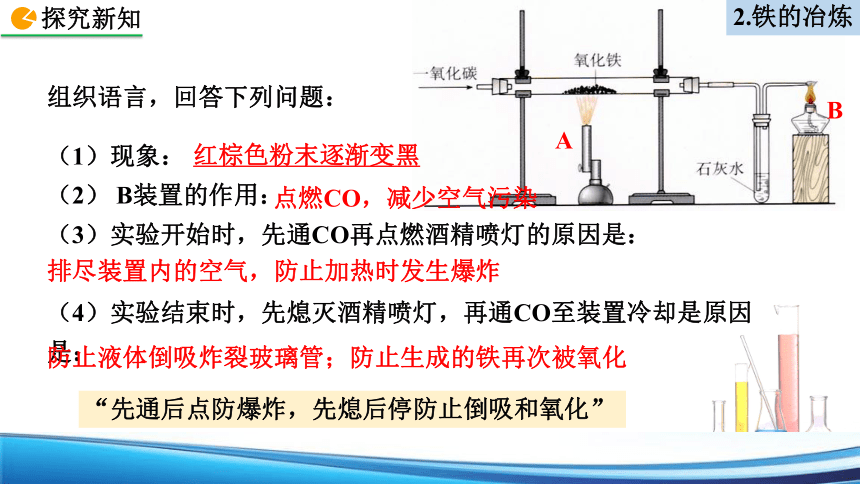
(1)现象:
(2) B装置的作用:
(3)实验开始时,先通CO再点燃酒精喷灯的原因是:
(4)实验结束时,先熄灭酒精喷灯,再通CO至装置冷却是原因是:
A
B
组织语言,回答下列问题:
探究新知
红棕色粉末逐渐变黑
点燃CO,减少空气污染
排尽装置内的空气,防止加热时发生爆炸
防止液体倒吸炸裂玻璃管;防止生成的铁再次被氧化
“先通后点防爆炸,先熄后停防止倒吸和氧化”
2.铁的冶炼
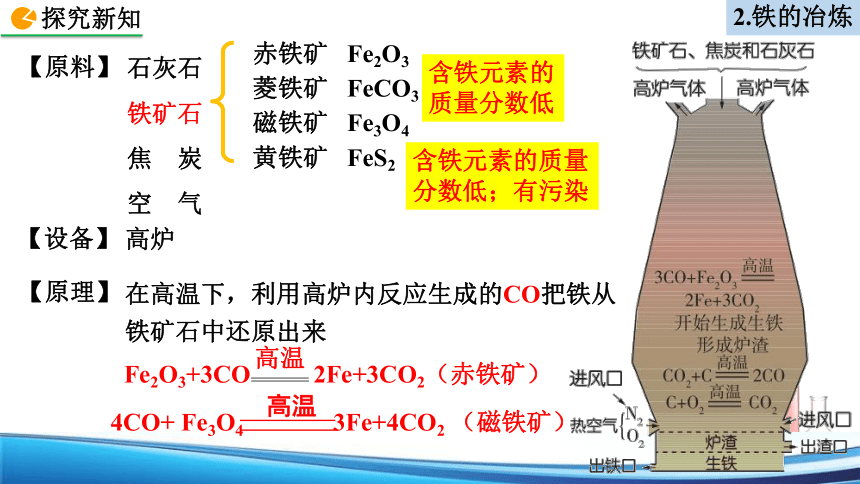
【原料】
【设备】
高炉
在高温下,利用高炉内反应生成的CO把铁从铁矿石中还原出来
【原理】
黄铁矿 FeS2
赤铁矿 Fe2O3
菱铁矿 FeCO3
磁铁矿 Fe3O4
石灰石
铁矿石
焦 炭
空 气
含铁元素的质量分数低
含铁元素的质量分数低;有污染
Fe2O3+3CO 2Fe+3CO2(赤铁矿)
高温
4CO+ Fe3O4 3Fe+4CO2 (磁铁矿)
高温
探究新知
2.铁的冶炼
Q1:焦炭的作用?
Q2:石灰石的作用?
生铁(含碳量2%~4.3%的铁合金,不是纯铁
提供热量;提供还原剂
将矿石中的二氧化硅转变为炉渣
Q3:最终产品是?
探究新知
2.铁的冶炼
上海宝山钢铁公司炼铁高炉
百炼成钢
炼铁的主要原料是铁矿石,产品是生铁,炼钢的主要原料是生铁,产品是钢。
将生铁炼成钢主要是将过量的
碳转化为气体除去。
C+O2 CO2
点燃
探究新知
2.铁的冶炼
拓展:常见金属的冶炼方法
1.电解法:较活泼金属(如钠、钾、镁、铝等)
2.热还原法:将金属化合物与焦炭、CO发生反应,还原成金属单质。如铁、铜、锡、铅等的冶炼
3.热分解法:极少数金属的化合物不稳定,加热就可以分解成金属单质,如银、汞的化合物。
2Al2O3 4Al+3O2↑
通电
3CO+ Fe2O3 2Fe+3CO2
高温
CO+ CuO Cu+CO2
△
2HgO 2Hg+O2↑
△
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
探究新知
例:用1000 t含氧化铁80%的赤铁矿石,理论上可以炼出含铁96%的生铁多少
设理论上可以炼出铁的质量为x
3CO +Fe2O3 2 Fe +3CO2
160 2×56
800t x
160 800t
2×56 x
x=
560 t
560 t 96%=583t。
1000t×80%=800t
答:可以炼出生铁583t。
解:1000t赤铁矿石中含氧化铁的质量为:
(1)若已知物不纯,需先算得其中纯物质的质量:
纯物质质量=不纯物质质量╳纯物质质量分数=不纯物质质量╳(1-杂质质量分数)
然后用纯物质质量带入化学方程式
(2)若待求物不纯,需先根据化学方程式算出待求物中所含纯物质质量,再由纯物质质量算得待求物(不纯物)
探究新知
如何防止铁锅生锈呢?
探究新知
3.金属的腐蚀与防护
【生活经验】
铁制品在干燥的空气中不易生锈,而在潮湿的空气中容易生锈。
铁生锈与氧气、水的存在有关。
【提出猜想】
【设计对比实验】
实验1:铁+氧气+水
探究新知
【提出问题】
铁生锈需要什么条件?
实验2:铁+水
实验3:铁+氧气
经煮沸迅速冷却的蒸馏水:除去水中溶解的氧气
植物油:隔绝空气
干燥剂氯化钙:吸收水分
常用干燥剂:浓硫酸、生石灰、无水氯化钙
探究:铁制品锈蚀的条件
3.金属的腐蚀与防护
【实验现象】
铁钉生锈,水面处锈蚀严重
【实验结论】
铁生锈的条件是铁与水、氧气同时接触,缺一不可。
铁锈的主要成分是Fe2O3 · xH2O
探究新知
实验1:铁+氧气+水
实验2:铁+水
实验3:铁+氧气
铁钉没有生锈
铁钉没有生锈
铁生锈是铁与空气中的_________共同作用的结果,属于_______变化,铁锈是_____色固体,质地_____,主要成分是______________。
红棕
疏松
Fe2O3 · xH2O
化学
氧气、水
3.金属的腐蚀与防护
探究新知
3.金属的腐蚀与防护
稀H2SO4中
食盐水中
铁钉沾了酸液:铁钉严重锈蚀
铁钉浸没一半的在食盐水中:浸没在食盐水中的铁钉几乎全部生锈
酸和氯化钠能使铁在水、氧气同时存的环境中加速锈蚀
探究新知
Q:为什么铁比铝更容易生锈?
铝与氧气反应生成致密的氧化铝薄膜,能覆盖铝的表面,从而保护里层的铝不再与氧气反应;而铁与空气中的水和氧气反应生成的铁锈很疏松,不能阻碍里层的铁继续与氧气、水等反应,因此铁制品可以全部锈蚀。
3.金属的腐蚀与防护
如何防止铁锅生锈呢?
学以致用
保持干燥
涂油
(换用不锈钢锅)
3.金属的腐蚀与防护
防止铁制品锈蚀的方法
1. 保持铁制品表面干燥和洁净
2. 形成保护层(刷漆、涂油、电镀)
3. 制成合金如不锈钢
防止铁制品锈蚀的原理
破坏铁制品锈蚀的条件,使铁制品隔绝空气、水(破坏一个即可)
探究新知
喷油漆
镀铬
涂油膜
镀铜
不锈钢
3.金属的腐蚀与防护
探究新知
除锈的方法
1. 物理方法:砂纸打磨
2. 化学方法:铁锈能与稀盐酸、稀硫酸反应生成可溶性物质
3.金属的腐蚀与防护
金属资源储量有限,而且不能再生
1.保护金属资源的必要性
2.保护金属资源的有效途径
(1)防止金属锈蚀
(2)回收利用废旧金属
(3)有计划、合理地开采矿物,严禁乱开矿
(4)寻找金属的代用品
4.金属资源的保护
探究新知
铜与氧气、水蒸气、二氧化碳接触。
2Cu + O2 + CO2 + H2O = Cu2(OH)2 CO3
铜锈的主要成分是碱式碳酸铜【Cu2(OH)2 CO3】从元素守恒的角度猜想铜制品锈蚀的条件。并设计实验证明。
拓展提高
AE
1. 下列关于高炉炼铁的说法正确的有( )
A.高炉中焦炭的作用是产生一氧化碳和供热;
B.高炉炼铁原料只有铁矿石、焦炭和石灰石;
C.工业炼铁主要利用焦炭的还原性夺取铁的氧化物中的氧元素;
D.高炉炼铁的产物为纯净物;
E.高炉中石灰石的作用是除去矿石中的二氧化硅。
巩固练习
2. 工业炼铁的转化过程如下,分别写出反应①②③的化学方程式:
①__________________________②_________________________
③__________________________
BD
巩固练习
【中考重庆】“对比法”是实验探究中常用的一种科学方法。
分析以下铁钉生锈实验的设计:
对比______可得出铁生锈一定要有氧气参与;
对比______可得出铁生锈一定要有水参与;
对比①②③可得__________________________________;
2.【2019·泰安】如图是某化学兴趣小组设计的观察铁制品锈蚀的实验装置。下列相关叙述中正确的是( )
A.一段时间后,铁丝会由下向上出现锈蚀现象
B.一段时间后,水面处铁丝锈蚀严重
C.一段时间后,塑料瓶会膨胀,因为铁生锈要放热
D.一段时间后,塑料瓶会变瘪,因为铁生锈与空气有关
①③
①②
铁生锈要有水和氧气同时存在
BD
巩固练习
1. 【2019·泰安】如图是某化学兴趣小组设计的观察铁制品锈蚀的实验装置。下列相关叙述中正确的是( )
A.一段时间后,铁丝会由下向上出现锈蚀现象
B.一段时间后,水面处铁丝锈蚀严重
C.一段时间后,塑料瓶会膨胀,因为铁生锈要放热
D.一段时间后,塑料瓶会变瘪,因为铁生锈与空气有关
3. 如图所示是探究铁锈蚀条件的装置。调节L端与R端的液面高度一致,塞紧橡胶塞,一周后观察。下列推断错误的是( )
A.b管中铁钉不会锈蚀
B.L端与R端液面高度仍然保持一致
C.该实验说明铁锈蚀与空气、水有关
D.若将a管中的水改为食盐水能加快铁的锈蚀
B
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
兼职招聘:
https://www.21cnjy.com/recruitment/home/admin
课题3 金属资源的利用和保护
学习目标
了解金属元素在自然界中的存在位置、存在形式
认识实验室炼铁和工业炼铁(反应原理、实验步骤、实验现象、注意事项等)的相同点和不同点。
有关化学反应中杂质问题的计算。
实验:铁制品锈蚀的条件(对比实验、控制变量法)
掌握金属锈蚀的条件以及防止金属锈蚀的方法。
知道废旧金属对环境的污染,认识保护金属资源的重要性。
问题索引
阅读课本P14-19,回答下列问题:
金属元素在自然界中的存在位置、存在形式(单质or化合物)?【P14】
赤铁矿、磁铁矿的主要成分?【P15】
实验室炼铁的原理、装置、注意事项?【P16】
工业炼铁的原料、原理、装置、产物?【P16】
铁锈的主要成分?【P18】
实验:铁生锈的条件;防止铁锈蚀的方法?【P18】
怎样保护金属资源?(4条)【P19】
1.金属元素在自然界中的存在
自然界中以单质形式存在的金
自然界中以单质形式存在的银
地球上的金属资源广泛地存在于地壳和浩瀚的海洋中,除少数很不活泼的金属如金、银等有单质形式存在外,其余都以化合物形式存在。
探究新知
赤铁矿(主要成分是Fe2O3 )
菱铁矿(主要成分是FeCO3 )
黄铁矿/硫铁矿(主要成分是FeS2 )
磁铁矿(主要成分是Fe3O4)
红棕色
黑色
铁矿石
二硫化亚铁
1.金属元素在自然界中的存在
探究新知
碳酸亚铁
铝土矿(主要成分Al2O3)
黄铜矿(主要成分是CuFeS2)
铝矿石和铜矿石
二硫化亚铁铜
辉铜矿(主要成分是Cu2S)
硫化亚铜
孔雀石[主要成分是Cu2(OH)2 CO3]
1.金属元素在自然界中的存在
探究新知
铁架台(2套)、硬质玻璃管、单孔橡胶塞(2个)、
酒精喷灯、酒精灯、试管、双孔橡胶塞、导气管若干
CO、Fe2O3、澄清石灰水
【仪器和药品】
2.铁的冶炼
【反应原理】
3CO+ Fe2O3 2Fe+3CO2
高温
探究新知
(1)现象:
(2) B装置的作用:
(3)实验开始时,先通CO再点燃酒精喷灯的原因是:
(4)实验结束时,先熄灭酒精喷灯,再通CO至装置冷却是原因是:
A
B
组织语言,回答下列问题:
探究新知
红棕色粉末逐渐变黑
点燃CO,减少空气污染
排尽装置内的空气,防止加热时发生爆炸
防止液体倒吸炸裂玻璃管;防止生成的铁再次被氧化
“先通后点防爆炸,先熄后停防止倒吸和氧化”
2.铁的冶炼
【原料】
【设备】
高炉
在高温下,利用高炉内反应生成的CO把铁从铁矿石中还原出来
【原理】
黄铁矿 FeS2
赤铁矿 Fe2O3
菱铁矿 FeCO3
磁铁矿 Fe3O4
石灰石
铁矿石
焦 炭
空 气
含铁元素的质量分数低
含铁元素的质量分数低;有污染
Fe2O3+3CO 2Fe+3CO2(赤铁矿)
高温
4CO+ Fe3O4 3Fe+4CO2 (磁铁矿)
高温
探究新知
2.铁的冶炼
Q1:焦炭的作用?
Q2:石灰石的作用?
生铁(含碳量2%~4.3%的铁合金,不是纯铁
提供热量;提供还原剂
将矿石中的二氧化硅转变为炉渣
Q3:最终产品是?
探究新知
2.铁的冶炼
上海宝山钢铁公司炼铁高炉
百炼成钢
炼铁的主要原料是铁矿石,产品是生铁,炼钢的主要原料是生铁,产品是钢。
将生铁炼成钢主要是将过量的
碳转化为气体除去。
C+O2 CO2
点燃
探究新知
2.铁的冶炼
拓展:常见金属的冶炼方法
1.电解法:较活泼金属(如钠、钾、镁、铝等)
2.热还原法:将金属化合物与焦炭、CO发生反应,还原成金属单质。如铁、铜、锡、铅等的冶炼
3.热分解法:极少数金属的化合物不稳定,加热就可以分解成金属单质,如银、汞的化合物。
2Al2O3 4Al+3O2↑
通电
3CO+ Fe2O3 2Fe+3CO2
高温
CO+ CuO Cu+CO2
△
2HgO 2Hg+O2↑
△
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
探究新知
例:用1000 t含氧化铁80%的赤铁矿石,理论上可以炼出含铁96%的生铁多少
设理论上可以炼出铁的质量为x
3CO +Fe2O3 2 Fe +3CO2
160 2×56
800t x
160 800t
2×56 x
x=
560 t
560 t 96%=583t。
1000t×80%=800t
答:可以炼出生铁583t。
解:1000t赤铁矿石中含氧化铁的质量为:
(1)若已知物不纯,需先算得其中纯物质的质量:
纯物质质量=不纯物质质量╳纯物质质量分数=不纯物质质量╳(1-杂质质量分数)
然后用纯物质质量带入化学方程式
(2)若待求物不纯,需先根据化学方程式算出待求物中所含纯物质质量,再由纯物质质量算得待求物(不纯物)
探究新知
如何防止铁锅生锈呢?
探究新知
3.金属的腐蚀与防护
【生活经验】
铁制品在干燥的空气中不易生锈,而在潮湿的空气中容易生锈。
铁生锈与氧气、水的存在有关。
【提出猜想】
【设计对比实验】
实验1:铁+氧气+水
探究新知
【提出问题】
铁生锈需要什么条件?
实验2:铁+水
实验3:铁+氧气
经煮沸迅速冷却的蒸馏水:除去水中溶解的氧气
植物油:隔绝空气
干燥剂氯化钙:吸收水分
常用干燥剂:浓硫酸、生石灰、无水氯化钙
探究:铁制品锈蚀的条件
3.金属的腐蚀与防护
【实验现象】
铁钉生锈,水面处锈蚀严重
【实验结论】
铁生锈的条件是铁与水、氧气同时接触,缺一不可。
铁锈的主要成分是Fe2O3 · xH2O
探究新知
实验1:铁+氧气+水
实验2:铁+水
实验3:铁+氧气
铁钉没有生锈
铁钉没有生锈
铁生锈是铁与空气中的_________共同作用的结果,属于_______变化,铁锈是_____色固体,质地_____,主要成分是______________。
红棕
疏松
Fe2O3 · xH2O
化学
氧气、水
3.金属的腐蚀与防护
探究新知
3.金属的腐蚀与防护
稀H2SO4中
食盐水中
铁钉沾了酸液:铁钉严重锈蚀
铁钉浸没一半的在食盐水中:浸没在食盐水中的铁钉几乎全部生锈
酸和氯化钠能使铁在水、氧气同时存的环境中加速锈蚀
探究新知
Q:为什么铁比铝更容易生锈?
铝与氧气反应生成致密的氧化铝薄膜,能覆盖铝的表面,从而保护里层的铝不再与氧气反应;而铁与空气中的水和氧气反应生成的铁锈很疏松,不能阻碍里层的铁继续与氧气、水等反应,因此铁制品可以全部锈蚀。
3.金属的腐蚀与防护
如何防止铁锅生锈呢?
学以致用
保持干燥
涂油
(换用不锈钢锅)
3.金属的腐蚀与防护
防止铁制品锈蚀的方法
1. 保持铁制品表面干燥和洁净
2. 形成保护层(刷漆、涂油、电镀)
3. 制成合金如不锈钢
防止铁制品锈蚀的原理
破坏铁制品锈蚀的条件,使铁制品隔绝空气、水(破坏一个即可)
探究新知
喷油漆
镀铬
涂油膜
镀铜
不锈钢
3.金属的腐蚀与防护
探究新知
除锈的方法
1. 物理方法:砂纸打磨
2. 化学方法:铁锈能与稀盐酸、稀硫酸反应生成可溶性物质
3.金属的腐蚀与防护
金属资源储量有限,而且不能再生
1.保护金属资源的必要性
2.保护金属资源的有效途径
(1)防止金属锈蚀
(2)回收利用废旧金属
(3)有计划、合理地开采矿物,严禁乱开矿
(4)寻找金属的代用品
4.金属资源的保护
探究新知
铜与氧气、水蒸气、二氧化碳接触。
2Cu + O2 + CO2 + H2O = Cu2(OH)2 CO3
铜锈的主要成分是碱式碳酸铜【Cu2(OH)2 CO3】从元素守恒的角度猜想铜制品锈蚀的条件。并设计实验证明。
拓展提高
AE
1. 下列关于高炉炼铁的说法正确的有( )
A.高炉中焦炭的作用是产生一氧化碳和供热;
B.高炉炼铁原料只有铁矿石、焦炭和石灰石;
C.工业炼铁主要利用焦炭的还原性夺取铁的氧化物中的氧元素;
D.高炉炼铁的产物为纯净物;
E.高炉中石灰石的作用是除去矿石中的二氧化硅。
巩固练习
2. 工业炼铁的转化过程如下,分别写出反应①②③的化学方程式:
①__________________________②_________________________
③__________________________
BD
巩固练习
【中考重庆】“对比法”是实验探究中常用的一种科学方法。
分析以下铁钉生锈实验的设计:
对比______可得出铁生锈一定要有氧气参与;
对比______可得出铁生锈一定要有水参与;
对比①②③可得__________________________________;
2.【2019·泰安】如图是某化学兴趣小组设计的观察铁制品锈蚀的实验装置。下列相关叙述中正确的是( )
A.一段时间后,铁丝会由下向上出现锈蚀现象
B.一段时间后,水面处铁丝锈蚀严重
C.一段时间后,塑料瓶会膨胀,因为铁生锈要放热
D.一段时间后,塑料瓶会变瘪,因为铁生锈与空气有关
①③
①②
铁生锈要有水和氧气同时存在
BD
巩固练习
1. 【2019·泰安】如图是某化学兴趣小组设计的观察铁制品锈蚀的实验装置。下列相关叙述中正确的是( )
A.一段时间后,铁丝会由下向上出现锈蚀现象
B.一段时间后,水面处铁丝锈蚀严重
C.一段时间后,塑料瓶会膨胀,因为铁生锈要放热
D.一段时间后,塑料瓶会变瘪,因为铁生锈与空气有关
3. 如图所示是探究铁锈蚀条件的装置。调节L端与R端的液面高度一致,塞紧橡胶塞,一周后观察。下列推断错误的是( )
A.b管中铁钉不会锈蚀
B.L端与R端液面高度仍然保持一致
C.该实验说明铁锈蚀与空气、水有关
D.若将a管中的水改为食盐水能加快铁的锈蚀
B
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
兼职招聘:
https://www.21cnjy.com/recruitment/home/admin
同课章节目录
