化学人教版2019必修第一册4.3.1 离子键(共16张ppt)
文档属性
| 名称 | 化学人教版2019必修第一册4.3.1 离子键(共16张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-30 09:09:43 | ||
图片预览




文档简介
(共16张PPT)
第四章
物质结构 元素周期律
思维课堂
第三节 化学键
课时 1 离子键
学习目标
1.结合典型实例认识理解离子键的形成过程和形成条件;
2. 知道离子键、离子化合物的概念;
3. 能用电子式表示离子化合物的形成过程。
1. 加热至100℃时,水会沸腾变成水蒸气。这一变化过程中,外界提供的能量的作用是什么?
2. 加热至2200℃以上时,水会分解。在这一过程中,外界提供的能量的作用是什么?
3. 为什么使水分解需要加热到2200℃以上,而使水沸腾只需要加热到100℃?
水分子之间存在相互作用,加热提供能量用来破坏水分子之间的作用力。
水分子内H和O之间也存在相互作用,加热提供能量用来破坏这种作用力使水分解。
水分子内H和O之间的作用力,远远大于水分子之间的作用力。
这种作用力称为化学键。
思考讨论
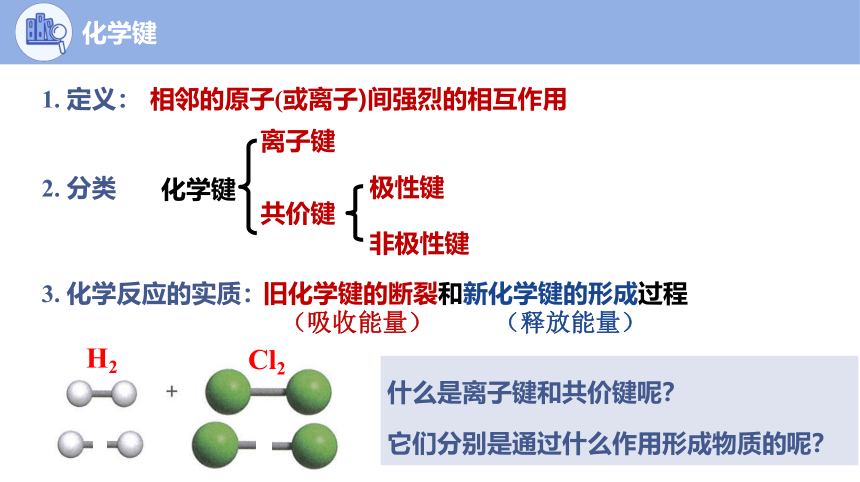
1. 定义:
化学键
2. 分类
离子键
共价键
非极性键
极性键
相邻的原子(或离子)间强烈的相互作用
3. 化学反应的实质:
旧化学键的断裂和新化学键的形成过程
(吸收能量) (释放能量)
化学键
H2
Cl2
HCl
HCl
什么是离子键和共价键呢?
它们分别是通过什么作用形成物质的呢?
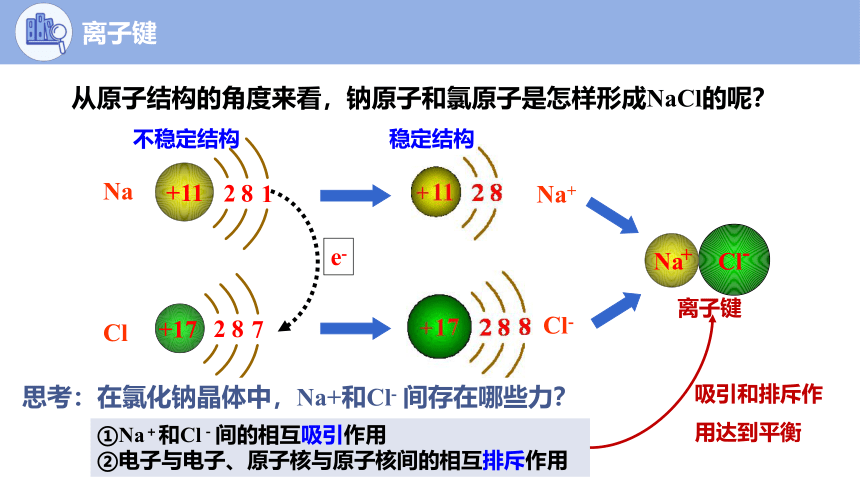
从原子结构的角度来看,钠原子和氯原子是怎样形成NaCl的呢?
e-
Na
Cl
Na+
Cl-
不稳定结构
稳定结构
思考:在氯化钠晶体中,Na+和Cl- 间存在哪些力?
①Na+和Cl-间的相互吸引作用
②电子与电子、原子核与原子核间的相互排斥作用
吸引和排斥作用达到平衡
离子键
离子键
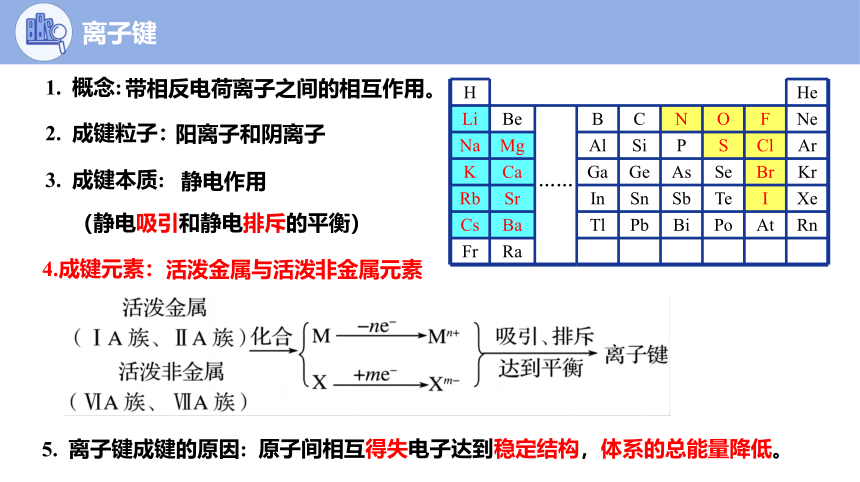
1. 概念:
带相反电荷离子之间的相互作用。
2. 成键粒子:
阳离子和阴离子
3. 成键本质:
静电作用
5. 离子键成键的原因:
4.成键元素:
活泼金属与活泼非金属元素
(静电吸引和静电排斥的平衡)
H He
Li Be …… B C N O F Ne
Na Mg Al Si P S Cl Ar
K Ca Ga Ge As Se Br Kr
Rb Sr In Sn Sb Te I Xe
Cs Ba Tl Pb Bi Po At Rn
Fr Ra
原子间相互得失电子达到稳定结构,体系的总能量降低。
离子键
1. 定义:由离子键构成的化合物叫做离子化合物。
2. 常见的离子化合物:
离子化合物
①活泼金属阳离子和活泼非金属阴离子形成的化合物
③活泼金属阳离子和酸根离子形成的盐
④铵根离子和酸根离子(或活泼非金属阴离子)形成的盐
如:NaCl、MgCl2、Na2O、MgO
如: Na2CO3 MgSO4
如: NH4Cl NH4NO3
如:NaOH、Mg(OH)2
②大多数碱
含有离子键的化合物一定是离子化合物。
离子化合物中一定含有离子键。
【思考1】含有离子键的化合物一定是离子化合物吗?
【思考2】离子化合物中一定含有离子键吗?
【思考3】含有金属元素的化合物一定是离子化合物吗?
不一定。如AlCl3中含有金属元素,但不属于离子化合物。
【思考4】离子化合物一定含有金属元素吗?
不一定。如NH4Cl不含金属元素,但属于离子化合物。
离子化合物
1. 下列说法正确的是( )
A. 离子键就是使阴、阳离子结合成化合物的静电引力
B. 所有金属元素原子与所有非金属元素原子之间都能形成离子键
C. 在化合物CaCl2中,两个氯离子之间也存在离子键
D. 含有离子键的化合物一定是离子化合物
D
2. 下列物质中属于离子化合物的是 ( )
A.硝酸 B.氨气 C.氯化铵 D.氯化氢
3. 下列物质中,含有离子键的是( )
A.HCl B.H2O2 C.K2O D.H2SO4
C
C
如何证明离子化合物中离子键的存在?
通过熔融状态下的物质导电性实验
思考讨论
NaCl溶解
克服离子键
什么情况下离子键会被破坏?
NaCl固体为什么不导电?
离子键
1. 定义:在元素符号周围用“ ”或“×”来表示原子的最外层 电子的式子。
2. 电子式的书写
(1)原子
书写原子的电子式时,一般将原子的最外层电子写在元素符号的上、下、左、右四个位置上。
原子电子式
H
Na
O
Cl
Mg
(2)简单阳离子
复杂阳离子
Na+
Mg 2+
Al 3+
[ ]
H
H
H
N
H
+
直接用阳离子符号
(3)简单阴离子
复杂阴离子
[ ]
一般用 表示
R
n-
[ ]
Cl
-
[ ]
O
2-
[ ]
O
H
-
[ ]
O
2-
O
离子电子式
1. 写出下列微粒的电子式:
硫原子、 溴原子、 硫离子、溴离子、铝离子
·S·
··
··
Br ·
··
··
··
[ S ]2-
··
··
:
:
[ Br ]-
··
··
:
:
Al3+
2. 下列电子式有误的是 (双选)( )
A.氯原子 B.硫离子
C.碘离子 D.钙离子Ca2+
BC
Cl
S
[ ]
I
2-
AB型
AB2型
A2B型
[ ]
Cl
Na
[ ]
O
2
Na
Na
[ ]
Cl
Mg
2
[ ]
Cl
写出MgO电子式
写出Na2S电子式
写出BaCl2电子式
注意:相同离子不合并(尽量对称), 同性电荷不相邻
离子化合物电子式
电子式表示离子化合物的形成过程
AB型
AB2型
A2B型
Na
Cl
+
[ ]
Cl
Na
[ ]
O
2
Na
Na
Na
O
+
Na
+
Mg
Cl
Cl
+
+
[ ]
Cl
Mg
2
[ ]
Cl
书写要点:
①左侧写原子的电子式
④右侧写离子化合物的电子式
③中间用 连接
②用弧形箭头表示电子转移的方向
1. 下列用电子式表示化合物的形成过程正确的是( )
K
O
K
O
]
[
K
2
K
A、
[
]
Ba
[
]
Cl
[
]
Cl
2
Ba
Cl
Cl
B、
]
Mg
F
F
Mg
F
2
[
2
C、
Cl
]
[
H
Cl
H
D、
A
Ba
[
]
Cl
[
]
Cl
2
]
Mg
F
2
[
]
F
[
Cl
H
×
×
×
√
第四章
物质结构 元素周期律
思维课堂
第三节 化学键
课时 1 离子键
学习目标
1.结合典型实例认识理解离子键的形成过程和形成条件;
2. 知道离子键、离子化合物的概念;
3. 能用电子式表示离子化合物的形成过程。
1. 加热至100℃时,水会沸腾变成水蒸气。这一变化过程中,外界提供的能量的作用是什么?
2. 加热至2200℃以上时,水会分解。在这一过程中,外界提供的能量的作用是什么?
3. 为什么使水分解需要加热到2200℃以上,而使水沸腾只需要加热到100℃?
水分子之间存在相互作用,加热提供能量用来破坏水分子之间的作用力。
水分子内H和O之间也存在相互作用,加热提供能量用来破坏这种作用力使水分解。
水分子内H和O之间的作用力,远远大于水分子之间的作用力。
这种作用力称为化学键。
思考讨论
1. 定义:
化学键
2. 分类
离子键
共价键
非极性键
极性键
相邻的原子(或离子)间强烈的相互作用
3. 化学反应的实质:
旧化学键的断裂和新化学键的形成过程
(吸收能量) (释放能量)
化学键
H2
Cl2
HCl
HCl
什么是离子键和共价键呢?
它们分别是通过什么作用形成物质的呢?
从原子结构的角度来看,钠原子和氯原子是怎样形成NaCl的呢?
e-
Na
Cl
Na+
Cl-
不稳定结构
稳定结构
思考:在氯化钠晶体中,Na+和Cl- 间存在哪些力?
①Na+和Cl-间的相互吸引作用
②电子与电子、原子核与原子核间的相互排斥作用
吸引和排斥作用达到平衡
离子键
离子键
1. 概念:
带相反电荷离子之间的相互作用。
2. 成键粒子:
阳离子和阴离子
3. 成键本质:
静电作用
5. 离子键成键的原因:
4.成键元素:
活泼金属与活泼非金属元素
(静电吸引和静电排斥的平衡)
H He
Li Be …… B C N O F Ne
Na Mg Al Si P S Cl Ar
K Ca Ga Ge As Se Br Kr
Rb Sr In Sn Sb Te I Xe
Cs Ba Tl Pb Bi Po At Rn
Fr Ra
原子间相互得失电子达到稳定结构,体系的总能量降低。
离子键
1. 定义:由离子键构成的化合物叫做离子化合物。
2. 常见的离子化合物:
离子化合物
①活泼金属阳离子和活泼非金属阴离子形成的化合物
③活泼金属阳离子和酸根离子形成的盐
④铵根离子和酸根离子(或活泼非金属阴离子)形成的盐
如:NaCl、MgCl2、Na2O、MgO
如: Na2CO3 MgSO4
如: NH4Cl NH4NO3
如:NaOH、Mg(OH)2
②大多数碱
含有离子键的化合物一定是离子化合物。
离子化合物中一定含有离子键。
【思考1】含有离子键的化合物一定是离子化合物吗?
【思考2】离子化合物中一定含有离子键吗?
【思考3】含有金属元素的化合物一定是离子化合物吗?
不一定。如AlCl3中含有金属元素,但不属于离子化合物。
【思考4】离子化合物一定含有金属元素吗?
不一定。如NH4Cl不含金属元素,但属于离子化合物。
离子化合物
1. 下列说法正确的是( )
A. 离子键就是使阴、阳离子结合成化合物的静电引力
B. 所有金属元素原子与所有非金属元素原子之间都能形成离子键
C. 在化合物CaCl2中,两个氯离子之间也存在离子键
D. 含有离子键的化合物一定是离子化合物
D
2. 下列物质中属于离子化合物的是 ( )
A.硝酸 B.氨气 C.氯化铵 D.氯化氢
3. 下列物质中,含有离子键的是( )
A.HCl B.H2O2 C.K2O D.H2SO4
C
C
如何证明离子化合物中离子键的存在?
通过熔融状态下的物质导电性实验
思考讨论
NaCl溶解
克服离子键
什么情况下离子键会被破坏?
NaCl固体为什么不导电?
离子键
1. 定义:在元素符号周围用“ ”或“×”来表示原子的最外层 电子的式子。
2. 电子式的书写
(1)原子
书写原子的电子式时,一般将原子的最外层电子写在元素符号的上、下、左、右四个位置上。
原子电子式
H
Na
O
Cl
Mg
(2)简单阳离子
复杂阳离子
Na+
Mg 2+
Al 3+
[ ]
H
H
H
N
H
+
直接用阳离子符号
(3)简单阴离子
复杂阴离子
[ ]
一般用 表示
R
n-
[ ]
Cl
-
[ ]
O
2-
[ ]
O
H
-
[ ]
O
2-
O
离子电子式
1. 写出下列微粒的电子式:
硫原子、 溴原子、 硫离子、溴离子、铝离子
·S·
··
··
Br ·
··
··
··
[ S ]2-
··
··
:
:
[ Br ]-
··
··
:
:
Al3+
2. 下列电子式有误的是 (双选)( )
A.氯原子 B.硫离子
C.碘离子 D.钙离子Ca2+
BC
Cl
S
[ ]
I
2-
AB型
AB2型
A2B型
[ ]
Cl
Na
[ ]
O
2
Na
Na
[ ]
Cl
Mg
2
[ ]
Cl
写出MgO电子式
写出Na2S电子式
写出BaCl2电子式
注意:相同离子不合并(尽量对称), 同性电荷不相邻
离子化合物电子式
电子式表示离子化合物的形成过程
AB型
AB2型
A2B型
Na
Cl
+
[ ]
Cl
Na
[ ]
O
2
Na
Na
Na
O
+
Na
+
Mg
Cl
Cl
+
+
[ ]
Cl
Mg
2
[ ]
Cl
书写要点:
①左侧写原子的电子式
④右侧写离子化合物的电子式
③中间用 连接
②用弧形箭头表示电子转移的方向
1. 下列用电子式表示化合物的形成过程正确的是( )
K
O
K
O
]
[
K
2
K
A、
[
]
Ba
[
]
Cl
[
]
Cl
2
Ba
Cl
Cl
B、
]
Mg
F
F
Mg
F
2
[
2
C、
Cl
]
[
H
Cl
H
D、
A
Ba
[
]
Cl
[
]
Cl
2
]
Mg
F
2
[
]
F
[
Cl
H
×
×
×
√
