2023春高中化学选择性必修2 (人教版2019)第二章第三节 分子结构与物质的性质 第2课时 分子间的作用力 分子的手性 课时练(含答案)
文档属性
| 名称 | 2023春高中化学选择性必修2 (人教版2019)第二章第三节 分子结构与物质的性质 第2课时 分子间的作用力 分子的手性 课时练(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 699.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-29 18:25:03 | ||
图片预览



文档简介
第2课时 分子间的作用力 分子的手性
题组一 分子间的作用力的理解及应用
1.下列有关物质性质判断正确且可以用范德华力来解释的是( )
A.沸点:HBr>HCl
B.沸点:CH3CH2Br<C2H5OH
C.稳定性:HF>HCl
D.—OH上氢原子的活泼性:H—O—H>C2H5—O—H
2.关于氢键,下列说法正确的是( )
A.由于冰中的水分子间存在氢键,所以其密度大于液态水
B.可以用氢键解释接近沸点的水蒸气的相对分子质量测定值比用化学式(H2O)计算出来的相对分子质量大
C.分子间氢键和分子内氢键都会使熔、沸点升高
D.水加热到很高的温度都难以分解,这是由于氢键所致
3.比较下列化合物的沸点,前者低于后者的是( )
A.乙醇与氯乙烷
B.邻羟基苯甲酸与对羟基苯甲酸
C.对羟基苯甲醇与邻羟基苯甲醇
D.H2O与H2Te
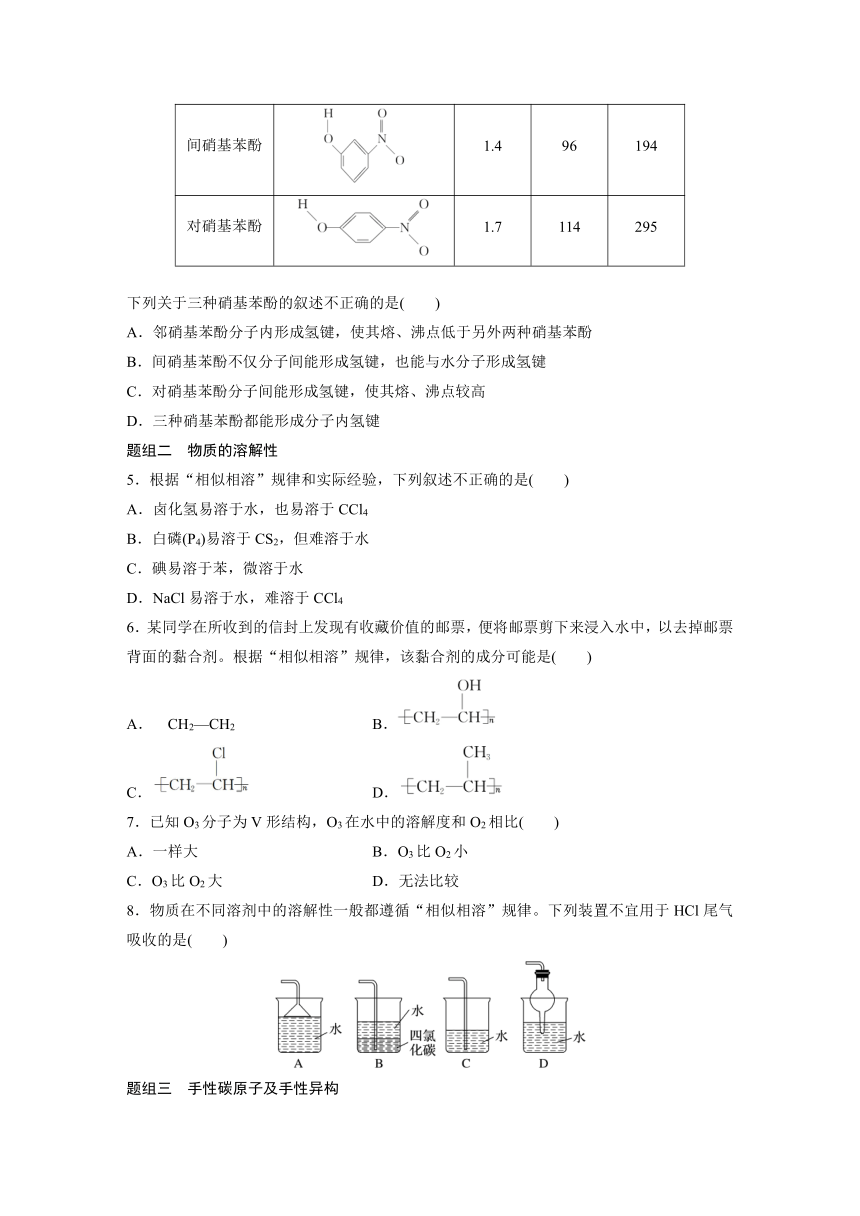
4.已知各种硝基苯酚的性质如下表:
名称 结构式 25 ℃水中溶解度/g 熔点/℃ 沸点/℃
邻硝基苯酚 0.2 45 100
间硝基苯酚 1.4 96 194
对硝基苯酚 1.7 114 295
下列关于三种硝基苯酚的叙述不正确的是( )
A.邻硝基苯酚分子内形成氢键,使其熔、沸点低于另外两种硝基苯酚
B.间硝基苯酚不仅分子间能形成氢键,也能与水分子形成氢键
C.对硝基苯酚分子间能形成氢键,使其熔、沸点较高
D.三种硝基苯酚都能形成分子内氢键
题组二 物质的溶解性
5.根据“相似相溶”规律和实际经验,下列叙述不正确的是( )
A.卤化氢易溶于水,也易溶于CCl4
B.白磷(P4)易溶于CS2,但难溶于水
C.碘易溶于苯,微溶于水
D.NaCl易溶于水,难溶于CCl4
6.某同学在所收到的信封上发现有收藏价值的邮票,便将邮票剪下来浸入水中,以去掉邮票背面的黏合剂。根据“相似相溶”规律,该黏合剂的成分可能是( )
A.?CH2—CH2? B.
C. D.
7.已知O3分子为V形结构,O3在水中的溶解度和O2相比( )
A.一样大 B.O3比O2小
C.O3比O2大 D.无法比较
8.物质在不同溶剂中的溶解性一般都遵循“相似相溶”规律。下列装置不宜用于HCl尾气吸收的是( )
题组三 手性碳原子及手性异构
9.当一个碳原子连接四个不同的原子或基团时,该碳原子叫“手性碳原子”。下列化合物中含有2个手性碳原子的是( )
A. B.
C. D.
10.下列关于丙氨酸的说法正确的是( )
A.Ⅰ和Ⅱ的结构和性质完全不同
B.Ⅰ和Ⅱ呈镜面对称,具有不同的分子极性
C.Ⅰ和Ⅱ都属于非极性分子
D.Ⅰ和Ⅱ中化学键的种类与数目完全相同
11.下列各项比较中前者高于(或大于或强于)后者的是( )
A.CH4在水中的溶解度和NH3在水中的溶解度
B.I2在水中的溶解度和I2在CCl4中的溶解度
C.I与H形成共价键的极性和F与H形成共价键的极性
D.乙酸(CH3COOH)的沸点和丙醇(CH3CH2CH2OH)的沸点
12.通常情况下,NCl3是一种油状液体,其分子空间结构与NH3相似,下列对NCl3和NH3的有关叙述错误的是( )
A.NCl3分子中N—Cl的键长与CCl4分子中C—Cl的键长不相等
B.NCl3分子是极性分子
C.NBr3比NCl3易挥发
D.在氨水中,大部分NH3与H2O以氢键(用“…”表示)结合形成NH3·H2O分子,则NH3·H2O的结构式主要为
13.(2022·湖南高中学业水平仿真模拟)我国科学家发现大脑进入“梦乡”的钥匙——多巴胺(DA),DA的结构简式如图所示。
下列说法正确的是( )
A.DA是只含极性键的共价化合物
B.DA分子能溶于水、乙醇等溶剂
C.键能大小决定DA的熔点和沸点
D.DA中所有元素均位于同一周期
14.(2022·湖南新宁县第一中学高二期中)白磷的结构为,下列有关白磷的说法错误的是( )
A.31 g P4含有1.5NA个P—P
B.P4为正四面体形结构,键角为109°28′
C.P4中P原子为sp3杂化
D.P4能保存在水中,因为P4是非极性分子,H2O是极性分子,且密度大于H2O
15.双氧水(H2O2)是一种医用消毒杀菌剂,已知H2O2分子的结构如图所示:
H2O2分子不是直线形的,两个H原子犹如在半展开的书的两面纸上,书面角为93°52′,而两个O—H与O—O的夹角均为96°52′。试回答:
(1)H2O2分子的电子式为________________________________________________________,
结构式为____________。
(2)H2O2分子中存在________键和________键,为________分子(填“极性”或“非极性”)。
(3)H2O2难溶于CS2,其原因是_____________________________________________
________________________________________________________________________。
(4)H2O2分子中氧元素的化合价为________________________________________________,
原因是________________________________________________________________________
________________________________________________________________________。
16.(1)已知苯酚()具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)________(填“>”或“<”)Ka(苯酚),其原因是_____________________________________________________
________________________________________________________________________。
(2)CO2由固态变为气态所需克服的微粒间作用力是________;氢、碳、氧元素的原子可共同形成多种分子,写出其中一种能形成同种分子间氢键的物质名称:________________。
(3)下图中曲线表示卤素某种性质随核电荷数的变化趋势,正确的是________(填字母)。
(4)O的氢化物(H2O)在乙醇中的溶解度大于H2S在乙醇中的溶解度,其原因是________________________________________________________________________
________________________________________________________________________。
(5)化合物NH3的沸点比化合物CH4的高,其主要原因是______________________。
第2课时 分子间的作用力 分子的手性
1.A [HBr与HCl结构相似,HBr的相对分子质量比HCl大,HBr分子间的范德华力比HCl大,所以其沸点比HCl高;C2H5Br的沸点比C2H5OH低是由于C2H5OH分子间形成氢键而增大了分子间的作用力;HF比HCl稳定是由于H—F的键能比H—Cl的键能大;H2O分子中—OH的氢原子比C2H5OH中—OH的氢原子更活泼是由于—C2H5是推电子基团,使O—H极性减弱。]
2.B [A项,由于冰中的水分子间存在氢键,增大了分子之间的距离,所以其密度小于液态水,错误;B项,由于水分子之间存在氢键,使水分子通常以几个分子缔合的形式存在,所以接近沸点的水蒸气的相对分子质量测定值比用化学式(H2O)计算出来的相对分子质量大,正确;C项,分子间氢键使熔、沸点升高,而分子内氢键则会使熔、沸点降低,错误;D项,水加热到很高的温度都难以分解,这是由于分子内的H—O共价键强的缘故,与分子间的氢键无关,错误。]
3.B [氢键分为两类:分子间氢键和分子内氢键。同类物质相比,分子内形成氢键的物质的熔、沸点要低于分子间形成氢键的物质的熔、沸点。如邻羟基苯甲酸、邻羟基苯甲醇等容易形成分子内氢键,沸点较低,而对羟基苯甲酸、对羟基苯甲醇则容易形成分子间氢键,沸点较高,所以B选项符合题意,C选项不符合题意;对于A选项,由于乙醇存在分子间氢键,而氯乙烷不存在氢键,所以乙醇的沸点高于氯乙烷的沸点;D选项中,H2O的沸点高于H2Te的沸点。]
4.D 5.A 6.B 7.C
8.C [HCl是极性分子,易溶于水而不溶于CCl4。C项装置易发生倒吸,A、D项装置分别使用了倒置漏斗和球形干燥管,能防止倒吸;B项装置中HCl气体先通过CCl4,由于HCl不溶于CCl4,HCl经过CCl4后再被上层的水吸收,也可以有效防止倒吸。]
9.C
10.D [从题图可看出,丙氨酸的分子中有1个碳原子与—H、—CH3、—NH2和—COOH相连,是手性碳原子,故丙氨酸分子有手性异构体。Ⅰ和Ⅱ的结构不同,但由于其所含官能团相同,化学性质相似,A项错误;Ⅰ和Ⅱ呈镜面对称,且分子的极性相同,B项错误;Ⅰ和Ⅱ的空间结构不对称,故均是极性分子,C项错误;Ⅰ和Ⅱ中化学键的种类(极性键和非极性键、σ键和π键、单键和双键)和数目完全相同,D项正确。]
11.D [NH3和水分子间可形成氢键,NH3在水中的溶解度大于CH4在水中的溶解度,故A错误;I2是非极性分子,水是极性分子,CCl4是非极性分子,根据“相似相溶”规律,I2在水中的溶解度小于I2在CCl4中的溶解度,故B错误;氟的电负性大于碘的电负性,所以I与H形成共价键的极性小于F与H形成共价键的极性,故C错误。]
12.C [C原子的原子半径大于N原子的原子半径,所以CCl4中C—Cl的键长比NCl3中N—Cl的键长长,故A正确;NCl3的分子空间结构与NH3相似,都是三角锥形,NH3分子是极性分子,所以NCl3分子也是极性分子,故B正确;共价化合物中物质的熔、沸点与相对分子质量有关,一般来说,对于组成和结构相似的物质,相对分子质量越大其熔、沸点越高,所以NBr3比NCl3的熔、沸点高,NCl3比NBr3易挥发,故C错误;在氨水中, NH3与H2O以氢键(用“…”表示)结合形成NH3·H2O分子,则NH3·H2O的结构式主要为,故D正确。]
13.B [由DA的结构简式可知,DA含有N—H、N—C、C—O、H—O、C—H等极性键,同时还含有C—C非极性键的共价化合物,A错误;DA分子中含有氨基和酚羟基,这两种官能团均能与水、乙醇形成分子间氢键,且DA属于极性分子,故可推知DA能溶于水、乙醇等溶剂,B正确;熔、沸点是物理性质,键能的大小决定物质的化学性质,故DA的熔、沸点高低与其分子中的键能大小无关,与分子间作用力大小有关,C错误;DA中含有H、C、N、O,其中C、N、O元素同位于第二周期,而H位于第一周期,D错误。]
14.B
15.(1) H—O—O—H
(2)极性 非极性 极性
(3)H2O2为极性分子,CS2为非极性分子,根据“相似相溶”规律可知H2O2难溶于CS2
(4)-1 O—O为非极性键,O—H为极性键,共用电子对偏向于氧,故氧元素显-1价
解析 (2)H2O2分子的空间结构不对称,为极性分子,含有O—O非极性键和O—H极性键。(3)根据“相似相溶”规律可知,H2O2为极性分子,难溶于非极性溶剂CS2。(4)共用电子对的偏移决定了元素在化合物中的化合价。
16.(1)< 中形成分子内氢键,使其更难电离出H+
(2)范德华力 乙酸(合理答案均可)
(3)a
(4)水分子与乙醇分子之间形成氢键
(5)NH3分子间可形成氢键
解析 (1)当形成分子内氢键后,导致酚羟基的电离能力减弱,故其电离能力比苯酚的弱。
(2)固态CO2中存在范德华力;根据氢键的形成条件,由H、C、O构成的能形成分子间氢键的分子,可联想到HCOOH、CH3COOH等。
(3)同主族元素从上到下,元素的电负性逐渐减小,a正确;F元素无正价,b错误;由于氟化氢中存在分子间氢键,所以其沸点高于溴化氢,c错误;随着相对分子质量的增大,范德华力增大,卤素单质的熔点升高,d错误。
(4)水与乙醇可形成分子间氢键,使得水与乙醇互溶;而硫化氢与乙醇不能形成分子间氢键,所以硫化氢在乙醇中的溶解度小于水。
(5)NH3分子间可形成氢键,使其沸点高于CH4的沸点。
题组一 分子间的作用力的理解及应用
1.下列有关物质性质判断正确且可以用范德华力来解释的是( )
A.沸点:HBr>HCl
B.沸点:CH3CH2Br<C2H5OH
C.稳定性:HF>HCl
D.—OH上氢原子的活泼性:H—O—H>C2H5—O—H
2.关于氢键,下列说法正确的是( )
A.由于冰中的水分子间存在氢键,所以其密度大于液态水
B.可以用氢键解释接近沸点的水蒸气的相对分子质量测定值比用化学式(H2O)计算出来的相对分子质量大
C.分子间氢键和分子内氢键都会使熔、沸点升高
D.水加热到很高的温度都难以分解,这是由于氢键所致
3.比较下列化合物的沸点,前者低于后者的是( )
A.乙醇与氯乙烷
B.邻羟基苯甲酸与对羟基苯甲酸
C.对羟基苯甲醇与邻羟基苯甲醇
D.H2O与H2Te
4.已知各种硝基苯酚的性质如下表:
名称 结构式 25 ℃水中溶解度/g 熔点/℃ 沸点/℃
邻硝基苯酚 0.2 45 100
间硝基苯酚 1.4 96 194
对硝基苯酚 1.7 114 295
下列关于三种硝基苯酚的叙述不正确的是( )
A.邻硝基苯酚分子内形成氢键,使其熔、沸点低于另外两种硝基苯酚
B.间硝基苯酚不仅分子间能形成氢键,也能与水分子形成氢键
C.对硝基苯酚分子间能形成氢键,使其熔、沸点较高
D.三种硝基苯酚都能形成分子内氢键
题组二 物质的溶解性
5.根据“相似相溶”规律和实际经验,下列叙述不正确的是( )
A.卤化氢易溶于水,也易溶于CCl4
B.白磷(P4)易溶于CS2,但难溶于水
C.碘易溶于苯,微溶于水
D.NaCl易溶于水,难溶于CCl4
6.某同学在所收到的信封上发现有收藏价值的邮票,便将邮票剪下来浸入水中,以去掉邮票背面的黏合剂。根据“相似相溶”规律,该黏合剂的成分可能是( )
A.?CH2—CH2? B.
C. D.
7.已知O3分子为V形结构,O3在水中的溶解度和O2相比( )
A.一样大 B.O3比O2小
C.O3比O2大 D.无法比较
8.物质在不同溶剂中的溶解性一般都遵循“相似相溶”规律。下列装置不宜用于HCl尾气吸收的是( )
题组三 手性碳原子及手性异构
9.当一个碳原子连接四个不同的原子或基团时,该碳原子叫“手性碳原子”。下列化合物中含有2个手性碳原子的是( )
A. B.
C. D.
10.下列关于丙氨酸的说法正确的是( )
A.Ⅰ和Ⅱ的结构和性质完全不同
B.Ⅰ和Ⅱ呈镜面对称,具有不同的分子极性
C.Ⅰ和Ⅱ都属于非极性分子
D.Ⅰ和Ⅱ中化学键的种类与数目完全相同
11.下列各项比较中前者高于(或大于或强于)后者的是( )
A.CH4在水中的溶解度和NH3在水中的溶解度
B.I2在水中的溶解度和I2在CCl4中的溶解度
C.I与H形成共价键的极性和F与H形成共价键的极性
D.乙酸(CH3COOH)的沸点和丙醇(CH3CH2CH2OH)的沸点
12.通常情况下,NCl3是一种油状液体,其分子空间结构与NH3相似,下列对NCl3和NH3的有关叙述错误的是( )
A.NCl3分子中N—Cl的键长与CCl4分子中C—Cl的键长不相等
B.NCl3分子是极性分子
C.NBr3比NCl3易挥发
D.在氨水中,大部分NH3与H2O以氢键(用“…”表示)结合形成NH3·H2O分子,则NH3·H2O的结构式主要为
13.(2022·湖南高中学业水平仿真模拟)我国科学家发现大脑进入“梦乡”的钥匙——多巴胺(DA),DA的结构简式如图所示。
下列说法正确的是( )
A.DA是只含极性键的共价化合物
B.DA分子能溶于水、乙醇等溶剂
C.键能大小决定DA的熔点和沸点
D.DA中所有元素均位于同一周期
14.(2022·湖南新宁县第一中学高二期中)白磷的结构为,下列有关白磷的说法错误的是( )
A.31 g P4含有1.5NA个P—P
B.P4为正四面体形结构,键角为109°28′
C.P4中P原子为sp3杂化
D.P4能保存在水中,因为P4是非极性分子,H2O是极性分子,且密度大于H2O
15.双氧水(H2O2)是一种医用消毒杀菌剂,已知H2O2分子的结构如图所示:
H2O2分子不是直线形的,两个H原子犹如在半展开的书的两面纸上,书面角为93°52′,而两个O—H与O—O的夹角均为96°52′。试回答:
(1)H2O2分子的电子式为________________________________________________________,
结构式为____________。
(2)H2O2分子中存在________键和________键,为________分子(填“极性”或“非极性”)。
(3)H2O2难溶于CS2,其原因是_____________________________________________
________________________________________________________________________。
(4)H2O2分子中氧元素的化合价为________________________________________________,
原因是________________________________________________________________________
________________________________________________________________________。
16.(1)已知苯酚()具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)________(填“>”或“<”)Ka(苯酚),其原因是_____________________________________________________
________________________________________________________________________。
(2)CO2由固态变为气态所需克服的微粒间作用力是________;氢、碳、氧元素的原子可共同形成多种分子,写出其中一种能形成同种分子间氢键的物质名称:________________。
(3)下图中曲线表示卤素某种性质随核电荷数的变化趋势,正确的是________(填字母)。
(4)O的氢化物(H2O)在乙醇中的溶解度大于H2S在乙醇中的溶解度,其原因是________________________________________________________________________
________________________________________________________________________。
(5)化合物NH3的沸点比化合物CH4的高,其主要原因是______________________。
第2课时 分子间的作用力 分子的手性
1.A [HBr与HCl结构相似,HBr的相对分子质量比HCl大,HBr分子间的范德华力比HCl大,所以其沸点比HCl高;C2H5Br的沸点比C2H5OH低是由于C2H5OH分子间形成氢键而增大了分子间的作用力;HF比HCl稳定是由于H—F的键能比H—Cl的键能大;H2O分子中—OH的氢原子比C2H5OH中—OH的氢原子更活泼是由于—C2H5是推电子基团,使O—H极性减弱。]
2.B [A项,由于冰中的水分子间存在氢键,增大了分子之间的距离,所以其密度小于液态水,错误;B项,由于水分子之间存在氢键,使水分子通常以几个分子缔合的形式存在,所以接近沸点的水蒸气的相对分子质量测定值比用化学式(H2O)计算出来的相对分子质量大,正确;C项,分子间氢键使熔、沸点升高,而分子内氢键则会使熔、沸点降低,错误;D项,水加热到很高的温度都难以分解,这是由于分子内的H—O共价键强的缘故,与分子间的氢键无关,错误。]
3.B [氢键分为两类:分子间氢键和分子内氢键。同类物质相比,分子内形成氢键的物质的熔、沸点要低于分子间形成氢键的物质的熔、沸点。如邻羟基苯甲酸、邻羟基苯甲醇等容易形成分子内氢键,沸点较低,而对羟基苯甲酸、对羟基苯甲醇则容易形成分子间氢键,沸点较高,所以B选项符合题意,C选项不符合题意;对于A选项,由于乙醇存在分子间氢键,而氯乙烷不存在氢键,所以乙醇的沸点高于氯乙烷的沸点;D选项中,H2O的沸点高于H2Te的沸点。]
4.D 5.A 6.B 7.C
8.C [HCl是极性分子,易溶于水而不溶于CCl4。C项装置易发生倒吸,A、D项装置分别使用了倒置漏斗和球形干燥管,能防止倒吸;B项装置中HCl气体先通过CCl4,由于HCl不溶于CCl4,HCl经过CCl4后再被上层的水吸收,也可以有效防止倒吸。]
9.C
10.D [从题图可看出,丙氨酸的分子中有1个碳原子与—H、—CH3、—NH2和—COOH相连,是手性碳原子,故丙氨酸分子有手性异构体。Ⅰ和Ⅱ的结构不同,但由于其所含官能团相同,化学性质相似,A项错误;Ⅰ和Ⅱ呈镜面对称,且分子的极性相同,B项错误;Ⅰ和Ⅱ的空间结构不对称,故均是极性分子,C项错误;Ⅰ和Ⅱ中化学键的种类(极性键和非极性键、σ键和π键、单键和双键)和数目完全相同,D项正确。]
11.D [NH3和水分子间可形成氢键,NH3在水中的溶解度大于CH4在水中的溶解度,故A错误;I2是非极性分子,水是极性分子,CCl4是非极性分子,根据“相似相溶”规律,I2在水中的溶解度小于I2在CCl4中的溶解度,故B错误;氟的电负性大于碘的电负性,所以I与H形成共价键的极性小于F与H形成共价键的极性,故C错误。]
12.C [C原子的原子半径大于N原子的原子半径,所以CCl4中C—Cl的键长比NCl3中N—Cl的键长长,故A正确;NCl3的分子空间结构与NH3相似,都是三角锥形,NH3分子是极性分子,所以NCl3分子也是极性分子,故B正确;共价化合物中物质的熔、沸点与相对分子质量有关,一般来说,对于组成和结构相似的物质,相对分子质量越大其熔、沸点越高,所以NBr3比NCl3的熔、沸点高,NCl3比NBr3易挥发,故C错误;在氨水中, NH3与H2O以氢键(用“…”表示)结合形成NH3·H2O分子,则NH3·H2O的结构式主要为,故D正确。]
13.B [由DA的结构简式可知,DA含有N—H、N—C、C—O、H—O、C—H等极性键,同时还含有C—C非极性键的共价化合物,A错误;DA分子中含有氨基和酚羟基,这两种官能团均能与水、乙醇形成分子间氢键,且DA属于极性分子,故可推知DA能溶于水、乙醇等溶剂,B正确;熔、沸点是物理性质,键能的大小决定物质的化学性质,故DA的熔、沸点高低与其分子中的键能大小无关,与分子间作用力大小有关,C错误;DA中含有H、C、N、O,其中C、N、O元素同位于第二周期,而H位于第一周期,D错误。]
14.B
15.(1) H—O—O—H
(2)极性 非极性 极性
(3)H2O2为极性分子,CS2为非极性分子,根据“相似相溶”规律可知H2O2难溶于CS2
(4)-1 O—O为非极性键,O—H为极性键,共用电子对偏向于氧,故氧元素显-1价
解析 (2)H2O2分子的空间结构不对称,为极性分子,含有O—O非极性键和O—H极性键。(3)根据“相似相溶”规律可知,H2O2为极性分子,难溶于非极性溶剂CS2。(4)共用电子对的偏移决定了元素在化合物中的化合价。
16.(1)< 中形成分子内氢键,使其更难电离出H+
(2)范德华力 乙酸(合理答案均可)
(3)a
(4)水分子与乙醇分子之间形成氢键
(5)NH3分子间可形成氢键
解析 (1)当形成分子内氢键后,导致酚羟基的电离能力减弱,故其电离能力比苯酚的弱。
(2)固态CO2中存在范德华力;根据氢键的形成条件,由H、C、O构成的能形成分子间氢键的分子,可联想到HCOOH、CH3COOH等。
(3)同主族元素从上到下,元素的电负性逐渐减小,a正确;F元素无正价,b错误;由于氟化氢中存在分子间氢键,所以其沸点高于溴化氢,c错误;随着相对分子质量的增大,范德华力增大,卤素单质的熔点升高,d错误。
(4)水与乙醇可形成分子间氢键,使得水与乙醇互溶;而硫化氢与乙醇不能形成分子间氢键,所以硫化氢在乙醇中的溶解度小于水。
(5)NH3分子间可形成氢键,使其沸点高于CH4的沸点。
