2023春高中化学选择性必修2 (人教版2019)第三章 晶体结构与性质 阶段重点突破练(三)(含答案)
文档属性
| 名称 | 2023春高中化学选择性必修2 (人教版2019)第三章 晶体结构与性质 阶段重点突破练(三)(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 562.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-29 19:32:05 | ||
图片预览


文档简介
阶段重点突破练(三)
一、分子晶体、共价晶体的微粒分析
1.下列各组晶体物质中,化学键类型相同,晶体类型也相同的是( )
①SiO2和SO3 ②晶体硼和HCl ③CO2和SO2 ④晶体硅和金刚石 ⑤晶体氖和晶体氮
⑥硫黄和碘
A.①②③ B.④⑤⑥
C.③④⑥ D.①③⑤
2.干冰和二氧化硅晶体同属第ⅣA族元素的最高价氧化物,它们的熔、沸点差别很大的原因是( )
A.二氧化硅的相对分子质量大于二氧化碳的相对分子质量
B.C—O的键能比Si—O的键能小
C.干冰为分子晶体,二氧化硅为共价晶体
D.干冰易升华,二氧化硅不能
3.(2022·沈阳高二检测)下列叙述中,结论(事实)和对应的解释(事实)均不正确的是( )
A.金刚石的熔、沸点高于晶体硅,因为C—C的键能大于Si—Si的键能
B.二氧化硅晶体中不存在SiO2分子,因为它含有硅氧四面体的空间网状结构
C.稀有气体的晶体属于共价晶体,因为其组成微粒是原子,不存在分子间作用力
D.空间结构为正四面体的分子中,化学键的键角不一定是109°28′,可能为60°
二、分子晶体、共价晶体的结构分析及应用
4.如图为碘晶体晶胞结构。下列有关说法正确的是( )
A.碘分子的排列有2种不同的取向,2种取向不同的碘分子以4配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是共价晶体
D.碘晶体中的碘原子间存在非极性键和范德华力
5.如图分别表示冰晶体、干冰晶体、金刚石晶体的结构,下列关于这些晶体的说法正确的是( )
A.冰晶体中只存在范德华力和氢键两种作用力
B.沸点:金刚石>干冰>冰
C.冰晶体中的氧原子和金刚石晶体中的碳原子均可形成四面体结构
D.干冰晶体中每个CO2周围距离相等且最近的CO2有10个
6.P元素有白磷、红磷、黑磷三种常见的单质。黑磷是一种黑色有金属光泽的晶体,是一种比石墨烯更优秀的新型材料。白磷、红磷都是分子晶体,黑磷晶体具有与石墨类似的层状结构,如图所示。下列有关黑磷晶体的说法正确的是( )
A.黑磷晶体中磷原子的杂化方式为sp2杂化
B.黑磷晶体中层与层之间的作用力是分子间作用力
C.黑磷晶体的每一层中磷原子都在同一平面上
D.P元素三种常见的单质中,白磷的熔、沸点最高
三、分子晶体、共价晶体的性质分析及应用
7.X是核外电子数最少的元素,Y是地壳中含量最丰富的元素,Z在地壳中的含量仅次于Y,W可以形成自然界中最硬的共价晶体。下列有关叙述错误的是( )
A.WX4是沼气的主要成分
B.固态X2Y是分子晶体
C.ZW是共价晶体
D.ZY2的水溶液俗称“水玻璃”
8.在20世纪90年代末期,科学家发现并证明碳有新的单质形态C60存在。后来人们又相继得到了C70、C76、C90、C94等另外一些球碳分子。21世纪初,科学家又发现了管状碳分子和洋葱状碳分子,大大丰富了碳元素单质的家庭。下列有关说法错误的是( )
A.金刚石、C60、C70、管状碳和洋葱状碳都不能与H2发生加成反应
B.已知C(石墨,s)===C(金刚石,s) ΔH>0,则石墨比金刚石稳定
C.C60晶胞结构如图所示,每个C60分子周围与它最近且等距离的C60分子有12个
D.熔点:C60<C70<C90<金刚石
9.(1)锗、砷、硒、溴的第一电离能由大到小的顺序为________________(用元素符号表示);其中锗的化合物四氯化锗可用作光导纤维掺杂剂,其熔点为-49.5 ℃,沸点为83.1 ℃,则其晶体类型为__________,中心原子的杂化类型为________。
(2)在高压下氮气会发生聚合得到高聚氮,晶体结构如图所示。晶体中每个氮原子与另外三个氮原子结合形成三维骨架结构。氮原子的杂化轨道类型为________。这种高聚氮N—N 的键能为160 kJ·mol-1,而N2的键能为942 kJ·mol-1,其可能潜在的应用是__________________。
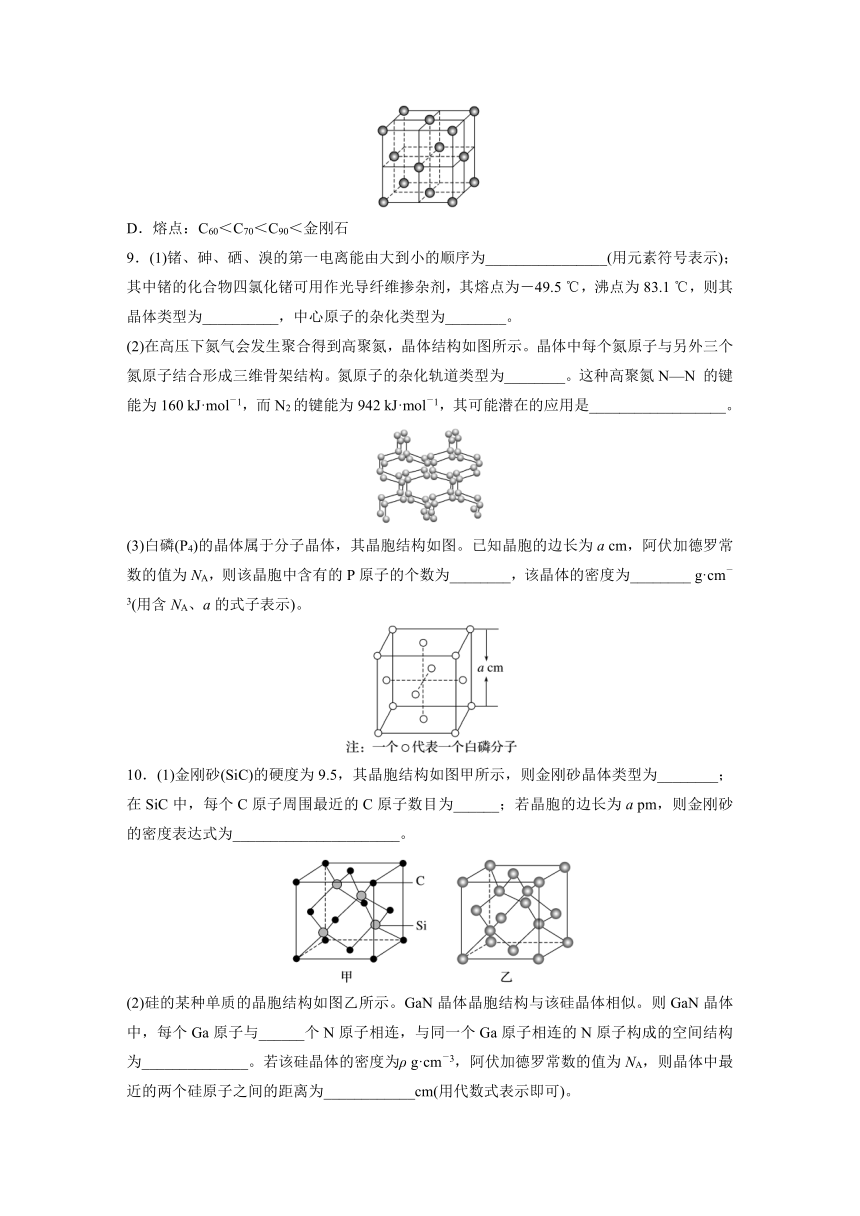
(3)白磷(P4)的晶体属于分子晶体,其晶胞结构如图。已知晶胞的边长为a cm,阿伏加德罗常数的值为NA,则该晶胞中含有的P原子的个数为________,该晶体的密度为________ g·cm-3(用含NA、a的式子表示)。
10.(1)金刚砂(SiC)的硬度为9.5,其晶胞结构如图甲所示,则金刚砂晶体类型为________;在SiC中,每个C原子周围最近的C原子数目为______;若晶胞的边长为a pm,则金刚砂的密度表达式为______________________。
(2)硅的某种单质的晶胞结构如图乙所示。GaN晶体晶胞结构与该硅晶体相似。则GaN晶体中,每个Ga原子与______个N原子相连,与同一个Ga原子相连的N原子构成的空间结构为______________。若该硅晶体的密度为ρ g·cm-3,阿伏加德罗常数的值为NA,则晶体中最近的两个硅原子之间的距离为____________cm(用代数式表示即可)。
11.回答下列问题:
(1)CO2由固态变为气态需克服的微粒间作用力是______________。
(2)熔点:金刚石________(填“>”或“<”,下同)晶体硅;沸点:CH4________SiH4。
(3)下列有关元素锗及其化合物的叙述正确的是________(填字母)。
A.锗的第一电离能高于碳而电负性低于碳
B.四氯化锗与四氯化碳分子都是正四面体结构
C.常温下,二氧化锗与二氧化碳都是非极性的气体化合物
D.锗和碳都存在具有共价晶体结构的单质
(4)冰晶胞中水分子的空间排列方式与金刚石晶胞(结构如图所示,其中空心球所示原子位于立方体的顶点或面心,实心球所示原子位于立方体内)类似。每个冰晶胞平均占有________个水分子。冰晶胞与金刚石晶胞中微粒排列方式相同的原因是______________________________
_______________________________________________________________________________。
(5)二氧化硅的结构相当于在硅晶体结构中每个硅硅单键之间插入1个氧原子,二氧化硅的空间网状结构中,硅、氧原子形成的最小环上氧原子数目是________。
(6)已知晶体硼结构单元是由硼原子组成的正二十面体(如图所示),其中有20个等边三角形的面和一定数目的顶角,每个顶角上各有1个B原子。通过观察图形及推算,此晶体结构单元由________个硼原子构成,其中B—B的键角为________,共含有________个B—B。
12.有E、Q、T、X、Z五种前四周期元素,原子序数依次增大。E、Q、T三种元素的基态原子具有相同的能层和能级,且第一电离能I1(E)<I1(T)<I1(Q),其中基态Q原子的2p轨道处于半充满状态,且QT与ET2具有相同的原子数和价
电子数。X为周期表前四周期中电负性最小的元素,Z的原子序数为28。请回答下列问题(答题时如需表示具体元素,请用相应的元素符号):
(1)基态Z原子的核外电子排布式为______________________________________________
________________。
(2)Q的简单氢化物极易溶于T的简单氢化物,其主要原因是_________________________、
________________________________________________________________________。
(3)化合物甲由T、X两种元素组成,其晶胞如图所示,则甲的化学式为________。
(4)化合物乙的结构如图所示,乙由E、Q两种元素组成,硬度超过金刚石。
①乙的晶体类型为________,其硬度超过金刚石的原因是____________________________
________________________________________________________________________。
②乙的晶体中E、Q两种元素原子的杂化方式均为________。
阶段重点突破练(三)
1.C 2.C
3.C [金刚石、晶体硅都属于共价晶体,键能大小决定晶体的熔、沸点高低,因为C—C的键能大于Si—Si的键能,故金刚石的熔、沸点高于晶体硅,A正确;二氧化硅晶体属于共价晶体,含有硅氧四面体的空间网状结构,不存在SiO2分子,只有硅、氧原子最简比,即化学式为SiO2,B正确;稀有气体的晶体属于分子晶体,组成微粒是分子,存在分子间作用力,C错误;空间结构为正四面体的分子中,化学键的键角可能为60°,如白磷等,D正确。]
4.A [每个晶胞中有4个碘分子,B项错误;碘晶体是分子晶体,C项错误;碘原子间只存在非极性共价键,范德华力存在于分子之间,D项错误。]
5.C [冰晶体中还存在H—O共价键,故A错误;金刚石晶体是共价晶体,冰、干冰晶体都是分子晶体,所以金刚石的沸点最高,由于冰中存在氢键,故其沸点比干冰高,故B错误;根据冰晶体和金刚石晶体的结构可知,冰晶体中1个O原子与邻近的4个O原子可形成四面体结构,金刚石晶体中1个C原子与邻近的4个C原子可形成正四面体结构,故C正确;干冰晶体中每个CO2周围距离相等且最近的CO2有12个,故D错误。]
6.B 7.D
8.A [C60的结构中存在碳碳双键,可与H2发生加成反应,A错误;石墨转化为金刚石为吸热反应,则石墨能量低,金刚石能量高,能量越高,越不稳定,所以石墨比金刚石稳定,B正确;以晶胞顶点上的C60分子为例,与之距离最近的C60分子有12个,C正确;C60、C70、C90为分子晶体,分子晶体的相对分子质量越大,熔点越高,金刚石为共价晶体,在这四种物质中熔点最高,所以熔点:C60<C70<C90<金刚石,D正确。]
9.(1)Br>As>Se>Ge 分子晶体 sp3 (2)sp3 制炸药(或高能燃料) (3)16
解析 (3)根据均摊法,P原子的个数为×4=16;晶胞的摩尔质量是16×31 g·mol-1=496 g·mol-1,1个晶胞的体积是a3 cm3,ρ= = g·cm-3。
10.(1)共价晶体 12
g·cm-3
(2)4 正四面体形 ×
解析 (1)金刚砂(SiC)的硬度为9.5,硬度大,属于共价晶体;每个碳原子连接4个硅原子,每个硅原子连接4个碳原子,所以每个碳原子周围最近的碳原子数目为12;该晶胞中C原子个数为8×+6×=4,Si原子个数为4,晶胞边长为a×10-10 cm,体积V=(a×10-10 cm)3,ρ== g·cm-3。
(2)根据物质的晶胞结构可知,在GaN晶体中,每个Ga原子与4个N原子相连,与同一个Ga原子相连的N原子构成的空间结构为正四面体形。在该硅晶体的晶胞中含有Si原子的数目是8×+6×+4=8,则1个晶胞的体积为 cm3= cm3,晶胞的边长为
cm,在晶胞中两个最近的Si原子之间的距离为晶胞体对角线长的,即 ×
cm。
11.(1)分子间作用力(或范德华力) (2)> < (3)BD (4)8 碳原子与氧原子都为sp3杂化,且氢键和共价键都具有方向性和饱和性(每个水分子与相邻的4个水分子形成氢键) (5)6 (6)12 60° 30
解析 (3)锗与碳同主族,其中锗位于第四周期,故锗的第一电离能、电负性均小于碳;GeCl4与CCl4的结构相似,因中心原子价电子全部成键且价层电子对数为4,故为正四面体;常温下,GeO2为固体;晶体锗、金刚石均为共价晶体。(6)20个正三角形,共60个硼原子,每个硼原子为5个正三角形共有,故硼原子个数为60×=12,B—B的个数为20×3×=30。
12.(1)1s22s22p63s23p63d84s2 (2)这两种氢化物均为极性分子 分子之间能形成氢键 (3)KO2 (4)①共价晶体 C—N的键长小于C—C的键长,C—N的键能大于C—C的键能 ②sp3
一、分子晶体、共价晶体的微粒分析
1.下列各组晶体物质中,化学键类型相同,晶体类型也相同的是( )
①SiO2和SO3 ②晶体硼和HCl ③CO2和SO2 ④晶体硅和金刚石 ⑤晶体氖和晶体氮
⑥硫黄和碘
A.①②③ B.④⑤⑥
C.③④⑥ D.①③⑤
2.干冰和二氧化硅晶体同属第ⅣA族元素的最高价氧化物,它们的熔、沸点差别很大的原因是( )
A.二氧化硅的相对分子质量大于二氧化碳的相对分子质量
B.C—O的键能比Si—O的键能小
C.干冰为分子晶体,二氧化硅为共价晶体
D.干冰易升华,二氧化硅不能
3.(2022·沈阳高二检测)下列叙述中,结论(事实)和对应的解释(事实)均不正确的是( )
A.金刚石的熔、沸点高于晶体硅,因为C—C的键能大于Si—Si的键能
B.二氧化硅晶体中不存在SiO2分子,因为它含有硅氧四面体的空间网状结构
C.稀有气体的晶体属于共价晶体,因为其组成微粒是原子,不存在分子间作用力
D.空间结构为正四面体的分子中,化学键的键角不一定是109°28′,可能为60°
二、分子晶体、共价晶体的结构分析及应用
4.如图为碘晶体晶胞结构。下列有关说法正确的是( )
A.碘分子的排列有2种不同的取向,2种取向不同的碘分子以4配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是共价晶体
D.碘晶体中的碘原子间存在非极性键和范德华力
5.如图分别表示冰晶体、干冰晶体、金刚石晶体的结构,下列关于这些晶体的说法正确的是( )
A.冰晶体中只存在范德华力和氢键两种作用力
B.沸点:金刚石>干冰>冰
C.冰晶体中的氧原子和金刚石晶体中的碳原子均可形成四面体结构
D.干冰晶体中每个CO2周围距离相等且最近的CO2有10个
6.P元素有白磷、红磷、黑磷三种常见的单质。黑磷是一种黑色有金属光泽的晶体,是一种比石墨烯更优秀的新型材料。白磷、红磷都是分子晶体,黑磷晶体具有与石墨类似的层状结构,如图所示。下列有关黑磷晶体的说法正确的是( )
A.黑磷晶体中磷原子的杂化方式为sp2杂化
B.黑磷晶体中层与层之间的作用力是分子间作用力
C.黑磷晶体的每一层中磷原子都在同一平面上
D.P元素三种常见的单质中,白磷的熔、沸点最高
三、分子晶体、共价晶体的性质分析及应用
7.X是核外电子数最少的元素,Y是地壳中含量最丰富的元素,Z在地壳中的含量仅次于Y,W可以形成自然界中最硬的共价晶体。下列有关叙述错误的是( )
A.WX4是沼气的主要成分
B.固态X2Y是分子晶体
C.ZW是共价晶体
D.ZY2的水溶液俗称“水玻璃”
8.在20世纪90年代末期,科学家发现并证明碳有新的单质形态C60存在。后来人们又相继得到了C70、C76、C90、C94等另外一些球碳分子。21世纪初,科学家又发现了管状碳分子和洋葱状碳分子,大大丰富了碳元素单质的家庭。下列有关说法错误的是( )
A.金刚石、C60、C70、管状碳和洋葱状碳都不能与H2发生加成反应
B.已知C(石墨,s)===C(金刚石,s) ΔH>0,则石墨比金刚石稳定
C.C60晶胞结构如图所示,每个C60分子周围与它最近且等距离的C60分子有12个
D.熔点:C60<C70<C90<金刚石
9.(1)锗、砷、硒、溴的第一电离能由大到小的顺序为________________(用元素符号表示);其中锗的化合物四氯化锗可用作光导纤维掺杂剂,其熔点为-49.5 ℃,沸点为83.1 ℃,则其晶体类型为__________,中心原子的杂化类型为________。
(2)在高压下氮气会发生聚合得到高聚氮,晶体结构如图所示。晶体中每个氮原子与另外三个氮原子结合形成三维骨架结构。氮原子的杂化轨道类型为________。这种高聚氮N—N 的键能为160 kJ·mol-1,而N2的键能为942 kJ·mol-1,其可能潜在的应用是__________________。
(3)白磷(P4)的晶体属于分子晶体,其晶胞结构如图。已知晶胞的边长为a cm,阿伏加德罗常数的值为NA,则该晶胞中含有的P原子的个数为________,该晶体的密度为________ g·cm-3(用含NA、a的式子表示)。
10.(1)金刚砂(SiC)的硬度为9.5,其晶胞结构如图甲所示,则金刚砂晶体类型为________;在SiC中,每个C原子周围最近的C原子数目为______;若晶胞的边长为a pm,则金刚砂的密度表达式为______________________。
(2)硅的某种单质的晶胞结构如图乙所示。GaN晶体晶胞结构与该硅晶体相似。则GaN晶体中,每个Ga原子与______个N原子相连,与同一个Ga原子相连的N原子构成的空间结构为______________。若该硅晶体的密度为ρ g·cm-3,阿伏加德罗常数的值为NA,则晶体中最近的两个硅原子之间的距离为____________cm(用代数式表示即可)。
11.回答下列问题:
(1)CO2由固态变为气态需克服的微粒间作用力是______________。
(2)熔点:金刚石________(填“>”或“<”,下同)晶体硅;沸点:CH4________SiH4。
(3)下列有关元素锗及其化合物的叙述正确的是________(填字母)。
A.锗的第一电离能高于碳而电负性低于碳
B.四氯化锗与四氯化碳分子都是正四面体结构
C.常温下,二氧化锗与二氧化碳都是非极性的气体化合物
D.锗和碳都存在具有共价晶体结构的单质
(4)冰晶胞中水分子的空间排列方式与金刚石晶胞(结构如图所示,其中空心球所示原子位于立方体的顶点或面心,实心球所示原子位于立方体内)类似。每个冰晶胞平均占有________个水分子。冰晶胞与金刚石晶胞中微粒排列方式相同的原因是______________________________
_______________________________________________________________________________。
(5)二氧化硅的结构相当于在硅晶体结构中每个硅硅单键之间插入1个氧原子,二氧化硅的空间网状结构中,硅、氧原子形成的最小环上氧原子数目是________。
(6)已知晶体硼结构单元是由硼原子组成的正二十面体(如图所示),其中有20个等边三角形的面和一定数目的顶角,每个顶角上各有1个B原子。通过观察图形及推算,此晶体结构单元由________个硼原子构成,其中B—B的键角为________,共含有________个B—B。
12.有E、Q、T、X、Z五种前四周期元素,原子序数依次增大。E、Q、T三种元素的基态原子具有相同的能层和能级,且第一电离能I1(E)<I1(T)<I1(Q),其中基态Q原子的2p轨道处于半充满状态,且QT与ET2具有相同的原子数和价
电子数。X为周期表前四周期中电负性最小的元素,Z的原子序数为28。请回答下列问题(答题时如需表示具体元素,请用相应的元素符号):
(1)基态Z原子的核外电子排布式为______________________________________________
________________。
(2)Q的简单氢化物极易溶于T的简单氢化物,其主要原因是_________________________、
________________________________________________________________________。
(3)化合物甲由T、X两种元素组成,其晶胞如图所示,则甲的化学式为________。
(4)化合物乙的结构如图所示,乙由E、Q两种元素组成,硬度超过金刚石。
①乙的晶体类型为________,其硬度超过金刚石的原因是____________________________
________________________________________________________________________。
②乙的晶体中E、Q两种元素原子的杂化方式均为________。
阶段重点突破练(三)
1.C 2.C
3.C [金刚石、晶体硅都属于共价晶体,键能大小决定晶体的熔、沸点高低,因为C—C的键能大于Si—Si的键能,故金刚石的熔、沸点高于晶体硅,A正确;二氧化硅晶体属于共价晶体,含有硅氧四面体的空间网状结构,不存在SiO2分子,只有硅、氧原子最简比,即化学式为SiO2,B正确;稀有气体的晶体属于分子晶体,组成微粒是分子,存在分子间作用力,C错误;空间结构为正四面体的分子中,化学键的键角可能为60°,如白磷等,D正确。]
4.A [每个晶胞中有4个碘分子,B项错误;碘晶体是分子晶体,C项错误;碘原子间只存在非极性共价键,范德华力存在于分子之间,D项错误。]
5.C [冰晶体中还存在H—O共价键,故A错误;金刚石晶体是共价晶体,冰、干冰晶体都是分子晶体,所以金刚石的沸点最高,由于冰中存在氢键,故其沸点比干冰高,故B错误;根据冰晶体和金刚石晶体的结构可知,冰晶体中1个O原子与邻近的4个O原子可形成四面体结构,金刚石晶体中1个C原子与邻近的4个C原子可形成正四面体结构,故C正确;干冰晶体中每个CO2周围距离相等且最近的CO2有12个,故D错误。]
6.B 7.D
8.A [C60的结构中存在碳碳双键,可与H2发生加成反应,A错误;石墨转化为金刚石为吸热反应,则石墨能量低,金刚石能量高,能量越高,越不稳定,所以石墨比金刚石稳定,B正确;以晶胞顶点上的C60分子为例,与之距离最近的C60分子有12个,C正确;C60、C70、C90为分子晶体,分子晶体的相对分子质量越大,熔点越高,金刚石为共价晶体,在这四种物质中熔点最高,所以熔点:C60<C70<C90<金刚石,D正确。]
9.(1)Br>As>Se>Ge 分子晶体 sp3 (2)sp3 制炸药(或高能燃料) (3)16
解析 (3)根据均摊法,P原子的个数为×4=16;晶胞的摩尔质量是16×31 g·mol-1=496 g·mol-1,1个晶胞的体积是a3 cm3,ρ= = g·cm-3。
10.(1)共价晶体 12
g·cm-3
(2)4 正四面体形 ×
解析 (1)金刚砂(SiC)的硬度为9.5,硬度大,属于共价晶体;每个碳原子连接4个硅原子,每个硅原子连接4个碳原子,所以每个碳原子周围最近的碳原子数目为12;该晶胞中C原子个数为8×+6×=4,Si原子个数为4,晶胞边长为a×10-10 cm,体积V=(a×10-10 cm)3,ρ== g·cm-3。
(2)根据物质的晶胞结构可知,在GaN晶体中,每个Ga原子与4个N原子相连,与同一个Ga原子相连的N原子构成的空间结构为正四面体形。在该硅晶体的晶胞中含有Si原子的数目是8×+6×+4=8,则1个晶胞的体积为 cm3= cm3,晶胞的边长为
cm,在晶胞中两个最近的Si原子之间的距离为晶胞体对角线长的,即 ×
cm。
11.(1)分子间作用力(或范德华力) (2)> < (3)BD (4)8 碳原子与氧原子都为sp3杂化,且氢键和共价键都具有方向性和饱和性(每个水分子与相邻的4个水分子形成氢键) (5)6 (6)12 60° 30
解析 (3)锗与碳同主族,其中锗位于第四周期,故锗的第一电离能、电负性均小于碳;GeCl4与CCl4的结构相似,因中心原子价电子全部成键且价层电子对数为4,故为正四面体;常温下,GeO2为固体;晶体锗、金刚石均为共价晶体。(6)20个正三角形,共60个硼原子,每个硼原子为5个正三角形共有,故硼原子个数为60×=12,B—B的个数为20×3×=30。
12.(1)1s22s22p63s23p63d84s2 (2)这两种氢化物均为极性分子 分子之间能形成氢键 (3)KO2 (4)①共价晶体 C—N的键长小于C—C的键长,C—N的键能大于C—C的键能 ②sp3
