专题2 化学反应速率与化学平衡 体系构建 体验高考(共30张ppt)
文档属性
| 名称 | 专题2 化学反应速率与化学平衡 体系构建 体验高考(共30张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 770.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-29 23:15:34 | ||
图片预览











文档简介
(共30张PPT)
体系构建 理清脉络 / 体验高考 素养提升
体系构建 体验高考
专题2
内容索引
体系构建 理清脉络
体验高考 素养提升
体系构建 理清脉络
化学反应速率
表示方法:v=
单位:mol·L-1·s-1或mol·L-1·min-1
简单计算
公式法
化学计量数之比法
影响因素
内因:反应物结构、性质(活化分子)
外因
浓度:c增大,v增大
压强:有气体参加的反应,p增大,v增大
温度:T升高,v增大
催化剂:一般加快反应速率
化学反应速率与化学平衡
化学反应速率与化学平衡
化学反应的方向
焓判据:使体系能量降低的方向,就是反应容易进行
的方向
熵判据:使体系熵增大的方向,就是反应容易进行的
方向
复合判据
(ΔG=ΔH-TΔS)
ΔG<0,反应自发进行
ΔG>0,反应不能自发进行
ΔG=0,反应达到平衡
化学反应速率与化学平衡
化学平衡
概念:可逆反应、条件一定,v正=v逆,各组分浓度不变
特征:逆、动、等、定、变
移动因果
原因:外界条件(浓度、压强、温度)改变,v正=
v逆―→v正≠v逆
结果:再次v正=v逆,各组分的含量又不变
方向:依据勒夏特列原理判断
返回
化学反应速率与化学平衡
化学平衡
化学平衡常数
表达式:对于aA(g)+bB(g) cC(g)+dD(g),
K=
影响因素:只与温度有关,与反应物或生成物的
浓度变化无关
应用
判断可逆反应进行的程度
判断可逆反应进行的方向
求反应物的转化率
体验高考 素养提升
考向一 化学反应速率、转化率及平衡常数的相关计算
例1
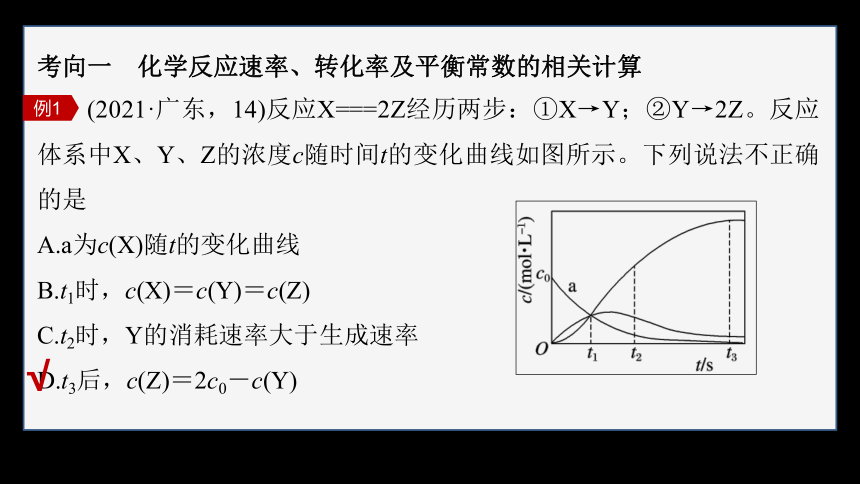
(2021·广东,14)反应X===2Z经历两步:①X→Y;②Y→2Z。反应体系中X、Y、Z的浓度c随时间t的变化曲线如图所示。下列说法不正确的是
A.a为c(X)随t的变化曲线
B.t1时,c(X)=c(Y)=c(Z)
C.t2时,Y的消耗速率大于生成速率
D.t3后,c(Z)=2c0-c(Y)
√
X是唯一的反应物,随着反应的发生,其浓度不断减小,因此,a为c(X)随t的变化曲线,A正确;
由图可知,分别代表3种不同物质的曲线相交于t1时刻,因此t1时,c(X)=c(Y)=c(Z),B正确;
由图中信息可知,t2时刻以后,Y的浓度仍在不断减小,说明t2时Y的消耗速率大于生成速率,C正确;
由图可知,t3时刻反应①完成,X完全转化为Y,若无反应②发生,则Y的浓度为c0,由于反应②Y→2Z的发生,t3时刻后Y的浓度的变化量为c0-c(Y),则生成的Z为c(Z)=2c0-2c(Y),D不正确。
例2
[2021·全国甲卷,28(2)]二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。二氧化碳加氢制甲醇的总反应可表示为
CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH=-49 kJ·mol-1
合成总反应在起始物 =3时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为x(CH3OH),在t=250 ℃下的x(CH3OH)~p、在p=5×105 Pa下的x(CH3OH)~t如图所示。
①用各物质的平衡分压表示总反应的平衡常数,
表达式Kp=________________。
二氧化碳加氢制甲醇的总反应为CO2(g)+3H2(g)===CH3OH(g)+H2O(g),用各物质的平衡分压表示总反应的平衡常数,表达式Kp=
②图中对应等压过程的曲线是_____,判断的理由是_____________________________________
__________________________________。
b
总反应ΔH<0,升高温度时平衡向逆反应
方向移动,甲醇的物质的量分数变小
该反应正反应方向为放热反应,升高温度时平衡逆向移动,体系中x(CH3OH)将减小,因此图中对应等压过程的曲线是b。
③当x(CH3OH)=0.10时,CO2的平衡转化率α=________,反应条件可能为__________________或________________。
33.3%
5×105 Pa,210 ℃
9×105 Pa,250 ℃
设起始n(CO2)=1 mol,n(H2)=3 mol,则
3H2(g)+CO2(g)===CH3OH(g)+H2O(g)
起始/mol 3 1 0 0
转化/mol 3x x x x
平衡/mol 3-3x 1-x x x
当平衡时,若x(CH3OH)=0.10,
由图可知,满足平衡时x(CH3OH)=0.10的条件有5×105Pa,210 ℃或9×105Pa,250 ℃。
[2021·广东,19(1)(2)(3)(4)]我国力争于2030年前做到碳达峰,2060年前实现碳中和。CH4与CO2重整是CO2利用的研究热点之一。该重整反应体系主要涉及以下反应:
(a)CH4(g)+CO2(g) 2CO(g)+2H2(g) ΔH1
(b)CO2(g)+H2(g) CO(g)+H2O(g) ΔH2
(c)CH4(g) C(s)+2H2(g) ΔH3
(d)2CO(g) CO2(g)+C(s) ΔH4
(e)CO(g)+H2(g) H2O(g)+C(s) ΔH5
例3
考向二 化学反应速率及平衡的影响因素
(1)根据盖斯定律,反应a的ΔH1 =______________________________(写出一个代数式即可)。
ΔH2+ΔH3-ΔH5(或ΔH3-ΔH4)
根据题目所给出反应的化学方程式关系可知,a=b+c-e=c-d,根据盖斯定律得ΔH1=ΔH2+ΔH3-ΔH5=ΔH3-ΔH4。
(2)题述反应体系在一定条件下建立平衡后,下列说法正确的有_____。
A.增大CO2与CH4的浓度,反应a、b、c的正反应速率都增加
B.移去部分C(s),反应c、d、e的平衡均向右移动
C.加入反应a的催化剂,可提高CH4的平衡转化率
D.降低反应温度,反应a~e的正、逆反应速率都减小
AD
增大CO2和CH4的浓度,对于反应a、b、c来说,均增大了反应物的浓度,反应的正反应速率均增大,A正确;
移去部分C(s),没有改变反应体系中的压强,反应的正、逆反应速率均不变,平衡不移动,B错误;
催化剂可在同等条件下增大正、逆反应速率,但只能加快反应进程,不改变反应的平衡状态,平衡转化率不变,C错误;
降低温度,体系的总能量降低,正、逆反应速率均减小,D正确。
(3)一定条件下,CH4分解形成碳的反应历程如图1所示。该历程分____步进行,其中,第___步的正反应活化能最大。
4
4
由图1可知,反应进程中能量变化出现了4个峰,即吸收了4次活化能,经历了4步反应;且从左往右看4次活化能吸收中,第4次对应的峰最高,即正反应方向第4步吸收的能量最多,对应的正反应活化能最大。
(4)设 为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0 =100 kPa)。
反应a、c、e的ln 随 (温度的倒数)的变化如图2所示。
①反应a、c、e中,属于吸热反应的有_____(填字母)。
ac
随着温度的升高,反应a和c的ln 增大,说明 的数值增大,反应向正反应方向进行,反应a和c为吸热反应,同理反应e的ln 减小,说明 的数值减小,反应向逆反应方向进行,反应e为放热反应。
②反应c的相对压力平衡常数表达式为
=____________。
③在图中A点对应温度下、原料组成为n(CO2)∶n(CH4)=1∶1、初始总压为100 kPa的恒容密闭容器中进行反应,体系达到平衡时H2的分压为40 kPa。计算CH4的平衡转化率,写出计算过程。
例4
[2020·天津,16(3)(4)]用H2还原CO2可以在一定条件下合成CH3OH(不考虑副反应)
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH<0
(3)某温度下,恒容密闭容器中,CO2和H2的起始浓度分别为a mol·L-1和3a mol·L-1,反应平衡时,CH3OH的产率为b,该温度下反应平衡常数
的值为_________________。
恒温恒容条件下进行反应,平衡时,CH3OH的产率为b,则反应物转化率为b,按“三段式”法计算:
CO2(g)+3H2(g) CH3OH(g)+H2O(g)
起始浓度/(mol·L-1) a 3a 0 0
转化浓度/(mol·L-1) ab 3ab ab ab
平衡浓度/(mol·L-1) a(1-b) 3a(1-b) ab ab
(4)恒压下,CO2和H2的起始物质的量比为1∶3时,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜时甲醇的产率随温度的变化如图所示,其中分子筛膜能选择性分离出H2O。
①甲醇的平衡产率随温度升高而降低的原因为______________________
_____________________________________。
②P点甲醇产率高于T点的原因为__________________________________
________________________________________。
该反应为放热反应,温
度升高,平衡逆向移动(或平衡常数减小)
分子筛膜从反应体系中不断分离出
H2O,有利于反应正向进行,甲醇产率升高
P点有分子筛膜,T点无分子筛膜,而分子筛膜能选择性分离出H2O,使平衡正向移动,提高甲醇的产率。
③根据图,在此条件下采用该分子筛膜时的最佳反应温度为______ ℃。
210
由题图可知,当有分子筛膜、温度为210 ℃时,甲醇产率最大,故采用该分子筛膜时的最佳反应温度为210 ℃。
返回
专题2
本课结束
体系构建 理清脉络 / 体验高考 素养提升
体系构建 体验高考
专题2
内容索引
体系构建 理清脉络
体验高考 素养提升
体系构建 理清脉络
化学反应速率
表示方法:v=
单位:mol·L-1·s-1或mol·L-1·min-1
简单计算
公式法
化学计量数之比法
影响因素
内因:反应物结构、性质(活化分子)
外因
浓度:c增大,v增大
压强:有气体参加的反应,p增大,v增大
温度:T升高,v增大
催化剂:一般加快反应速率
化学反应速率与化学平衡
化学反应速率与化学平衡
化学反应的方向
焓判据:使体系能量降低的方向,就是反应容易进行
的方向
熵判据:使体系熵增大的方向,就是反应容易进行的
方向
复合判据
(ΔG=ΔH-TΔS)
ΔG<0,反应自发进行
ΔG>0,反应不能自发进行
ΔG=0,反应达到平衡
化学反应速率与化学平衡
化学平衡
概念:可逆反应、条件一定,v正=v逆,各组分浓度不变
特征:逆、动、等、定、变
移动因果
原因:外界条件(浓度、压强、温度)改变,v正=
v逆―→v正≠v逆
结果:再次v正=v逆,各组分的含量又不变
方向:依据勒夏特列原理判断
返回
化学反应速率与化学平衡
化学平衡
化学平衡常数
表达式:对于aA(g)+bB(g) cC(g)+dD(g),
K=
影响因素:只与温度有关,与反应物或生成物的
浓度变化无关
应用
判断可逆反应进行的程度
判断可逆反应进行的方向
求反应物的转化率
体验高考 素养提升
考向一 化学反应速率、转化率及平衡常数的相关计算
例1
(2021·广东,14)反应X===2Z经历两步:①X→Y;②Y→2Z。反应体系中X、Y、Z的浓度c随时间t的变化曲线如图所示。下列说法不正确的是
A.a为c(X)随t的变化曲线
B.t1时,c(X)=c(Y)=c(Z)
C.t2时,Y的消耗速率大于生成速率
D.t3后,c(Z)=2c0-c(Y)
√
X是唯一的反应物,随着反应的发生,其浓度不断减小,因此,a为c(X)随t的变化曲线,A正确;
由图可知,分别代表3种不同物质的曲线相交于t1时刻,因此t1时,c(X)=c(Y)=c(Z),B正确;
由图中信息可知,t2时刻以后,Y的浓度仍在不断减小,说明t2时Y的消耗速率大于生成速率,C正确;
由图可知,t3时刻反应①完成,X完全转化为Y,若无反应②发生,则Y的浓度为c0,由于反应②Y→2Z的发生,t3时刻后Y的浓度的变化量为c0-c(Y),则生成的Z为c(Z)=2c0-2c(Y),D不正确。
例2
[2021·全国甲卷,28(2)]二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。二氧化碳加氢制甲醇的总反应可表示为
CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH=-49 kJ·mol-1
合成总反应在起始物 =3时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为x(CH3OH),在t=250 ℃下的x(CH3OH)~p、在p=5×105 Pa下的x(CH3OH)~t如图所示。
①用各物质的平衡分压表示总反应的平衡常数,
表达式Kp=________________。
二氧化碳加氢制甲醇的总反应为CO2(g)+3H2(g)===CH3OH(g)+H2O(g),用各物质的平衡分压表示总反应的平衡常数,表达式Kp=
②图中对应等压过程的曲线是_____,判断的理由是_____________________________________
__________________________________。
b
总反应ΔH<0,升高温度时平衡向逆反应
方向移动,甲醇的物质的量分数变小
该反应正反应方向为放热反应,升高温度时平衡逆向移动,体系中x(CH3OH)将减小,因此图中对应等压过程的曲线是b。
③当x(CH3OH)=0.10时,CO2的平衡转化率α=________,反应条件可能为__________________或________________。
33.3%
5×105 Pa,210 ℃
9×105 Pa,250 ℃
设起始n(CO2)=1 mol,n(H2)=3 mol,则
3H2(g)+CO2(g)===CH3OH(g)+H2O(g)
起始/mol 3 1 0 0
转化/mol 3x x x x
平衡/mol 3-3x 1-x x x
当平衡时,若x(CH3OH)=0.10,
由图可知,满足平衡时x(CH3OH)=0.10的条件有5×105Pa,210 ℃或9×105Pa,250 ℃。
[2021·广东,19(1)(2)(3)(4)]我国力争于2030年前做到碳达峰,2060年前实现碳中和。CH4与CO2重整是CO2利用的研究热点之一。该重整反应体系主要涉及以下反应:
(a)CH4(g)+CO2(g) 2CO(g)+2H2(g) ΔH1
(b)CO2(g)+H2(g) CO(g)+H2O(g) ΔH2
(c)CH4(g) C(s)+2H2(g) ΔH3
(d)2CO(g) CO2(g)+C(s) ΔH4
(e)CO(g)+H2(g) H2O(g)+C(s) ΔH5
例3
考向二 化学反应速率及平衡的影响因素
(1)根据盖斯定律,反应a的ΔH1 =______________________________(写出一个代数式即可)。
ΔH2+ΔH3-ΔH5(或ΔH3-ΔH4)
根据题目所给出反应的化学方程式关系可知,a=b+c-e=c-d,根据盖斯定律得ΔH1=ΔH2+ΔH3-ΔH5=ΔH3-ΔH4。
(2)题述反应体系在一定条件下建立平衡后,下列说法正确的有_____。
A.增大CO2与CH4的浓度,反应a、b、c的正反应速率都增加
B.移去部分C(s),反应c、d、e的平衡均向右移动
C.加入反应a的催化剂,可提高CH4的平衡转化率
D.降低反应温度,反应a~e的正、逆反应速率都减小
AD
增大CO2和CH4的浓度,对于反应a、b、c来说,均增大了反应物的浓度,反应的正反应速率均增大,A正确;
移去部分C(s),没有改变反应体系中的压强,反应的正、逆反应速率均不变,平衡不移动,B错误;
催化剂可在同等条件下增大正、逆反应速率,但只能加快反应进程,不改变反应的平衡状态,平衡转化率不变,C错误;
降低温度,体系的总能量降低,正、逆反应速率均减小,D正确。
(3)一定条件下,CH4分解形成碳的反应历程如图1所示。该历程分____步进行,其中,第___步的正反应活化能最大。
4
4
由图1可知,反应进程中能量变化出现了4个峰,即吸收了4次活化能,经历了4步反应;且从左往右看4次活化能吸收中,第4次对应的峰最高,即正反应方向第4步吸收的能量最多,对应的正反应活化能最大。
(4)设 为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0 =100 kPa)。
反应a、c、e的ln 随 (温度的倒数)的变化如图2所示。
①反应a、c、e中,属于吸热反应的有_____(填字母)。
ac
随着温度的升高,反应a和c的ln 增大,说明 的数值增大,反应向正反应方向进行,反应a和c为吸热反应,同理反应e的ln 减小,说明 的数值减小,反应向逆反应方向进行,反应e为放热反应。
②反应c的相对压力平衡常数表达式为
=____________。
③在图中A点对应温度下、原料组成为n(CO2)∶n(CH4)=1∶1、初始总压为100 kPa的恒容密闭容器中进行反应,体系达到平衡时H2的分压为40 kPa。计算CH4的平衡转化率,写出计算过程。
例4
[2020·天津,16(3)(4)]用H2还原CO2可以在一定条件下合成CH3OH(不考虑副反应)
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH<0
(3)某温度下,恒容密闭容器中,CO2和H2的起始浓度分别为a mol·L-1和3a mol·L-1,反应平衡时,CH3OH的产率为b,该温度下反应平衡常数
的值为_________________。
恒温恒容条件下进行反应,平衡时,CH3OH的产率为b,则反应物转化率为b,按“三段式”法计算:
CO2(g)+3H2(g) CH3OH(g)+H2O(g)
起始浓度/(mol·L-1) a 3a 0 0
转化浓度/(mol·L-1) ab 3ab ab ab
平衡浓度/(mol·L-1) a(1-b) 3a(1-b) ab ab
(4)恒压下,CO2和H2的起始物质的量比为1∶3时,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜时甲醇的产率随温度的变化如图所示,其中分子筛膜能选择性分离出H2O。
①甲醇的平衡产率随温度升高而降低的原因为______________________
_____________________________________。
②P点甲醇产率高于T点的原因为__________________________________
________________________________________。
该反应为放热反应,温
度升高,平衡逆向移动(或平衡常数减小)
分子筛膜从反应体系中不断分离出
H2O,有利于反应正向进行,甲醇产率升高
P点有分子筛膜,T点无分子筛膜,而分子筛膜能选择性分离出H2O,使平衡正向移动,提高甲醇的产率。
③根据图,在此条件下采用该分子筛膜时的最佳反应温度为______ ℃。
210
由题图可知,当有分子筛膜、温度为210 ℃时,甲醇产率最大,故采用该分子筛膜时的最佳反应温度为210 ℃。
返回
专题2
本课结束
