专题2第二单元 化学反应的方向与限度 第2课时 化学平衡状态(共69张ppt)
文档属性
| 名称 | 专题2第二单元 化学反应的方向与限度 第2课时 化学平衡状态(共69张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-30 09:04:48 | ||
图片预览










文档简介
(共69张PPT)
第2课时
DIERKESHI
可逆反应及其特征 / 化学平衡状态及其特征 / 课时对点练
化学平衡状态
专题2
1.变化观念与平衡思想:
从可逆反应化学平衡状态的建立过程,认识化学平衡是一种动态平衡。
2.证据推理与模型认知:
熟知化学平衡状态的特征,建立化学平衡状态判断方法的思维模型。
内容索引
一、可逆反应及其特征
二、化学平衡状态及其特征
课时对点练
可逆反应及其特征
一
1.可逆反应
(1)概念:在相同条件下,既能向 方向进行,同时又能向 方向进行的反应。
(2)特征
正反应
逆反应
相同
同时
2.常见的可逆反应
(1)H2与O2点燃可以生成水,电解水又可以生成H2与O2,所以两个反应是可逆反应( )
(2)合成氨反应中,如果N2过量,则可以使H2完全被消耗( )
(3)对于可逆反应,若加入反应物,则反应先向正反应方向进行,停止后再向逆反应方向进行( )
(4)Pb+PbO2+2H2SO4 2PbSO4+2H2O为可逆反应( )
正误判断
×
×
×
×
1.在容器中充入SO2和18O2,在一定条件下发生反应:2SO2+O2
2SO3,一段时间后,18O原子存在于哪些分子中?原因是什么?
提示 SO2、O2、SO3分子中都可能存在。SO2与18O2反应生成SO3,所以SO3中有18O原子,该反应是可逆反应,生成的SO3同时又有部分分解,分解出的SO2和O2中也会有18O原子。
2.为探究FeCl3溶液和KI溶液的反应为可逆反应,某小组取5 mL 0.1 mol·L-1
KI溶液向其中滴加0.1 mol·L-1FeCl3溶液4~5滴,充分反应,试根据下列提供的试剂分析该小组确定FeCl3和KI反应为可逆反应的依据。(试剂:AgNO3溶液、CCl4、KSCN溶液、淀粉溶液)
提示 根据反应:2Fe3++2I-===I2+2Fe2+,KI溶液过量,如反应不为可逆反应,则Fe3+会完全反应,因此只要证明溶液中有Fe3+,则证明上述反应为可逆反应,故可取反应后的溶液,向溶液中加入KSCN溶液,如溶液变血红色,则证明上述反应为可逆反应。
返回
化学平衡状态及其特征
二
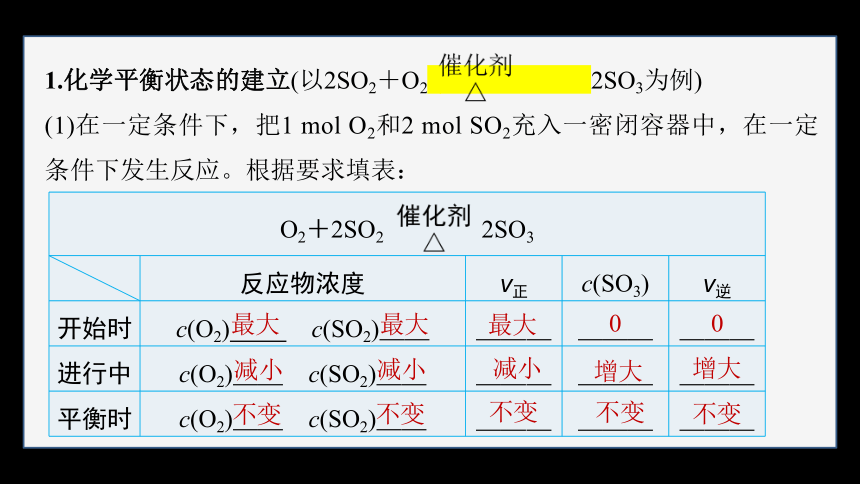
1.化学平衡状态的建立(以2SO2+O2 2SO3为例)
(1)在一定条件下,把1 mol O2和2 mol SO2充入一密闭容器中,在一定条件下发生反应。根据要求填表:
O2+2SO2 2SO3 反应物浓度 v正 c(SO3) v逆
开始时 c(O2) c(SO2)__ ___ ___ ___
进行中 c(O2)__ c(SO2)__ ___ ___ ___
平衡时 c(O2)__ c(SO2)__ ___ ___ ___
最大
最大
减小
不变
不变
减小
最大
减小
不变
0
增大
不变
0
增大
不变
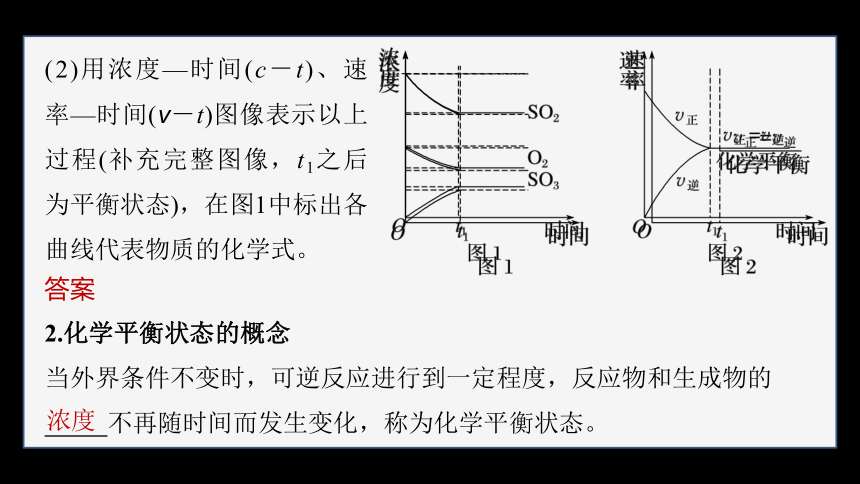
(2)用浓度—时间(c-t)、速率—时间(v-t)图像表示以上过程(补充完整图像,t1之后为平衡状态),在图1中标出各曲线代表物质的化学式。
答案
2.化学平衡状态的概念
当外界条件不变时,可逆反应进行到一定程度,反应物和生成物的
不再随时间而发生变化,称为化学平衡状态。
浓度
3.化学平衡状态的特征
可逆反应
相等
v正=v逆
v正=v逆≠0
一定
(1)只有可逆反应才存在平衡状态( )
(2)化学平衡状态是一定条件下可逆反应进行到最大限度的结果( )
(3)化学反应达到化学平衡状态时,正、逆反应的速率都为0( )
(4)化学反应达到化学平衡状态时反应物和生成物的浓度相等( )
(5)化学反应达到化学平衡状态时,反应混合物中各组分的浓度一定与化学方程式中对应物质的化学计量数成比例( )
正误判断
√
√
×
×
×
1.在一定条件下,可逆反应2A(g) B(g)+3C(g),在下列几种状态中,达
到平衡状态的是________(填序号)。
①正反应速率v(A)=2 mol·L-1·min-1,逆反应速率v(A)=2 mol·L-1·min-1
②正反应速率v(A)=2 mol·L-1·min-1,逆反应速率v(B)=1 mol·L-1·min-1
③正反应速率v(A)=2 mol·L-1·min-1,正反应速率v(B)=1 mol·L-1·min-1
④正反应速率v(A)=2 mol·L-1·min-1,逆反应速率v(C)=2 mol·L-1·min-1
对比②③、对比②④分别可得出利用反应速率判断反应是否达到平衡状态有哪些注意事项?
答案 ①② 对比②③可得出反应速率不能全为同一方向的速率,应一正一逆;对比②④可得出不同物质表示的一正一逆速率数值不一定相等,应转化成同一物质表示的速率且相等或速率比等于化学计量数之比。
2.在恒温恒容的密闭容器中,当下列物理量不再发生变化时:①混合气体的压强,②混合气体的密度,③混合气体的总物质的量,④混合气体的平均相对分子质量,⑤混合气体的颜色,⑥各反应物或生成物的反应速率之比都等于化学计量数之比。
(1)一定能证明2SO2(g)+O2(g) 2SO3(g)达到平衡状态的是________(填序号,下同)。
①③④
混合气体的密度是混合气体的总质量与容器容积的比值,混合气体的平均相对分子质量是混合气体的总质量与总物质的量的比值,混合气体颜色的深浅与有色气体的浓度有关系。在任何时刻各反应物或生成物的反应速率之比都等于化学计量数之比。
反应2SO2(g)+O2(g) 2SO3(g)是反应前后气体体积减小的可逆反应,
因此混合气体的压强、总物质的量和平均相对分子质量不变均可以说明反应达到平衡状态。
(2)一定能证明I2(g)+H2(g) 2HI(g)达到平衡状态的是____。
⑤
反应I2(g)+H2(g) 2HI(g)是反应前后气体体积不变的可逆反应,由于碘蒸气是有色气体,则混合气体的颜色不变可以说明反应达到平衡状态。
(3)一定能证明A(s)+2B(g) C(g)+D(g)达到平衡状态的是_______。
②④
反应A(s)+2B(g) C(g)+D(g)是反应前后气体体积不变,但气体质量
增加的可逆反应,因此混合气体的密度、混合气体的平均相对分子质量不变可以说明反应达到平衡状态。
应用体验
1.如图是可逆反应X+3Y 2Z在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是
A.t2~t3时,各物质的浓度不再发生变化
B.t2时,反应未达到限度
C.t2~t3时,反应已停止进行
D.t1时,反应只向正反应方向进行
√
t2~t3时,正、逆反应速率相等,反应达到平衡状态,各物质的浓度不再发生变化,A正确;
t2时,正、逆反应的速率相等,反应达到平衡状态,即反应达到限度,B错误;
t2~t3时,正、逆反应速率相等,反应达到平衡状态,但反应速率不为0,反应没有停止,C错误;
t1时,正、逆反应速率均不为0,反应向正反应方向进行的同时也向逆反应方向进行,D错误。
2.一定条件下,向2 L恒容密闭容器中充入1 mol COCl2(g),发生反应:COCl2(g) Cl2(g)+ CO(g),
t/s 0 2 4 6 8
n(Cl2)/mol 0 0.30 0.39 0.40 0.40
反应过程中测得的有关数据如表所示,下列说法不正确的是
A.6 s之后反应达到平衡状态,容器内的压强不再随时间的延续而改变
B.达到6 s时,反应停止,不再进行
C.8 s时,反应容器中各物质的浓度不再发生变化
D.生成Cl2的平均反应速率:0~2 s>2~4 s
√
6 s之后氯气的物质的量不再改变,化学反应达到平衡状态,容器内气体总物质的量保持不变,因而压强不变,故A正确;
6 s时反应处于平衡状态,反应不会停止,仍在进行,故B错误;
在8 s时是平衡状态,反应容器中各物质的浓度不再发生变化,故C正确;
0~2 s生成氯气0.30 mol,2~4 s生成氯气0.09 mol,可知0~2 s反应生成Cl2的平均反应速率大,故D正确。
t/s 0 2 4 6 8
n(Cl2)/mol 0 0.30 0.39 0.40 0.40
归纳总结
判断可逆反应是否达到平衡状态的方法
(1)直接判据
①v正=v逆。
②反应混合物中各组分的质量和浓度保持不变。
(2)间接判据
①常用物理量:气体总的物质的量、压强、混合气体的平均密度(ρ= )、平均摩尔质量( )。
归纳总结
②判断方法:“变量不变即为平”,即假设反应向正反应方向进行时,该物理量若发生变化,则某时刻该物理量不再改变时,即认为达到平衡状态。若该物理量为一直不变的量,则无法用于判断。
返回
课时对点练
题组一 可逆反应概念的理解
1.已知298 K时,合成氨反应:N2(g)+3H2(g) 2NH3(g) ΔH=-92.0 kJ·
mol-1,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量(忽略能量损失)
A.一定大于92.0 kJ B.一定等于92.0 kJ
C.一定小于92.0 kJ D.不能确定
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
N2和H2发生反应生成NH3的反应为可逆反应,可逆反应不能进行到底,此温度下的1 mol N2和3 mol H2放在一密闭容器中,生成NH3的物质的量小于2 mol,则反应放出的热量小于92.0 kJ,故C正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
2.14CO2与碳在高温条件下发生反应:14CO2+C 2CO,达到化学平衡后,平衡混合物中含14C的粒子有
A.14CO2 B.14CO2、14CO
C.14CO2、14CO、14C D.14CO
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
当可逆反应达到平衡状态时,反应并没停止,是一种动态平衡,所以在三种物质中都含有14C。
3.一定条件下,在一密闭容器中进行反应2SO2(g)+O2(g) 2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 mol·L-1、0.1 mol·
L-1、0.2 mol·L-1,当反应达到平衡时,可能存在的情况是
A.SO2为0.4 mol·L-1,O2为0.2 mol·L-1
B.SO2为0.25 mol·L-1
C.SO2、SO3均为0.15 mol·L-1
D.SO3为0.4 mol·L-1
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
SO2和O2的浓度增大,说明反应从逆反应方向建立平衡,若SO3完全反应,则SO2和O2的浓度变化分别为0.2 mol·L-1、0.1 mol·L-1,又因该反应为可逆反应,实际变化应小于该值,所以达到平衡时SO2小于0.4 mol·
L-1,O2小于0.2 mol·L-1,故A错误;
该项中SO2浓度实际变化为0.05 mol·L-1,小于0.2 mol·L-1,故B正确;
反应物、生成物的浓度不可能同时减小,故C错误;
SO3的浓度增大,说明该反应从正反应方向建立平衡,若二氧化硫和氧气完全反应,SO3的浓度变化为0.2 mol·L-1,又因该反应为可逆反应,实际变化应小于该值,故D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
题组二 化学平衡状态
4.下列对化学反应限度的叙述,不正确的是
A.任何可逆反应在给定的条件下的进程都有一定的限度,不同反应的限
度不同
B.可逆反应不能进行到底,所以可逆反应不容易发生
C.化学反应达到平衡时,反应物和生成物的浓度均不再改变,但物质间
的转化仍在进行
D.改变反应条件,化学反应限度可能改变
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
任何可逆反应都有一定的限度,但化学反应不同,限度不同,A正确;
可逆反应不可能完全转化,但有些可逆反应容易发生,如氨气与水反应就是容易发生的可逆反应,B错误;
当化学反应达到反应限度时,正、逆反应速率相等,但反应没有停止,只不过生成与消耗的同种物质的物质的量相等,C正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
5.一定条件下,向密闭容器中充入1 mol NO和1 mol CO进行反应:NO(g)+CO(g) N2(g)+CO2(g),测得化学反应速率随时间的变化关系如图所示,其中处于化学平衡状态的点是
A.d点 B.b点
C.c点 D.a点
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
由图可知,a、b、c点的正反应速率均大于逆反应速率,都未达到平衡状态;只有d点正、逆反应速率相等,由正、逆反应速率相等的状态为平衡状态可知,选项A正确。
6.在1 273 K、100.0 kPa条件下,乙烷生成乙烯的反应C2H6(g) C2H4(g)+H2(g)达到平衡后
A.C2H6的浓度保持不变
B.C2H6仍在不断分解,其浓度不断减少
C.C2H6的分解速率大于生成速率
D.C2H4仍在不断生成,其浓度不断增加
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
达到平衡后,正、逆反应速率相等,各物质的浓度不再变化,但各种物质仍在反应。
7.一定条件下,0.3 mol X(g)与0.3 mol Y(g)在容积固定的密闭容器中发生反应:X(g)+3Y(g) 2Z(g) ΔH=-a kJ·mol-1,下列说法正确的是
A.反应一段时间后,X与Y的物质的量之比仍为1∶1
B.达到平衡时,反应放出0.1a kJ的热量
C.达到平衡后,若向平衡体系中充入稀有气体,Z的正反应速率将不发生
变化
D.X的体积分数保持不变,说明反应已达到平衡
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
√
A项,反应过程中X与Y的变化量之比是1∶3,则反应一段时间后,X与Y的物质的量之比不可能仍为1∶1,错误;
B项,达到平衡时,因可逆反应不能反应完全,则反应的X小于0.1 mol,反应放出的热量小于0.1a kJ,错误;
C项,恒容条件下,达到平衡后,若向平衡体系中充入稀有气体,不影响反应物和生成物的浓度,反应速率也不变,正确;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
D项,
X(g)+ 3Y(g) 2Z(g)
起始/mol 0.3 0.3 0
变化/mol x 3x 2x
变后/mol 0.3-x 0.3-3x 2x
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
则X的体积分数保持不变,不能说明反应已达到平衡,错误。
题组三 化学平衡状态的判断
8.(2022·北京延庆区高二检测)用氮化硅陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率。工业上用化学气相沉积制备氮化硅,其反应如下:3SiCl4(g)+2N2(g)+6H2(g) Si3N4(s)+12HCl(g) ΔH<0。一定条件下,在恒容密闭容器中发生上述反应,能说明反应达到化学平衡状态的是
A.3v正(N2)=v正(H2) B.v正(HCl)=4v正(SiCl4)
C.混合气体的密度保持不变 D.c(N2)∶c(H2)∶c(HCl)=1∶3∶6
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
3v正(N2)=v正(H2),v正(HCl)=4v正(SiCl4),两个等式两边都表示正反应速率,反应过程中始终成立,不能说明达到化学平衡状态,故A、B错误;
该反应有固体生成,属于反应前后气体的质量发生变化的反应,恒容密闭容器中,混合气体的密度保持不变,说明混合气体的总质量不变,正、逆反应速率相等,反应达到平衡状态,故C正确;
某时刻各物质浓度关系与其起始浓度和转化率有关,与是否达到平衡状态无关,则c(N2)∶c(H2)∶c(HCl)=1∶3∶6不能说明反应达到平衡状态,故D错误。
17
9.对于反应2SO2(g)+O2(g) 2SO3(g),判断下列说法正确的是
①单位时间内生成2 mol SO2,同时生成1 mol O2,则处于化学平衡状态 ②SO2的生成速率等于SO2的消耗速率,则处于化学平衡状态 ③SO2、O2、SO3的体积分数不再发生变化,则处于化学平衡状态 ④SO2、O2、SO3的分子数之比为2∶1∶2,则处于化学平衡状态
A.①③ B.②④ C.②③ D.③④
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
①生成2 mol SO2、生成1 mol O2均代表逆反应方向,错误;
②正、逆反应速率相等,则处于平衡状态,正确;
③SO2、O2、SO3的体积分数不再发生变化,即各组分的浓度保持不变,处于平衡状态,正确;
④SO2、O2、SO3的分子数之比为2∶1∶2,并不能说明各组分的浓度保持不变,不一定处于平衡状态,错误。
17
10.一定条件下,将NO2与SO2以体积比为1∶2置于密闭容器中,发生反应:NO2(g)+SO2(g) SO3(g)+NO(g) ΔH=-41.8 kJ·mol-1,下列能说明反应达到平衡状态的是
A.体系压强保持不变
B.混合气体颜色保持不变
C.SO3和NO的体积比保持不变
D.每消耗1 mol SO3的同时生成1 mol NO2
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
17
由于该反应为反应前后气体体积相等的反应,体系的压强始终保持不变,故不能以压强不变作为判断反应是否达到平衡状态的标志,A错误;
SO3与NO的体积比始终保持1∶1,C错误;
消耗SO3和生成NO2为同一方向的反应,D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
11.将一定量纯净的氨基甲酸铵置于密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:H2NCOONH4(s) 2NH3(g)+CO2(g)。下列各项:①2v(NH3)=v(CO2);②密闭容器中总压强不变;③密闭容器中混合气体的密度不变;④密闭容器中氨气的体积分数不变;⑤密闭容器中c(NH3)不变,能判断该反应已经达到化学平衡状态的是
A.②③⑤ B.②③④
C.①④ D.全部
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
17
2v(NH3)=v(CO2),没有说明是正反应速率,还是逆反应速率,也不符合化学计量数的比例关系,①错误;
该反应是气体体积增大、压强增大的反应,密闭容器中总压强不变,能说明反应达到平衡,②正确;
根据ρ= ,气体质量增加,容器体积不变,密闭容器中混合气体的密度不变,能说明反应达到平衡,③正确;
NH3(g)、CO2(g)的量始终是以2∶1增加,因此密闭容器中氨气的体积分数始终不变,不能说明反应达到平衡,④错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
密闭容器中c(NH3)不变,各物质的浓度不再改变能作为反应达到平衡状态的标志,⑤正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
12.在一定温度下、容积不变的密闭容器中,可逆反应A(g)+3B(g) 2C(g)+2D(s)达到平衡状态的标志是
①C的生成速率与C的消耗速率相等
②单位时间内生成a mol A,同时生成3a mol B
③A、B、C的浓度不再改变
④混合气体的密度不再改变
⑤混合气体的总压强不再改变
⑥混合气体的总物质的量不再改变
⑦A、B、C的浓度之比为1∶3∶2
A.③④⑤⑥⑦ B.①③④⑤⑥ C.①②③④⑦ D.②③④⑤⑥
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
√
①C的生成速率与C的消耗速率相等,即v正=v逆,说明该反应达到平衡状态,正确;
②无论该反应是否达到平衡状态,单位时间内生成a mol A的同时都会生成3a mol B,所以不能作为达到平衡状态的标志,错误;
③反应达到平衡状态时,各物质的物质的量保持不变,浓度也不变,所以A、B、C的浓度不再变化,说明该反应达到平衡状态,正确;
④反应前后气体的总质量发生改变,容器容积一定,当混合气体的密度不再发生改变时,说明反应达到平衡状态,正确;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
⑤该反应是反应前后气体分子数减小的反应,容器容积、温度均不变,当混合气体的总压强不再变化时,说明反应达到平衡状态,正确;
⑥该反应是反应前后气体的物质的量减小的反应,当混合气体的总物质的量不再变化时,说明反应达到平衡状态,正确;
⑦达到平衡状态时,A、B、C三种物质的浓度之比可能是1∶3∶2,也可能不是1∶3∶2,错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
题组四 化学平衡的简单计算
13.(2022·湖北巴东高二检测)将2 mol X和2 mol Y充入2 L密闭容器中发生如下反应:X(g)+3Y(g) 2Z(g)+aQ(g),2 min后达到平衡状态时生成0.8 mol Z,测得Q的浓度为0.4 mol·L-1,则下列叙述错误的是
A.a的值为2
B.平衡时X的浓度为0.2 mol·L-1
C.平衡时Z的体积百分含量为20%
D.2 min内平均反应速率v(Y)=0.3 mol·L-1·min-1
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
平衡时生成0.8 mol Z,测得Q的浓度为0.4 mol·L-1,则生成的Q的物质的量n(Q)=0.4 mol·L-1×2 L=0.8 mol,所以2∶a=0.8 mol∶0.8 mol,计算得出a=2,A正确;
平衡时生成0.8 mol Z,则参加反应的X的物质的量为0.8 mol× =0.4 mol,故平衡时X的物质的量为2 mol-0.4 mol=1.6 mol,平衡时X的浓度为
=0.8 mol·L-1,B错误;
2 min内平均反应速率v(Y)= =0.3 mol·L-1·min-1,D正确。
14.一定条件下,对于反应X(g)+3Y(g) 2Z(g),若起始时,X、Y、Z的浓度分别为c1 mol·L-1、c2 mol·L-1、c3 mol·L-1(均不为零)。达平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1和0.08 mol·L-1,则下列判断错误的是
A.c1∶c2=1∶3
B.平衡时,Y和Z的生成速率之比为2∶3
C.平衡时消耗的X和Z的物质的量之比为1∶2
D.c1的取值范围为0<c1<0.14
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
√
分析浓度变化关系:
X(g)+3Y(g) 2Z(g)
起始/(mol·L-1) c1 c2 c3
平衡/(mol·L-1) 0.1 0.3 0.08
反应方程式中反应物X、Y的化学计量数之比为1∶3,所以反应中X和Y必然以物质的量之比为1∶3消耗,因为达平衡时X和Y的浓度之比为1∶3,故c1∶c2=1∶3,A项正确;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
平衡时Y和Z的生成速率之比和反应方程式中二者的化学计量数之比相等,故Y和Z的生成速率之比为3∶2,B项错误;
平衡时消耗X和Z的物质的量之比和反应方程式中二者的化学计量数之比相等,故平衡时消耗的X和Z的物质的量之比为1∶2,C项正确;
运用极限法,假设起始时Z的浓度为0 mol·L-1,则c1的最大值为0.14,而c1>0,反应又是可逆的,D项正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
15.(2021·郑州高二质量检测)恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2(g)+3H2(g)
2NH3(g)。
(1)反应进行到某时刻t时,nt(N2)=13 mol,nt(NH3)=6 mol,则a=____。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
16
反应进行到t时,nt(N2)=13 mol,nt(NH3)=6 mol,由化学方程式可知,参加反应的N2的物质的量为3 mol,故N2的起始物质的量为13 mol+
3 mol=16 mol,即a=16。
(2)反应达到平衡时,混合气体的体积为716.8 L(标准状况),其中NH3的含量(体积分数)为25%,平衡时NH3的物质的量为________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
8 mol
达到平衡时,混合气体的总物质的量n(总)= =32 mol,其中NH3的物质的量为32 mol×25%=8 mol。
(3)原混合气体与平衡时混合气体的总物质的量之比n(始)∶n(平)=______(写出最简整数比)。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
5∶4
利用差量法计算
N2(g)+3H2(g) 2NH3(g) 减少的物质的量
转化/mol 4 12 8 8
由以上分析可知,当生成8 mol NH3达到平衡时,减少的物质的量为8 mol。
由(2)知,平衡时混合气体的总物质的量为32 mol,故原混合气体的物质的量为32 mol+8 mol=40 mol,原混合气体与平衡时混合气体的总物质的量之比为40 mol∶32 mol=5∶4。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
16.(2021·无锡高二月考)在698 K时,向某V L的密闭容器中充入2 mol H2(g)和2 mol I2(g),发生反应:H2(g)+I2(g) 2HI(g) ΔH=-26.5 kJ·mol-1,测得各物质的物质的量浓度与时间变化的关系如图所示。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
请回答下列问题:
(1)V=___。
2
由图知初始反应时,c(H2)=c(I2)=1.00 mol·L-1,而加入的H2和I2的物质的量均为2 mol,所以V=2。
(2)该反应达到最大限度的时间是_____,该时间内平均反应速率v(HI)=___________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
5 s
0.316 mol·L-1·s-1
反应达到最大限度即达到化学平衡,所需时间为5 s,v(HI)=
=0.316 mol·L-1·s-1。
(3)该反应达到平衡状态时,______(填“吸收”或“放出”)的热量为__________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
放出
41.87 kJ
可逆反应从正反应方向建立,所以需放出热量。由反应H2(g)+I2(g)
2HI(g) ΔH=-26.5 kJ·mol-1可知,达到平衡时共生成n(HI)=1.58 mol·L-1
×2 L=3.16 mol,所以放出的热量为 ×3.16 mol=41.87 kJ。
17.一定温度下,在10 L密闭容器中加入5 mol SO2和3 mol O2,发生反应:2SO2(g)+O2(g) 2SO3(g),10 min时,反应达到平衡状态,此时有3 mol
SO2发生了反应。
(1)反应生成了____ mol SO3,v(SO2)=____________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
3
0.03 mol·L-1·min-1
(2)平衡时SO3的浓度是_____________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
0.3 mol·L-1
2SO2(g)+O2(g) 2SO3(g)
起始/mol 5 3 0
变化/mol 3 1.5 3
平衡/mol 2 1.5 3
则平衡时SO3的浓度为 =0.3 mol·L-1。
(3)平衡时容器内气体的总物质的量为______ mol。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
6.5
平衡时混合气体的总物质的量为2 mol+1.5 mol+3 mol=6.5 mol。
(4)物质的浓度不再改变标志着该反应已达平衡状态,下列还可以说明该反应已达平衡状态的是________(填序号)。
①体系内压强不再改变
②容器内气体的密度不再改变
③混合气体的平均相对分子质量不再改变
④v正(SO3)=2v逆(O2)
⑤n(SO3)∶n(O2)∶n(SO2)=2∶1∶2
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
①③④
根据反应的化学方程式知:①中体系压强不变,说明反应已达平衡状态;
②中容器的体积不变,混合气体的质量不变,则反应过程中密度始终不变,密度不变不能说明反应已达平衡状态;
③中混合气体的总质量不变,但反应过程中混合气体的总物质的量改变,若平均相对分子质量不变,说明反应已达平衡状态;
④表示v正=v逆,说明反应已达平衡状态;
⑤中三者的物质的量之比等于化学计量数之比,不能说明反应已达平衡状态。
返回
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
专题2
本课结束
第2课时
DIERKESHI
可逆反应及其特征 / 化学平衡状态及其特征 / 课时对点练
化学平衡状态
专题2
1.变化观念与平衡思想:
从可逆反应化学平衡状态的建立过程,认识化学平衡是一种动态平衡。
2.证据推理与模型认知:
熟知化学平衡状态的特征,建立化学平衡状态判断方法的思维模型。
内容索引
一、可逆反应及其特征
二、化学平衡状态及其特征
课时对点练
可逆反应及其特征
一
1.可逆反应
(1)概念:在相同条件下,既能向 方向进行,同时又能向 方向进行的反应。
(2)特征
正反应
逆反应
相同
同时
2.常见的可逆反应
(1)H2与O2点燃可以生成水,电解水又可以生成H2与O2,所以两个反应是可逆反应( )
(2)合成氨反应中,如果N2过量,则可以使H2完全被消耗( )
(3)对于可逆反应,若加入反应物,则反应先向正反应方向进行,停止后再向逆反应方向进行( )
(4)Pb+PbO2+2H2SO4 2PbSO4+2H2O为可逆反应( )
正误判断
×
×
×
×
1.在容器中充入SO2和18O2,在一定条件下发生反应:2SO2+O2
2SO3,一段时间后,18O原子存在于哪些分子中?原因是什么?
提示 SO2、O2、SO3分子中都可能存在。SO2与18O2反应生成SO3,所以SO3中有18O原子,该反应是可逆反应,生成的SO3同时又有部分分解,分解出的SO2和O2中也会有18O原子。
2.为探究FeCl3溶液和KI溶液的反应为可逆反应,某小组取5 mL 0.1 mol·L-1
KI溶液向其中滴加0.1 mol·L-1FeCl3溶液4~5滴,充分反应,试根据下列提供的试剂分析该小组确定FeCl3和KI反应为可逆反应的依据。(试剂:AgNO3溶液、CCl4、KSCN溶液、淀粉溶液)
提示 根据反应:2Fe3++2I-===I2+2Fe2+,KI溶液过量,如反应不为可逆反应,则Fe3+会完全反应,因此只要证明溶液中有Fe3+,则证明上述反应为可逆反应,故可取反应后的溶液,向溶液中加入KSCN溶液,如溶液变血红色,则证明上述反应为可逆反应。
返回
化学平衡状态及其特征
二
1.化学平衡状态的建立(以2SO2+O2 2SO3为例)
(1)在一定条件下,把1 mol O2和2 mol SO2充入一密闭容器中,在一定条件下发生反应。根据要求填表:
O2+2SO2 2SO3 反应物浓度 v正 c(SO3) v逆
开始时 c(O2) c(SO2)__ ___ ___ ___
进行中 c(O2)__ c(SO2)__ ___ ___ ___
平衡时 c(O2)__ c(SO2)__ ___ ___ ___
最大
最大
减小
不变
不变
减小
最大
减小
不变
0
增大
不变
0
增大
不变
(2)用浓度—时间(c-t)、速率—时间(v-t)图像表示以上过程(补充完整图像,t1之后为平衡状态),在图1中标出各曲线代表物质的化学式。
答案
2.化学平衡状态的概念
当外界条件不变时,可逆反应进行到一定程度,反应物和生成物的
不再随时间而发生变化,称为化学平衡状态。
浓度
3.化学平衡状态的特征
可逆反应
相等
v正=v逆
v正=v逆≠0
一定
(1)只有可逆反应才存在平衡状态( )
(2)化学平衡状态是一定条件下可逆反应进行到最大限度的结果( )
(3)化学反应达到化学平衡状态时,正、逆反应的速率都为0( )
(4)化学反应达到化学平衡状态时反应物和生成物的浓度相等( )
(5)化学反应达到化学平衡状态时,反应混合物中各组分的浓度一定与化学方程式中对应物质的化学计量数成比例( )
正误判断
√
√
×
×
×
1.在一定条件下,可逆反应2A(g) B(g)+3C(g),在下列几种状态中,达
到平衡状态的是________(填序号)。
①正反应速率v(A)=2 mol·L-1·min-1,逆反应速率v(A)=2 mol·L-1·min-1
②正反应速率v(A)=2 mol·L-1·min-1,逆反应速率v(B)=1 mol·L-1·min-1
③正反应速率v(A)=2 mol·L-1·min-1,正反应速率v(B)=1 mol·L-1·min-1
④正反应速率v(A)=2 mol·L-1·min-1,逆反应速率v(C)=2 mol·L-1·min-1
对比②③、对比②④分别可得出利用反应速率判断反应是否达到平衡状态有哪些注意事项?
答案 ①② 对比②③可得出反应速率不能全为同一方向的速率,应一正一逆;对比②④可得出不同物质表示的一正一逆速率数值不一定相等,应转化成同一物质表示的速率且相等或速率比等于化学计量数之比。
2.在恒温恒容的密闭容器中,当下列物理量不再发生变化时:①混合气体的压强,②混合气体的密度,③混合气体的总物质的量,④混合气体的平均相对分子质量,⑤混合气体的颜色,⑥各反应物或生成物的反应速率之比都等于化学计量数之比。
(1)一定能证明2SO2(g)+O2(g) 2SO3(g)达到平衡状态的是________(填序号,下同)。
①③④
混合气体的密度是混合气体的总质量与容器容积的比值,混合气体的平均相对分子质量是混合气体的总质量与总物质的量的比值,混合气体颜色的深浅与有色气体的浓度有关系。在任何时刻各反应物或生成物的反应速率之比都等于化学计量数之比。
反应2SO2(g)+O2(g) 2SO3(g)是反应前后气体体积减小的可逆反应,
因此混合气体的压强、总物质的量和平均相对分子质量不变均可以说明反应达到平衡状态。
(2)一定能证明I2(g)+H2(g) 2HI(g)达到平衡状态的是____。
⑤
反应I2(g)+H2(g) 2HI(g)是反应前后气体体积不变的可逆反应,由于碘蒸气是有色气体,则混合气体的颜色不变可以说明反应达到平衡状态。
(3)一定能证明A(s)+2B(g) C(g)+D(g)达到平衡状态的是_______。
②④
反应A(s)+2B(g) C(g)+D(g)是反应前后气体体积不变,但气体质量
增加的可逆反应,因此混合气体的密度、混合气体的平均相对分子质量不变可以说明反应达到平衡状态。
应用体验
1.如图是可逆反应X+3Y 2Z在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是
A.t2~t3时,各物质的浓度不再发生变化
B.t2时,反应未达到限度
C.t2~t3时,反应已停止进行
D.t1时,反应只向正反应方向进行
√
t2~t3时,正、逆反应速率相等,反应达到平衡状态,各物质的浓度不再发生变化,A正确;
t2时,正、逆反应的速率相等,反应达到平衡状态,即反应达到限度,B错误;
t2~t3时,正、逆反应速率相等,反应达到平衡状态,但反应速率不为0,反应没有停止,C错误;
t1时,正、逆反应速率均不为0,反应向正反应方向进行的同时也向逆反应方向进行,D错误。
2.一定条件下,向2 L恒容密闭容器中充入1 mol COCl2(g),发生反应:COCl2(g) Cl2(g)+ CO(g),
t/s 0 2 4 6 8
n(Cl2)/mol 0 0.30 0.39 0.40 0.40
反应过程中测得的有关数据如表所示,下列说法不正确的是
A.6 s之后反应达到平衡状态,容器内的压强不再随时间的延续而改变
B.达到6 s时,反应停止,不再进行
C.8 s时,反应容器中各物质的浓度不再发生变化
D.生成Cl2的平均反应速率:0~2 s>2~4 s
√
6 s之后氯气的物质的量不再改变,化学反应达到平衡状态,容器内气体总物质的量保持不变,因而压强不变,故A正确;
6 s时反应处于平衡状态,反应不会停止,仍在进行,故B错误;
在8 s时是平衡状态,反应容器中各物质的浓度不再发生变化,故C正确;
0~2 s生成氯气0.30 mol,2~4 s生成氯气0.09 mol,可知0~2 s反应生成Cl2的平均反应速率大,故D正确。
t/s 0 2 4 6 8
n(Cl2)/mol 0 0.30 0.39 0.40 0.40
归纳总结
判断可逆反应是否达到平衡状态的方法
(1)直接判据
①v正=v逆。
②反应混合物中各组分的质量和浓度保持不变。
(2)间接判据
①常用物理量:气体总的物质的量、压强、混合气体的平均密度(ρ= )、平均摩尔质量( )。
归纳总结
②判断方法:“变量不变即为平”,即假设反应向正反应方向进行时,该物理量若发生变化,则某时刻该物理量不再改变时,即认为达到平衡状态。若该物理量为一直不变的量,则无法用于判断。
返回
课时对点练
题组一 可逆反应概念的理解
1.已知298 K时,合成氨反应:N2(g)+3H2(g) 2NH3(g) ΔH=-92.0 kJ·
mol-1,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量(忽略能量损失)
A.一定大于92.0 kJ B.一定等于92.0 kJ
C.一定小于92.0 kJ D.不能确定
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
N2和H2发生反应生成NH3的反应为可逆反应,可逆反应不能进行到底,此温度下的1 mol N2和3 mol H2放在一密闭容器中,生成NH3的物质的量小于2 mol,则反应放出的热量小于92.0 kJ,故C正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
2.14CO2与碳在高温条件下发生反应:14CO2+C 2CO,达到化学平衡后,平衡混合物中含14C的粒子有
A.14CO2 B.14CO2、14CO
C.14CO2、14CO、14C D.14CO
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
当可逆反应达到平衡状态时,反应并没停止,是一种动态平衡,所以在三种物质中都含有14C。
3.一定条件下,在一密闭容器中进行反应2SO2(g)+O2(g) 2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 mol·L-1、0.1 mol·
L-1、0.2 mol·L-1,当反应达到平衡时,可能存在的情况是
A.SO2为0.4 mol·L-1,O2为0.2 mol·L-1
B.SO2为0.25 mol·L-1
C.SO2、SO3均为0.15 mol·L-1
D.SO3为0.4 mol·L-1
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
SO2和O2的浓度增大,说明反应从逆反应方向建立平衡,若SO3完全反应,则SO2和O2的浓度变化分别为0.2 mol·L-1、0.1 mol·L-1,又因该反应为可逆反应,实际变化应小于该值,所以达到平衡时SO2小于0.4 mol·
L-1,O2小于0.2 mol·L-1,故A错误;
该项中SO2浓度实际变化为0.05 mol·L-1,小于0.2 mol·L-1,故B正确;
反应物、生成物的浓度不可能同时减小,故C错误;
SO3的浓度增大,说明该反应从正反应方向建立平衡,若二氧化硫和氧气完全反应,SO3的浓度变化为0.2 mol·L-1,又因该反应为可逆反应,实际变化应小于该值,故D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
题组二 化学平衡状态
4.下列对化学反应限度的叙述,不正确的是
A.任何可逆反应在给定的条件下的进程都有一定的限度,不同反应的限
度不同
B.可逆反应不能进行到底,所以可逆反应不容易发生
C.化学反应达到平衡时,反应物和生成物的浓度均不再改变,但物质间
的转化仍在进行
D.改变反应条件,化学反应限度可能改变
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
任何可逆反应都有一定的限度,但化学反应不同,限度不同,A正确;
可逆反应不可能完全转化,但有些可逆反应容易发生,如氨气与水反应就是容易发生的可逆反应,B错误;
当化学反应达到反应限度时,正、逆反应速率相等,但反应没有停止,只不过生成与消耗的同种物质的物质的量相等,C正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
5.一定条件下,向密闭容器中充入1 mol NO和1 mol CO进行反应:NO(g)+CO(g) N2(g)+CO2(g),测得化学反应速率随时间的变化关系如图所示,其中处于化学平衡状态的点是
A.d点 B.b点
C.c点 D.a点
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
由图可知,a、b、c点的正反应速率均大于逆反应速率,都未达到平衡状态;只有d点正、逆反应速率相等,由正、逆反应速率相等的状态为平衡状态可知,选项A正确。
6.在1 273 K、100.0 kPa条件下,乙烷生成乙烯的反应C2H6(g) C2H4(g)+H2(g)达到平衡后
A.C2H6的浓度保持不变
B.C2H6仍在不断分解,其浓度不断减少
C.C2H6的分解速率大于生成速率
D.C2H4仍在不断生成,其浓度不断增加
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
达到平衡后,正、逆反应速率相等,各物质的浓度不再变化,但各种物质仍在反应。
7.一定条件下,0.3 mol X(g)与0.3 mol Y(g)在容积固定的密闭容器中发生反应:X(g)+3Y(g) 2Z(g) ΔH=-a kJ·mol-1,下列说法正确的是
A.反应一段时间后,X与Y的物质的量之比仍为1∶1
B.达到平衡时,反应放出0.1a kJ的热量
C.达到平衡后,若向平衡体系中充入稀有气体,Z的正反应速率将不发生
变化
D.X的体积分数保持不变,说明反应已达到平衡
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
√
A项,反应过程中X与Y的变化量之比是1∶3,则反应一段时间后,X与Y的物质的量之比不可能仍为1∶1,错误;
B项,达到平衡时,因可逆反应不能反应完全,则反应的X小于0.1 mol,反应放出的热量小于0.1a kJ,错误;
C项,恒容条件下,达到平衡后,若向平衡体系中充入稀有气体,不影响反应物和生成物的浓度,反应速率也不变,正确;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
D项,
X(g)+ 3Y(g) 2Z(g)
起始/mol 0.3 0.3 0
变化/mol x 3x 2x
变后/mol 0.3-x 0.3-3x 2x
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
则X的体积分数保持不变,不能说明反应已达到平衡,错误。
题组三 化学平衡状态的判断
8.(2022·北京延庆区高二检测)用氮化硅陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率。工业上用化学气相沉积制备氮化硅,其反应如下:3SiCl4(g)+2N2(g)+6H2(g) Si3N4(s)+12HCl(g) ΔH<0。一定条件下,在恒容密闭容器中发生上述反应,能说明反应达到化学平衡状态的是
A.3v正(N2)=v正(H2) B.v正(HCl)=4v正(SiCl4)
C.混合气体的密度保持不变 D.c(N2)∶c(H2)∶c(HCl)=1∶3∶6
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
3v正(N2)=v正(H2),v正(HCl)=4v正(SiCl4),两个等式两边都表示正反应速率,反应过程中始终成立,不能说明达到化学平衡状态,故A、B错误;
该反应有固体生成,属于反应前后气体的质量发生变化的反应,恒容密闭容器中,混合气体的密度保持不变,说明混合气体的总质量不变,正、逆反应速率相等,反应达到平衡状态,故C正确;
某时刻各物质浓度关系与其起始浓度和转化率有关,与是否达到平衡状态无关,则c(N2)∶c(H2)∶c(HCl)=1∶3∶6不能说明反应达到平衡状态,故D错误。
17
9.对于反应2SO2(g)+O2(g) 2SO3(g),判断下列说法正确的是
①单位时间内生成2 mol SO2,同时生成1 mol O2,则处于化学平衡状态 ②SO2的生成速率等于SO2的消耗速率,则处于化学平衡状态 ③SO2、O2、SO3的体积分数不再发生变化,则处于化学平衡状态 ④SO2、O2、SO3的分子数之比为2∶1∶2,则处于化学平衡状态
A.①③ B.②④ C.②③ D.③④
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
①生成2 mol SO2、生成1 mol O2均代表逆反应方向,错误;
②正、逆反应速率相等,则处于平衡状态,正确;
③SO2、O2、SO3的体积分数不再发生变化,即各组分的浓度保持不变,处于平衡状态,正确;
④SO2、O2、SO3的分子数之比为2∶1∶2,并不能说明各组分的浓度保持不变,不一定处于平衡状态,错误。
17
10.一定条件下,将NO2与SO2以体积比为1∶2置于密闭容器中,发生反应:NO2(g)+SO2(g) SO3(g)+NO(g) ΔH=-41.8 kJ·mol-1,下列能说明反应达到平衡状态的是
A.体系压强保持不变
B.混合气体颜色保持不变
C.SO3和NO的体积比保持不变
D.每消耗1 mol SO3的同时生成1 mol NO2
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
17
由于该反应为反应前后气体体积相等的反应,体系的压强始终保持不变,故不能以压强不变作为判断反应是否达到平衡状态的标志,A错误;
SO3与NO的体积比始终保持1∶1,C错误;
消耗SO3和生成NO2为同一方向的反应,D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
11.将一定量纯净的氨基甲酸铵置于密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:H2NCOONH4(s) 2NH3(g)+CO2(g)。下列各项:①2v(NH3)=v(CO2);②密闭容器中总压强不变;③密闭容器中混合气体的密度不变;④密闭容器中氨气的体积分数不变;⑤密闭容器中c(NH3)不变,能判断该反应已经达到化学平衡状态的是
A.②③⑤ B.②③④
C.①④ D.全部
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
17
2v(NH3)=v(CO2),没有说明是正反应速率,还是逆反应速率,也不符合化学计量数的比例关系,①错误;
该反应是气体体积增大、压强增大的反应,密闭容器中总压强不变,能说明反应达到平衡,②正确;
根据ρ= ,气体质量增加,容器体积不变,密闭容器中混合气体的密度不变,能说明反应达到平衡,③正确;
NH3(g)、CO2(g)的量始终是以2∶1增加,因此密闭容器中氨气的体积分数始终不变,不能说明反应达到平衡,④错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
密闭容器中c(NH3)不变,各物质的浓度不再改变能作为反应达到平衡状态的标志,⑤正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
12.在一定温度下、容积不变的密闭容器中,可逆反应A(g)+3B(g) 2C(g)+2D(s)达到平衡状态的标志是
①C的生成速率与C的消耗速率相等
②单位时间内生成a mol A,同时生成3a mol B
③A、B、C的浓度不再改变
④混合气体的密度不再改变
⑤混合气体的总压强不再改变
⑥混合气体的总物质的量不再改变
⑦A、B、C的浓度之比为1∶3∶2
A.③④⑤⑥⑦ B.①③④⑤⑥ C.①②③④⑦ D.②③④⑤⑥
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
√
①C的生成速率与C的消耗速率相等,即v正=v逆,说明该反应达到平衡状态,正确;
②无论该反应是否达到平衡状态,单位时间内生成a mol A的同时都会生成3a mol B,所以不能作为达到平衡状态的标志,错误;
③反应达到平衡状态时,各物质的物质的量保持不变,浓度也不变,所以A、B、C的浓度不再变化,说明该反应达到平衡状态,正确;
④反应前后气体的总质量发生改变,容器容积一定,当混合气体的密度不再发生改变时,说明反应达到平衡状态,正确;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
⑤该反应是反应前后气体分子数减小的反应,容器容积、温度均不变,当混合气体的总压强不再变化时,说明反应达到平衡状态,正确;
⑥该反应是反应前后气体的物质的量减小的反应,当混合气体的总物质的量不再变化时,说明反应达到平衡状态,正确;
⑦达到平衡状态时,A、B、C三种物质的浓度之比可能是1∶3∶2,也可能不是1∶3∶2,错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
题组四 化学平衡的简单计算
13.(2022·湖北巴东高二检测)将2 mol X和2 mol Y充入2 L密闭容器中发生如下反应:X(g)+3Y(g) 2Z(g)+aQ(g),2 min后达到平衡状态时生成0.8 mol Z,测得Q的浓度为0.4 mol·L-1,则下列叙述错误的是
A.a的值为2
B.平衡时X的浓度为0.2 mol·L-1
C.平衡时Z的体积百分含量为20%
D.2 min内平均反应速率v(Y)=0.3 mol·L-1·min-1
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
平衡时生成0.8 mol Z,测得Q的浓度为0.4 mol·L-1,则生成的Q的物质的量n(Q)=0.4 mol·L-1×2 L=0.8 mol,所以2∶a=0.8 mol∶0.8 mol,计算得出a=2,A正确;
平衡时生成0.8 mol Z,则参加反应的X的物质的量为0.8 mol× =0.4 mol,故平衡时X的物质的量为2 mol-0.4 mol=1.6 mol,平衡时X的浓度为
=0.8 mol·L-1,B错误;
2 min内平均反应速率v(Y)= =0.3 mol·L-1·min-1,D正确。
14.一定条件下,对于反应X(g)+3Y(g) 2Z(g),若起始时,X、Y、Z的浓度分别为c1 mol·L-1、c2 mol·L-1、c3 mol·L-1(均不为零)。达平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1和0.08 mol·L-1,则下列判断错误的是
A.c1∶c2=1∶3
B.平衡时,Y和Z的生成速率之比为2∶3
C.平衡时消耗的X和Z的物质的量之比为1∶2
D.c1的取值范围为0<c1<0.14
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
√
分析浓度变化关系:
X(g)+3Y(g) 2Z(g)
起始/(mol·L-1) c1 c2 c3
平衡/(mol·L-1) 0.1 0.3 0.08
反应方程式中反应物X、Y的化学计量数之比为1∶3,所以反应中X和Y必然以物质的量之比为1∶3消耗,因为达平衡时X和Y的浓度之比为1∶3,故c1∶c2=1∶3,A项正确;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
平衡时Y和Z的生成速率之比和反应方程式中二者的化学计量数之比相等,故Y和Z的生成速率之比为3∶2,B项错误;
平衡时消耗X和Z的物质的量之比和反应方程式中二者的化学计量数之比相等,故平衡时消耗的X和Z的物质的量之比为1∶2,C项正确;
运用极限法,假设起始时Z的浓度为0 mol·L-1,则c1的最大值为0.14,而c1>0,反应又是可逆的,D项正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
15.(2021·郑州高二质量检测)恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2(g)+3H2(g)
2NH3(g)。
(1)反应进行到某时刻t时,nt(N2)=13 mol,nt(NH3)=6 mol,则a=____。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
16
反应进行到t时,nt(N2)=13 mol,nt(NH3)=6 mol,由化学方程式可知,参加反应的N2的物质的量为3 mol,故N2的起始物质的量为13 mol+
3 mol=16 mol,即a=16。
(2)反应达到平衡时,混合气体的体积为716.8 L(标准状况),其中NH3的含量(体积分数)为25%,平衡时NH3的物质的量为________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
8 mol
达到平衡时,混合气体的总物质的量n(总)= =32 mol,其中NH3的物质的量为32 mol×25%=8 mol。
(3)原混合气体与平衡时混合气体的总物质的量之比n(始)∶n(平)=______(写出最简整数比)。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
5∶4
利用差量法计算
N2(g)+3H2(g) 2NH3(g) 减少的物质的量
转化/mol 4 12 8 8
由以上分析可知,当生成8 mol NH3达到平衡时,减少的物质的量为8 mol。
由(2)知,平衡时混合气体的总物质的量为32 mol,故原混合气体的物质的量为32 mol+8 mol=40 mol,原混合气体与平衡时混合气体的总物质的量之比为40 mol∶32 mol=5∶4。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
16.(2021·无锡高二月考)在698 K时,向某V L的密闭容器中充入2 mol H2(g)和2 mol I2(g),发生反应:H2(g)+I2(g) 2HI(g) ΔH=-26.5 kJ·mol-1,测得各物质的物质的量浓度与时间变化的关系如图所示。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
请回答下列问题:
(1)V=___。
2
由图知初始反应时,c(H2)=c(I2)=1.00 mol·L-1,而加入的H2和I2的物质的量均为2 mol,所以V=2。
(2)该反应达到最大限度的时间是_____,该时间内平均反应速率v(HI)=___________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
5 s
0.316 mol·L-1·s-1
反应达到最大限度即达到化学平衡,所需时间为5 s,v(HI)=
=0.316 mol·L-1·s-1。
(3)该反应达到平衡状态时,______(填“吸收”或“放出”)的热量为__________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
放出
41.87 kJ
可逆反应从正反应方向建立,所以需放出热量。由反应H2(g)+I2(g)
2HI(g) ΔH=-26.5 kJ·mol-1可知,达到平衡时共生成n(HI)=1.58 mol·L-1
×2 L=3.16 mol,所以放出的热量为 ×3.16 mol=41.87 kJ。
17.一定温度下,在10 L密闭容器中加入5 mol SO2和3 mol O2,发生反应:2SO2(g)+O2(g) 2SO3(g),10 min时,反应达到平衡状态,此时有3 mol
SO2发生了反应。
(1)反应生成了____ mol SO3,v(SO2)=____________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
3
0.03 mol·L-1·min-1
(2)平衡时SO3的浓度是_____________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
0.3 mol·L-1
2SO2(g)+O2(g) 2SO3(g)
起始/mol 5 3 0
变化/mol 3 1.5 3
平衡/mol 2 1.5 3
则平衡时SO3的浓度为 =0.3 mol·L-1。
(3)平衡时容器内气体的总物质的量为______ mol。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
6.5
平衡时混合气体的总物质的量为2 mol+1.5 mol+3 mol=6.5 mol。
(4)物质的浓度不再改变标志着该反应已达平衡状态,下列还可以说明该反应已达平衡状态的是________(填序号)。
①体系内压强不再改变
②容器内气体的密度不再改变
③混合气体的平均相对分子质量不再改变
④v正(SO3)=2v逆(O2)
⑤n(SO3)∶n(O2)∶n(SO2)=2∶1∶2
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
①③④
根据反应的化学方程式知:①中体系压强不变,说明反应已达平衡状态;
②中容器的体积不变,混合气体的质量不变,则反应过程中密度始终不变,密度不变不能说明反应已达平衡状态;
③中混合气体的总质量不变,但反应过程中混合气体的总物质的量改变,若平均相对分子质量不变,说明反应已达平衡状态;
④表示v正=v逆,说明反应已达平衡状态;
⑤中三者的物质的量之比等于化学计量数之比,不能说明反应已达平衡状态。
返回
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
专题2
本课结束
