专题2第三单元 化学平衡的移动 第2课时 温度变化对化学平衡的影响 勒夏特列原理(共87张ppt)
文档属性
| 名称 | 专题2第三单元 化学平衡的移动 第2课时 温度变化对化学平衡的影响 勒夏特列原理(共87张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-30 09:12:16 | ||
图片预览











文档简介
DIERKESHI
温度变化对化学平衡的影响 / 化学平衡移动原理(勒夏特列原理) / 课时对点练
温度变化对化学平衡的影响 勒夏特列原理
专题2
第2课时
1.变化观念与平衡思想:
从变化的角度认识化学平衡的移动,即可逆反应达到平衡后,温度改变,平衡将会发生移动而建立新的平衡。
2.证据推理与模型认知:
通过实验论证说明温度、催化剂的改变对化学平衡移动的影响,构建分析判断化学平衡移动方向的思维模型(勒夏特列原理)。
内容索引
一、温度变化对化学平衡的影响
二、化学平衡移动原理(勒夏特列原理)
课时对点练
温度变化对化学平衡的影响
一
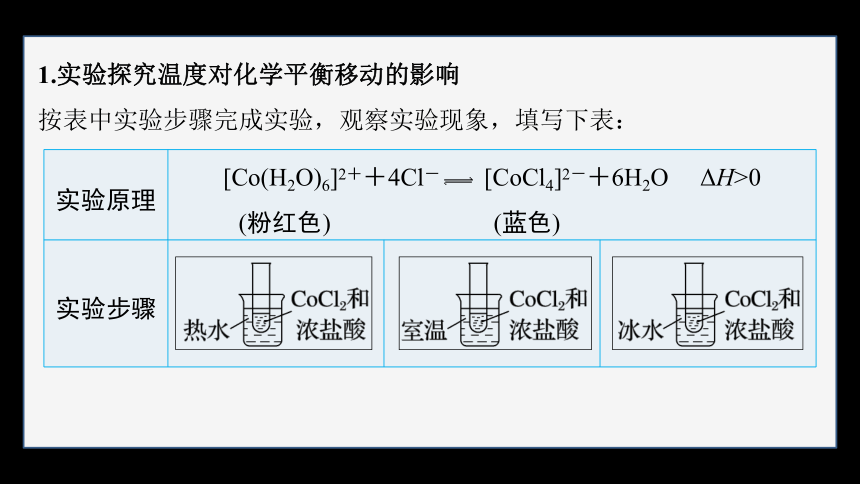
1.实验探究温度对化学平衡移动的影响
按表中实验步骤完成实验,观察实验现象,填写下表:
实验原理
[Co(H2O)6]2++4Cl- [CoCl4]2-+6H2O ΔH>0
(粉红色) (蓝色)
实验步骤
?
?
?
实验现象
溶液变为 色
溶液不变色
溶液变为 色
实验结论
其他条件一定时,升高温度,平衡向 方向(即 热反应方向)移动;降低温度,平衡向 方向(即 热反应方向)移动
蓝
粉红
正反应
吸
逆反应
放
2.温度变化对化学平衡移动的影响规律
(1)任何化学反应都伴随着能量的变化(放热或吸热),所以任意可逆反应的化学平衡状态都受温度的影响。
(2)当其他条件不变时:
升高温度,化学平衡向 方向移动;
降低温度,化学平衡向 方向移动。
吸热反应
放热反应
3.用v—t图像分析温度对化学平衡移动的影响
已知反应:mA(g)+nB(g) pC(g) ΔH<0,当反应达平衡后,若温度改变,其反应速率的变化曲线分别如图所示:
①t1时刻,升高温度,v′正、v′逆均 ,但吸热反应方向的 增大幅度大,则v′逆>v′正,平衡 移动。
增大
v′逆
逆向
②t1时刻,降低温度,v′正、v′逆均 ,但吸热反应方向的 减
小幅度大。则v′正>v′逆,平衡 移动。
减小
v′逆
正向
4.催化剂对化学平衡的影响
(1)催化剂对化学平衡的影响规律
当其他条件不变时:
催化剂不能改变达到化学平衡状态时反应混合物的组成,但是使用催化剂能改变反应达到化学平衡所需的时间。
(2)用v—t图像分析催化剂对化学平衡的影响
t1时刻,加入催化剂,v′正、v′逆同等倍数增大,
则v′正=v′逆,平衡不移动。
提醒 一般情况下,催化剂都是正催化剂,即可以加快反应速率,特殊情况下,也使用负催化剂,减慢反应速率。
(1)温度可以影响任意可逆反应的化学平衡状态( )
(2)升高温度,反应速率加快,化学平衡正向移动( )
(3)升高温度,反应速率加快,但反应物的转化率可能降低( )
(4)化学平衡正向移动,反应物的转化率一定增大( )
(5)C(s)+CO2(g) 2CO(g) ΔH>0,其他条件不变时,升高温度,CO2的平衡转化率增大( )
(6)催化剂能加快反应速率,提高单位时间内的产量,也能提高反应物的转化率( )
正误判断
×
√
×
×
√
√
1.已知反应:2NO2(g)(红棕色) N2O4(g)(无色) ΔH=-56.9 kJ·mol-1,设计实验探究温度对上述平衡有什么影响?
提示 (1)把NO2、N2O4的混合气体盛装在两个连通的烧瓶里,然后用弹簧夹夹住橡胶管,把烧瓶A放入热水中,把烧瓶B放入冰水中,与常温时烧瓶C内气体的颜色进行对比,如图所示:
(2)现象:放在热水中的气体颜色变深,放在
冰水中的气体颜色变浅。
(3)结论:其他条件不变时,升高温度,化学平衡向吸热反应方向移动,降低温度,化学平衡向放热反应方向移动。
2.已知反应:mA(g)+nB(g) pC(g) m+n(1)图①表示的温度变化是 ,平衡移动的方向是 方向。
(2)图②表示的温度变化是 ,平衡移动的方向是 方向。
(3)正反应是 热反应,逆反应是 热反应。
升温
逆反应
降温
正反应
放
吸
3.一定温度下,可逆反应aX(g)+bY(g) cZ(g)在一密闭容器内达到平衡后,t0时刻改变某一外界条件,化学反应速率(v)随时间(t)的变化如图所示。
(1)若a+b=c,则t0时刻改变的外界条件可能是
或者 。
(2)若a+b≠c,则t0时刻改变的外界条件只能是
。
增大压强
加入催化剂
加入催化剂
应用体验
1.关节炎首次发作一般在寒冷季节,原因是关节滑液中形成了尿酸钠晶体(NaUr),易诱发关节疼痛,其化学机理是①HUr(aq)+H2O(l) Ur-(aq)+H3O+(aq) ②Ur-(aq)+Na+(aq) NaUr(s) ΔH。下列叙述错误的是
A.降低温度,反应②平衡正向移动
B.反应②正方向是吸热反应
C.降低关节滑液中HUr及Na+的含量是治疗方法之一
D.关节保暖可以缓解疼痛,原理是反应②平衡逆向移动
√
由题意知,寒冷季节即降温使反应②平衡正向移动形成NaUr(s),所以反应②正向为放热反应,要减少NaUr(s),应使反应②平衡逆向移动。
2.如图所示,在密闭容器中发生反应:N2(g)+3H2(g) 2NH3(g) ΔH<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,改变的条件是
A.加入适当催化剂
B.升高的温度
C.增大反应物的浓度
D.增大压强
√
加入催化剂,正、逆反应速率同时增大且相等,平衡不移动,与图像不符,A错误;
升高温度,正、逆反应速率都增大,但是逆反应速率大于正反应速率,平衡逆向移动,与图像相符,B正确;
增大反应物浓度,在t时刻逆反应速率不变,正反应速率增大,与图像不符,C错误;
增大压强,正、逆反应速率均增大,正反应速率大于逆反应速率,平衡正向移动,与图像不符,D错误。
归纳总结
(1)升高温度:K值增大→正反应为吸热反应;K值减小→正反应为放热反应。
(2)降低温度:K值增大→正反应为放热反应;K值减小→正反应为吸热反应。
(3)升高温度,正、逆反应速率均增大,但增大的幅度不同;同理,降低温度,正、逆反应速率均减小,减小的幅度也不同。
返回
化学平衡移动原理(勒夏特列原理)
二
1.平衡移动过程中的量变分析
向一密闭容器中通入1 mol N2、3 mol H2发生反应:N2(g)+3H2(g)
2NH3(g) ΔH<0,一段时间后达到平衡,当改变下列条件后,请填写下列内容:
(1)若增大N2的浓度,平衡移动的方向是 ;达到新平衡时,氮气的浓度与改变时相比较,其变化是 ;但新平衡时的浓度 原平衡时的浓度。
正向移动
减小
大于
(2)若升高温度,平衡移动的方向是 ;达到新平衡时的温度与改变时相比较,其变化是 ;但新平衡时的温度 原平衡时的温度。
(3)若增大压强,平衡移动的方向是 ;达到新平衡时的压强与改变时相比较,其变化是 ;但新平衡时的压强 原平衡时的压强。
2.化学平衡移动原理(勒夏特列原理)
(1)定义
如果改变影响化学平衡的一个因素(如参加反应的化学物质的浓度、压强或温度),平衡将向着能够 这种改变的方向移动。
逆向移动
降低
高于
正向移动
减小
大于
减弱
(2)对平衡移动原理的理解
3.化学平衡移动原理在化工生产中的应用
(1)选择和优化反应条件;
(2)改进工艺和装置等。
(1)光照时,氯水颜色变浅,可用勒夏特列原理解释( )
(2)对于化学反应:2HBr(g) H2(g)+Br2(g),压强增大,体系气体颜色加深,可用勒夏特列原理解释( )
(3)向酸性KMnO4溶液中通入少量SO2气体,溶液颜色变浅,利用了勒夏特列原理( )
(4)工业生产中,为提高生产效率,常使用高效催化剂和过量便宜原料,这些措施都可用勒夏特列原理解释( )
(5)实验室可以用排饱和NaHCO3溶液的方法收集CO2( )
正误判断
×
√
×
×
√
1.已知N2与H2合成NH3的反应是一个可逆反应,其热化学方程式为N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1。在工业生产中,可以通过以下途径来提高合成氨的产率,请利用有关知识分析采取这些措施的原因。
(1)向反应器中注入过量N2:_______________________________________
_______;
(2)采用适当的催化剂:___________________________________________
__________;
增大反应物浓度,平衡正向移动,提高氢气的
利用率
加快反应速率,提高单位时间内的产量,提高
生产效率
(3)在高压下进行反应:____________________________________________
____________________________________;
(4)在较高温度下进行反应:___________________;
(5)不断将氨液化,并移去液氨:____________________________________
___________。
增大压强使平衡正向移动,增大化学反应速率,
加快化学反应速率
减小生成物浓度,平衡正向移动,提高
氨气的产率
提高单位时间内的产量和原料的转化率
2.在工业合成硫酸中,其中一步反应为2SO2(g)+O2(g) 2SO3(g) ΔH
=-196.6 kJ·mol-1。
(1)根据反应特点,利用原理分析,增大反应速率的措施有_____________
______________________________________________,增大原料转化率的措施有________________________________。
增大SO2和O2
的浓度、增大压强、升高温度、选用合适的催化剂
增大压强、降低温度(合理即可)
(2)利用下表实验数据回答问题:
温度
平衡时SO2的转化率/%
1×105 Pa
5×105 Pa
1×106 Pa
5×106 Pa
1×107 Pa
450 ℃
97.5
98.9
99.2
99.6
99.7
550 ℃
85.6
92.9
94.9
97.7
98.3
①应选择的温度是________,理由是________________________________
__________________________________________。
450 ℃
该反应是放热反应,升高温度,转
化率降低,且在450 ℃时反应物的转化率较高
温度
平衡时SO2的转化率/%
1×105 Pa
5×105 Pa
1×106 Pa
5×106 Pa
1×107 Pa
450 ℃
97.5
98.9
99.2
99.6
99.7
550 ℃
85.6
92.9
94.9
97.7
98.3
②应采用的压强是_________,理由是_______________________________
___________________________________________________________________________。
1×105 Pa
该压强下SO2的转化率已经很高,若采用更大的压强,SO2的转化率提高很少,但需要的动力更大,对设备的要求更高
应用体验
1.(2021·杭州高二月考)将NO2装入带活塞的密闭容器中,当反应2NO2(g)
N2O4(g)达到平衡后,改变下列一个条件,其中叙述错误的是
A.慢慢压缩气体体积,平衡向右移动,混合气体颜色较原来浅
B.保持容器容积不变,升高温度,气体颜色加深,则此正反应为放热反应
C.慢慢压缩气体使体积减小一半,压强增大,但小于原来的两倍
D.恒温恒容时,充入惰性气体,压强增大,平衡不会移动
√
压缩气体体积即加压,平衡向右移动,但新平衡的c(NO2)比原平衡大,混合气体颜色较原来深,A错误;
NO2(g)为红棕色,N2O4(g)为无色,升高温度使气体颜色加深,则平衡左移,说明正反应放热,B正确;
假设体积减半时平衡不移动,则压强加倍,实际平衡右移,使压强小于原来的两倍,C正确;
恒温恒容时,充入惰性气体,虽然容器内总压强变大,但没有改变c(NO2)、c(N2O4),正、逆反应速率均不变,化学平衡不移动,D正确。
2.下列事实,不能用勒夏特列原理解释的是______(填字母)。
A.溴水中存在如下平衡:Br2+H2O HBr+HBrO,当加入NaOH溶液后
颜色变浅
B.对于反应:2H2O2 2H2O+O2↑,使用MnO2可加快制O2的反应速率
C.对于反应:CO(g)+NO2(g) CO2(g)+NO(g) ΔH<0,升高温度,平
衡向逆反应方向移动
D.合成氨反应:N2(g)+3H2(g) 2NH3(g) ΔH<0,为使氨的产率提高,
理论上应采取低温高压的措施
E.对于反应:H2(g)+I2(g) 2HI(g),缩小体积、加压,颜色加深
BE
催化剂只能改变反应速率,对化学平衡的移动无影响。
归纳总结
勒夏特列原理只能解决与平衡移动有关的问题,不涉及平衡移动的问题都不能用勒夏特列原理解释,常见的有:
(1)使用催化剂不能使化学平衡发生移动;
(2)反应前后气体体积不变的可逆反应,改变压强可以改变化学反应速率,但不能使化学平衡发生移动;
(3)化学反应本身不是可逆反应;
(4)外界条件的改变对化学平衡移动的影响与生产要求不完全一致的反应。
返回
课时对点练
题组一 温度变化对化学平衡的影响
1.将H2(g)和Br2(g)充入恒容密闭容器,恒温下发生反应:H2(g)+Br2(g)
2HBr(g) ΔH<0,平衡时Br2(g)的转化率为a;若初始条件相同,绝热条件下进行上述反应,平衡时Br2(g)的转化率为b。a与b的关系是
A.a>b B.a=b
C.a√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
该反应为放热反应,绝热下进行反应,温度升高,平衡逆向移动,所以绝热条件下平衡时Br2(g)的转化率低于恒温条件下平衡时Br2(g)的转化率,即a>b。
2.反应2A(g) 2B(g)+C(g) ΔH>0,达到平衡时要使v正降低,c(A)增大,应采取的措施是
A.加压 B.减压
C.加催化剂 D.降温
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
3.已知反应:2NO2(g) N2O4(g),把NO2、N2O4的混合气体盛装在两个连
通的烧瓶里,然后用弹簧夹夹住橡胶管,把烧瓶A放入热水里,把烧瓶B放入冰水里,如图所示。与常温时烧瓶内气体的颜色进行对比发现,A烧瓶内气体颜色变深,B烧瓶内气体颜色变浅。下列说法错误的是
A.题述过程中,A烧瓶内正、逆反应速率均增大
B.题述过程中,B烧瓶内c(NO2)减小,c(N2O4)增大
C.题述过程中,A、B烧瓶内气体密度均保持不变
D.反应2NO2(g) N2O4(g)的逆反应为放热反应
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
升高温度,正、逆反应速率都增大,A项正确;
B烧瓶内气体颜色变浅,说明平衡正向移动,
B烧瓶内c(NO2)减小,c(N2O4)增大,B项正确;
容器的容积不变,混合气体的质量不变,A、B烧瓶内气体密度都不变,C项正确;
放在热水中的A烧瓶内气体颜色变深,放在冰水中的B烧瓶内气体颜色变浅,说明升高温度平衡逆向移动,降低温度平衡正向移动,故反应2NO2(g) N2O4(g)的正反应为放热反应,D项错误。
题组二 多因素对化学平衡影响的分析
4.对于可逆反应:2A(s)+3B(g) 2C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是
①增加A的量,平衡向正反应方向移动
②升高温度,平衡向逆反应方向移动,v正减小
③压强增大一倍,平衡不移动,v正、v逆不变
④增大B的浓度,v正>v逆
⑤加入催化剂,平衡向正反应方向移动
A.①② B.④ C.③ D.④⑤
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
①A是固体,增加A的量,平衡不移动,错误;
②升高温度,v正、v逆均增大,但v逆增大的幅度大,平衡向逆反应方向移动,错误;
③压强增大,平衡逆向移动,且v正、v逆都增大,错误;
④增大B的浓度,平衡向正反应方向移动,v正>v逆,正确;
⑤加入催化剂,平衡不移动,错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
5.已知反应:COCl2(g) CO(g)+Cl2(g) ΔH>0,当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,其中能提高COCl2转化率的是
A.①②④ B.①④⑥
C.②③⑤ D.③⑤⑥
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
②恒容通入惰性气体,平衡不移动;
③增加CO的浓度,平衡左移,COCl2的转化率降低;
⑤加入催化剂,平衡不移动。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
题组三 勒夏特列原理的应用
6.(2022·河南正阳高中高二月考)下列事实不能用勒夏特列原理解释的是
A.工业上生产硫酸时,充入过量的空气以提高SO2的转化率
B.打开可乐瓶盖后看到有大量气泡逸出
C.H2、I2(g)、HI平衡时的混合气体加压后颜色变深
D.工业上用氮气、氢气合成氨气的过程中,通过加压将氨气液化以增大
转化率
√
生产硫酸流程中存在平衡:2SO2+O2 2SO3,过量的空气可以提高O2的浓度,平衡正向移动,能用勒夏特列原理解释,故A不符合题意;
打开可乐瓶盖后看到有大量气泡逸出,是因为减小压强,反应H2CO3(aq)
H2O(l)+CO2(g)和CO2(aq) CO2(g)的平衡正向移动,产生大量二氧化碳气体,能用勒夏特列原理解释,故B不符合题意;
该平衡体系中存在可逆反应:2HI(g) H2(g)+I2(g),反应前后气体体积不变,加压平衡不移动,混合气体颜色变深是因为体积缩小浓度增大,和平衡移动无关,不能用勒夏特列原理解释,故C符合题意;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
合成氨反应是气体体积减小的放热反应,增大压强,平衡正向移动,通过加压将氨气液化及时分离出来,使平衡正向移动,能用勒夏特列原理解释,故D不符合题意。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
7.下列事实不能用勒夏特列原理解释的是
A.夏天,打开啤酒瓶时会从瓶口逸出气体
B.浓氨水中加入氢氧化钠固体时产生较多的刺激性气味的气体
C.温度控制在500 ℃有利于合成氨反应
D.将盛有二氧化氮和四氧化二氮混合气体的密闭容器置于冷水中,混合
气体的颜色变浅
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
题组四 化学平衡移动的相关图像
8.在容积不变的密闭容器中存在如下反应:2SO2(g)+O2(g) 2SO3(g) ΔH<0。某研究小组探究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
A.图Ⅰ表示的是t1时刻增大O2的浓度对反应速率的影响
B.图Ⅱ表示的是t1时刻加入催化剂对反应速率的影响
C.图Ⅲ表示的是催化剂对平衡的影响,且甲的催化剂效率比乙高
D.图Ⅲ表示的是压强对化学平衡的影响,且乙的压强较高
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
A项,图Ⅰ改变的条件应是增大压强;
B项,由于正、逆反应速率同等幅度地增大,所以加入的应是催化剂;
C项,由于平衡发生了移动,所以改变的条件不是加入催化剂;
D项,改变的应是温度,且乙的温度高。
9.(2022·湖南临澧一中高二检测)对于可逆反应:2A(g)+B(g) 2C(g),分别测定反应在不同温度下达到平衡时B的转化率,绘制了如图所示的曲线,图中a、b、c三点分别表示不同时刻的状态。下列分析正确的是
A.该反应的ΔH<0
B.b点时的v正小于c点时的v正
C.增大压强,可使a点达到T1温度下的平衡状态
D.c点表示的状态:v正<v逆
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
根据图像可知,温度升高,平衡时B的转化率增大,说明平衡向正反应方向移动,则正反应为吸热反应,ΔH>0,A错误;
根据图像可知,b点的温度小于c点的温度,温
度越高,反应速率越大,c点未达到平衡状态,反应正向进行,则b点时的v正小于c点时的v正,B正确;
根据反应的化学方程式可知,增大压强平衡向正反应方向移动,B的转化率增大,而要使a点达到T1温度下的平衡状态,应使平衡向B的转化率减小的方向移动,应减小压强,C错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
c点不是平衡状态,要达到平衡,反应应向B的转化率增大的方向进行,即向正反应方向进行,正反应速率大于逆反应速率,D错误。
10.(2021·山东临朐实验中学高二月考)2NO2(红棕色) N2O4(无色) ΔH
<0,将一定量的NO2充入注射器中并密封,改变活塞位置的过程中,气体透光率随时间的变化如图所示。已知气体颜色越深,透光率越小,下列说法不正确的是
A.a点达到了平衡状态
B.b点改变的条件是将注射器的活塞向外拉
C.d点:v正<v逆
D.若在c点将温度降低,其透光率将增大
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
a点透光率没有发生变化,则a点达到平衡状态,A正确;
颜色越深,透光率越小,可以知道b点后c(NO2)迅速增大,若将注射器的活塞向外拉,则容积增大,c(NO2)减小,B错误;
d点后透光率减小,平衡逆向移动,则v正<v逆,C正确;
该反应为放热反应,降低温度,平衡正向移动,则透光率将增大,D正确。
11.t ℃时,某一气态平衡体系中含有X(g)、Y(g)、Z(g)、W(g)四种物质,此温度下发生反应的平衡常数表达式为K= ,有关该平衡体系的说法正确的是
A.升高温度,平衡常数K一定增大
B.升高温度,若混合气体的平均相对分子质量变小,则正反应是放热反应
C.增大压强,W(g)的质量分数增加
D.增大X(g)的浓度,平衡向正反应方向移动
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
根据化学平衡常数的表达式可写出反应的化学方程式为2Z(g)+2W(g)
X(g)+2Y(g)。由于不知道该反应的ΔH,无法确定升温时K的变化,A项错误;
升温,若混合气体的平均相对分子质量减小,平衡逆向移动,则正反应为放热反应,B项正确;
增大压强,平衡正向移动,W(g)的质量分数减小,C项错误;
增大X(g)的浓度,平衡向逆反应方向移动,D项错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
12.在一体积可变的密闭容器中,加入一定量的X、Y,发生反应:mX(g)
nY(g) ΔH=Q kJ·mol-1。反应达到平衡时,Y的物质的量浓度与温度、容器体积的关系如下表所示:
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
容器体积/L
c(Y)/(mol·L-1)
温度/℃
1
2
4
100
1.00
0.75
0.53
200
1.20
0.90
0.63
300
1.30
1.00
0.70
下列说法正确的是
A.m>n
B.Q<0
C.温度不变,压强增大,Y的质量分数减小
D.体积不变,温度升高,平衡向逆反应方向移动
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
由表可知,体积不变,升高温度,c(Y)增大,平衡右移,则正反应为吸热反应,Q>0,B、D错;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
容器体积/L
c(Y)/(mol·L-1)
温度/℃
1
2
4
100
1.00
0.75
0.53
200
1.20
0.90
0.63
300
1.30
1.00
0.70
温度不变,容器体积增大,即由1 L变为2 L,若平衡不移动,此时c(Y)应减小为原来的一半,现c(Y)比原来的一半大,即减压,平衡向右移动,即向气体体积增大的方向移动,所以m1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
容器体积/L
c(Y)/(mol·L-1)
温度/℃
1
2
4
100
1.00
0.75
0.53
200
1.20
0.90
0.63
300
1.30
1.00
0.70
因为m1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
容器体积/L
c(Y)/(mol·L-1)
温度/℃
1
2
4
100
1.00
0.75
0.53
200
1.20
0.90
0.63
300
1.30
1.00
0.70
13.已知:4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ΔH=-1 025 kJ·mol-1。若反应物起始的物质的量相同,下列关于该反应的示意图不正确的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
正反应为放热反应,升高温度,反应速率加快,达到平衡所用时间减少,但是平衡向逆反应方向移动,NO的含量减小,A正确、C错误;
增大压强,反应速率加快,达到平衡所用时间减少,正反应为气体体积增大的反应,增大压强,平衡向逆反应方向移动,NO的含量减小,B正确;
催化剂对平衡没有影响,只是加快反应速率,缩短达到平衡所用的时间,D正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
14.N2O5是一种新型硝化剂,在一定温度下可以发生以下反应:2N2O5(g)
4NO2(g)+O2(g) ΔH>0。T1温度时,向密闭容器中通入N2O5,部分实验数据见下表:
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
时间/s
0
500
1 000
1 500
c(N2O5)/(mol·L-1)
5.00
3.52
2.50
2.50
下列说法不正确的是
A.500 s内,N2O5的分解速率为2.96×10-3 mol·L-1·s-1
B.T1温度下的平衡常数K1=125,平衡时N2O5的转化率为50%
C.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1D.达到平衡后,其他条件不变,将容器的体积压缩到原来的 ,则再次
达到平衡时,c(N2O5)>5.00 mol·L-1
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
时间/s
0
500
1 000
1 500
c(N2O5)/(mol·L-1)
5.00
3.52
2.50
2.50
√
A项,500 s内,N2O5的浓度变化量为(5.00-3.52) mol·L-1=1.48 mol·L-1,v(N2O5)= =2.96×10-3 mol·L-1·s-1;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
时间/s
0
500
1 000
1 500
c(N2O5)/(mol·L-1)
5.00
3.52
2.50
2.50
B项,分析如下:
2N2O5(g) 4NO2(g)+O2(g)
起始/(mol·L-1) 5.00 0 0
转化/(mol·L-1) 2.50 5.00 1.25
平衡/(mol·L-1) 2.50 5.00 1.25
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
时间/s
0
500
1 000
1 500
c(N2O5)/(mol·L-1)
5.00
3.52
2.50
2.50
C项,该反应的正反应为吸热反应,升高温度,平衡常数增大,故K1>K2;
D项,达到平衡后,其他条件不变,将容器的体积压缩到原来的 ,相当于增大压强,平衡向左移动,则c(N2O5)>5.00 mol·L-1。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
时间/s
0
500
1 000
1 500
c(N2O5)/(mol·L-1)
5.00
3.52
2.50
2.50
15.2021年1月,中国按照国际标准研制的拥有自主知识产权的大型客机C919完成了高寒试验试飞任务,科学家在实验室中研究的利用催化技术将飞机尾气中的NO和CO转变成CO2和N2的反应为2NO(g)+2CO(g)
N2(g)+2CO2(g) ΔH<0。
(1)假设在密闭容器中发生上述反应,达到平衡时,下列措施能提高NO转化率的是______(填字母)。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的容积
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
CD
使用催化剂不能改变平衡状态,不影响反应物的转化率,故A不符合题意;
该反应正向为放热反应,升高温度,平衡逆向移动,NO的转化率降低,故B不符合题意;
降低反应体系的温度,平衡正向移动,NO的转化率提高,故C符合题意;
该反应的正反应是气体体积减小的反应,缩小容器的容积,相当于加压,平衡正向移动,NO的转化率提高,故D符合题意。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(2)若将1 mol NO和2 mol CO通入2 L的恒容密闭容器中,在一定条件下发生上述反应,反应中生成的N2的物质的量浓度随时间的变化情况如图所示。则NO从反应开始到平衡时的平均反应速率v(NO)=___________________,4 min末CO的浓度为_____mol·L-1。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
0.05 mol·L-1·min-1
0.8
NO从反应开始到平衡时的平均反应速率v(NO)=2v(N2)= ×2=0.05 mol·L-1·min-1;4 min末CO的浓度为(1-0.2) mol·L-1=0.8 mol·L -1。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
16.(1)亚硝酰氯(ClNO)是有机合成中常用的试剂,已知:2NO(g)+Cl2(g)
2ClNO(g) ΔH<0,一定温度下,将2 mol NO与2 mol Cl2置于2 L密闭容器中发生反应。
①下列可判断反应达到平衡状态的是______(填字母,下同)。
A.混合气体的平均相对分子质量不变
B.混合气体的密度保持不变
C.NO和Cl2的物质的量之比保持不变
D.每消耗1 mol NO同时生成1 mol ClNO
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
AC
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
起始时投入的NO与Cl2的物质的量之比是1∶1,而变化的NO与Cl2的物质的量之比是2∶1,所以在未达到平衡前,NO与Cl2的物质的量之比是变化的,当NO与Cl2的物质的量之比保持不变时,反应达到平衡状态,C正确;
反应的任一阶段,每消耗1 mol NO一定会生成1 mol ClNO,不能确定是否达到平衡状态,D错误。
②为了加快化学反应速率,同时提高NO的转化率,其他条件不变时,可采取的措施有_____。
A.升高温度 B.缩小容器容积
C.再充入Cl2 D.使用合适的催化剂
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
BC
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
升高温度,反应速率加快,但该反应正向为放热反应,平衡逆向移动,NO的转化率降低,A错误;
缩小容器容积,相当于加压,平衡正向移动,反应速率加快,B正确;
充入Cl2,反应速率加快,平衡正向移动,NO的转化率提高,C正确;
使用合适的催化剂,能加快反应速率,但不影响平衡移动,即NO的转化率不变,D错误。
③一定条件下在恒温恒容的密闭容器中,按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数φ(ClNO)随 的变化图像如图甲所示,当 =2.5时,达到平衡状态,ClNO的体积分数可能是图甲中的____点(填“D”“E”或“F”)。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
F
当反应物的物质的量之比等于其化学计量数之比时生成物的体积分数最大,当 =2.5时ClNO的体积分数减小,所以应该是F点。
(2)在容积为10 L的密闭容器中充入3 mol NO和2 mol Cl2,在不同温度下发生反应:2NO(g)+Cl2(g) 2ClNO(g),ClNO的体积百分含量随时间的变化如图乙所示。已知T1>T2>T3。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
①与实验Ⅰ相比,实验Ⅱ除温度不同外,还改变的条件是____________
________。
加入催化剂
(或加压)
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
ΔH<0,升高温度,ClNO的百分含量不断减小,平衡逆向移动。与实验Ⅰ相比,实验Ⅱ的反应温度:T2②实验Ⅲ反应至25 min达到平衡,用NO的浓度变化表示的平均反应速率为_____________________。
若实验Ⅲ达到平衡时的热量变化为Q kJ,则该反应的热化学方程式为____________________________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
0.008 mol·L-1·min-1
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
实验Ⅲ反应至25 min达到平衡,
2NO(g) + Cl2(g) 2ClNO(g)
起始/(mol·L-1) 0.3 0.2 0
变化/(mol·L-1) 2c c 2c
平衡/(mol·L-1) 0.3-2c 0.2-c 2c
平衡时ClNO的体积百分含量为50%,
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
则用NO的浓度变化表示的平均反应速率
达到平衡时,Cl2的物质的量的变化量为0.1 mol·L-1×
10 L=1 mol,反应放出Q kJ热量,则该反应的热化学方程式为2NO(g)+Cl2(g) 2ClNO(g) ΔH=-Q kJ·mol-1。
返回
专题2
本课结束
温度变化对化学平衡的影响 / 化学平衡移动原理(勒夏特列原理) / 课时对点练
温度变化对化学平衡的影响 勒夏特列原理
专题2
第2课时
1.变化观念与平衡思想:
从变化的角度认识化学平衡的移动,即可逆反应达到平衡后,温度改变,平衡将会发生移动而建立新的平衡。
2.证据推理与模型认知:
通过实验论证说明温度、催化剂的改变对化学平衡移动的影响,构建分析判断化学平衡移动方向的思维模型(勒夏特列原理)。
内容索引
一、温度变化对化学平衡的影响
二、化学平衡移动原理(勒夏特列原理)
课时对点练
温度变化对化学平衡的影响
一
1.实验探究温度对化学平衡移动的影响
按表中实验步骤完成实验,观察实验现象,填写下表:
实验原理
[Co(H2O)6]2++4Cl- [CoCl4]2-+6H2O ΔH>0
(粉红色) (蓝色)
实验步骤
?
?
?
实验现象
溶液变为 色
溶液不变色
溶液变为 色
实验结论
其他条件一定时,升高温度,平衡向 方向(即 热反应方向)移动;降低温度,平衡向 方向(即 热反应方向)移动
蓝
粉红
正反应
吸
逆反应
放
2.温度变化对化学平衡移动的影响规律
(1)任何化学反应都伴随着能量的变化(放热或吸热),所以任意可逆反应的化学平衡状态都受温度的影响。
(2)当其他条件不变时:
升高温度,化学平衡向 方向移动;
降低温度,化学平衡向 方向移动。
吸热反应
放热反应
3.用v—t图像分析温度对化学平衡移动的影响
已知反应:mA(g)+nB(g) pC(g) ΔH<0,当反应达平衡后,若温度改变,其反应速率的变化曲线分别如图所示:
①t1时刻,升高温度,v′正、v′逆均 ,但吸热反应方向的 增大幅度大,则v′逆>v′正,平衡 移动。
增大
v′逆
逆向
②t1时刻,降低温度,v′正、v′逆均 ,但吸热反应方向的 减
小幅度大。则v′正>v′逆,平衡 移动。
减小
v′逆
正向
4.催化剂对化学平衡的影响
(1)催化剂对化学平衡的影响规律
当其他条件不变时:
催化剂不能改变达到化学平衡状态时反应混合物的组成,但是使用催化剂能改变反应达到化学平衡所需的时间。
(2)用v—t图像分析催化剂对化学平衡的影响
t1时刻,加入催化剂,v′正、v′逆同等倍数增大,
则v′正=v′逆,平衡不移动。
提醒 一般情况下,催化剂都是正催化剂,即可以加快反应速率,特殊情况下,也使用负催化剂,减慢反应速率。
(1)温度可以影响任意可逆反应的化学平衡状态( )
(2)升高温度,反应速率加快,化学平衡正向移动( )
(3)升高温度,反应速率加快,但反应物的转化率可能降低( )
(4)化学平衡正向移动,反应物的转化率一定增大( )
(5)C(s)+CO2(g) 2CO(g) ΔH>0,其他条件不变时,升高温度,CO2的平衡转化率增大( )
(6)催化剂能加快反应速率,提高单位时间内的产量,也能提高反应物的转化率( )
正误判断
×
√
×
×
√
√
1.已知反应:2NO2(g)(红棕色) N2O4(g)(无色) ΔH=-56.9 kJ·mol-1,设计实验探究温度对上述平衡有什么影响?
提示 (1)把NO2、N2O4的混合气体盛装在两个连通的烧瓶里,然后用弹簧夹夹住橡胶管,把烧瓶A放入热水中,把烧瓶B放入冰水中,与常温时烧瓶C内气体的颜色进行对比,如图所示:
(2)现象:放在热水中的气体颜色变深,放在
冰水中的气体颜色变浅。
(3)结论:其他条件不变时,升高温度,化学平衡向吸热反应方向移动,降低温度,化学平衡向放热反应方向移动。
2.已知反应:mA(g)+nB(g) pC(g) m+n
(2)图②表示的温度变化是 ,平衡移动的方向是 方向。
(3)正反应是 热反应,逆反应是 热反应。
升温
逆反应
降温
正反应
放
吸
3.一定温度下,可逆反应aX(g)+bY(g) cZ(g)在一密闭容器内达到平衡后,t0时刻改变某一外界条件,化学反应速率(v)随时间(t)的变化如图所示。
(1)若a+b=c,则t0时刻改变的外界条件可能是
或者 。
(2)若a+b≠c,则t0时刻改变的外界条件只能是
。
增大压强
加入催化剂
加入催化剂
应用体验
1.关节炎首次发作一般在寒冷季节,原因是关节滑液中形成了尿酸钠晶体(NaUr),易诱发关节疼痛,其化学机理是①HUr(aq)+H2O(l) Ur-(aq)+H3O+(aq) ②Ur-(aq)+Na+(aq) NaUr(s) ΔH。下列叙述错误的是
A.降低温度,反应②平衡正向移动
B.反应②正方向是吸热反应
C.降低关节滑液中HUr及Na+的含量是治疗方法之一
D.关节保暖可以缓解疼痛,原理是反应②平衡逆向移动
√
由题意知,寒冷季节即降温使反应②平衡正向移动形成NaUr(s),所以反应②正向为放热反应,要减少NaUr(s),应使反应②平衡逆向移动。
2.如图所示,在密闭容器中发生反应:N2(g)+3H2(g) 2NH3(g) ΔH<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,改变的条件是
A.加入适当催化剂
B.升高的温度
C.增大反应物的浓度
D.增大压强
√
加入催化剂,正、逆反应速率同时增大且相等,平衡不移动,与图像不符,A错误;
升高温度,正、逆反应速率都增大,但是逆反应速率大于正反应速率,平衡逆向移动,与图像相符,B正确;
增大反应物浓度,在t时刻逆反应速率不变,正反应速率增大,与图像不符,C错误;
增大压强,正、逆反应速率均增大,正反应速率大于逆反应速率,平衡正向移动,与图像不符,D错误。
归纳总结
(1)升高温度:K值增大→正反应为吸热反应;K值减小→正反应为放热反应。
(2)降低温度:K值增大→正反应为放热反应;K值减小→正反应为吸热反应。
(3)升高温度,正、逆反应速率均增大,但增大的幅度不同;同理,降低温度,正、逆反应速率均减小,减小的幅度也不同。
返回
化学平衡移动原理(勒夏特列原理)
二
1.平衡移动过程中的量变分析
向一密闭容器中通入1 mol N2、3 mol H2发生反应:N2(g)+3H2(g)
2NH3(g) ΔH<0,一段时间后达到平衡,当改变下列条件后,请填写下列内容:
(1)若增大N2的浓度,平衡移动的方向是 ;达到新平衡时,氮气的浓度与改变时相比较,其变化是 ;但新平衡时的浓度 原平衡时的浓度。
正向移动
减小
大于
(2)若升高温度,平衡移动的方向是 ;达到新平衡时的温度与改变时相比较,其变化是 ;但新平衡时的温度 原平衡时的温度。
(3)若增大压强,平衡移动的方向是 ;达到新平衡时的压强与改变时相比较,其变化是 ;但新平衡时的压强 原平衡时的压强。
2.化学平衡移动原理(勒夏特列原理)
(1)定义
如果改变影响化学平衡的一个因素(如参加反应的化学物质的浓度、压强或温度),平衡将向着能够 这种改变的方向移动。
逆向移动
降低
高于
正向移动
减小
大于
减弱
(2)对平衡移动原理的理解
3.化学平衡移动原理在化工生产中的应用
(1)选择和优化反应条件;
(2)改进工艺和装置等。
(1)光照时,氯水颜色变浅,可用勒夏特列原理解释( )
(2)对于化学反应:2HBr(g) H2(g)+Br2(g),压强增大,体系气体颜色加深,可用勒夏特列原理解释( )
(3)向酸性KMnO4溶液中通入少量SO2气体,溶液颜色变浅,利用了勒夏特列原理( )
(4)工业生产中,为提高生产效率,常使用高效催化剂和过量便宜原料,这些措施都可用勒夏特列原理解释( )
(5)实验室可以用排饱和NaHCO3溶液的方法收集CO2( )
正误判断
×
√
×
×
√
1.已知N2与H2合成NH3的反应是一个可逆反应,其热化学方程式为N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1。在工业生产中,可以通过以下途径来提高合成氨的产率,请利用有关知识分析采取这些措施的原因。
(1)向反应器中注入过量N2:_______________________________________
_______;
(2)采用适当的催化剂:___________________________________________
__________;
增大反应物浓度,平衡正向移动,提高氢气的
利用率
加快反应速率,提高单位时间内的产量,提高
生产效率
(3)在高压下进行反应:____________________________________________
____________________________________;
(4)在较高温度下进行反应:___________________;
(5)不断将氨液化,并移去液氨:____________________________________
___________。
增大压强使平衡正向移动,增大化学反应速率,
加快化学反应速率
减小生成物浓度,平衡正向移动,提高
氨气的产率
提高单位时间内的产量和原料的转化率
2.在工业合成硫酸中,其中一步反应为2SO2(g)+O2(g) 2SO3(g) ΔH
=-196.6 kJ·mol-1。
(1)根据反应特点,利用原理分析,增大反应速率的措施有_____________
______________________________________________,增大原料转化率的措施有________________________________。
增大SO2和O2
的浓度、增大压强、升高温度、选用合适的催化剂
增大压强、降低温度(合理即可)
(2)利用下表实验数据回答问题:
温度
平衡时SO2的转化率/%
1×105 Pa
5×105 Pa
1×106 Pa
5×106 Pa
1×107 Pa
450 ℃
97.5
98.9
99.2
99.6
99.7
550 ℃
85.6
92.9
94.9
97.7
98.3
①应选择的温度是________,理由是________________________________
__________________________________________。
450 ℃
该反应是放热反应,升高温度,转
化率降低,且在450 ℃时反应物的转化率较高
温度
平衡时SO2的转化率/%
1×105 Pa
5×105 Pa
1×106 Pa
5×106 Pa
1×107 Pa
450 ℃
97.5
98.9
99.2
99.6
99.7
550 ℃
85.6
92.9
94.9
97.7
98.3
②应采用的压强是_________,理由是_______________________________
___________________________________________________________________________。
1×105 Pa
该压强下SO2的转化率已经很高,若采用更大的压强,SO2的转化率提高很少,但需要的动力更大,对设备的要求更高
应用体验
1.(2021·杭州高二月考)将NO2装入带活塞的密闭容器中,当反应2NO2(g)
N2O4(g)达到平衡后,改变下列一个条件,其中叙述错误的是
A.慢慢压缩气体体积,平衡向右移动,混合气体颜色较原来浅
B.保持容器容积不变,升高温度,气体颜色加深,则此正反应为放热反应
C.慢慢压缩气体使体积减小一半,压强增大,但小于原来的两倍
D.恒温恒容时,充入惰性气体,压强增大,平衡不会移动
√
压缩气体体积即加压,平衡向右移动,但新平衡的c(NO2)比原平衡大,混合气体颜色较原来深,A错误;
NO2(g)为红棕色,N2O4(g)为无色,升高温度使气体颜色加深,则平衡左移,说明正反应放热,B正确;
假设体积减半时平衡不移动,则压强加倍,实际平衡右移,使压强小于原来的两倍,C正确;
恒温恒容时,充入惰性气体,虽然容器内总压强变大,但没有改变c(NO2)、c(N2O4),正、逆反应速率均不变,化学平衡不移动,D正确。
2.下列事实,不能用勒夏特列原理解释的是______(填字母)。
A.溴水中存在如下平衡:Br2+H2O HBr+HBrO,当加入NaOH溶液后
颜色变浅
B.对于反应:2H2O2 2H2O+O2↑,使用MnO2可加快制O2的反应速率
C.对于反应:CO(g)+NO2(g) CO2(g)+NO(g) ΔH<0,升高温度,平
衡向逆反应方向移动
D.合成氨反应:N2(g)+3H2(g) 2NH3(g) ΔH<0,为使氨的产率提高,
理论上应采取低温高压的措施
E.对于反应:H2(g)+I2(g) 2HI(g),缩小体积、加压,颜色加深
BE
催化剂只能改变反应速率,对化学平衡的移动无影响。
归纳总结
勒夏特列原理只能解决与平衡移动有关的问题,不涉及平衡移动的问题都不能用勒夏特列原理解释,常见的有:
(1)使用催化剂不能使化学平衡发生移动;
(2)反应前后气体体积不变的可逆反应,改变压强可以改变化学反应速率,但不能使化学平衡发生移动;
(3)化学反应本身不是可逆反应;
(4)外界条件的改变对化学平衡移动的影响与生产要求不完全一致的反应。
返回
课时对点练
题组一 温度变化对化学平衡的影响
1.将H2(g)和Br2(g)充入恒容密闭容器,恒温下发生反应:H2(g)+Br2(g)
2HBr(g) ΔH<0,平衡时Br2(g)的转化率为a;若初始条件相同,绝热条件下进行上述反应,平衡时Br2(g)的转化率为b。a与b的关系是
A.a>b B.a=b
C.a√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
该反应为放热反应,绝热下进行反应,温度升高,平衡逆向移动,所以绝热条件下平衡时Br2(g)的转化率低于恒温条件下平衡时Br2(g)的转化率,即a>b。
2.反应2A(g) 2B(g)+C(g) ΔH>0,达到平衡时要使v正降低,c(A)增大,应采取的措施是
A.加压 B.减压
C.加催化剂 D.降温
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
3.已知反应:2NO2(g) N2O4(g),把NO2、N2O4的混合气体盛装在两个连
通的烧瓶里,然后用弹簧夹夹住橡胶管,把烧瓶A放入热水里,把烧瓶B放入冰水里,如图所示。与常温时烧瓶内气体的颜色进行对比发现,A烧瓶内气体颜色变深,B烧瓶内气体颜色变浅。下列说法错误的是
A.题述过程中,A烧瓶内正、逆反应速率均增大
B.题述过程中,B烧瓶内c(NO2)减小,c(N2O4)增大
C.题述过程中,A、B烧瓶内气体密度均保持不变
D.反应2NO2(g) N2O4(g)的逆反应为放热反应
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
升高温度,正、逆反应速率都增大,A项正确;
B烧瓶内气体颜色变浅,说明平衡正向移动,
B烧瓶内c(NO2)减小,c(N2O4)增大,B项正确;
容器的容积不变,混合气体的质量不变,A、B烧瓶内气体密度都不变,C项正确;
放在热水中的A烧瓶内气体颜色变深,放在冰水中的B烧瓶内气体颜色变浅,说明升高温度平衡逆向移动,降低温度平衡正向移动,故反应2NO2(g) N2O4(g)的正反应为放热反应,D项错误。
题组二 多因素对化学平衡影响的分析
4.对于可逆反应:2A(s)+3B(g) 2C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是
①增加A的量,平衡向正反应方向移动
②升高温度,平衡向逆反应方向移动,v正减小
③压强增大一倍,平衡不移动,v正、v逆不变
④增大B的浓度,v正>v逆
⑤加入催化剂,平衡向正反应方向移动
A.①② B.④ C.③ D.④⑤
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
①A是固体,增加A的量,平衡不移动,错误;
②升高温度,v正、v逆均增大,但v逆增大的幅度大,平衡向逆反应方向移动,错误;
③压强增大,平衡逆向移动,且v正、v逆都增大,错误;
④增大B的浓度,平衡向正反应方向移动,v正>v逆,正确;
⑤加入催化剂,平衡不移动,错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
5.已知反应:COCl2(g) CO(g)+Cl2(g) ΔH>0,当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,其中能提高COCl2转化率的是
A.①②④ B.①④⑥
C.②③⑤ D.③⑤⑥
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
②恒容通入惰性气体,平衡不移动;
③增加CO的浓度,平衡左移,COCl2的转化率降低;
⑤加入催化剂,平衡不移动。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
题组三 勒夏特列原理的应用
6.(2022·河南正阳高中高二月考)下列事实不能用勒夏特列原理解释的是
A.工业上生产硫酸时,充入过量的空气以提高SO2的转化率
B.打开可乐瓶盖后看到有大量气泡逸出
C.H2、I2(g)、HI平衡时的混合气体加压后颜色变深
D.工业上用氮气、氢气合成氨气的过程中,通过加压将氨气液化以增大
转化率
√
生产硫酸流程中存在平衡:2SO2+O2 2SO3,过量的空气可以提高O2的浓度,平衡正向移动,能用勒夏特列原理解释,故A不符合题意;
打开可乐瓶盖后看到有大量气泡逸出,是因为减小压强,反应H2CO3(aq)
H2O(l)+CO2(g)和CO2(aq) CO2(g)的平衡正向移动,产生大量二氧化碳气体,能用勒夏特列原理解释,故B不符合题意;
该平衡体系中存在可逆反应:2HI(g) H2(g)+I2(g),反应前后气体体积不变,加压平衡不移动,混合气体颜色变深是因为体积缩小浓度增大,和平衡移动无关,不能用勒夏特列原理解释,故C符合题意;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
合成氨反应是气体体积减小的放热反应,增大压强,平衡正向移动,通过加压将氨气液化及时分离出来,使平衡正向移动,能用勒夏特列原理解释,故D不符合题意。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
7.下列事实不能用勒夏特列原理解释的是
A.夏天,打开啤酒瓶时会从瓶口逸出气体
B.浓氨水中加入氢氧化钠固体时产生较多的刺激性气味的气体
C.温度控制在500 ℃有利于合成氨反应
D.将盛有二氧化氮和四氧化二氮混合气体的密闭容器置于冷水中,混合
气体的颜色变浅
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
题组四 化学平衡移动的相关图像
8.在容积不变的密闭容器中存在如下反应:2SO2(g)+O2(g) 2SO3(g) ΔH<0。某研究小组探究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
A.图Ⅰ表示的是t1时刻增大O2的浓度对反应速率的影响
B.图Ⅱ表示的是t1时刻加入催化剂对反应速率的影响
C.图Ⅲ表示的是催化剂对平衡的影响,且甲的催化剂效率比乙高
D.图Ⅲ表示的是压强对化学平衡的影响,且乙的压强较高
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
A项,图Ⅰ改变的条件应是增大压强;
B项,由于正、逆反应速率同等幅度地增大,所以加入的应是催化剂;
C项,由于平衡发生了移动,所以改变的条件不是加入催化剂;
D项,改变的应是温度,且乙的温度高。
9.(2022·湖南临澧一中高二检测)对于可逆反应:2A(g)+B(g) 2C(g),分别测定反应在不同温度下达到平衡时B的转化率,绘制了如图所示的曲线,图中a、b、c三点分别表示不同时刻的状态。下列分析正确的是
A.该反应的ΔH<0
B.b点时的v正小于c点时的v正
C.增大压强,可使a点达到T1温度下的平衡状态
D.c点表示的状态:v正<v逆
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
根据图像可知,温度升高,平衡时B的转化率增大,说明平衡向正反应方向移动,则正反应为吸热反应,ΔH>0,A错误;
根据图像可知,b点的温度小于c点的温度,温
度越高,反应速率越大,c点未达到平衡状态,反应正向进行,则b点时的v正小于c点时的v正,B正确;
根据反应的化学方程式可知,增大压强平衡向正反应方向移动,B的转化率增大,而要使a点达到T1温度下的平衡状态,应使平衡向B的转化率减小的方向移动,应减小压强,C错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
c点不是平衡状态,要达到平衡,反应应向B的转化率增大的方向进行,即向正反应方向进行,正反应速率大于逆反应速率,D错误。
10.(2021·山东临朐实验中学高二月考)2NO2(红棕色) N2O4(无色) ΔH
<0,将一定量的NO2充入注射器中并密封,改变活塞位置的过程中,气体透光率随时间的变化如图所示。已知气体颜色越深,透光率越小,下列说法不正确的是
A.a点达到了平衡状态
B.b点改变的条件是将注射器的活塞向外拉
C.d点:v正<v逆
D.若在c点将温度降低,其透光率将增大
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
a点透光率没有发生变化,则a点达到平衡状态,A正确;
颜色越深,透光率越小,可以知道b点后c(NO2)迅速增大,若将注射器的活塞向外拉,则容积增大,c(NO2)减小,B错误;
d点后透光率减小,平衡逆向移动,则v正<v逆,C正确;
该反应为放热反应,降低温度,平衡正向移动,则透光率将增大,D正确。
11.t ℃时,某一气态平衡体系中含有X(g)、Y(g)、Z(g)、W(g)四种物质,此温度下发生反应的平衡常数表达式为K= ,有关该平衡体系的说法正确的是
A.升高温度,平衡常数K一定增大
B.升高温度,若混合气体的平均相对分子质量变小,则正反应是放热反应
C.增大压强,W(g)的质量分数增加
D.增大X(g)的浓度,平衡向正反应方向移动
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
根据化学平衡常数的表达式可写出反应的化学方程式为2Z(g)+2W(g)
X(g)+2Y(g)。由于不知道该反应的ΔH,无法确定升温时K的变化,A项错误;
升温,若混合气体的平均相对分子质量减小,平衡逆向移动,则正反应为放热反应,B项正确;
增大压强,平衡正向移动,W(g)的质量分数减小,C项错误;
增大X(g)的浓度,平衡向逆反应方向移动,D项错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
12.在一体积可变的密闭容器中,加入一定量的X、Y,发生反应:mX(g)
nY(g) ΔH=Q kJ·mol-1。反应达到平衡时,Y的物质的量浓度与温度、容器体积的关系如下表所示:
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
容器体积/L
c(Y)/(mol·L-1)
温度/℃
1
2
4
100
1.00
0.75
0.53
200
1.20
0.90
0.63
300
1.30
1.00
0.70
下列说法正确的是
A.m>n
B.Q<0
C.温度不变,压强增大,Y的质量分数减小
D.体积不变,温度升高,平衡向逆反应方向移动
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
由表可知,体积不变,升高温度,c(Y)增大,平衡右移,则正反应为吸热反应,Q>0,B、D错;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
容器体积/L
c(Y)/(mol·L-1)
温度/℃
1
2
4
100
1.00
0.75
0.53
200
1.20
0.90
0.63
300
1.30
1.00
0.70
温度不变,容器体积增大,即由1 L变为2 L,若平衡不移动,此时c(Y)应减小为原来的一半,现c(Y)比原来的一半大,即减压,平衡向右移动,即向气体体积增大的方向移动,所以m
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
容器体积/L
c(Y)/(mol·L-1)
温度/℃
1
2
4
100
1.00
0.75
0.53
200
1.20
0.90
0.63
300
1.30
1.00
0.70
因为m
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
容器体积/L
c(Y)/(mol·L-1)
温度/℃
1
2
4
100
1.00
0.75
0.53
200
1.20
0.90
0.63
300
1.30
1.00
0.70
13.已知:4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ΔH=-1 025 kJ·mol-1。若反应物起始的物质的量相同,下列关于该反应的示意图不正确的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
正反应为放热反应,升高温度,反应速率加快,达到平衡所用时间减少,但是平衡向逆反应方向移动,NO的含量减小,A正确、C错误;
增大压强,反应速率加快,达到平衡所用时间减少,正反应为气体体积增大的反应,增大压强,平衡向逆反应方向移动,NO的含量减小,B正确;
催化剂对平衡没有影响,只是加快反应速率,缩短达到平衡所用的时间,D正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
14.N2O5是一种新型硝化剂,在一定温度下可以发生以下反应:2N2O5(g)
4NO2(g)+O2(g) ΔH>0。T1温度时,向密闭容器中通入N2O5,部分实验数据见下表:
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
时间/s
0
500
1 000
1 500
c(N2O5)/(mol·L-1)
5.00
3.52
2.50
2.50
下列说法不正确的是
A.500 s内,N2O5的分解速率为2.96×10-3 mol·L-1·s-1
B.T1温度下的平衡常数K1=125,平衡时N2O5的转化率为50%
C.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1
达到平衡时,c(N2O5)>5.00 mol·L-1
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
时间/s
0
500
1 000
1 500
c(N2O5)/(mol·L-1)
5.00
3.52
2.50
2.50
√
A项,500 s内,N2O5的浓度变化量为(5.00-3.52) mol·L-1=1.48 mol·L-1,v(N2O5)= =2.96×10-3 mol·L-1·s-1;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
时间/s
0
500
1 000
1 500
c(N2O5)/(mol·L-1)
5.00
3.52
2.50
2.50
B项,分析如下:
2N2O5(g) 4NO2(g)+O2(g)
起始/(mol·L-1) 5.00 0 0
转化/(mol·L-1) 2.50 5.00 1.25
平衡/(mol·L-1) 2.50 5.00 1.25
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
时间/s
0
500
1 000
1 500
c(N2O5)/(mol·L-1)
5.00
3.52
2.50
2.50
C项,该反应的正反应为吸热反应,升高温度,平衡常数增大,故K1>K2;
D项,达到平衡后,其他条件不变,将容器的体积压缩到原来的 ,相当于增大压强,平衡向左移动,则c(N2O5)>5.00 mol·L-1。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
时间/s
0
500
1 000
1 500
c(N2O5)/(mol·L-1)
5.00
3.52
2.50
2.50
15.2021年1月,中国按照国际标准研制的拥有自主知识产权的大型客机C919完成了高寒试验试飞任务,科学家在实验室中研究的利用催化技术将飞机尾气中的NO和CO转变成CO2和N2的反应为2NO(g)+2CO(g)
N2(g)+2CO2(g) ΔH<0。
(1)假设在密闭容器中发生上述反应,达到平衡时,下列措施能提高NO转化率的是______(填字母)。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的容积
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
CD
使用催化剂不能改变平衡状态,不影响反应物的转化率,故A不符合题意;
该反应正向为放热反应,升高温度,平衡逆向移动,NO的转化率降低,故B不符合题意;
降低反应体系的温度,平衡正向移动,NO的转化率提高,故C符合题意;
该反应的正反应是气体体积减小的反应,缩小容器的容积,相当于加压,平衡正向移动,NO的转化率提高,故D符合题意。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(2)若将1 mol NO和2 mol CO通入2 L的恒容密闭容器中,在一定条件下发生上述反应,反应中生成的N2的物质的量浓度随时间的变化情况如图所示。则NO从反应开始到平衡时的平均反应速率v(NO)=___________________,4 min末CO的浓度为_____mol·L-1。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
0.05 mol·L-1·min-1
0.8
NO从反应开始到平衡时的平均反应速率v(NO)=2v(N2)= ×2=0.05 mol·L-1·min-1;4 min末CO的浓度为(1-0.2) mol·L-1=0.8 mol·L -1。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
16.(1)亚硝酰氯(ClNO)是有机合成中常用的试剂,已知:2NO(g)+Cl2(g)
2ClNO(g) ΔH<0,一定温度下,将2 mol NO与2 mol Cl2置于2 L密闭容器中发生反应。
①下列可判断反应达到平衡状态的是______(填字母,下同)。
A.混合气体的平均相对分子质量不变
B.混合气体的密度保持不变
C.NO和Cl2的物质的量之比保持不变
D.每消耗1 mol NO同时生成1 mol ClNO
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
AC
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
起始时投入的NO与Cl2的物质的量之比是1∶1,而变化的NO与Cl2的物质的量之比是2∶1,所以在未达到平衡前,NO与Cl2的物质的量之比是变化的,当NO与Cl2的物质的量之比保持不变时,反应达到平衡状态,C正确;
反应的任一阶段,每消耗1 mol NO一定会生成1 mol ClNO,不能确定是否达到平衡状态,D错误。
②为了加快化学反应速率,同时提高NO的转化率,其他条件不变时,可采取的措施有_____。
A.升高温度 B.缩小容器容积
C.再充入Cl2 D.使用合适的催化剂
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
BC
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
升高温度,反应速率加快,但该反应正向为放热反应,平衡逆向移动,NO的转化率降低,A错误;
缩小容器容积,相当于加压,平衡正向移动,反应速率加快,B正确;
充入Cl2,反应速率加快,平衡正向移动,NO的转化率提高,C正确;
使用合适的催化剂,能加快反应速率,但不影响平衡移动,即NO的转化率不变,D错误。
③一定条件下在恒温恒容的密闭容器中,按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数φ(ClNO)随 的变化图像如图甲所示,当 =2.5时,达到平衡状态,ClNO的体积分数可能是图甲中的____点(填“D”“E”或“F”)。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
F
当反应物的物质的量之比等于其化学计量数之比时生成物的体积分数最大,当 =2.5时ClNO的体积分数减小,所以应该是F点。
(2)在容积为10 L的密闭容器中充入3 mol NO和2 mol Cl2,在不同温度下发生反应:2NO(g)+Cl2(g) 2ClNO(g),ClNO的体积百分含量随时间的变化如图乙所示。已知T1>T2>T3。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
①与实验Ⅰ相比,实验Ⅱ除温度不同外,还改变的条件是____________
________。
加入催化剂
(或加压)
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
ΔH<0,升高温度,ClNO的百分含量不断减小,平衡逆向移动。与实验Ⅰ相比,实验Ⅱ的反应温度:T2
若实验Ⅲ达到平衡时的热量变化为Q kJ,则该反应的热化学方程式为____________________________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
0.008 mol·L-1·min-1
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
实验Ⅲ反应至25 min达到平衡,
2NO(g) + Cl2(g) 2ClNO(g)
起始/(mol·L-1) 0.3 0.2 0
变化/(mol·L-1) 2c c 2c
平衡/(mol·L-1) 0.3-2c 0.2-c 2c
平衡时ClNO的体积百分含量为50%,
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
则用NO的浓度变化表示的平均反应速率
达到平衡时,Cl2的物质的量的变化量为0.1 mol·L-1×
10 L=1 mol,反应放出Q kJ热量,则该反应的热化学方程式为2NO(g)+Cl2(g) 2ClNO(g) ΔH=-Q kJ·mol-1。
返回
专题2
本课结束
