专题2第三单元 化学平衡的移动 微专题7 化学平衡图像的分析与应用(共30张ppt)
文档属性
| 名称 | 专题2第三单元 化学平衡的移动 微专题7 化学平衡图像的分析与应用(共30张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 998.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-30 09:13:58 | ||
图片预览











文档简介
(共30张PPT)
微专题7
WEIZHUANTIQI
化学平衡图像的分析与应用
专题2
1.解题思维建模
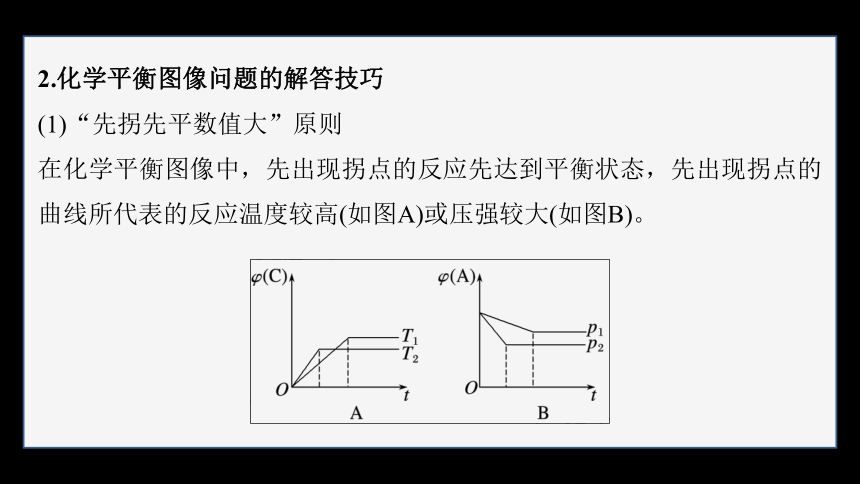
2.化学平衡图像问题的解答技巧
(1)“先拐先平数值大”原则
在化学平衡图像中,先出现拐点的反应先达到平衡状态,先出现拐点的曲线所代表的反应温度较高(如图A)或压强较大(如图B)。
对于反应:aA(g)+bB(g) cC(g),根据题述图像解答下列问题:
例1
(1)图A表示T2__T1,由T2→T1,φ(C)______,降低温度平衡______移动,故正反应是_____反应。
(2)图B表示p1____p2,由p2→p1,φ(A)增大,减小压强,平衡_____移动,故a+b___c。
>
增大
正向
放热
<
逆向
>
(2)“定一议二”原则
图像中有三个量时,先确定一个量不变,再讨论另外两个量的关系。
对于可逆反应:mA(g)+nB(g) qC(g) ΔH=Q kJ·mol-1
例2
(1)根据图①回答问题:
①m+n___q(填“>”“<”或“=”,下同);
②若Q>0,则T1____T2。
(2)根据图②回答问题:
①Q____0;
②若p1>p2,则m+n___q。
<
>
>
>
(3)①特殊图像分析:由于某一条件对平衡的影响只能向一个方向移动,所以最高点(最低点)及以后为平衡状态受条件影响的情况,前面为未达到平衡的情况。
②结合题目信息也有图像曲线上的点全为对应条件下的平衡点。
(1)对于反应:aA(g)+bB(g)
cC(g)+dD(g) ΔH<0,M点前,表示化学反应从反应开始到建立平衡的过程,则v正 v逆,M点为 ,M点后为平衡受温度的影响情况。
例3
>
平衡点
(2)如图所示曲线是其他条件不变时,某反应物的平衡转化率与温度的关系曲线。图中标出的1、2、3、4四个点,表示v正>v逆的是点 ,表示v正<v逆的是点 ,而点2、4表示v正 v逆。
3
1
=
1
2
3
4
1.我国自主知识产权的首套煤基乙醇工业化项目的生产过程为先用煤制得乙酸甲酯,再将乙酸甲酯转化为乙醇。乙酸甲酯转化为乙醇的反应原理为CH3COOCH3(g)+2H2(g) C2H5OH(g)+CH3OH(g) ΔH<0。该反应中的反应速率随时间变化的曲线如图所示,t1、t3、t4时刻分别改变某一外界条件。下列说法错误的是
A.t1时升高温度
B.t3时加入催化剂
C.t4时增大反应容器的容积,使体系压强减小
D.在反应保持化学平衡的时间段中,C2H5OH的体积分数最小的时间段是t2~t3
√
5
6
7
升高温度,正、逆反应速率均增大,且平衡逆向移动,因此t1时升高温度,A项正确;
加入催化剂,正、逆反应速率同等程度增大,平衡不移动,因此t3时加入催化剂,B项正确;
当温度一定时,增大反应容器的容积,体系压强减小,正、逆反应速率都减小,且平衡逆向移动,C项正确;
由图和上述分析可知,在反应保持化学平衡的时间段中,C2H5OH的体积分数最小的时间段是t5~t6,D项错误。
1
2
3
4
5
6
7
2.已知某可逆反应mA(g)+nB(g) pC(g)在密闭容器中进行,如图表示
在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数φ(B)的关系曲线,由曲线分析,下列判断正确的是
A.T1<T2,p1>p2,m+n>p,放热反应
B.T1>T2,p1<p2,m+n>p,吸热反应
C.T1<T2,p1>p2,m+n<p,放热反应
D.T1>T2,p1<p2,m+n<p,吸热反应
√
1
2
3
4
5
6
7
由“先拐先平数值大”原则,对比①②可知T1>T2,对比②③可知p2>p1;对比①②,温度由T2升高到T1,φ(B)减小,说明升温平衡向正反应方向移动,所以正向为吸热反应;对比②③,由p1加压到p2,φ(B)增大,说明加压平衡向逆反应方向移动,所以逆向为气体体积减小的反应,即m+n<p。
1
2
3
4
5
6
7
3.反应mA(s)+nB(g) eC(g)+fD(g),反应过程中,当其他条件不变时,
C的百分含量(C%)与温度(T)和压强(p)的关系如图所示,下列叙述正确的是
A.达到平衡后,加入催化剂,C%增大
B.化学方程式中n<e+f
C.达到平衡后,若升温,平衡向左移动
D.达到平衡后,增加A的量有利于平衡向右移动
√
1
2
3
4
5
6
7
加入催化剂,正反应速率和逆反应速率同等程度地增大,平衡不移动,C%没有改变,A项错误;
从图像上可以看出,温度一定时,C的百分含量随压强的增大而增大,即增大压强平衡向正反应方
向移动,根据勒夏特列原理,正反应方向为气体体积减小的方向,即n>e+f,B项错误;
由图像可知,当压强一定时,温度升高(200 ℃→300 ℃→400 ℃),生成物C的百分含量减小,平衡向逆反应方向移动,C项正确;
A是固体,固体浓度视为常数,增加A的量平衡不发生移动,D项错误。
1
2
3
4
5
6
7
4.(2021·南昌高二月考)在保持体系总压为105 Pa的条件下进行反应:SO2(g)+ O2(g) SO3(g),原料气中SO2和O2的物质的量之比m= 不同时,
SO2的平衡转化率与温度(T)的关系如图所示。图中A点原料气的成分是n(SO2)=10 mol,n(O2)=24.4 mol,n(N2)=70 mol,下列有关说法正确的是(已知:用分压表示的平衡常数为Kp,分压=总压×物质的量分数)
A.该反应的正反应是吸热反应
B.m1<m2<m3
C.A点时SO2的分压p(SO2)=4.0×103 Pa
D.在500 ℃、m3的条件下,该反应的平衡常数Kp=5.2×10-2
√
1
2
3
4
5
6
7
由图可知,m相同时,温度越高,SO2的平衡转化率越小,则升高温度平衡逆向移动,该反应的正反应为放热反应,A项错误;
相同条件下,增大氧气的量可增大二氧化硫的平衡
转化率,则m越小,SO2的平衡转化率越大,则m1>m2>m3,B项错误;
A点原料气的成分是n(SO2)=10 mol,n(O2)=24.4 mol,n(N2)=70 mol,二氧化硫的平衡转化率为88%,则:
1
2
3
4
5
6
7
SO2(g)+ O2(g) SO3(g)
起始量/mol 10 24.4 0
转化量/mol 8.8 4.4 8.8
平衡量/mol 1.2 20 8.8
1
2
3
4
5
6
7
1
2
3
4
5
6
7
5.一定条件下存在反应:C(s)+H2O(g) CO(g)+H2(g)
ΔH>0,在甲、乙、丙三个恒容容器中发生上述反应,各容器中温度、反应物的起始量如表所示,甲、丙反应过程中CO的物质的量浓度随时间变化的曲线如图所示。
容器 甲 乙 丙
容积 0.5 L 0.5 L V
温度 T1 ℃ T2 ℃ T1 ℃
起始量 2 mol C、1 mol H2O 1 mol CO、1 mol H2 4 mol C、2 mol H2O
1
2
3
4
5
6
7
下列说法错误的是
A.甲容器中,0~15 min内v(H2)=0.1 mol·L-1·min-1
B.乙容器中,若平衡时n(H2O)=0.4 mol,则T2<T1
C.当温度为T1 ℃时,反应的平衡常数K=4.5
D.丙容器的容积V>0.5 L
容器 甲 乙 丙
容积 0.5 L 0.5 L V
温度 T1 ℃ T2 ℃ T1 ℃
起始量 2 mol C、1 mol H2O 1 mol CO、1 mol H2 4 mol C、2 mol H2O
√
1
2
3
4
5
6
7
由图可知,0~15 min内甲容器中CO的浓度变化量为1.5 mol·L-1,v(CO)= =0.1 mol·L-1·min-1,速率之比等于化学计量数之比,所以v(H2)=0.1 mol·
L-1·min-1,A项正确;
容器 甲 乙 丙
容积 0.5 L 0.5 L V
温度 T1 ℃ T2 ℃ T1 ℃
起始量 2 mol C、1 mol H2O 1 mol CO、1 mol H2 4 mol C、2 mol H2O
1
2
3
4
5
6
7
甲容器中平衡时n(H2O)=1 mol-1.5 mol·L-1×0.5 L=0.25 mol,乙容器中,若平衡时n(H2O)=0.4 mol,因C(s)的量不影响平衡移动,则乙相对甲来说平衡向逆反应方向移动,因为正反应吸热,所以乙的温度低,即T2<T1,B项正确;
容器 甲 乙 丙
容积 0.5 L 0.5 L V
温度 T1 ℃ T2 ℃ T1 ℃
起始量 2 mol C、1 mol H2O 1 mol CO、1 mol H2 4 mol C、2 mol H2O
1
2
3
4
5
6
7
根据甲容器中反应数据计算:
C(s)+H2O(g) CO(g)+H2(g)
起始/(mol·L-1) 2 0 0
转化/(mol·L-1) 1.5 1.5 1.5
平衡/(mol·L-1) 0.5 1.5 1.5
1
2
3
4
5
6
7
丙容器中反应物的起始量为甲容器的2倍,若V为0.5 L,由于正反应为气体分子数增大的反应,加压平衡左移,c(CO)<3 mol·L-1,要使c(CO)=3 mol·L-1,则应压缩体积,虽然压缩体积会使平衡左移,导致CO的物质的量减小,但压缩体积对CO的物质的量浓度的影响程度更大,故丙容器的容积V<0.5 L,D项错误。
容器 丙
容积 V
温度 T1 ℃
起始量 4 mol C、2 mol H2O
1
2
3
4
5
6
7
6.(2021·银川高二月考)在三个容积均为1 L的密闭容器中以不同的氢碳比
充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2(g)
C2H4(g)+4H2O(g) ΔH。CO2的平衡转化率与温度的关系如图所示。下列说法正确的是
A.ΔH>0
B.氢碳比:①<②
C.氢碳比为2.0时,Q点:v正<v逆
D.若起始时,CO2、H2的浓度分别为0.5 mol·L-1和1.0 mol·L-1,则可得
P点的平衡常数K(P)=512
√
1
2
3
4
5
6
7
由图可知,相同氢碳比时,随温度升高CO2的平衡转化率减小,说明升高温度平衡逆向移动,则该反应为放热反应,故ΔH<0,A项错误;
相同条件下,氢碳比越大,二氧化碳的平衡转化率越大,故由图可知,氢碳比:①>②,B项错误;
相同温度下在氢碳比为2.0时,Q点二氧化碳转化率小于平衡时的转化率,说明Q点未达到平衡,反应向正反应方向进行,故Q点:v正>v逆,C项错误;
1
2
3
4
5
6
7
P点时CO2的平衡转化率为50%,则:
2CO2(g)+6H2(g) C2H4(g)+4H2O(g)
起始/mol 0.5 1.0 0 0
转化/mol 0.25 0.75 0.125 0.5
平衡/mol 0.25 0.25 0.125 0.5
1
2
3
4
5
6
7
7.对于可逆反应N2(g)+3H2(g) 2NH3(g) ΔH<0。下列研究目的和图示相符的是
A B C D
研究目的 温度(T)对反应的影响(T2>T1) 压强(p)对平衡常数的影响 温度(T)对反应的影响 压强(p)对反应的影响(p2>p1)
图示
√
1
2
3
4
5
6
7
温度越高,反应速率越快,则温度T2对应曲线斜率大,A错误;
平衡常数只受温度的影响,所以压强增大时,平衡常数不变,B错误;
在建立平衡的过程中,反应要正向进行,氮气的体积分数变小,当达到平衡后,升高温度,由于该反应为放热反应,平衡逆向移动,氮气的体积分数变大,C正确;
由于该反应是气体体积减小的反应,增大压强,平衡向正反应方向移动,氨气的体积分数变大,即压强越大,氨气的体积分数越大,且首先达到平衡状态,D错误。
1
2
3
4
5
6
7
专题2
本课结束
微专题7
WEIZHUANTIQI
化学平衡图像的分析与应用
专题2
1.解题思维建模
2.化学平衡图像问题的解答技巧
(1)“先拐先平数值大”原则
在化学平衡图像中,先出现拐点的反应先达到平衡状态,先出现拐点的曲线所代表的反应温度较高(如图A)或压强较大(如图B)。
对于反应:aA(g)+bB(g) cC(g),根据题述图像解答下列问题:
例1
(1)图A表示T2__T1,由T2→T1,φ(C)______,降低温度平衡______移动,故正反应是_____反应。
(2)图B表示p1____p2,由p2→p1,φ(A)增大,减小压强,平衡_____移动,故a+b___c。
>
增大
正向
放热
<
逆向
>
(2)“定一议二”原则
图像中有三个量时,先确定一个量不变,再讨论另外两个量的关系。
对于可逆反应:mA(g)+nB(g) qC(g) ΔH=Q kJ·mol-1
例2
(1)根据图①回答问题:
①m+n___q(填“>”“<”或“=”,下同);
②若Q>0,则T1____T2。
(2)根据图②回答问题:
①Q____0;
②若p1>p2,则m+n___q。
<
>
>
>
(3)①特殊图像分析:由于某一条件对平衡的影响只能向一个方向移动,所以最高点(最低点)及以后为平衡状态受条件影响的情况,前面为未达到平衡的情况。
②结合题目信息也有图像曲线上的点全为对应条件下的平衡点。
(1)对于反应:aA(g)+bB(g)
cC(g)+dD(g) ΔH<0,M点前,表示化学反应从反应开始到建立平衡的过程,则v正 v逆,M点为 ,M点后为平衡受温度的影响情况。
例3
>
平衡点
(2)如图所示曲线是其他条件不变时,某反应物的平衡转化率与温度的关系曲线。图中标出的1、2、3、4四个点,表示v正>v逆的是点 ,表示v正<v逆的是点 ,而点2、4表示v正 v逆。
3
1
=
1
2
3
4
1.我国自主知识产权的首套煤基乙醇工业化项目的生产过程为先用煤制得乙酸甲酯,再将乙酸甲酯转化为乙醇。乙酸甲酯转化为乙醇的反应原理为CH3COOCH3(g)+2H2(g) C2H5OH(g)+CH3OH(g) ΔH<0。该反应中的反应速率随时间变化的曲线如图所示,t1、t3、t4时刻分别改变某一外界条件。下列说法错误的是
A.t1时升高温度
B.t3时加入催化剂
C.t4时增大反应容器的容积,使体系压强减小
D.在反应保持化学平衡的时间段中,C2H5OH的体积分数最小的时间段是t2~t3
√
5
6
7
升高温度,正、逆反应速率均增大,且平衡逆向移动,因此t1时升高温度,A项正确;
加入催化剂,正、逆反应速率同等程度增大,平衡不移动,因此t3时加入催化剂,B项正确;
当温度一定时,增大反应容器的容积,体系压强减小,正、逆反应速率都减小,且平衡逆向移动,C项正确;
由图和上述分析可知,在反应保持化学平衡的时间段中,C2H5OH的体积分数最小的时间段是t5~t6,D项错误。
1
2
3
4
5
6
7
2.已知某可逆反应mA(g)+nB(g) pC(g)在密闭容器中进行,如图表示
在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数φ(B)的关系曲线,由曲线分析,下列判断正确的是
A.T1<T2,p1>p2,m+n>p,放热反应
B.T1>T2,p1<p2,m+n>p,吸热反应
C.T1<T2,p1>p2,m+n<p,放热反应
D.T1>T2,p1<p2,m+n<p,吸热反应
√
1
2
3
4
5
6
7
由“先拐先平数值大”原则,对比①②可知T1>T2,对比②③可知p2>p1;对比①②,温度由T2升高到T1,φ(B)减小,说明升温平衡向正反应方向移动,所以正向为吸热反应;对比②③,由p1加压到p2,φ(B)增大,说明加压平衡向逆反应方向移动,所以逆向为气体体积减小的反应,即m+n<p。
1
2
3
4
5
6
7
3.反应mA(s)+nB(g) eC(g)+fD(g),反应过程中,当其他条件不变时,
C的百分含量(C%)与温度(T)和压强(p)的关系如图所示,下列叙述正确的是
A.达到平衡后,加入催化剂,C%增大
B.化学方程式中n<e+f
C.达到平衡后,若升温,平衡向左移动
D.达到平衡后,增加A的量有利于平衡向右移动
√
1
2
3
4
5
6
7
加入催化剂,正反应速率和逆反应速率同等程度地增大,平衡不移动,C%没有改变,A项错误;
从图像上可以看出,温度一定时,C的百分含量随压强的增大而增大,即增大压强平衡向正反应方
向移动,根据勒夏特列原理,正反应方向为气体体积减小的方向,即n>e+f,B项错误;
由图像可知,当压强一定时,温度升高(200 ℃→300 ℃→400 ℃),生成物C的百分含量减小,平衡向逆反应方向移动,C项正确;
A是固体,固体浓度视为常数,增加A的量平衡不发生移动,D项错误。
1
2
3
4
5
6
7
4.(2021·南昌高二月考)在保持体系总压为105 Pa的条件下进行反应:SO2(g)+ O2(g) SO3(g),原料气中SO2和O2的物质的量之比m= 不同时,
SO2的平衡转化率与温度(T)的关系如图所示。图中A点原料气的成分是n(SO2)=10 mol,n(O2)=24.4 mol,n(N2)=70 mol,下列有关说法正确的是(已知:用分压表示的平衡常数为Kp,分压=总压×物质的量分数)
A.该反应的正反应是吸热反应
B.m1<m2<m3
C.A点时SO2的分压p(SO2)=4.0×103 Pa
D.在500 ℃、m3的条件下,该反应的平衡常数Kp=5.2×10-2
√
1
2
3
4
5
6
7
由图可知,m相同时,温度越高,SO2的平衡转化率越小,则升高温度平衡逆向移动,该反应的正反应为放热反应,A项错误;
相同条件下,增大氧气的量可增大二氧化硫的平衡
转化率,则m越小,SO2的平衡转化率越大,则m1>m2>m3,B项错误;
A点原料气的成分是n(SO2)=10 mol,n(O2)=24.4 mol,n(N2)=70 mol,二氧化硫的平衡转化率为88%,则:
1
2
3
4
5
6
7
SO2(g)+ O2(g) SO3(g)
起始量/mol 10 24.4 0
转化量/mol 8.8 4.4 8.8
平衡量/mol 1.2 20 8.8
1
2
3
4
5
6
7
1
2
3
4
5
6
7
5.一定条件下存在反应:C(s)+H2O(g) CO(g)+H2(g)
ΔH>0,在甲、乙、丙三个恒容容器中发生上述反应,各容器中温度、反应物的起始量如表所示,甲、丙反应过程中CO的物质的量浓度随时间变化的曲线如图所示。
容器 甲 乙 丙
容积 0.5 L 0.5 L V
温度 T1 ℃ T2 ℃ T1 ℃
起始量 2 mol C、1 mol H2O 1 mol CO、1 mol H2 4 mol C、2 mol H2O
1
2
3
4
5
6
7
下列说法错误的是
A.甲容器中,0~15 min内v(H2)=0.1 mol·L-1·min-1
B.乙容器中,若平衡时n(H2O)=0.4 mol,则T2<T1
C.当温度为T1 ℃时,反应的平衡常数K=4.5
D.丙容器的容积V>0.5 L
容器 甲 乙 丙
容积 0.5 L 0.5 L V
温度 T1 ℃ T2 ℃ T1 ℃
起始量 2 mol C、1 mol H2O 1 mol CO、1 mol H2 4 mol C、2 mol H2O
√
1
2
3
4
5
6
7
由图可知,0~15 min内甲容器中CO的浓度变化量为1.5 mol·L-1,v(CO)= =0.1 mol·L-1·min-1,速率之比等于化学计量数之比,所以v(H2)=0.1 mol·
L-1·min-1,A项正确;
容器 甲 乙 丙
容积 0.5 L 0.5 L V
温度 T1 ℃ T2 ℃ T1 ℃
起始量 2 mol C、1 mol H2O 1 mol CO、1 mol H2 4 mol C、2 mol H2O
1
2
3
4
5
6
7
甲容器中平衡时n(H2O)=1 mol-1.5 mol·L-1×0.5 L=0.25 mol,乙容器中,若平衡时n(H2O)=0.4 mol,因C(s)的量不影响平衡移动,则乙相对甲来说平衡向逆反应方向移动,因为正反应吸热,所以乙的温度低,即T2<T1,B项正确;
容器 甲 乙 丙
容积 0.5 L 0.5 L V
温度 T1 ℃ T2 ℃ T1 ℃
起始量 2 mol C、1 mol H2O 1 mol CO、1 mol H2 4 mol C、2 mol H2O
1
2
3
4
5
6
7
根据甲容器中反应数据计算:
C(s)+H2O(g) CO(g)+H2(g)
起始/(mol·L-1) 2 0 0
转化/(mol·L-1) 1.5 1.5 1.5
平衡/(mol·L-1) 0.5 1.5 1.5
1
2
3
4
5
6
7
丙容器中反应物的起始量为甲容器的2倍,若V为0.5 L,由于正反应为气体分子数增大的反应,加压平衡左移,c(CO)<3 mol·L-1,要使c(CO)=3 mol·L-1,则应压缩体积,虽然压缩体积会使平衡左移,导致CO的物质的量减小,但压缩体积对CO的物质的量浓度的影响程度更大,故丙容器的容积V<0.5 L,D项错误。
容器 丙
容积 V
温度 T1 ℃
起始量 4 mol C、2 mol H2O
1
2
3
4
5
6
7
6.(2021·银川高二月考)在三个容积均为1 L的密闭容器中以不同的氢碳比
充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2(g)
C2H4(g)+4H2O(g) ΔH。CO2的平衡转化率与温度的关系如图所示。下列说法正确的是
A.ΔH>0
B.氢碳比:①<②
C.氢碳比为2.0时,Q点:v正<v逆
D.若起始时,CO2、H2的浓度分别为0.5 mol·L-1和1.0 mol·L-1,则可得
P点的平衡常数K(P)=512
√
1
2
3
4
5
6
7
由图可知,相同氢碳比时,随温度升高CO2的平衡转化率减小,说明升高温度平衡逆向移动,则该反应为放热反应,故ΔH<0,A项错误;
相同条件下,氢碳比越大,二氧化碳的平衡转化率越大,故由图可知,氢碳比:①>②,B项错误;
相同温度下在氢碳比为2.0时,Q点二氧化碳转化率小于平衡时的转化率,说明Q点未达到平衡,反应向正反应方向进行,故Q点:v正>v逆,C项错误;
1
2
3
4
5
6
7
P点时CO2的平衡转化率为50%,则:
2CO2(g)+6H2(g) C2H4(g)+4H2O(g)
起始/mol 0.5 1.0 0 0
转化/mol 0.25 0.75 0.125 0.5
平衡/mol 0.25 0.25 0.125 0.5
1
2
3
4
5
6
7
7.对于可逆反应N2(g)+3H2(g) 2NH3(g) ΔH<0。下列研究目的和图示相符的是
A B C D
研究目的 温度(T)对反应的影响(T2>T1) 压强(p)对平衡常数的影响 温度(T)对反应的影响 压强(p)对反应的影响(p2>p1)
图示
√
1
2
3
4
5
6
7
温度越高,反应速率越快,则温度T2对应曲线斜率大,A错误;
平衡常数只受温度的影响,所以压强增大时,平衡常数不变,B错误;
在建立平衡的过程中,反应要正向进行,氮气的体积分数变小,当达到平衡后,升高温度,由于该反应为放热反应,平衡逆向移动,氮气的体积分数变大,C正确;
由于该反应是气体体积减小的反应,增大压强,平衡向正反应方向移动,氨气的体积分数变大,即压强越大,氨气的体积分数越大,且首先达到平衡状态,D错误。
1
2
3
4
5
6
7
专题2
本课结束
