专题2第一单元 化学反应速率 微专题5 化学反应历程与化学反(共15张ppt)
文档属性
| 名称 | 专题2第一单元 化学反应速率 微专题5 化学反应历程与化学反(共15张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 461.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-30 09:15:49 | ||
图片预览





文档简介
(共15张PPT)
微专题5
WEIZHUANTIWU
化学反应历程与化学反应速率
专题2
1.基元反应、过渡态理论及活化能
(1)基元反应:研究发现,大多数化学反应并不是经过简单碰撞就能完成,往往要经过多个反应步骤才能实现。每一步反应都称为基元反应。
(2)过渡态理论:过渡态理论认为,反应物分子并不只是通过简单碰撞直接形成产物,而是必须经过一个形成活化络合物的过渡状态,并且达到这个过渡状态需要一定的活化能。这与爬山类似,山的最高点便是过渡态。
2.多步反应的活化能及与速率的关系
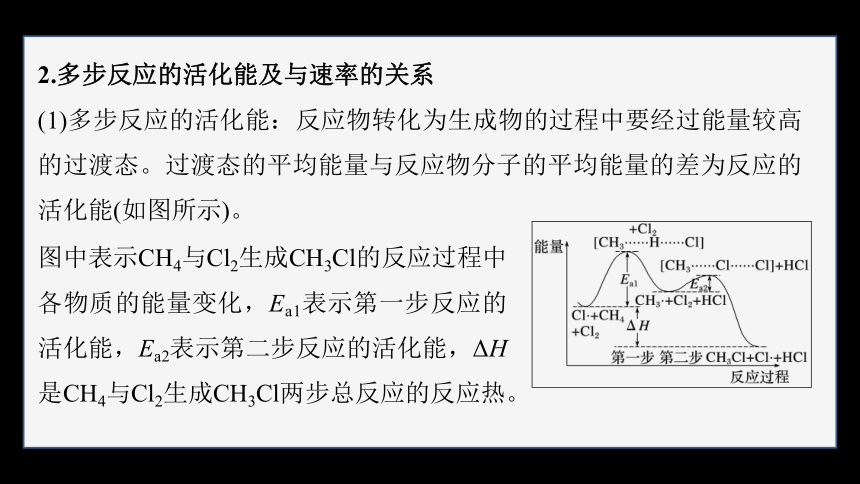
(1)多步反应的活化能:反应物转化为生成物的过程中要经过能量较高的过渡态。过渡态的平均能量与反应物分子的平均能量的差为反应的活化能(如图所示)。
图中表示CH4与Cl2生成CH3Cl的反应过程中各物质的能量变化,Ea1表示第一步反应的活化能,Ea2表示第二步反应的活化能,ΔH是CH4与Cl2生成CH3Cl两步总反应的反应热。
(2)活化能和速率的关系:基元反应的活化能越大,反应物到达过渡态就越不容易,该基元反应的速率就越慢。一个化学反应的速率取决于速率最慢的基元反应。
上述反应中Ea2较小,因而第二步为快反应,第一步是慢反应,它决定了CH4与Cl2生成CH3Cl的反应速率。
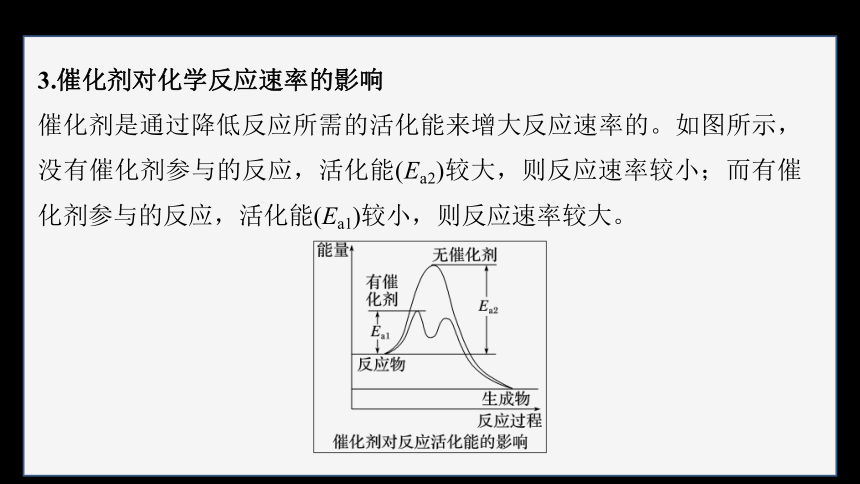
3.催化剂对化学反应速率的影响
催化剂是通过降低反应所需的活化能来增大反应速率的。如图所示,没有催化剂参与的反应,活化能(Ea2)较大,则反应速率较小;而有催化剂参与的反应,活化能(Ea1)较小,则反应速率较大。
1
2
3
4
1.研究表明CO与N2O在Fe+作用下发生反应的能量变化及反应历程如图所示,两步反应分别为:①N2O+Fe+===N2
+FeO+(慢);②FeO++CO===CO2+Fe+(快)。下列说法正确的是
A.反应①是氧化还原反应,反应②是非氧化还原反应
B.两步反应均为放热反应,总反应的化学反应速率由反应②决定
C.Fe+使反应的活化能减小,FeO+是中间产物
D.若转移1 mol电子,则消耗11.2 L N2O
√
1
2
3
4
反应②FeO++CO===CO2+Fe+(快),有元素化合价发生变化,属于氧化还原反应,故A项错误;
总反应速率由反应慢的一步决定,即由反应①决定,故B项错误;
Fe+作催化剂,使反应的活化能减小,FeO+是中间产物,故C项正确;
气体存在的条件未知,不能确定气体的体积,故D项错误。
2.(2022·山东潍坊高二月考)某反应加入催化剂后,反应过程变成两个基元反应,相关能量变化如图所示(E为正值,单位:kJ·mol-1)。下列有关说法正确的是
A.总反应的活化能Ea=E1+E3
B.总反应的焓变ΔH=-(E4+E2-E1-E3)
C.此条件下,第一个基元反应的反应速率
小于第二个
D.对于Ea>0的反应,必须加热才能进行
1
2
3
4
√
1
2
3
4
焓变等于正、逆反应活化能之差,所以ΔH=E1+E3-(E4+E2)=-(E4+E2-E1-E3),故B正确;
据图可知第一个基元反应的活化能E1小于第二个基元反应的活化能E3,活化能越小反应速率越快,
所以此条件下,第一个基元反应的反应速率大于第二个,故C错误;
活化能是活化分子具有的平均能量与反应物分子具有的平均能量之差,不能根据活化能判断反应发生的条件,故D错误。
3.(2022·安徽芜湖单元测试)反应4HBr(g)+O2(g)===2H2O(g)+2Br2(g)的能量与反应过程的关系如图所示:
下列说法错误的是
A.HOOBr和HOBr均是反应的中间体
B.活化能最大的步骤反应为HBr(g)+
O2(g)===HOOBr(g)
C.三步反应中,第一步反应的速率最慢
D.用E表示键能,该反应的ΔH=2E(Br—Br)+4E(H—O)-4E(H—Br)-
E(O==O)
1
2
3
4
√
1
2
3
4
由图可得HOOBr和HOBr均是反应的中间体,A项正确;
第一步反应的活化能最大,发生反应4HBr(g)+O2(g)===3HBr(g)+HOOBr(g),
简化为HBr(g)+O2(g)===HOOBr(g),B项正确;
第一步反应的活化能最大,反应速率最慢,C项正确;
ΔH=反应物的总键能-生成物的总键能,D项错误。
1
2
3
4
4.(2021·长沙检测)活泼自由基与氧气的反应一直是关注的热点。HNO自由基与O2反应过程的能量变化如图所示。下列说法正确的是
A.该反应为吸热反应
B.产物的稳定性:P1>P2
C.该过程中最大正反应的活化能
E正=186.19 kJ·mol-1
D.相同条件下,由中间产物Z转化为产物的速率:v(P1)√
1
2
3
4
根据图像可知,此反应的反应物的总能量大于生成物的总能量,故此反应是放热反应,故A错误;
物质的能量越高越不稳定,根据图像可知,产物P1的能量高于产物P2的能量,故产物的稳定性:P1最大的正反应的活化能出现在由中间产物Z到过渡态Ⅳ时,即最大正反应的活化能E正=-18.92 kJ·mol-1-(-205.11 kJ·mol-1)=186.19 kJ·mol-1,故C正确;
1
2
3
4
相同条件下,反应所需的活化能越小,则反应的速率越快,由于到产物P1所需活化能小,故反应速率快,v(P1)>v(P2),故D错误。
专题2
本课结束
微专题5
WEIZHUANTIWU
化学反应历程与化学反应速率
专题2
1.基元反应、过渡态理论及活化能
(1)基元反应:研究发现,大多数化学反应并不是经过简单碰撞就能完成,往往要经过多个反应步骤才能实现。每一步反应都称为基元反应。
(2)过渡态理论:过渡态理论认为,反应物分子并不只是通过简单碰撞直接形成产物,而是必须经过一个形成活化络合物的过渡状态,并且达到这个过渡状态需要一定的活化能。这与爬山类似,山的最高点便是过渡态。
2.多步反应的活化能及与速率的关系
(1)多步反应的活化能:反应物转化为生成物的过程中要经过能量较高的过渡态。过渡态的平均能量与反应物分子的平均能量的差为反应的活化能(如图所示)。
图中表示CH4与Cl2生成CH3Cl的反应过程中各物质的能量变化,Ea1表示第一步反应的活化能,Ea2表示第二步反应的活化能,ΔH是CH4与Cl2生成CH3Cl两步总反应的反应热。
(2)活化能和速率的关系:基元反应的活化能越大,反应物到达过渡态就越不容易,该基元反应的速率就越慢。一个化学反应的速率取决于速率最慢的基元反应。
上述反应中Ea2较小,因而第二步为快反应,第一步是慢反应,它决定了CH4与Cl2生成CH3Cl的反应速率。
3.催化剂对化学反应速率的影响
催化剂是通过降低反应所需的活化能来增大反应速率的。如图所示,没有催化剂参与的反应,活化能(Ea2)较大,则反应速率较小;而有催化剂参与的反应,活化能(Ea1)较小,则反应速率较大。
1
2
3
4
1.研究表明CO与N2O在Fe+作用下发生反应的能量变化及反应历程如图所示,两步反应分别为:①N2O+Fe+===N2
+FeO+(慢);②FeO++CO===CO2+Fe+(快)。下列说法正确的是
A.反应①是氧化还原反应,反应②是非氧化还原反应
B.两步反应均为放热反应,总反应的化学反应速率由反应②决定
C.Fe+使反应的活化能减小,FeO+是中间产物
D.若转移1 mol电子,则消耗11.2 L N2O
√
1
2
3
4
反应②FeO++CO===CO2+Fe+(快),有元素化合价发生变化,属于氧化还原反应,故A项错误;
总反应速率由反应慢的一步决定,即由反应①决定,故B项错误;
Fe+作催化剂,使反应的活化能减小,FeO+是中间产物,故C项正确;
气体存在的条件未知,不能确定气体的体积,故D项错误。
2.(2022·山东潍坊高二月考)某反应加入催化剂后,反应过程变成两个基元反应,相关能量变化如图所示(E为正值,单位:kJ·mol-1)。下列有关说法正确的是
A.总反应的活化能Ea=E1+E3
B.总反应的焓变ΔH=-(E4+E2-E1-E3)
C.此条件下,第一个基元反应的反应速率
小于第二个
D.对于Ea>0的反应,必须加热才能进行
1
2
3
4
√
1
2
3
4
焓变等于正、逆反应活化能之差,所以ΔH=E1+E3-(E4+E2)=-(E4+E2-E1-E3),故B正确;
据图可知第一个基元反应的活化能E1小于第二个基元反应的活化能E3,活化能越小反应速率越快,
所以此条件下,第一个基元反应的反应速率大于第二个,故C错误;
活化能是活化分子具有的平均能量与反应物分子具有的平均能量之差,不能根据活化能判断反应发生的条件,故D错误。
3.(2022·安徽芜湖单元测试)反应4HBr(g)+O2(g)===2H2O(g)+2Br2(g)的能量与反应过程的关系如图所示:
下列说法错误的是
A.HOOBr和HOBr均是反应的中间体
B.活化能最大的步骤反应为HBr(g)+
O2(g)===HOOBr(g)
C.三步反应中,第一步反应的速率最慢
D.用E表示键能,该反应的ΔH=2E(Br—Br)+4E(H—O)-4E(H—Br)-
E(O==O)
1
2
3
4
√
1
2
3
4
由图可得HOOBr和HOBr均是反应的中间体,A项正确;
第一步反应的活化能最大,发生反应4HBr(g)+O2(g)===3HBr(g)+HOOBr(g),
简化为HBr(g)+O2(g)===HOOBr(g),B项正确;
第一步反应的活化能最大,反应速率最慢,C项正确;
ΔH=反应物的总键能-生成物的总键能,D项错误。
1
2
3
4
4.(2021·长沙检测)活泼自由基与氧气的反应一直是关注的热点。HNO自由基与O2反应过程的能量变化如图所示。下列说法正确的是
A.该反应为吸热反应
B.产物的稳定性:P1>P2
C.该过程中最大正反应的活化能
E正=186.19 kJ·mol-1
D.相同条件下,由中间产物Z转化为产物的速率:v(P1)
1
2
3
4
根据图像可知,此反应的反应物的总能量大于生成物的总能量,故此反应是放热反应,故A错误;
物质的能量越高越不稳定,根据图像可知,产物P1的能量高于产物P2的能量,故产物的稳定性:P1
1
2
3
4
相同条件下,反应所需的活化能越小,则反应的速率越快,由于到产物P1所需活化能小,故反应速率快,v(P1)>v(P2),故D错误。
专题2
本课结束
