化学人教版2019必修第一册4.3 .1 离子键(共22张ppt)
文档属性
| 名称 | 化学人教版2019必修第一册4.3 .1 离子键(共22张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-30 16:18:17 | ||
图片预览



文档简介
(共22张PPT)
Li
Na
K
Rb
Cs
+9
2
7
+17
2
8
7
+35
2
8
7
18
+53
2
8
18
7
18
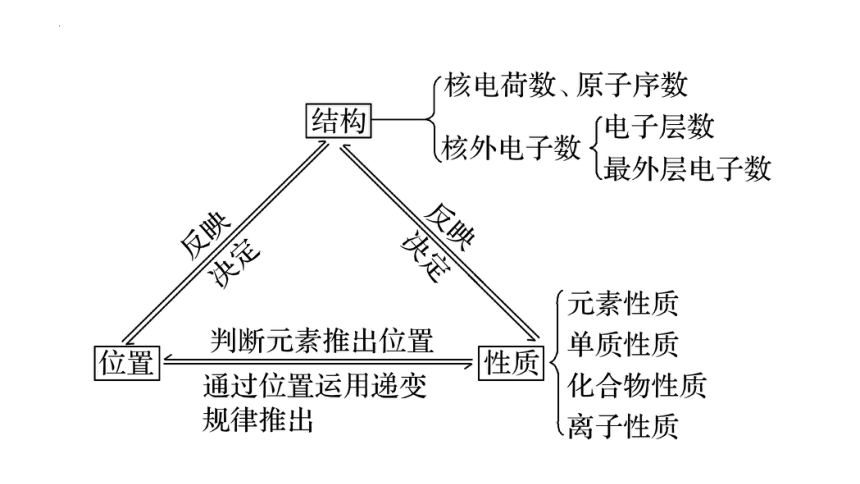
卤
族
元
素(ⅦA)
氟氯溴
碘
ⅠA
半径递增
层数递增
失电子能力递增
得电子能力递减
金属性递增
非金属性递减
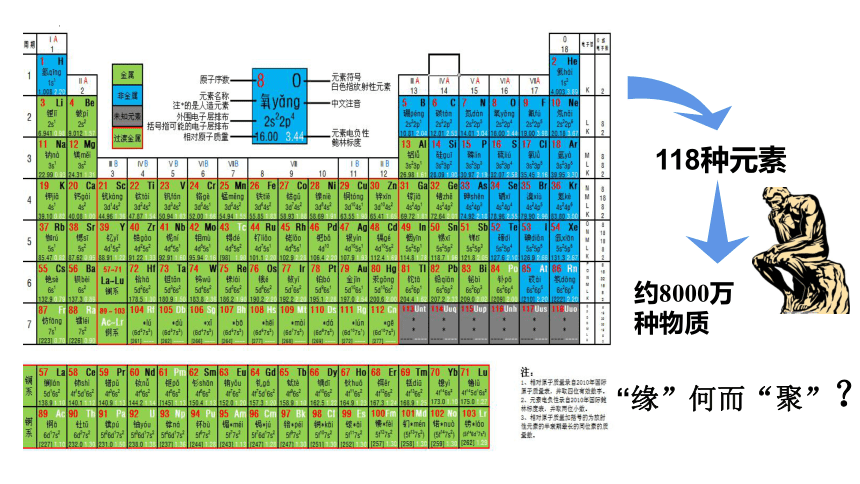
原子结构
元素性质
决定
原子核对价电子引力减弱
随着原子序数的递增
元素原子的核外电子排布呈现周期性变化
元素原子半径呈现周期性变化
元素化合价呈现周期性变化
元素金属性呈现周期性变化
元素非金属性呈现周期性变化
约8000万种物质
118种元素
“缘”何而“聚”?
组织建设
第三节 化学键
(第1课时 离子键)
第四章 物质结构 元素周期律
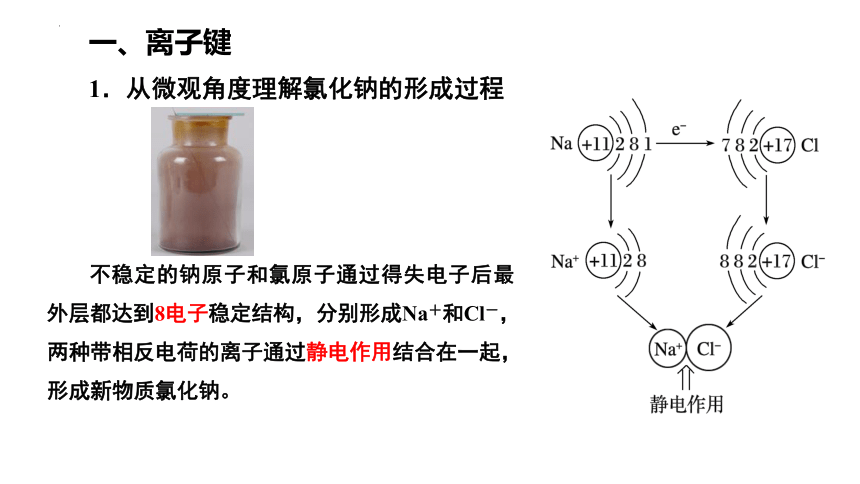
一、离子键
1.从微观角度理解氯化钠的形成过程
不稳定的钠原子和氯原子通过得失电子后最外层都达到8电子稳定结构,分别形成Na+和Cl-,两种带相反电荷的离子通过静电作用结合在一起,形成新物质氯化钠。
2.离子键
(1)定义:
带相反电荷离子之间的相互作用
(3)成键元素:
静电作用
(2)成键粒子:
阳离子和阴离子
(4)成键本质:
一般是活泼金属和活泼非金属元素
阳离子:Na+、Mg2+、Ba2+、NH4+等
阴离子:Cl-、O2-、 O22- 、OH-、CO32-等
阴阳离子间的静电吸引力,阴阳离子的电子与电子、原子核与原子核之间的排斥力
一般是ⅠA、ⅡA族的金属和ⅥA、ⅦA族的非金属
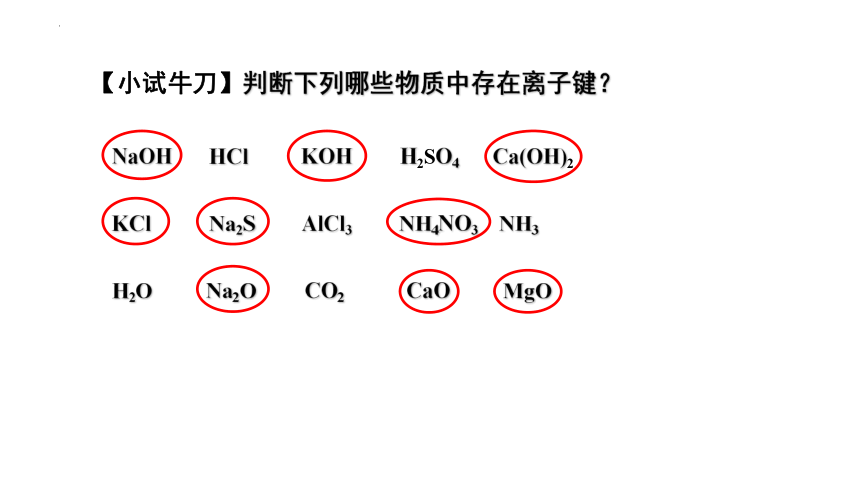
【小试牛刀】判断下列哪些物质中存在离子键?
NaOH HCl KOH H2SO4 Ca(OH)2
KCl Na2S AlCl3 NH4NO3 NH3
H2O Na2O CO2 CaO MgO
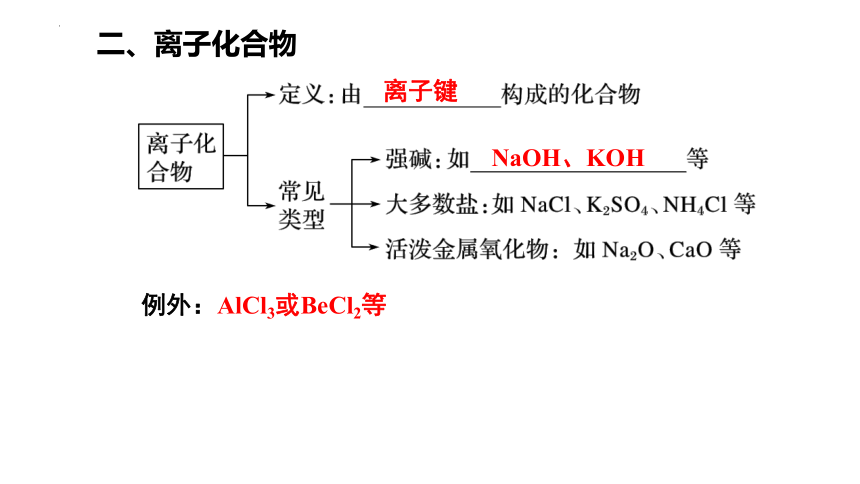
二、离子化合物
例外:AlCl3或BeCl2等
离子键
NaOH、KOH
【小试牛刀】判断下列哪些物质是离子化合物
一般地,活泼金属氧化物、强碱、盐是离子化合物。
NaOH HCl KOH H2SO4 Ca(OH)2
KCl Na2S AlCl3 NH4NO3 NH3
H2O Na2O CO2 CaO MgO
三、电子式
1.概念:在元素符号周围用“·”或“×”来表示原子的最外层电子的式子。
2.电子式的书写
(1)原子的电子式:
布四方,再成双,对称分布。(《物质结构与性质》再讨论)
(2)离子的电子式:
H+
K+
Mg2+
简单阳离子的电子式就是它的离子符号。
①阳离子的电子式:
[ O ]2-
··
··
:
:
[ Cl ]-
··
··
:
:
要画出最外层电子数,还要用“[ ]”括起来,并在右上角标出所带电荷“n-”。
标电子,标电荷
②阴离子的电子式:
由阴、阳离子的电子式组成,但相同离子不能合并,一般对称排列。
(3)离子化合物的电子式:
NaCl
MgCl2
Na2O
【小试牛刀】书写CaS、MgBr2电子式
(4)用电子式表示离子化合物的形成过程
用电子式表示氯化钠的形成过程:
Cl :
··
··
·
[ Cl ]-
··
··
:
:
Na ·
+
→
Na+
原子电子式→化合物电子式
用电子式表示氧化钠的形成过程
【小试牛刀】用电子式表示Na2S、MgBr2的形成过程
2-
【小试牛刀】下列电子式及形成过程是否正确,错误的请写出正确书写。
(1)S2-: ;
(2)Na2S: ;
(3)Cl-: ;
(4)CaF2: ;
(5)KCl的形成过程:
(6)MgCl2的形成过程:
。
错误,
错误,
错误,
错误,
错误,
错误,
(1)一个“·”或“×”代表一个电子,原子的电子式中“·”(或“×”)的个数即原子的最外层电子数。
(2)同一原子的电子式不能既用“×”又用“·”表示。
(3)“[ ]”在所有的阴离子、复杂的阳离子中出现。
(4)在化合物中,如果有多个阴、阳离子,阴、阳离子必须是间隔的,即不能将两个阴离子或两个阳离子写在一起,如CaF2要写成 ,不能写成 ,也不能写成 。
(5)用电子式表示化合物形成过程时,由于不是化学方程式,不能出现“===”。“―→”前是原子的电子式,“―→”后是化合物的电子式。
【易错点拨】书写电子式的注意事项
【归纳总结】
1.下列说法正确的是( )
A.离子键就是阴、阳离子间的静电引力
B.所有金属元素与所有非金属元素间都能形成离子键
C.钠原子与氯原子结合成氯化钠后体系总能量降低
D.在化合物CaCl2中,两个Cl-间也存在离子键
C
2.下列物质中属于离子化合物的是( )
A.苛性钠 B.碘化氢 C.硫酸 D.醋酸
A
3.下列电子式的书写正确的是( )
A.氮原子: B.O2-离子:
C.Na2O: D.CaCl2:
C
4.下列关于离子键的说法错误的是( )
A.离子键是阴、阳离子之间的静电作用力
B.离子键是阴、阳离子这样的正、负电荷之间的相互吸引力
C.H-与Ca2+两种微粒之间可以形成离子键
D.F-与K+两种微粒之间可以形成离子键
B
5.下列用电子式表示化合物的形成过程正确的是( )
C
6.用电子式表示下列离子化合物的形成过程:
BaCl2:______________________________;
NaF:_____________________;
MgS:______________________;
K2O:_________________________。
Li
Na
K
Rb
Cs
+9
2
7
+17
2
8
7
+35
2
8
7
18
+53
2
8
18
7
18
卤
族
元
素(ⅦA)
氟氯溴
碘
ⅠA
半径递增
层数递增
失电子能力递增
得电子能力递减
金属性递增
非金属性递减
原子结构
元素性质
决定
原子核对价电子引力减弱
随着原子序数的递增
元素原子的核外电子排布呈现周期性变化
元素原子半径呈现周期性变化
元素化合价呈现周期性变化
元素金属性呈现周期性变化
元素非金属性呈现周期性变化
约8000万种物质
118种元素
“缘”何而“聚”?
组织建设
第三节 化学键
(第1课时 离子键)
第四章 物质结构 元素周期律
一、离子键
1.从微观角度理解氯化钠的形成过程
不稳定的钠原子和氯原子通过得失电子后最外层都达到8电子稳定结构,分别形成Na+和Cl-,两种带相反电荷的离子通过静电作用结合在一起,形成新物质氯化钠。
2.离子键
(1)定义:
带相反电荷离子之间的相互作用
(3)成键元素:
静电作用
(2)成键粒子:
阳离子和阴离子
(4)成键本质:
一般是活泼金属和活泼非金属元素
阳离子:Na+、Mg2+、Ba2+、NH4+等
阴离子:Cl-、O2-、 O22- 、OH-、CO32-等
阴阳离子间的静电吸引力,阴阳离子的电子与电子、原子核与原子核之间的排斥力
一般是ⅠA、ⅡA族的金属和ⅥA、ⅦA族的非金属
【小试牛刀】判断下列哪些物质中存在离子键?
NaOH HCl KOH H2SO4 Ca(OH)2
KCl Na2S AlCl3 NH4NO3 NH3
H2O Na2O CO2 CaO MgO
二、离子化合物
例外:AlCl3或BeCl2等
离子键
NaOH、KOH
【小试牛刀】判断下列哪些物质是离子化合物
一般地,活泼金属氧化物、强碱、盐是离子化合物。
NaOH HCl KOH H2SO4 Ca(OH)2
KCl Na2S AlCl3 NH4NO3 NH3
H2O Na2O CO2 CaO MgO
三、电子式
1.概念:在元素符号周围用“·”或“×”来表示原子的最外层电子的式子。
2.电子式的书写
(1)原子的电子式:
布四方,再成双,对称分布。(《物质结构与性质》再讨论)
(2)离子的电子式:
H+
K+
Mg2+
简单阳离子的电子式就是它的离子符号。
①阳离子的电子式:
[ O ]2-
··
··
:
:
[ Cl ]-
··
··
:
:
要画出最外层电子数,还要用“[ ]”括起来,并在右上角标出所带电荷“n-”。
标电子,标电荷
②阴离子的电子式:
由阴、阳离子的电子式组成,但相同离子不能合并,一般对称排列。
(3)离子化合物的电子式:
NaCl
MgCl2
Na2O
【小试牛刀】书写CaS、MgBr2电子式
(4)用电子式表示离子化合物的形成过程
用电子式表示氯化钠的形成过程:
Cl :
··
··
·
[ Cl ]-
··
··
:
:
Na ·
+
→
Na+
原子电子式→化合物电子式
用电子式表示氧化钠的形成过程
【小试牛刀】用电子式表示Na2S、MgBr2的形成过程
2-
【小试牛刀】下列电子式及形成过程是否正确,错误的请写出正确书写。
(1)S2-: ;
(2)Na2S: ;
(3)Cl-: ;
(4)CaF2: ;
(5)KCl的形成过程:
(6)MgCl2的形成过程:
。
错误,
错误,
错误,
错误,
错误,
错误,
(1)一个“·”或“×”代表一个电子,原子的电子式中“·”(或“×”)的个数即原子的最外层电子数。
(2)同一原子的电子式不能既用“×”又用“·”表示。
(3)“[ ]”在所有的阴离子、复杂的阳离子中出现。
(4)在化合物中,如果有多个阴、阳离子,阴、阳离子必须是间隔的,即不能将两个阴离子或两个阳离子写在一起,如CaF2要写成 ,不能写成 ,也不能写成 。
(5)用电子式表示化合物形成过程时,由于不是化学方程式,不能出现“===”。“―→”前是原子的电子式,“―→”后是化合物的电子式。
【易错点拨】书写电子式的注意事项
【归纳总结】
1.下列说法正确的是( )
A.离子键就是阴、阳离子间的静电引力
B.所有金属元素与所有非金属元素间都能形成离子键
C.钠原子与氯原子结合成氯化钠后体系总能量降低
D.在化合物CaCl2中,两个Cl-间也存在离子键
C
2.下列物质中属于离子化合物的是( )
A.苛性钠 B.碘化氢 C.硫酸 D.醋酸
A
3.下列电子式的书写正确的是( )
A.氮原子: B.O2-离子:
C.Na2O: D.CaCl2:
C
4.下列关于离子键的说法错误的是( )
A.离子键是阴、阳离子之间的静电作用力
B.离子键是阴、阳离子这样的正、负电荷之间的相互吸引力
C.H-与Ca2+两种微粒之间可以形成离子键
D.F-与K+两种微粒之间可以形成离子键
B
5.下列用电子式表示化合物的形成过程正确的是( )
C
6.用电子式表示下列离子化合物的形成过程:
BaCl2:______________________________;
NaF:_____________________;
MgS:______________________;
K2O:_________________________。
