第一章第二节 原子结构与元素的性质 第1课时 原子结构与元素周期表 学案(含答案)
文档属性
| 名称 | 第一章第二节 原子结构与元素的性质 第1课时 原子结构与元素周期表 学案(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 478.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-30 19:10:51 | ||
图片预览



文档简介
第二节 原子结构与元素的性质
第1课时 原子结构与元素周期表
[核心素养发展目标] 1.通过辨识原子结构及价层电子排布与元素在周期表中的位置之间的关系,形成“结构决定性质”的观念。2.认识周期表中各区及元素周期表的规律,培养学生的模型认知能力。
一、元素周期系和元素周期表
1.含义
元素按其原子核电荷数递增排列的序列,称为元素周期系。元素周期表是呈现元素周期系的表格。
2.元素周期系的形成
(1)每一周期从________元素开始到________元素结束,最外层电子排布从________递增到________(第一周期除外),但元素周期系的周期不是单调的,每一周期里元素的数目不总是一样多。
(2)元素形成周期系的根本原因是________________________发生周期性的重复。
(3)根据构造原理得出的核外电子排布,可以解释元素周期系的基本结构。例如,第一周期从________开始,以________结束;其余各周期总是从________能级开始,以________能级结束,其间递增的核电荷数(或电子数)就等于每个周期里的元素数。
1s 2s→ 2p 3s→ 3p 4s→3d →4p 5s→ 4d→5p 6s→ 4f→ 5d→6p 7s→ 5f→ 6d→7p
周期 一 二 三 四 五 六 七
元素数 2 8 8 18 18 32 32
(4)元素周期表中,同族元素价层电子数________,这是同族元素性质相似的结构基础。
(1)价层电子一定是最外层电子( )
(2)元素的价层电子数一定等于其所在族的族序数( )
(3)同一族元素的价层电子数一定相同( )
(4)基态原子的N层上只有一个电子的元素,一定是第ⅠA族元素( )
(5)基态原子的价层电子排布为(n-1)d6~8ns2的元素一定是过渡元素( )
1.过渡元素、价层电子数跟它们的族序数有什么关系?写出它们的价层电子排布通式。
2.预言119号元素基态原子最外层电子排布;预言第八周期有多少种元素。
3.同一族元素的价层电子排布一定相同吗?
1.若某原子的价层电子排布式为4d15s2,则下列说法正确的是( )
A.该元素位于元素周期表中第五周期第ⅢB族
B.该元素原子价层电子数为2
C.该元素为非金属元素
D.该元素原子N能层共有8个电子
2.已知某元素+2价离子的电子排布式为1s22s22p63s23p6,该元素在周期表中属于( )
A.第ⅤB族 B.第ⅡB族
C.第Ⅷ族 D.第ⅡA族
(1)价层电子排布和元素周期表的关系
①原子的电子层数=能级中最高能层序数=周期序数。
②主族元素原子的价层电子数=该元素在周期表中的主族序数。
族序数 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
价层电 子排布 ns1 ns2 ns2 np1 ns2 np2 ns2 np3 ns2 np4 ns2 np5 ns2 np6(除He 为1s2外)
③过渡元素(除镧系、锕系外,以第四周期为例)。
周期表中列数 族序数 价层电子排布
3 ⅢB (n-1)d1ns2
4 ⅣB (n-1)d2ns2
5 ⅤB (n-1)d3ns2
6 ⅥB (n-1)d5ns1
7 ⅦB (n-1)d5ns2
8~10 Ⅷ (n-1)d6~8ns2
11 ⅠB (n-1)d10ns1
12 ⅡB (n-1)d10ns2
(2)价层电子排布与元素的最高正价
①当主族元素失去全部价层电子后,表现出该元素的最高化合价,最高正价=主族序数(O、F除外)。
②第ⅢB~ⅦB族可失去ns和(n-1)d轨道上的全部电子,所以,最高正价=族序数。
③第Ⅷ族可失去最外层的s电子和次外层的部分(n-1)d电子,所以最高正价低于族序数(8),只有Ru和Os可表现正八价。
④第ⅠB族可失去ns1电子和部分(n-1)d电子,所以第ⅠB族的族序数<最高正价,第ⅡB族只失去ns2电子,第ⅡB族的族序数=最高正价。
二、元素周期表的分区
1.元素周期表的分区
(1)根据核外电子的排布分区
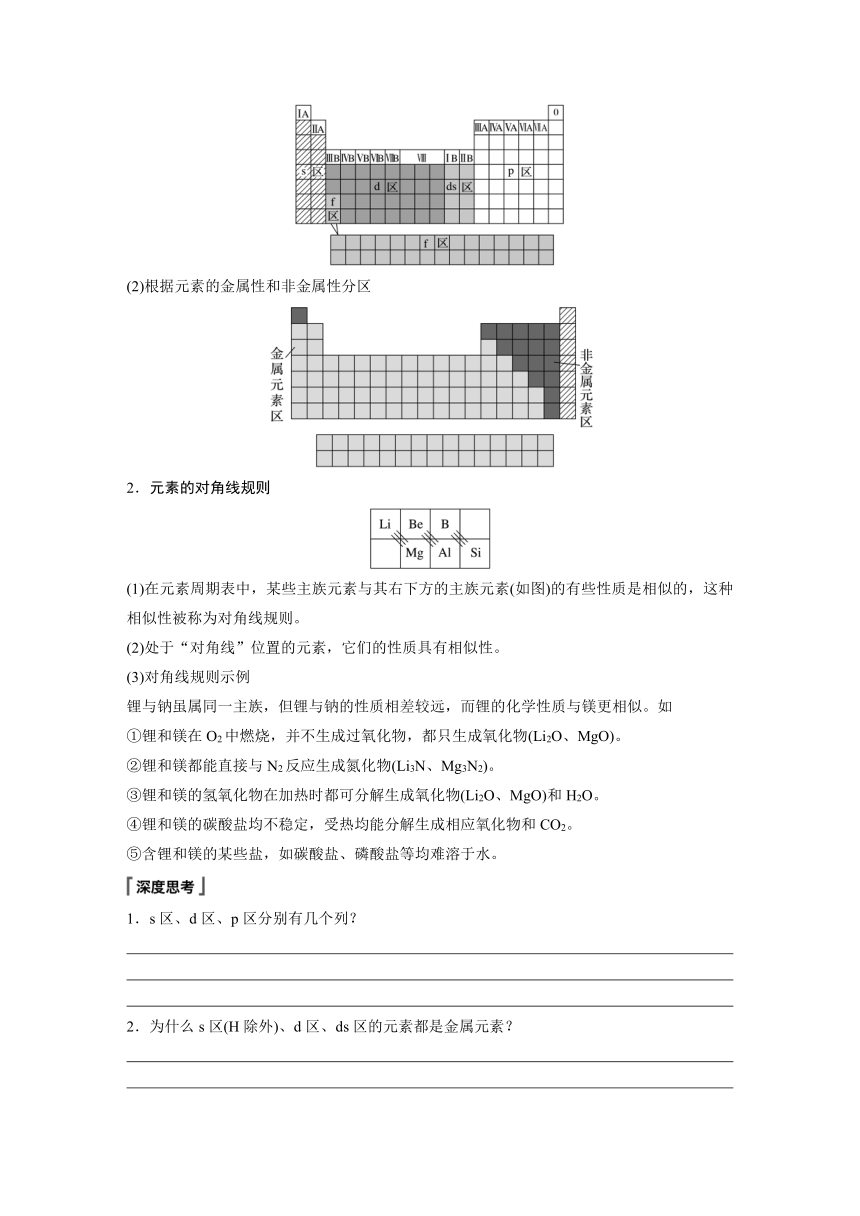
按核外电子排布和构造原理最后填入电子的________,可将元素周期表分为s、p、d、f 4个区,而第ⅠB、第ⅡB族这2个纵列的元素的核外电子因先填满了________能级而后再填充________能级而得名ds区。5个区的位置关系如图所示。
(2)根据元素的金属性和非金属性分区
2.元素的对角线规则
(1)在元素周期表中,某些主族元素与其右下方的主族元素(如图)的有些性质是相似的,这种相似性被称为对角线规则。
(2)处于“对角线”位置的元素,它们的性质具有相似性。
(3)对角线规则示例
锂与钠虽属同一主族,但锂与钠的性质相差较远,而锂的化学性质与镁更相似。如
①锂和镁在O2中燃烧,并不生成过氧化物,都只生成氧化物(Li2O、MgO)。
②锂和镁都能直接与N2反应生成氮化物(Li3N、Mg3N2)。
③锂和镁的氢氧化物在加热时都可分解生成氧化物(Li2O、MgO)和H2O。
④锂和镁的碳酸盐均不稳定,受热均能分解生成相应氧化物和CO2。
⑤含锂和镁的某些盐,如碳酸盐、磷酸盐等均难溶于水。
1.s区、d区、p区分别有几个列?
2.为什么s区(H除外)、d区、ds区的元素都是金属元素?
3.处于非金属与金属分界线上的元素常被称为半金属或类金属,为什么?
4.为什么副族元素又称为过渡元素?
1.下列说法正确的是( )
A.所有金属元素都分布在d区和ds区
B.最外层电子数为2的元素都分布在s区
C.元素周期表中第ⅢB族到第ⅡB族10个纵列的元素都是金属元素
D.基态原子的p能级上半充满的元素不一定位于p区
2.下列关于元素在元素周期表中的位置以及元素原子的价层电子排布特点的有关叙述正确的是( )
A.Cu位于元素周期表中第四周期第ⅠB族,属于ds区元素
B.O的基态原子中,2p能级为半充满,属于p区元素
C.最外层电子排布式为4s1,一定属于第ⅠA族
D.最外层电子排布式为ns2np1,该元素可能是第ⅢA族或第ⅢB族
3.仔细观察下图,回答下列问题:
(1)B的原子结构示意图为____________,B元素位于元素周期表的第________周期第________族。
(2)铍的最高价氧化物的水化物是________(填“酸性”“碱性”或“两性”)化合物,证明这一结论的有关离子方程式是________________________________________________________
_______________________________________________________________________________。
(3)根据元素周期律知识,硼酸酸性比碳酸____,理由是______________________________。
(4)根据Mg在空气中的燃烧情况,Li在空气中燃烧生成的产物为___________________(用化学式表示)。
根据原子结构特征判断元素在元素周期表中的位置
电子排布式价层电子排布式
1.下列叙述正确的是( )
A.除0族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数
B.除短周期外,其他周期均有18种元素
C.副族元素中没有非金属元素
D.碱金属元素是指第ⅠA族的所有元素
2.价层电子排布为4d55s1的元素在周期表中的位置是( )
A.第四周期第ⅠB族 B.第五周期第ⅠB族
C.第四周期第ⅥB族 D.第五周期第ⅥB族
3.(2022·石家庄高二检测)世界瞩目的港珠澳大桥是世界上最长的斜拉桥,桥受力部件采用高强度拉力钢索。钢索表面的合金保护层含有锌、铝和少量钒,下列说法错误的是( )
A.锌位于元素周期表的d区
B.基态Al原子的电子占据最高能级的电子云轮廓图为哑铃形
C.钒位于元素周期表中第四周期第ⅤB族
D.钒的价层电子排布式为3d34s2
4.(2022·河南许昌高二期中)已知基态R2+的核外电子排布式为[Ar]3d7,则有关R元素的说法错误的是( )
A.质子数为27
B.在周期表中位于第ⅡB族
C.在周期表中处于d区
D.属于过渡金属元素
5.在研究原子核外电子排布与元素周期表的关系时,人们发现价层电子排布相似的元素集中在一起。据此,人们将元素周期表分为5个区,如图所示。请回答下列问题:
(1)在s区中,族序数最大、原子序数最小的元素,其原子的价层电子的电子云轮廓图为________________。
(2)在d区中,族序数最大、原子序数最小的元素,其常见离子的电子排布式为________________________________________________________________________
________________________________________________________________________,
其中较稳定的是________。
(3)在ds区中,族序数最大、原子序数最小的元素,其原子的价层电子排布式为_________。
(4)在p区中,第二周期第ⅤA族元素原子的价层电子的轨道表示式为________________________________________________________________________。
(5)当今常用于核能开发的元素是铀和钚,它们在______区中。
第二节 原子结构与元素的性质
第1课时 原子结构与元素周期表
一、
2.(1)碱金属 稀有气体 ns1 ns2np6 (2)元素的原子核外电子排布 (3)1s1 1s2 ns np (4)相同
正误判断
(1)× (2)× (3)× (4)× (5)√
深度思考
1.第ⅢB族元素到第ⅦB族元素的价层电子数等于它们的族序数(除镧系、锕系外);第Ⅷ族有3列元素,其族序数等于该族的第1列元素的价层电子数;第ⅠB族、第ⅡB族的价层电子数等于族序数加10。过渡元素的价层电子排布通式为(n-1)d1~10ns1~2(镧系和锕系除外)。
2.119号元素基态原子最外层电子排布为8s1;第八周期应有50种元素。
3.过渡元素中的镧系和锕系元素的价层电子排布不相同,在第Ⅷ族中部分元素的价层电子排布也不相同。
应用体验
1.A [该原子的价层电子排布式为4d15s2,该元素基态原子的电子排布式为1s22s22p63s23p63d104s24p64d15s2,该元素位于元素周期表中第五周期第ⅢB族,故A正确;该原子的价层电子排布式为4d15s2,位于元素周期表第ⅢB族,所以该元素原子价层电子数为3,故B错误;该元素是金属元素,故C错误;第N能层的电子排布式为4s24p64d1,共有9个电子,故D错误。]
2.D [由题意推知,该元素的价层电子排布为4s2,故该元素位于第四周期第ⅡA族。]
二、
1.(1)能级符号 (n-1)d ns
深度思考
1.s区有2列;d区有8列,p区有6列。
2.因为s区(H除外)、d区和ds区元素的最外层电子数为1~2个。
3.处于非金属与金属分界线上的元素既能表现出一定的非金属性,又能表现出一定的金属性,因此这些元素常被称为半金属或类金属。
4.由于副族元素是从典型的金属元素过渡到非金属元素的中间元素,因而又被称为过渡元素。
应用体验
1.C 2.A
3.(1) 二 ⅢA
(2)两性 Be(OH)2+2OH-===BeO+2H2O、Be(OH)2+2H+===Be2++2H2O
(3)弱 硼的非金属性比碳弱 (4)Li2O、Li3N
解析 (1)B是5号元素,原子结构示意图为。
(2)Be(OH)2与Al(OH)3的化学性质相似,但差别在于Be的化合价是+2价。(4)Mg在空气中与O2、CO2、N2反应生成MgO、Mg3N2,将Li与Mg类比得答案。
随堂演练 知识落实
1.C
2.D [由于该元素的最高能级为5s,所以处于第五周期,价层电子排布为4d55s1,所以位于第ⅥB族。]
3.A [锌的原子序数为30,在周期表中处于第四周期第ⅡB族,在ds区,故A错误;基态Al原子核外电子占据的最高能级为3p能级,电子云轮廓图为哑铃形,故B正确;钒的原子序数为23,在周期表中处于第四周期第ⅤB族,故C正确;钒的原子序数为23,其基态原子的核外电子排布式为1s22s22p63s23p63d34s2,则钒的价层电子排布式为3d34s2,故D正确。]
4.B [基态R2+的核外电子排布式为[Ar]3d7,则基态原子R的核外电子排布式为[Ar]3d74s2,R为Co元素;由分析可知,R为Co元素,是27号元素,则质子数为27,A正确;Co元素位于第四周期第Ⅷ族,处于d区,B错误、C正确;过渡金属元素是指元素周期表中d区与ds区元素,则Co属于过渡金属元素,D正确。]
5.(1)球形 (2)Fe2+:1s22s22p63s23p63d6、Fe3+:1s22s22p63s23p63d5 Fe3+ (3)3d104s2
(4) (5)f
解析 (1)s区为第ⅠA族、第ⅡA族,符合条件的元素为Be,其基态原子的电子排布式为1s22s2,价层电子的电子云轮廓图为球形。
(2)d区为第ⅢB~ⅦB族(不包括镧系、锕系)、Ⅷ族,族序数最大且原子序数最小的元素为Fe,其常见离子为Fe2+、Fe3+,电子排布式分别为1s22s22p63s23p63d6、1s22s22p63s23p63d5,由离子的电子排布式可知Fe3+的3d能级为半充满状态,其稳定性大于Fe2+。
(3)符合条件的元素为Zn,其基态原子电子排布式为1s22s22p63s23p63d104s2,价层电子排布式为3d104s2。
(4)符合题意的元素为N,其价层电子的轨道表示式为。
(5)铀和钚均为锕系元素,位于f区。
第1课时 原子结构与元素周期表
[核心素养发展目标] 1.通过辨识原子结构及价层电子排布与元素在周期表中的位置之间的关系,形成“结构决定性质”的观念。2.认识周期表中各区及元素周期表的规律,培养学生的模型认知能力。
一、元素周期系和元素周期表
1.含义
元素按其原子核电荷数递增排列的序列,称为元素周期系。元素周期表是呈现元素周期系的表格。
2.元素周期系的形成
(1)每一周期从________元素开始到________元素结束,最外层电子排布从________递增到________(第一周期除外),但元素周期系的周期不是单调的,每一周期里元素的数目不总是一样多。
(2)元素形成周期系的根本原因是________________________发生周期性的重复。
(3)根据构造原理得出的核外电子排布,可以解释元素周期系的基本结构。例如,第一周期从________开始,以________结束;其余各周期总是从________能级开始,以________能级结束,其间递增的核电荷数(或电子数)就等于每个周期里的元素数。
1s 2s→ 2p 3s→ 3p 4s→3d →4p 5s→ 4d→5p 6s→ 4f→ 5d→6p 7s→ 5f→ 6d→7p
周期 一 二 三 四 五 六 七
元素数 2 8 8 18 18 32 32
(4)元素周期表中,同族元素价层电子数________,这是同族元素性质相似的结构基础。
(1)价层电子一定是最外层电子( )
(2)元素的价层电子数一定等于其所在族的族序数( )
(3)同一族元素的价层电子数一定相同( )
(4)基态原子的N层上只有一个电子的元素,一定是第ⅠA族元素( )
(5)基态原子的价层电子排布为(n-1)d6~8ns2的元素一定是过渡元素( )
1.过渡元素、价层电子数跟它们的族序数有什么关系?写出它们的价层电子排布通式。
2.预言119号元素基态原子最外层电子排布;预言第八周期有多少种元素。
3.同一族元素的价层电子排布一定相同吗?
1.若某原子的价层电子排布式为4d15s2,则下列说法正确的是( )
A.该元素位于元素周期表中第五周期第ⅢB族
B.该元素原子价层电子数为2
C.该元素为非金属元素
D.该元素原子N能层共有8个电子
2.已知某元素+2价离子的电子排布式为1s22s22p63s23p6,该元素在周期表中属于( )
A.第ⅤB族 B.第ⅡB族
C.第Ⅷ族 D.第ⅡA族
(1)价层电子排布和元素周期表的关系
①原子的电子层数=能级中最高能层序数=周期序数。
②主族元素原子的价层电子数=该元素在周期表中的主族序数。
族序数 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
价层电 子排布 ns1 ns2 ns2 np1 ns2 np2 ns2 np3 ns2 np4 ns2 np5 ns2 np6(除He 为1s2外)
③过渡元素(除镧系、锕系外,以第四周期为例)。
周期表中列数 族序数 价层电子排布
3 ⅢB (n-1)d1ns2
4 ⅣB (n-1)d2ns2
5 ⅤB (n-1)d3ns2
6 ⅥB (n-1)d5ns1
7 ⅦB (n-1)d5ns2
8~10 Ⅷ (n-1)d6~8ns2
11 ⅠB (n-1)d10ns1
12 ⅡB (n-1)d10ns2
(2)价层电子排布与元素的最高正价
①当主族元素失去全部价层电子后,表现出该元素的最高化合价,最高正价=主族序数(O、F除外)。
②第ⅢB~ⅦB族可失去ns和(n-1)d轨道上的全部电子,所以,最高正价=族序数。
③第Ⅷ族可失去最外层的s电子和次外层的部分(n-1)d电子,所以最高正价低于族序数(8),只有Ru和Os可表现正八价。
④第ⅠB族可失去ns1电子和部分(n-1)d电子,所以第ⅠB族的族序数<最高正价,第ⅡB族只失去ns2电子,第ⅡB族的族序数=最高正价。
二、元素周期表的分区
1.元素周期表的分区
(1)根据核外电子的排布分区
按核外电子排布和构造原理最后填入电子的________,可将元素周期表分为s、p、d、f 4个区,而第ⅠB、第ⅡB族这2个纵列的元素的核外电子因先填满了________能级而后再填充________能级而得名ds区。5个区的位置关系如图所示。
(2)根据元素的金属性和非金属性分区
2.元素的对角线规则
(1)在元素周期表中,某些主族元素与其右下方的主族元素(如图)的有些性质是相似的,这种相似性被称为对角线规则。
(2)处于“对角线”位置的元素,它们的性质具有相似性。
(3)对角线规则示例
锂与钠虽属同一主族,但锂与钠的性质相差较远,而锂的化学性质与镁更相似。如
①锂和镁在O2中燃烧,并不生成过氧化物,都只生成氧化物(Li2O、MgO)。
②锂和镁都能直接与N2反应生成氮化物(Li3N、Mg3N2)。
③锂和镁的氢氧化物在加热时都可分解生成氧化物(Li2O、MgO)和H2O。
④锂和镁的碳酸盐均不稳定,受热均能分解生成相应氧化物和CO2。
⑤含锂和镁的某些盐,如碳酸盐、磷酸盐等均难溶于水。
1.s区、d区、p区分别有几个列?
2.为什么s区(H除外)、d区、ds区的元素都是金属元素?
3.处于非金属与金属分界线上的元素常被称为半金属或类金属,为什么?
4.为什么副族元素又称为过渡元素?
1.下列说法正确的是( )
A.所有金属元素都分布在d区和ds区
B.最外层电子数为2的元素都分布在s区
C.元素周期表中第ⅢB族到第ⅡB族10个纵列的元素都是金属元素
D.基态原子的p能级上半充满的元素不一定位于p区
2.下列关于元素在元素周期表中的位置以及元素原子的价层电子排布特点的有关叙述正确的是( )
A.Cu位于元素周期表中第四周期第ⅠB族,属于ds区元素
B.O的基态原子中,2p能级为半充满,属于p区元素
C.最外层电子排布式为4s1,一定属于第ⅠA族
D.最外层电子排布式为ns2np1,该元素可能是第ⅢA族或第ⅢB族
3.仔细观察下图,回答下列问题:
(1)B的原子结构示意图为____________,B元素位于元素周期表的第________周期第________族。
(2)铍的最高价氧化物的水化物是________(填“酸性”“碱性”或“两性”)化合物,证明这一结论的有关离子方程式是________________________________________________________
_______________________________________________________________________________。
(3)根据元素周期律知识,硼酸酸性比碳酸____,理由是______________________________。
(4)根据Mg在空气中的燃烧情况,Li在空气中燃烧生成的产物为___________________(用化学式表示)。
根据原子结构特征判断元素在元素周期表中的位置
电子排布式价层电子排布式
1.下列叙述正确的是( )
A.除0族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数
B.除短周期外,其他周期均有18种元素
C.副族元素中没有非金属元素
D.碱金属元素是指第ⅠA族的所有元素
2.价层电子排布为4d55s1的元素在周期表中的位置是( )
A.第四周期第ⅠB族 B.第五周期第ⅠB族
C.第四周期第ⅥB族 D.第五周期第ⅥB族
3.(2022·石家庄高二检测)世界瞩目的港珠澳大桥是世界上最长的斜拉桥,桥受力部件采用高强度拉力钢索。钢索表面的合金保护层含有锌、铝和少量钒,下列说法错误的是( )
A.锌位于元素周期表的d区
B.基态Al原子的电子占据最高能级的电子云轮廓图为哑铃形
C.钒位于元素周期表中第四周期第ⅤB族
D.钒的价层电子排布式为3d34s2
4.(2022·河南许昌高二期中)已知基态R2+的核外电子排布式为[Ar]3d7,则有关R元素的说法错误的是( )
A.质子数为27
B.在周期表中位于第ⅡB族
C.在周期表中处于d区
D.属于过渡金属元素
5.在研究原子核外电子排布与元素周期表的关系时,人们发现价层电子排布相似的元素集中在一起。据此,人们将元素周期表分为5个区,如图所示。请回答下列问题:
(1)在s区中,族序数最大、原子序数最小的元素,其原子的价层电子的电子云轮廓图为________________。
(2)在d区中,族序数最大、原子序数最小的元素,其常见离子的电子排布式为________________________________________________________________________
________________________________________________________________________,
其中较稳定的是________。
(3)在ds区中,族序数最大、原子序数最小的元素,其原子的价层电子排布式为_________。
(4)在p区中,第二周期第ⅤA族元素原子的价层电子的轨道表示式为________________________________________________________________________。
(5)当今常用于核能开发的元素是铀和钚,它们在______区中。
第二节 原子结构与元素的性质
第1课时 原子结构与元素周期表
一、
2.(1)碱金属 稀有气体 ns1 ns2np6 (2)元素的原子核外电子排布 (3)1s1 1s2 ns np (4)相同
正误判断
(1)× (2)× (3)× (4)× (5)√
深度思考
1.第ⅢB族元素到第ⅦB族元素的价层电子数等于它们的族序数(除镧系、锕系外);第Ⅷ族有3列元素,其族序数等于该族的第1列元素的价层电子数;第ⅠB族、第ⅡB族的价层电子数等于族序数加10。过渡元素的价层电子排布通式为(n-1)d1~10ns1~2(镧系和锕系除外)。
2.119号元素基态原子最外层电子排布为8s1;第八周期应有50种元素。
3.过渡元素中的镧系和锕系元素的价层电子排布不相同,在第Ⅷ族中部分元素的价层电子排布也不相同。
应用体验
1.A [该原子的价层电子排布式为4d15s2,该元素基态原子的电子排布式为1s22s22p63s23p63d104s24p64d15s2,该元素位于元素周期表中第五周期第ⅢB族,故A正确;该原子的价层电子排布式为4d15s2,位于元素周期表第ⅢB族,所以该元素原子价层电子数为3,故B错误;该元素是金属元素,故C错误;第N能层的电子排布式为4s24p64d1,共有9个电子,故D错误。]
2.D [由题意推知,该元素的价层电子排布为4s2,故该元素位于第四周期第ⅡA族。]
二、
1.(1)能级符号 (n-1)d ns
深度思考
1.s区有2列;d区有8列,p区有6列。
2.因为s区(H除外)、d区和ds区元素的最外层电子数为1~2个。
3.处于非金属与金属分界线上的元素既能表现出一定的非金属性,又能表现出一定的金属性,因此这些元素常被称为半金属或类金属。
4.由于副族元素是从典型的金属元素过渡到非金属元素的中间元素,因而又被称为过渡元素。
应用体验
1.C 2.A
3.(1) 二 ⅢA
(2)两性 Be(OH)2+2OH-===BeO+2H2O、Be(OH)2+2H+===Be2++2H2O
(3)弱 硼的非金属性比碳弱 (4)Li2O、Li3N
解析 (1)B是5号元素,原子结构示意图为。
(2)Be(OH)2与Al(OH)3的化学性质相似,但差别在于Be的化合价是+2价。(4)Mg在空气中与O2、CO2、N2反应生成MgO、Mg3N2,将Li与Mg类比得答案。
随堂演练 知识落实
1.C
2.D [由于该元素的最高能级为5s,所以处于第五周期,价层电子排布为4d55s1,所以位于第ⅥB族。]
3.A [锌的原子序数为30,在周期表中处于第四周期第ⅡB族,在ds区,故A错误;基态Al原子核外电子占据的最高能级为3p能级,电子云轮廓图为哑铃形,故B正确;钒的原子序数为23,在周期表中处于第四周期第ⅤB族,故C正确;钒的原子序数为23,其基态原子的核外电子排布式为1s22s22p63s23p63d34s2,则钒的价层电子排布式为3d34s2,故D正确。]
4.B [基态R2+的核外电子排布式为[Ar]3d7,则基态原子R的核外电子排布式为[Ar]3d74s2,R为Co元素;由分析可知,R为Co元素,是27号元素,则质子数为27,A正确;Co元素位于第四周期第Ⅷ族,处于d区,B错误、C正确;过渡金属元素是指元素周期表中d区与ds区元素,则Co属于过渡金属元素,D正确。]
5.(1)球形 (2)Fe2+:1s22s22p63s23p63d6、Fe3+:1s22s22p63s23p63d5 Fe3+ (3)3d104s2
(4) (5)f
解析 (1)s区为第ⅠA族、第ⅡA族,符合条件的元素为Be,其基态原子的电子排布式为1s22s2,价层电子的电子云轮廓图为球形。
(2)d区为第ⅢB~ⅦB族(不包括镧系、锕系)、Ⅷ族,族序数最大且原子序数最小的元素为Fe,其常见离子为Fe2+、Fe3+,电子排布式分别为1s22s22p63s23p63d6、1s22s22p63s23p63d5,由离子的电子排布式可知Fe3+的3d能级为半充满状态,其稳定性大于Fe2+。
(3)符合条件的元素为Zn,其基态原子电子排布式为1s22s22p63s23p63d104s2,价层电子排布式为3d104s2。
(4)符合题意的元素为N,其价层电子的轨道表示式为。
(5)铀和钚均为锕系元素,位于f区。
