沪教版(全国)化学专题复习认识化学变化(含答案)
文档属性
| 名称 | 沪教版(全国)化学专题复习认识化学变化(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 223.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-30 19:59:07 | ||
图片预览


文档简介
沪教版(全国) 化学专题复习 认识化学变化
一、单选题
1.关于燃烧和灭火,下列说法正确的是
A.可燃性气体达到爆炸极限时就会发生爆炸
B.炒菜时油锅起火,向锅中放入较多菜叶灭火,是降低了油的着火点
C.木柴架空有利于燃烧,是因为增大了可燃物与氧气的接触面积
D.干粉灭火器可以用来扑灭图书、档案、贵重设备、精密仪器等物的失火
2.如果发现火险或遭遇火灾要沉着应对。下列做法正确的是
A.油锅中的油着火用水浇灭
B.室内起火迅速打开门窗通风
C.家中燃气泄漏,立即打开排气扇通风
D.遭遇火灾时,用湿毛巾捂住口鼻远离着火区域
3.“绿色化学”要求原料物质中所有的原子完全被利用,全部转入期望的产品中,即原子利用率为100%。一定条件下,CO和H2可以按照不同比例反应,只生成一种产物就能实现“绿色化学”,这种产物不可能是
A.甲醛(CH2O)
B.甲醇(CH4O)
C.乙醇(C2H6O)
D.乙酸(C2H4O2)
4.下列关于燃烧和灭火的说法,错误的是
A.可燃物只要与氧气接触就能燃烧
B.家用电器着火时,应先切断电源
C.将木柴架空燃烧,是为了使木柴与空气充分接触
D.扑灭森林火灾时,可设置隔离带将树木与燃烧区隔离
5.下列有关氧气的说法中,不正确的是
A.氧气可供给呼吸
B.鱼类能在水中生存,说明氧气易溶于水
C.植物的光合作用是空气中氧气的主要来源
D.焊接或切割金属时使用纯氧代替空气以获得更高的温度
6.有关粉尘爆炸实验说法正确的是
A.剧烈燃烧一定会引起爆炸
B.燃着的蜡烛可升高面粉着火点
C.鼓空气是为了增大氧气的含量
D.面粉加工厂必须严禁烟火
7.现将20gA和足量B在一定条件下充分反应,生成16gC和11gD,则参加反应的A和B的质量比是
A.20:11 B.20:7 C.5:4 D.16:11
8.装运汽油或乙醇的运输车上,所贴的危险化学品标志为
A. B.
C. D.
9.密闭容器中有甲、乙、丙、丁四种物质,在一定条件下发生化学反应,测得反应前后有关数据如下:
物质 甲 乙 丙 丁
反应前质量/g 6 2 14 35
反应后质量/g 待测 2 22 13
关于此反应说法正确的是A.该反应是分解反应 B.物质乙一定是该反应的催化剂
C.待测数值是14 D.反应中甲与丙变化的质量比4∶7
10.2022年4月29日《科技日报》报道“我国科学家实现二氧化碳到葡萄糖和油脂的“人工合成”,合成过程中的一个反应微观示意图如下,有关说法正确的是
A.反应前后分子的种类不变
B.反应前后共有三种氧化物
C.丙物质由8个原子构成
D.反应中甲和丁的分子个数比是2∶1
11.2019年5月12日是我国第11个全国防灾减灾日,主题是“提高灾害防治能力,构筑生命安全防线”。下列说法错误的是( )
A.草原着火了,在火的蔓延方向前面再点一条火线
B.油库、面粉加工厂、纺织厂等场所要严禁烟火
C.火灾发生后应用湿毛巾捂住口鼻迅速逃离,并拨打火警电话
D.只要温度达到着火点,可燃物一定会燃烧
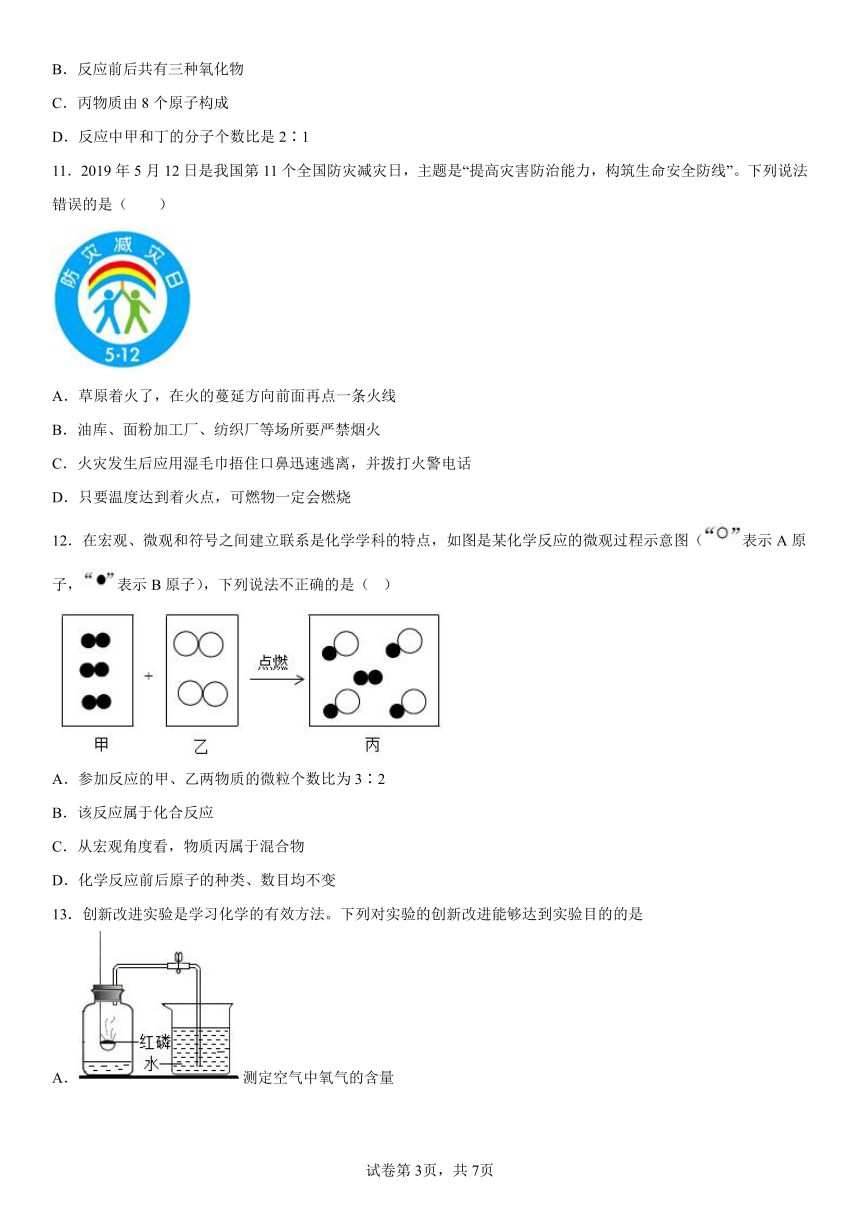
12.在宏观、微观和符号之间建立联系是化学学科的特点,如图是某化学反应的微观过程示意图(表示A原子,表示B原子),下列说法不正确的是( )
A.参加反应的甲、乙两物质的微粒个数比为3∶2
B.该反应属于化合反应
C.从宏观角度看,物质丙属于混合物
D.化学反应前后原子的种类、数目均不变
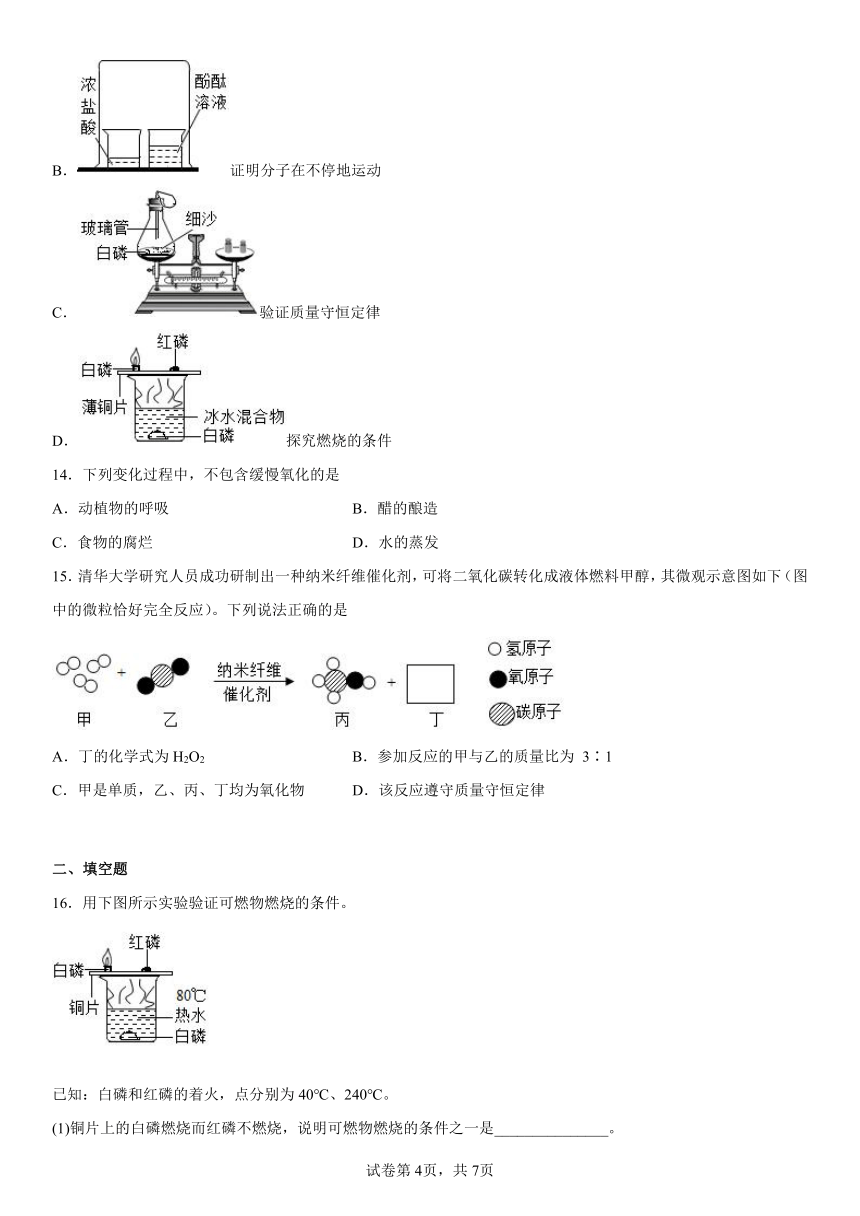
13.创新改进实验是学习化学的有效方法。下列对实验的创新改进能够达到实验目的的是
A.测定空气中氧气的含量
B.证明分子在不停地运动
C.验证质量守恒定律
D.探究燃烧的条件
14.下列变化过程中,不包含缓慢氧化的是
A.动植物的呼吸 B.醋的酿造
C.食物的腐烂 D.水的蒸发
15.清华大学研究人员成功研制出一种纳米纤维催化剂,可将二氧化碳转化成液体燃料甲醇,其微观示意图如下(图中的微粒恰好完全反应)。下列说法正确的是
A.丁的化学式为H2O2 B.参加反应的甲与乙的质量比为 3∶1
C.甲是单质,乙、丙、丁均为氧化物 D.该反应遵守质量守恒定律
二、填空题
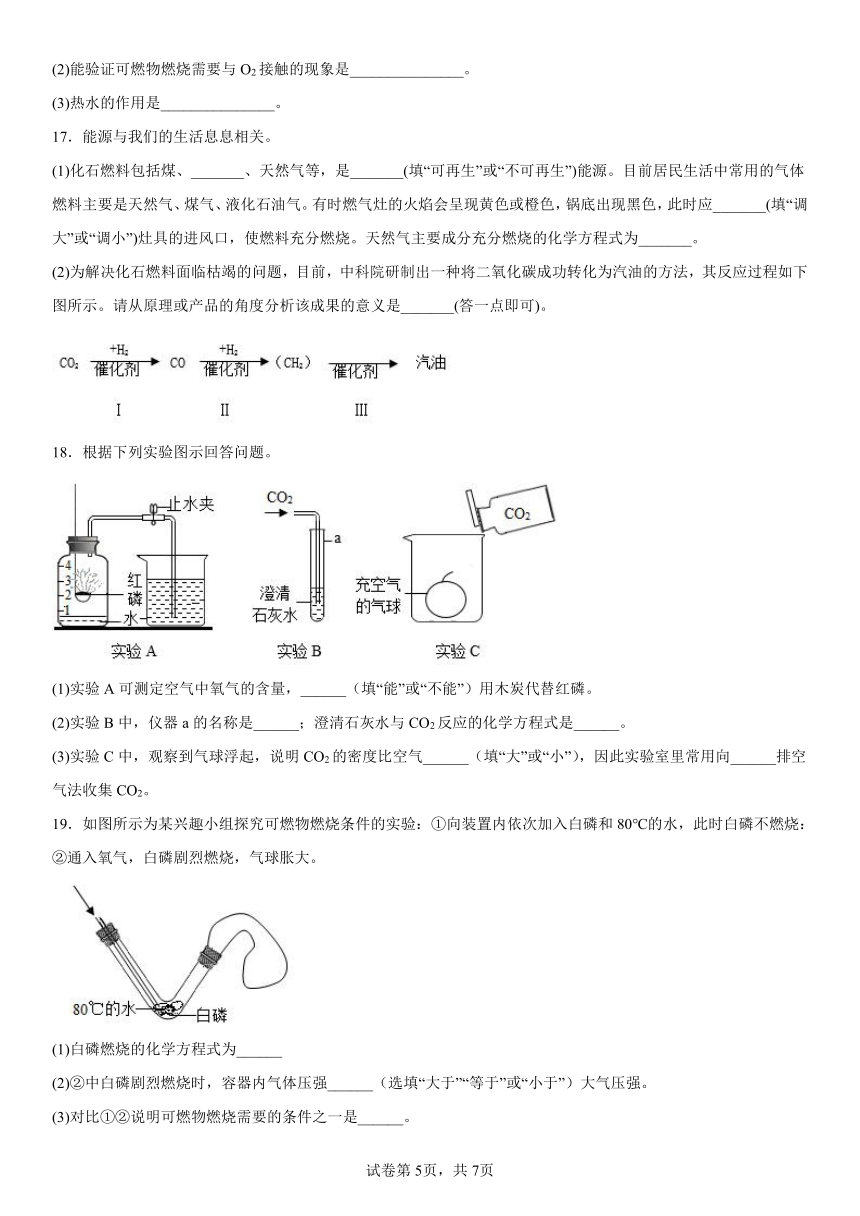
16.用下图所示实验验证可燃物燃烧的条件。
已知:白磷和红磷的着火,点分别为40℃、240℃。
(1)铜片上的白磷燃烧而红磷不燃烧,说明可燃物燃烧的条件之一是_______________。
(2)能验证可燃物燃烧需要与O2接触的现象是_______________。
(3)热水的作用是_______________。
17.能源与我们的生活息息相关。
(1)化石燃料包括煤、_______、天然气等,是_______(填“可再生”或“不可再生”)能源。目前居民生活中常用的气体燃料主要是天然气、煤气、液化石油气。有时燃气灶的火焰会呈现黄色或橙色,锅底出现黑色,此时应_______(填“调大”或“调小”)灶具的进风口,使燃料充分燃烧。天然气主要成分充分燃烧的化学方程式为_______。
(2)为解决化石燃料面临枯竭的问题,目前,中科院研制出一种将二氧化碳成功转化为汽油的方法,其反应过程如下图所示。请从原理或产品的角度分析该成果的意义是_______(答一点即可)。
18.根据下列实验图示回答问题。
(1)实验A可测定空气中氧气的含量,______(填“能”或“不能”)用木炭代替红磷。
(2)实验B中,仪器a的名称是______;澄清石灰水与CO2反应的化学方程式是______。
(3)实验C中,观察到气球浮起,说明CO2的密度比空气______(填“大”或“小”),因此实验室里常用向______排空气法收集CO2。
19.如图所示为某兴趣小组探究可燃物燃烧条件的实验:①向装置内依次加入白磷和80℃的水,此时白磷不燃烧:②通入氧气,白磷剧烈燃烧,气球胀大。
(1)白磷燃烧的化学方程式为______
(2)②中白磷剧烈燃烧时,容器内气体压强______(选填“大于”“等于”或“小于”)大气压强。
(3)对比①②说明可燃物燃烧需要的条件之一是______。
三、实验题
20.根据给出的装置回答下列问题:
(1)写出仪器名称:a_________________;b________________;c_________________ 。
(2)安装好仪器,装入药品前必须进行的一步操作是__________________,图A 中试管口略向下倾斜的原因是________ 。
(3)实验室制取氧气,常用的发生装置是___________(填序号,下同)。若用 A 装置以________________色的高锰酸钾为原料制取氧气,化学方程式是___________,需要对装置 A 改进的地方是______,目的是____________。若收集较纯净的氧气,选用的收集装置是__________,待 ____________时,开始收集氧气;停止加热时,应先____________, 再____________,防止_________。
(4)若用过氧化氢制取较干燥的氧气,装置组合是_________。反应的化学方程式为____。二氧化锰(不溶于水的固体)在该反应前后质量和____________不变,实验结束后可采用 __________方法,予以回收利用。
(5)实验室可用 _____________色的氯酸钾和________________色的二氧化锰共热制取氧气, 制取的装置组合为 ________________(填序号),该反应后,欲从反应后的固体剩余物中回收二氧化锰(氯化钾可以溶于水),操作方法为 ________________、________________、洗涤、干燥。
(6)二氧化碳是一种密度比空气大且能溶于水的气体,选用大理石和稀盐酸溶液常温下反应制取二氧化碳时,应选择的发生装置为 _______________,收集装置为_______________,选择此收集装置的依据是 _______________。
(7)工业上用分离液态空气的方法制氧气,属于 _______________(“物理”或“化学”)变化。
(8)实验室用浓盐酸溶液和二氧化锰固体共热制备氯气,那么发生装置_____(填“能” 或“不能”,下同)选用装置 A,_________________选用装置 B。
(9)NO气体难溶于水,密度略大于空气,易与氧气反应生成NO2,则应选择___(填序号)装置来收集NO。
(10)B 装置用 10%的过氧化氢溶液和二氧化锰混合制备 O2,反应太快不利于氧气的收集,装置改进措施为_________。
(11)我们做铁丝在氧气中燃烧的实验时,把红热的铁丝伸入装有氧气的集气瓶里,做 这个实验时盛氧气的集气瓶预先加少量水,水的作用是_____________。
(12)硫酸铜溶液_______________(“能”或“不能”)催化过氧化氢的分解。
21.火的利用推动了人类文明的进程,观察下图:
选择序号回答(1)~(3):①与氧气接触②温度达到着火点③有可燃物
(1)图一所示实验现象,说明燃烧应具备的条件是__________________。
(2)图二烧杯中蜡烛渐渐熄灭,说明燃烧应具备的条件是__________________。
(3)图三铜片上白磷燃烧红磷不燃烧,说明燃烧应具备的条件是__________________。
(4)图三实验中所用药品的保存方法正确的是_________________(选填图四中的字母编号)。
四、计算题
22.学习小组同学为测定某品牌钙片中含碳酸钙的质量分数,向盛有10g钙片的烧杯中加入过量稀盐酸,充分反应后,测得烧杯内混合物的总质量比反应前稀盐酸与钙片的总质量减少了3.3g。(钙片中其他成分不与稀盐酸反应放出气体)
(1)反应中生成二氧化碳的质量是___________g。
(2)计算该品牌钙片中含碳酸钙的质量分数。
23.高铁酸钠(Na2FeO4)是一种高效多功能水处理剂,工业上常采用次氯酸钠(NaClO)氧化法生产,反应原理用化学方程式表示为:3NaClO+2Fe(NO3) 3+10NaOH=2Na2FeO4↓+3NaCl+6NaNO3+5H2O
(1)次氯酸钠(NaClO) 中Cl元素的化合价为_____;
(2)高铁酸钠(Na2FeO4)中铁元素和氧元素的质量比为_____ (填最简比);
(3)现要制得830kg含杂质20%的高铁酸钠,至少需要次氯酸钠的质量是多少_________?(列式计算)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.D
3.C
4.A
5.B
6.D
7.B
8.C
9.A
10.D
11.D
12.A
13.A
14.D
15.D
16.(1)温度达到可燃物的着火点
(2)铜片上的白磷燃烧,水中的白磷不燃烧
(3)提供热量和隔绝空气
17. 石油 不可再生 调大 CH4+2O2CO2+2H2O 缓解温室效应加剧(或减缓能源危机)
18.(1)不能
(2) 试管 Ca(OH)2+CO2=CaCO3↓+ H2O
(3) 大 上
19.(1)
(2)大于
(3)可燃物要和氧气接触
20.(1) 铁架台 长颈漏斗 水槽
(2) 检查气密性 防止冷凝水倒流,炸裂试管
(3) A或B 紫黑 试管口放一团棉花 防止高锰酸钾粉末进入导管 C 导管口气泡连续均匀冒出 从水中取出导管 熄灭酒精灯 防止水倒流炸裂试管
(4) BG 化学性质 过滤
(5) 白 黑 AC或AG 溶解 过滤
(6) B G 二氧化碳密度大于空气
(7)物理
(8) 不能 不能
(9)C
(10)将长颈漏斗改为分液漏斗
(11)防止生成物溅落炸裂集气瓶
(12)能
21. ③ ① ② AB
22.(1)3.3
(2)解:设参加反应的碳酸钙的质量为x。
解得:x=7.5g
该品牌钙片中含碳酸钙的质量分数为
答:该品牌钙片中含碳酸钙的质量分数为75%。
23.(1) +1 (2) 7:8 (3)447kg
答案第1页,共2页
答案第1页,共2页
一、单选题
1.关于燃烧和灭火,下列说法正确的是
A.可燃性气体达到爆炸极限时就会发生爆炸
B.炒菜时油锅起火,向锅中放入较多菜叶灭火,是降低了油的着火点
C.木柴架空有利于燃烧,是因为增大了可燃物与氧气的接触面积
D.干粉灭火器可以用来扑灭图书、档案、贵重设备、精密仪器等物的失火
2.如果发现火险或遭遇火灾要沉着应对。下列做法正确的是
A.油锅中的油着火用水浇灭
B.室内起火迅速打开门窗通风
C.家中燃气泄漏,立即打开排气扇通风
D.遭遇火灾时,用湿毛巾捂住口鼻远离着火区域
3.“绿色化学”要求原料物质中所有的原子完全被利用,全部转入期望的产品中,即原子利用率为100%。一定条件下,CO和H2可以按照不同比例反应,只生成一种产物就能实现“绿色化学”,这种产物不可能是
A.甲醛(CH2O)
B.甲醇(CH4O)
C.乙醇(C2H6O)
D.乙酸(C2H4O2)
4.下列关于燃烧和灭火的说法,错误的是
A.可燃物只要与氧气接触就能燃烧
B.家用电器着火时,应先切断电源
C.将木柴架空燃烧,是为了使木柴与空气充分接触
D.扑灭森林火灾时,可设置隔离带将树木与燃烧区隔离
5.下列有关氧气的说法中,不正确的是
A.氧气可供给呼吸
B.鱼类能在水中生存,说明氧气易溶于水
C.植物的光合作用是空气中氧气的主要来源
D.焊接或切割金属时使用纯氧代替空气以获得更高的温度
6.有关粉尘爆炸实验说法正确的是
A.剧烈燃烧一定会引起爆炸
B.燃着的蜡烛可升高面粉着火点
C.鼓空气是为了增大氧气的含量
D.面粉加工厂必须严禁烟火
7.现将20gA和足量B在一定条件下充分反应,生成16gC和11gD,则参加反应的A和B的质量比是
A.20:11 B.20:7 C.5:4 D.16:11
8.装运汽油或乙醇的运输车上,所贴的危险化学品标志为
A. B.
C. D.
9.密闭容器中有甲、乙、丙、丁四种物质,在一定条件下发生化学反应,测得反应前后有关数据如下:
物质 甲 乙 丙 丁
反应前质量/g 6 2 14 35
反应后质量/g 待测 2 22 13
关于此反应说法正确的是A.该反应是分解反应 B.物质乙一定是该反应的催化剂
C.待测数值是14 D.反应中甲与丙变化的质量比4∶7
10.2022年4月29日《科技日报》报道“我国科学家实现二氧化碳到葡萄糖和油脂的“人工合成”,合成过程中的一个反应微观示意图如下,有关说法正确的是
A.反应前后分子的种类不变
B.反应前后共有三种氧化物
C.丙物质由8个原子构成
D.反应中甲和丁的分子个数比是2∶1
11.2019年5月12日是我国第11个全国防灾减灾日,主题是“提高灾害防治能力,构筑生命安全防线”。下列说法错误的是( )
A.草原着火了,在火的蔓延方向前面再点一条火线
B.油库、面粉加工厂、纺织厂等场所要严禁烟火
C.火灾发生后应用湿毛巾捂住口鼻迅速逃离,并拨打火警电话
D.只要温度达到着火点,可燃物一定会燃烧
12.在宏观、微观和符号之间建立联系是化学学科的特点,如图是某化学反应的微观过程示意图(表示A原子,表示B原子),下列说法不正确的是( )
A.参加反应的甲、乙两物质的微粒个数比为3∶2
B.该反应属于化合反应
C.从宏观角度看,物质丙属于混合物
D.化学反应前后原子的种类、数目均不变
13.创新改进实验是学习化学的有效方法。下列对实验的创新改进能够达到实验目的的是
A.测定空气中氧气的含量
B.证明分子在不停地运动
C.验证质量守恒定律
D.探究燃烧的条件
14.下列变化过程中,不包含缓慢氧化的是
A.动植物的呼吸 B.醋的酿造
C.食物的腐烂 D.水的蒸发
15.清华大学研究人员成功研制出一种纳米纤维催化剂,可将二氧化碳转化成液体燃料甲醇,其微观示意图如下(图中的微粒恰好完全反应)。下列说法正确的是
A.丁的化学式为H2O2 B.参加反应的甲与乙的质量比为 3∶1
C.甲是单质,乙、丙、丁均为氧化物 D.该反应遵守质量守恒定律
二、填空题
16.用下图所示实验验证可燃物燃烧的条件。
已知:白磷和红磷的着火,点分别为40℃、240℃。
(1)铜片上的白磷燃烧而红磷不燃烧,说明可燃物燃烧的条件之一是_______________。
(2)能验证可燃物燃烧需要与O2接触的现象是_______________。
(3)热水的作用是_______________。
17.能源与我们的生活息息相关。
(1)化石燃料包括煤、_______、天然气等,是_______(填“可再生”或“不可再生”)能源。目前居民生活中常用的气体燃料主要是天然气、煤气、液化石油气。有时燃气灶的火焰会呈现黄色或橙色,锅底出现黑色,此时应_______(填“调大”或“调小”)灶具的进风口,使燃料充分燃烧。天然气主要成分充分燃烧的化学方程式为_______。
(2)为解决化石燃料面临枯竭的问题,目前,中科院研制出一种将二氧化碳成功转化为汽油的方法,其反应过程如下图所示。请从原理或产品的角度分析该成果的意义是_______(答一点即可)。
18.根据下列实验图示回答问题。
(1)实验A可测定空气中氧气的含量,______(填“能”或“不能”)用木炭代替红磷。
(2)实验B中,仪器a的名称是______;澄清石灰水与CO2反应的化学方程式是______。
(3)实验C中,观察到气球浮起,说明CO2的密度比空气______(填“大”或“小”),因此实验室里常用向______排空气法收集CO2。
19.如图所示为某兴趣小组探究可燃物燃烧条件的实验:①向装置内依次加入白磷和80℃的水,此时白磷不燃烧:②通入氧气,白磷剧烈燃烧,气球胀大。
(1)白磷燃烧的化学方程式为______
(2)②中白磷剧烈燃烧时,容器内气体压强______(选填“大于”“等于”或“小于”)大气压强。
(3)对比①②说明可燃物燃烧需要的条件之一是______。
三、实验题
20.根据给出的装置回答下列问题:
(1)写出仪器名称:a_________________;b________________;c_________________ 。
(2)安装好仪器,装入药品前必须进行的一步操作是__________________,图A 中试管口略向下倾斜的原因是________ 。
(3)实验室制取氧气,常用的发生装置是___________(填序号,下同)。若用 A 装置以________________色的高锰酸钾为原料制取氧气,化学方程式是___________,需要对装置 A 改进的地方是______,目的是____________。若收集较纯净的氧气,选用的收集装置是__________,待 ____________时,开始收集氧气;停止加热时,应先____________, 再____________,防止_________。
(4)若用过氧化氢制取较干燥的氧气,装置组合是_________。反应的化学方程式为____。二氧化锰(不溶于水的固体)在该反应前后质量和____________不变,实验结束后可采用 __________方法,予以回收利用。
(5)实验室可用 _____________色的氯酸钾和________________色的二氧化锰共热制取氧气, 制取的装置组合为 ________________(填序号),该反应后,欲从反应后的固体剩余物中回收二氧化锰(氯化钾可以溶于水),操作方法为 ________________、________________、洗涤、干燥。
(6)二氧化碳是一种密度比空气大且能溶于水的气体,选用大理石和稀盐酸溶液常温下反应制取二氧化碳时,应选择的发生装置为 _______________,收集装置为_______________,选择此收集装置的依据是 _______________。
(7)工业上用分离液态空气的方法制氧气,属于 _______________(“物理”或“化学”)变化。
(8)实验室用浓盐酸溶液和二氧化锰固体共热制备氯气,那么发生装置_____(填“能” 或“不能”,下同)选用装置 A,_________________选用装置 B。
(9)NO气体难溶于水,密度略大于空气,易与氧气反应生成NO2,则应选择___(填序号)装置来收集NO。
(10)B 装置用 10%的过氧化氢溶液和二氧化锰混合制备 O2,反应太快不利于氧气的收集,装置改进措施为_________。
(11)我们做铁丝在氧气中燃烧的实验时,把红热的铁丝伸入装有氧气的集气瓶里,做 这个实验时盛氧气的集气瓶预先加少量水,水的作用是_____________。
(12)硫酸铜溶液_______________(“能”或“不能”)催化过氧化氢的分解。
21.火的利用推动了人类文明的进程,观察下图:
选择序号回答(1)~(3):①与氧气接触②温度达到着火点③有可燃物
(1)图一所示实验现象,说明燃烧应具备的条件是__________________。
(2)图二烧杯中蜡烛渐渐熄灭,说明燃烧应具备的条件是__________________。
(3)图三铜片上白磷燃烧红磷不燃烧,说明燃烧应具备的条件是__________________。
(4)图三实验中所用药品的保存方法正确的是_________________(选填图四中的字母编号)。
四、计算题
22.学习小组同学为测定某品牌钙片中含碳酸钙的质量分数,向盛有10g钙片的烧杯中加入过量稀盐酸,充分反应后,测得烧杯内混合物的总质量比反应前稀盐酸与钙片的总质量减少了3.3g。(钙片中其他成分不与稀盐酸反应放出气体)
(1)反应中生成二氧化碳的质量是___________g。
(2)计算该品牌钙片中含碳酸钙的质量分数。
23.高铁酸钠(Na2FeO4)是一种高效多功能水处理剂,工业上常采用次氯酸钠(NaClO)氧化法生产,反应原理用化学方程式表示为:3NaClO+2Fe(NO3) 3+10NaOH=2Na2FeO4↓+3NaCl+6NaNO3+5H2O
(1)次氯酸钠(NaClO) 中Cl元素的化合价为_____;
(2)高铁酸钠(Na2FeO4)中铁元素和氧元素的质量比为_____ (填最简比);
(3)现要制得830kg含杂质20%的高铁酸钠,至少需要次氯酸钠的质量是多少_________?(列式计算)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.D
3.C
4.A
5.B
6.D
7.B
8.C
9.A
10.D
11.D
12.A
13.A
14.D
15.D
16.(1)温度达到可燃物的着火点
(2)铜片上的白磷燃烧,水中的白磷不燃烧
(3)提供热量和隔绝空气
17. 石油 不可再生 调大 CH4+2O2CO2+2H2O 缓解温室效应加剧(或减缓能源危机)
18.(1)不能
(2) 试管 Ca(OH)2+CO2=CaCO3↓+ H2O
(3) 大 上
19.(1)
(2)大于
(3)可燃物要和氧气接触
20.(1) 铁架台 长颈漏斗 水槽
(2) 检查气密性 防止冷凝水倒流,炸裂试管
(3) A或B 紫黑 试管口放一团棉花 防止高锰酸钾粉末进入导管 C 导管口气泡连续均匀冒出 从水中取出导管 熄灭酒精灯 防止水倒流炸裂试管
(4) BG 化学性质 过滤
(5) 白 黑 AC或AG 溶解 过滤
(6) B G 二氧化碳密度大于空气
(7)物理
(8) 不能 不能
(9)C
(10)将长颈漏斗改为分液漏斗
(11)防止生成物溅落炸裂集气瓶
(12)能
21. ③ ① ② AB
22.(1)3.3
(2)解:设参加反应的碳酸钙的质量为x。
解得:x=7.5g
该品牌钙片中含碳酸钙的质量分数为
答:该品牌钙片中含碳酸钙的质量分数为75%。
23.(1) +1 (2) 7:8 (3)447kg
答案第1页,共2页
答案第1页,共2页
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
