第二章 分子结构与性质 体系构建 体验高考 学案(含答案)
文档属性
| 名称 | 第二章 分子结构与性质 体系构建 体验高考 学案(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 455.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-30 21:33:02 | ||
图片预览


文档简介
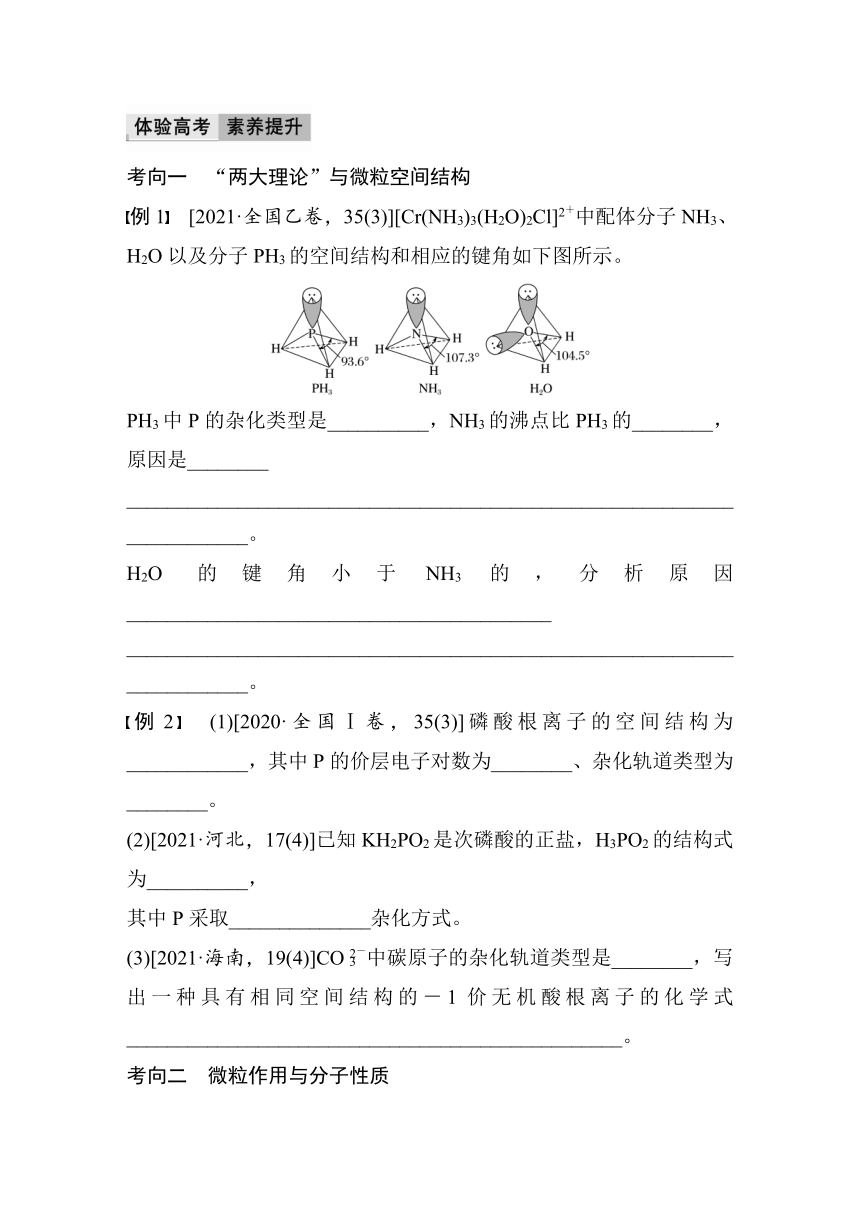
体系构建 体验高考
1.共价键和分子的空间结构
2.分子结构与物质的性质
(1)共价键的极性
(2)分子极性
(3)分子间的作用力→对其物质性质的影响
(4)溶解性
(5)分子的手性
考向一 “两大理论”与微粒空间结构
例1 [2021·全国乙卷,35(3)][Cr(NH3)3(H2O)2Cl]2+中配体分子NH3、H2O以及分子PH3的空间结构和相应的键角如下图所示。
PH3中P的杂化类型是__________,NH3的沸点比PH3的________,原因是________
________________________________________________________________________。
H2O 的键角小于NH3的,分析原因__________________________________________
________________________________________________________________________。
例2 (1)[2020·全国Ⅰ卷,35(3)]磷酸根离子的空间结构为____________,其中P的价层电子对数为________、杂化轨道类型为________。
(2)[2021·河北,17(4)]已知KH2PO2是次磷酸的正盐,H3PO2的结构式为__________,
其中P采取______________杂化方式。
(3)[2021·海南,19(4)]CO中碳原子的杂化轨道类型是________,写出一种具有相同空间结构的-1价无机酸根离子的化学式_________________________________________________。
考向二 微粒作用与分子性质
例3 (1)[2021·全国甲卷,35(3)]甲醇的沸点(64.7 ℃)介于水(100 ℃)和甲硫醇(CH3SH,7.6 ℃)之间,其原因是_________________________________________________________________
______________________________________________________________________________。
(2)[2021·山东,16(2)节选]OF2的熔、沸点________(填“高于”或“低于”)Cl2O,原因是______________________________________________________________________________
______________________________________________________________________________。
例4 [2021·广东,20(2)(5)](2)H2S、CH4、H2O的沸点由高到低顺序为__________________。
(5)汞解毒剂的水溶性好,有利于体内重金属元素汞的解毒。化合物 Ⅰ 与化合物 Ⅲ 相比,水溶性较好的是______________________。
例5 [2021·湖南,18(2)①节选]硅和卤素单质反应可以得到SiX4。
SiX4的熔、沸点
SiF4 SiCl4 SiBr4 SiI4
熔点/K 183.0 203.2 278.6 393.7
沸点/K 187.2 330.8 427.2 560.7
0 ℃时,SiF4、SiCl4、SiBr4、SiI4呈液态的是______(填化学式),沸点依次升高的原因是_______________________________________________________________________________
_______________________________________________________________________________。
体系构建 体验高考
例1 sp3 高 NH3存在分子间氢键 NH3含有1个孤电子对,而H2O含有2个孤电子对,H2O中的孤电子对对成键电子对的排斥作用较大
解析 PH3中P的价层电子对数为3+1=4,故PH3中P的杂化类型是sp3; N原子的电负性较强,NH3存在分子间氢键,因此NH3的沸点比PH3的高;H2O的键角小于NH3的键角,原因是NH3含有1个孤电子对,而H2O含有2个孤电子对,H2O中的孤电子对对成键电子对的排斥作用较大。
例2 (1)正四面体形 4 sp3 (2) sp3 (3)sp2 NO
解析 (1)根据价层电子对互斥模型,PO中P的价层电子对数为4+=4,无孤电子对,故杂化轨道类型为sp3,空间结构为正四面体形。(2)含氧酸分子中只有羟基上的H可以电离;由KH2PO2是次磷酸的正盐可知,H3PO2为一元酸,其分子中只有一个羟基,另外2个H与P成键,还有一个O与P形成双键,故其结构式为,其中P共形成4个σ键、没有孤电子对,故其价层电子对数为4,采取sp3杂化。(3)根据价层电子对互斥模型,CO中心原子C连接3个O原子,所以σ键数为3,孤电子对数=×(4-3×2+2)=0,所以CO中C原子价层电子对数为3,孤电子对数为0,故其离子结构为平面三角形;再根据价层电子对数与杂化轨道对应关系,可知CO中C原子的杂化轨道类型是sp2;按题目要求,阴离子中心原子价层电子对数应为3,孤电子对数为0,带电荷量为-1,无机酸根一般是含氧酸阴离子,所以代入孤电子对公式可解得其中心原子价电子数为5,所以应为NO。
例3 (1)甲硫醇不能形成分子间氢键,而水和甲醇均能形成氢键,且水比甲醇的氢键多
(2)低于 OF2和Cl2O结构相似,Cl2O的相对分子质量大,Cl2O的熔、沸点高
解析 (1)甲醇分子之间和水分子之间都存在氢键,因此沸点高于不含分子间氢键的甲硫醇,甲醇分子间氢键的总强度低于水分子间氢键的总强度,因此甲醇的沸点介于水和甲硫醇之间。
例4 (2)H2O>H2S>CH4 (5)化合物Ⅲ
解析 (2)H2O分子间存在氢键,沸点较高,H2S、CH4的分子间范德华力随相对分子质量的增大而增加,因此沸点由高到低顺序为H2O>H2S>CH4。(5) 中羟基能与水分子之间形成分子间氢键,为易溶于水的钠盐,溶于水后电离出的中O原子均能与水分子之间形成氢键,相同物质的量的两种物质溶于水后,形成的氢键更多,因此化合物Ⅲ水溶性更好。
例5 SiCl4 SiX4结构相似,相对分子质量依次增大,分子间作用力依次增大
解析 由题给熔、沸点数据可知,0 ℃时,四氟化硅为气态,四氯化硅为液态,四溴化硅、四碘化硅为固态;SiX4结构相似,相对分子质量依次增大,分子间作用力依次增大,则SiX4的沸点依次升高。
1.共价键和分子的空间结构
2.分子结构与物质的性质
(1)共价键的极性
(2)分子极性
(3)分子间的作用力→对其物质性质的影响
(4)溶解性
(5)分子的手性
考向一 “两大理论”与微粒空间结构
例1 [2021·全国乙卷,35(3)][Cr(NH3)3(H2O)2Cl]2+中配体分子NH3、H2O以及分子PH3的空间结构和相应的键角如下图所示。
PH3中P的杂化类型是__________,NH3的沸点比PH3的________,原因是________
________________________________________________________________________。
H2O 的键角小于NH3的,分析原因__________________________________________
________________________________________________________________________。
例2 (1)[2020·全国Ⅰ卷,35(3)]磷酸根离子的空间结构为____________,其中P的价层电子对数为________、杂化轨道类型为________。
(2)[2021·河北,17(4)]已知KH2PO2是次磷酸的正盐,H3PO2的结构式为__________,
其中P采取______________杂化方式。
(3)[2021·海南,19(4)]CO中碳原子的杂化轨道类型是________,写出一种具有相同空间结构的-1价无机酸根离子的化学式_________________________________________________。
考向二 微粒作用与分子性质
例3 (1)[2021·全国甲卷,35(3)]甲醇的沸点(64.7 ℃)介于水(100 ℃)和甲硫醇(CH3SH,7.6 ℃)之间,其原因是_________________________________________________________________
______________________________________________________________________________。
(2)[2021·山东,16(2)节选]OF2的熔、沸点________(填“高于”或“低于”)Cl2O,原因是______________________________________________________________________________
______________________________________________________________________________。
例4 [2021·广东,20(2)(5)](2)H2S、CH4、H2O的沸点由高到低顺序为__________________。
(5)汞解毒剂的水溶性好,有利于体内重金属元素汞的解毒。化合物 Ⅰ 与化合物 Ⅲ 相比,水溶性较好的是______________________。
例5 [2021·湖南,18(2)①节选]硅和卤素单质反应可以得到SiX4。
SiX4的熔、沸点
SiF4 SiCl4 SiBr4 SiI4
熔点/K 183.0 203.2 278.6 393.7
沸点/K 187.2 330.8 427.2 560.7
0 ℃时,SiF4、SiCl4、SiBr4、SiI4呈液态的是______(填化学式),沸点依次升高的原因是_______________________________________________________________________________
_______________________________________________________________________________。
体系构建 体验高考
例1 sp3 高 NH3存在分子间氢键 NH3含有1个孤电子对,而H2O含有2个孤电子对,H2O中的孤电子对对成键电子对的排斥作用较大
解析 PH3中P的价层电子对数为3+1=4,故PH3中P的杂化类型是sp3; N原子的电负性较强,NH3存在分子间氢键,因此NH3的沸点比PH3的高;H2O的键角小于NH3的键角,原因是NH3含有1个孤电子对,而H2O含有2个孤电子对,H2O中的孤电子对对成键电子对的排斥作用较大。
例2 (1)正四面体形 4 sp3 (2) sp3 (3)sp2 NO
解析 (1)根据价层电子对互斥模型,PO中P的价层电子对数为4+=4,无孤电子对,故杂化轨道类型为sp3,空间结构为正四面体形。(2)含氧酸分子中只有羟基上的H可以电离;由KH2PO2是次磷酸的正盐可知,H3PO2为一元酸,其分子中只有一个羟基,另外2个H与P成键,还有一个O与P形成双键,故其结构式为,其中P共形成4个σ键、没有孤电子对,故其价层电子对数为4,采取sp3杂化。(3)根据价层电子对互斥模型,CO中心原子C连接3个O原子,所以σ键数为3,孤电子对数=×(4-3×2+2)=0,所以CO中C原子价层电子对数为3,孤电子对数为0,故其离子结构为平面三角形;再根据价层电子对数与杂化轨道对应关系,可知CO中C原子的杂化轨道类型是sp2;按题目要求,阴离子中心原子价层电子对数应为3,孤电子对数为0,带电荷量为-1,无机酸根一般是含氧酸阴离子,所以代入孤电子对公式可解得其中心原子价电子数为5,所以应为NO。
例3 (1)甲硫醇不能形成分子间氢键,而水和甲醇均能形成氢键,且水比甲醇的氢键多
(2)低于 OF2和Cl2O结构相似,Cl2O的相对分子质量大,Cl2O的熔、沸点高
解析 (1)甲醇分子之间和水分子之间都存在氢键,因此沸点高于不含分子间氢键的甲硫醇,甲醇分子间氢键的总强度低于水分子间氢键的总强度,因此甲醇的沸点介于水和甲硫醇之间。
例4 (2)H2O>H2S>CH4 (5)化合物Ⅲ
解析 (2)H2O分子间存在氢键,沸点较高,H2S、CH4的分子间范德华力随相对分子质量的增大而增加,因此沸点由高到低顺序为H2O>H2S>CH4。(5) 中羟基能与水分子之间形成分子间氢键,为易溶于水的钠盐,溶于水后电离出的中O原子均能与水分子之间形成氢键,相同物质的量的两种物质溶于水后,形成的氢键更多,因此化合物Ⅲ水溶性更好。
例5 SiCl4 SiX4结构相似,相对分子质量依次增大,分子间作用力依次增大
解析 由题给熔、沸点数据可知,0 ℃时,四氟化硅为气态,四氯化硅为液态,四溴化硅、四碘化硅为固态;SiX4结构相似,相对分子质量依次增大,分子间作用力依次增大,则SiX4的沸点依次升高。
