第三章 晶体结构与性质 体系构建 体验高考 学案(含答案)
文档属性
| 名称 | 第三章 晶体结构与性质 体系构建 体验高考 学案(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 634.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-30 22:12:35 | ||
图片预览


文档简介
体系构建 体验高考
1.晶体结构与性质
2.配位键和配合物
3.超分子的重要特征
考向一 晶体结构的分析与计算
例1 [2021·全国甲卷,35(4)]
我国科学家发明了高选择性的二氧化碳加氢合成甲醇的催化剂,其组成为ZnO/ZrO2固溶体。四方ZrO2晶胞如图所示。Zr4+离子在晶胞中的配位数是________,晶胞参数为a pm、a pm、c pm,该晶体密度为____________g·cm-3(写出表达式)。在ZrO2中掺杂少量ZnO后形成的催化剂,化学式可表示为ZnxZr1-xOy,则y=__________________(用x表达)。
例2 [2021·全国乙卷,35(4)]在金属材料中添加AlCr2颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。AlCr2具有体心四方结构,如图所示。处于顶角位置的是________原子。设Cr和Al原子半径分别为rCr和rAl,则金属原子空间占有率为______________% (列出计算表达式)。
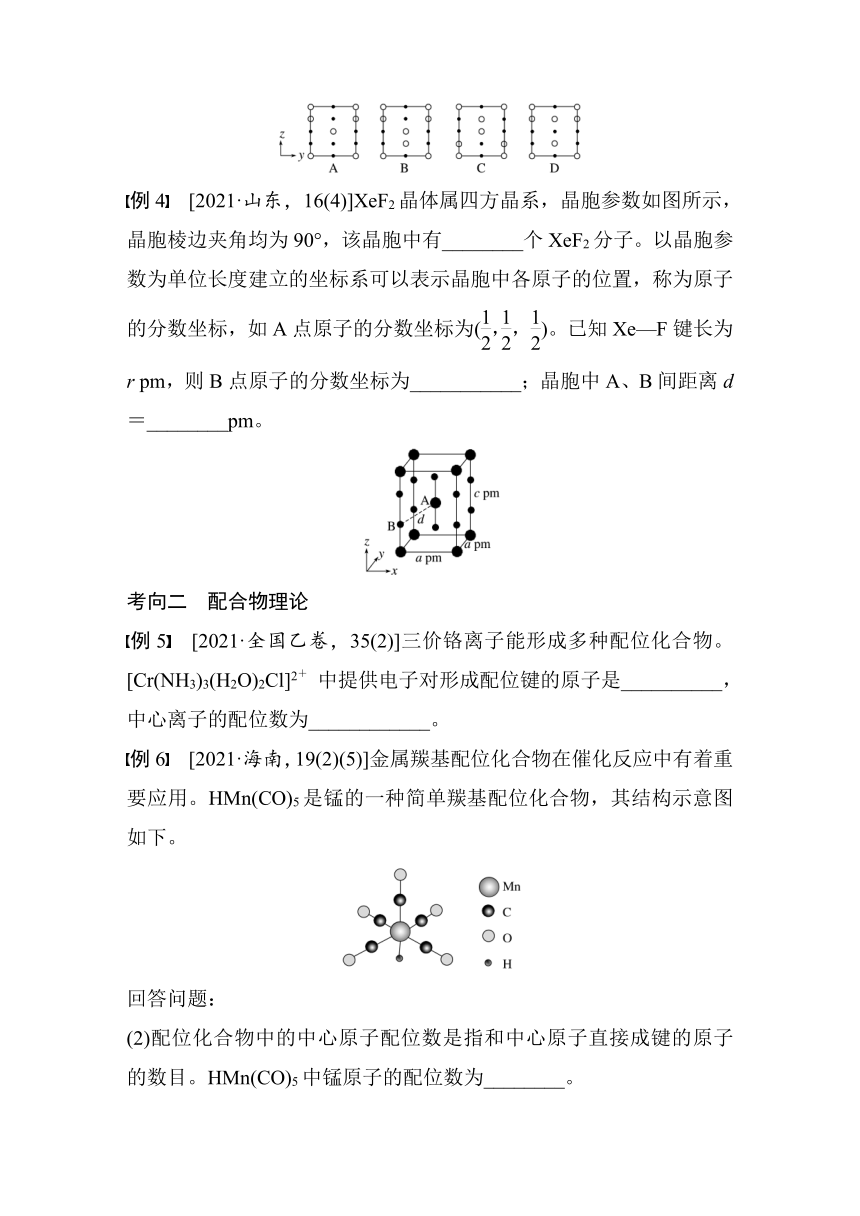
例3 [2021·河北,17(7)]分别用、表示H2PO和K+,KH2PO4晶体的四方晶胞如图(a)所示,图(b)、图(c)分别显示的是H2PO、K+在晶胞xz面、yz面上的位置:
①若晶胞底边的边长均为a pm、高为c pm,阿伏加德罗常数的值为NA,晶体的密度为____________g·cm-3(写出表达式)。
②晶胞在x轴方向的投影图为__________(填标号)。
例4 [2021·山东,16(4)]XeF2晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,该晶胞中有________个XeF2分子。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点原子的分数坐标为(,,)。已知Xe—F键长为
r pm,则B点原子的分数坐标为___________;晶胞中A、B间距离d=________pm。
考向二 配合物理论
例5 [2021·全国乙卷,35(2)]三价铬离子能形成多种配位化合物。[Cr(NH3)3(H2O)2Cl]2+ 中提供电子对形成配位键的原子是__________,中心离子的配位数为____________。
例6 [2021·海南,19(2)(5)]金属羰基配位化合物在催化反应中有着重要应用。HMn(CO)5是锰的一种简单羰基配位化合物,其结构示意图如下。
回答问题:
(2)配位化合物中的中心原子配位数是指和中心原子直接成键的原子的数目。HMn(CO)5中锰原子的配位数为________。
(5)CH3Mn(CO)5可看作是HMn(CO)5中的氢原子被甲基取代的产物。CH3Mn(CO)5与I2反应可用于制备CH3I,反应前后锰的配位数不变,CH3Mn(CO)5与I2反应的化学方程式为____________________________________________________________
___________________________________________________________。
体系构建 体验高考
例1 8 2-x
解析 以晶胞中右侧面心的Zr4+为例,同一晶胞中与Zr4+连接最近且等距的O2-数为4,同理可知右侧晶胞中有4个O2-与Zr4+相连,因此Zr4+离子在晶胞中的配位数是4+4=8;1个晶胞中含有4个ZrO2微粒,1个晶胞的质量为m= g,1个晶胞的体积为(a×10-10 cm)×(a×10-10 cm)×(c×10-10 cm)=a2c×10-30 cm3,因此该晶体密度为== g·cm-3;在ZrO2中掺杂少量ZnO后形成的催化剂,化学式可表示为ZnxZr1-xOy,其中Zn元素为+2价,Zr为+4价,O元素为-2价,根据化合物中各元素的化合价代数和为0可知2x+4×(1-x)=2y,解得y=2-x。
例2 Al ×100
解析 已知AlCr2具有体心四方结构,如图所示,灰球个数为8×+1=2,白球个数为8×+2=4,结合化学式AlCr2可知,白球为Cr,灰球为Al,即处于顶角位置的是Al原子。设Cr和Al原子半径分别为rCr和rAl,则金属原子的体积为×4+×2=,故金属原子空间占有率为×100%=×100%。
例3 ① ②B
解析 ①由晶胞结构可知,H2PO位于晶胞的顶角、面上和体心,顶角上有8个、面上有4个、体心有1个,故晶胞中H2PO的数目为8×+4×+1=4;K+位于面上和棱上,面上有6个、棱上4个,故晶胞中K+的数目为6×+4×=4。因此,平均每个晶胞中占有的H2PO和K+的数目均为4,若晶胞底边的边长均为a pm、高为c pm,则晶胞的体积为10-30a2c cm3,阿伏加德罗常数的值为NA,则晶体的密度为 g·cm-3。
②由图(a)、(b)、(c)可知,晶胞在x轴方向的投影图为 。
例4 2 (0,0,)
解析 图中大球的个数为8×+1=2,小球的个数为8×+2=4,根据XeF2的原子个数比知大球是Xe原子,小球是F原子,该晶胞中有2个XeF2分子;由A点坐标知该原子位于晶胞的中心,且每个坐标系的单位长度都记为1,B点在棱的处,其坐标为(0,0,);图中y是底面对角线的一半,y=a pm,x=(-r)pm,所以d== pm。
例5 N、O、Cl 6
解析 [Cr(NH3)3(H2O)2Cl]2+中三价铬离子提供空轨道,N、O、Cl提供孤电子对与三价铬离子形成配位键,中心离子的配位数为N、O、Cl三种原子的个数和,即3+2+1=6。
例6 (2)6 (5)CH3Mn(CO)5+I2―→CH3I+MnI(CO)5
解析 (2)由题干图例所示,HMn(CO)5中Mn原子以配位键连接5个C原子、1个H原子,所以HMn(CO)5中锰原子的配位数为6。(5)根据题目描述,CH3Mn(CO)5与I2交换原子(或原子团),形成新物质,故反应的化学方程式为CH3Mn(CO)5+I2―→CH3I+MnI(CO)5。
1.晶体结构与性质
2.配位键和配合物
3.超分子的重要特征
考向一 晶体结构的分析与计算
例1 [2021·全国甲卷,35(4)]
我国科学家发明了高选择性的二氧化碳加氢合成甲醇的催化剂,其组成为ZnO/ZrO2固溶体。四方ZrO2晶胞如图所示。Zr4+离子在晶胞中的配位数是________,晶胞参数为a pm、a pm、c pm,该晶体密度为____________g·cm-3(写出表达式)。在ZrO2中掺杂少量ZnO后形成的催化剂,化学式可表示为ZnxZr1-xOy,则y=__________________(用x表达)。
例2 [2021·全国乙卷,35(4)]在金属材料中添加AlCr2颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。AlCr2具有体心四方结构,如图所示。处于顶角位置的是________原子。设Cr和Al原子半径分别为rCr和rAl,则金属原子空间占有率为______________% (列出计算表达式)。
例3 [2021·河北,17(7)]分别用、表示H2PO和K+,KH2PO4晶体的四方晶胞如图(a)所示,图(b)、图(c)分别显示的是H2PO、K+在晶胞xz面、yz面上的位置:
①若晶胞底边的边长均为a pm、高为c pm,阿伏加德罗常数的值为NA,晶体的密度为____________g·cm-3(写出表达式)。
②晶胞在x轴方向的投影图为__________(填标号)。
例4 [2021·山东,16(4)]XeF2晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,该晶胞中有________个XeF2分子。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点原子的分数坐标为(,,)。已知Xe—F键长为
r pm,则B点原子的分数坐标为___________;晶胞中A、B间距离d=________pm。
考向二 配合物理论
例5 [2021·全国乙卷,35(2)]三价铬离子能形成多种配位化合物。[Cr(NH3)3(H2O)2Cl]2+ 中提供电子对形成配位键的原子是__________,中心离子的配位数为____________。
例6 [2021·海南,19(2)(5)]金属羰基配位化合物在催化反应中有着重要应用。HMn(CO)5是锰的一种简单羰基配位化合物,其结构示意图如下。
回答问题:
(2)配位化合物中的中心原子配位数是指和中心原子直接成键的原子的数目。HMn(CO)5中锰原子的配位数为________。
(5)CH3Mn(CO)5可看作是HMn(CO)5中的氢原子被甲基取代的产物。CH3Mn(CO)5与I2反应可用于制备CH3I,反应前后锰的配位数不变,CH3Mn(CO)5与I2反应的化学方程式为____________________________________________________________
___________________________________________________________。
体系构建 体验高考
例1 8 2-x
解析 以晶胞中右侧面心的Zr4+为例,同一晶胞中与Zr4+连接最近且等距的O2-数为4,同理可知右侧晶胞中有4个O2-与Zr4+相连,因此Zr4+离子在晶胞中的配位数是4+4=8;1个晶胞中含有4个ZrO2微粒,1个晶胞的质量为m= g,1个晶胞的体积为(a×10-10 cm)×(a×10-10 cm)×(c×10-10 cm)=a2c×10-30 cm3,因此该晶体密度为== g·cm-3;在ZrO2中掺杂少量ZnO后形成的催化剂,化学式可表示为ZnxZr1-xOy,其中Zn元素为+2价,Zr为+4价,O元素为-2价,根据化合物中各元素的化合价代数和为0可知2x+4×(1-x)=2y,解得y=2-x。
例2 Al ×100
解析 已知AlCr2具有体心四方结构,如图所示,灰球个数为8×+1=2,白球个数为8×+2=4,结合化学式AlCr2可知,白球为Cr,灰球为Al,即处于顶角位置的是Al原子。设Cr和Al原子半径分别为rCr和rAl,则金属原子的体积为×4+×2=,故金属原子空间占有率为×100%=×100%。
例3 ① ②B
解析 ①由晶胞结构可知,H2PO位于晶胞的顶角、面上和体心,顶角上有8个、面上有4个、体心有1个,故晶胞中H2PO的数目为8×+4×+1=4;K+位于面上和棱上,面上有6个、棱上4个,故晶胞中K+的数目为6×+4×=4。因此,平均每个晶胞中占有的H2PO和K+的数目均为4,若晶胞底边的边长均为a pm、高为c pm,则晶胞的体积为10-30a2c cm3,阿伏加德罗常数的值为NA,则晶体的密度为 g·cm-3。
②由图(a)、(b)、(c)可知,晶胞在x轴方向的投影图为 。
例4 2 (0,0,)
解析 图中大球的个数为8×+1=2,小球的个数为8×+2=4,根据XeF2的原子个数比知大球是Xe原子,小球是F原子,该晶胞中有2个XeF2分子;由A点坐标知该原子位于晶胞的中心,且每个坐标系的单位长度都记为1,B点在棱的处,其坐标为(0,0,);图中y是底面对角线的一半,y=a pm,x=(-r)pm,所以d== pm。
例5 N、O、Cl 6
解析 [Cr(NH3)3(H2O)2Cl]2+中三价铬离子提供空轨道,N、O、Cl提供孤电子对与三价铬离子形成配位键,中心离子的配位数为N、O、Cl三种原子的个数和,即3+2+1=6。
例6 (2)6 (5)CH3Mn(CO)5+I2―→CH3I+MnI(CO)5
解析 (2)由题干图例所示,HMn(CO)5中Mn原子以配位键连接5个C原子、1个H原子,所以HMn(CO)5中锰原子的配位数为6。(5)根据题目描述,CH3Mn(CO)5与I2交换原子(或原子团),形成新物质,故反应的化学方程式为CH3Mn(CO)5+I2―→CH3I+MnI(CO)5。
