第三章第三节 金属晶体与离子晶体 第3课时 常见晶体结构的比较与分析 晶体结构的计算 学案(含答案)
文档属性
| 名称 | 第三章第三节 金属晶体与离子晶体 第3课时 常见晶体结构的比较与分析 晶体结构的计算 学案(含答案) |
|
|
| 格式 | docx | ||
| 文件大小 | 840.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-11-30 00:00:00 | ||
图片预览


文档简介
第3课时 常见晶体结构的比较与分析 晶体结构的计算
[核心素养发展目标] 1.熟知共价、分子、离子晶体的典型代表的结构。2.学会晶体结构的相关分析。
一、常见晶体结构的比较与分析
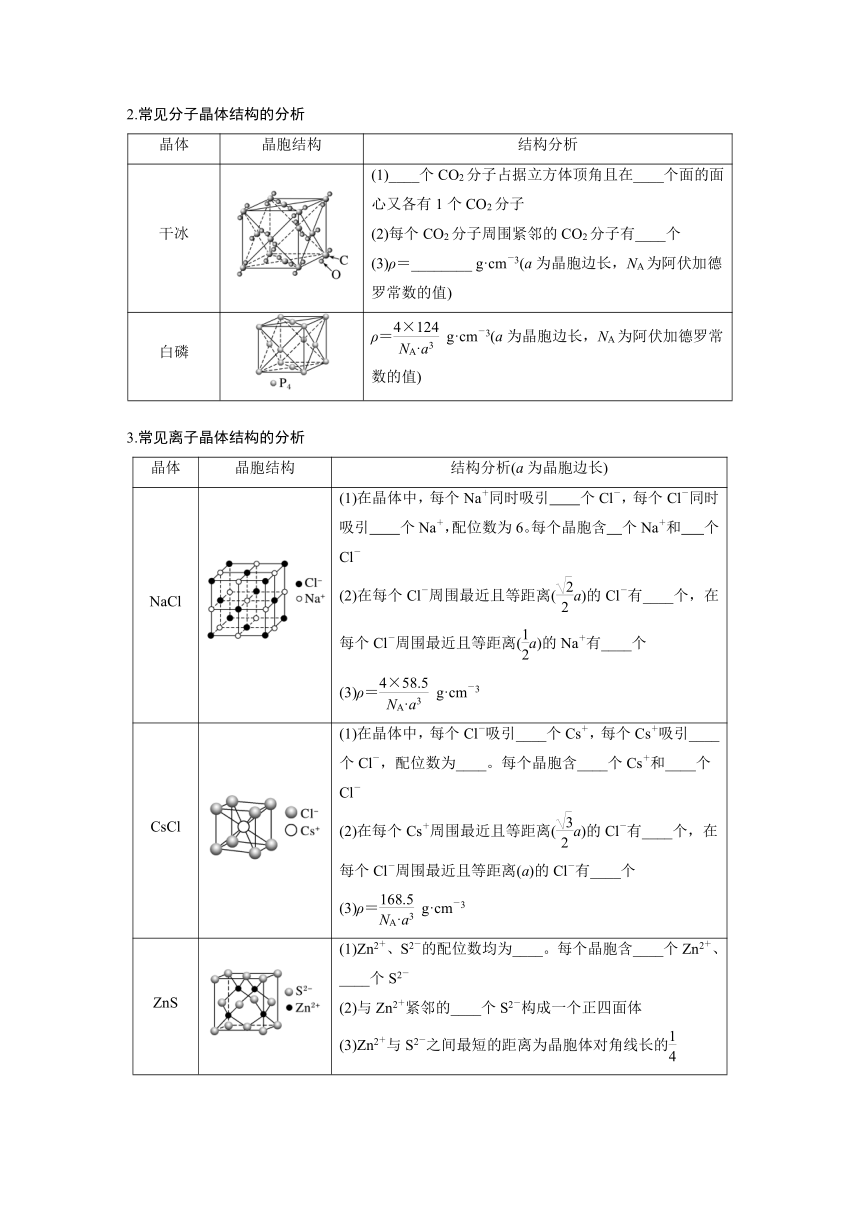
1.常见共价晶体结构的分析
晶体 晶胞结构 结构分析
金刚石 (1)每个C与相邻____个C以共价键结合,形成正四面体结构。每个晶胞中含____个C原子 (2)键角均为________ (3)最小碳环由____个C组成且6个C不在同一平面内,每个C原子被12个六元环共用 (4)每个C参与____个C—C的形成,C原子数与C—C数之比为________ (5)ρ=________ g·cm-3键长=a(a为晶胞边长,NA为阿伏加德罗常数的值)
SiO2 (1)每个Si与____个O以共价键结合,形成正四面体结构 (2)每个正四面体占有1个Si,4个“O”,因此二氧化硅晶体中Si与O的个数比为________ (3)最小环上有____个原子,即____个O,____个Si (4)ρ=________ g·cm-3(a为晶胞边长,NA为阿伏加德罗常数的值)
SiC、BP、AlN (1)每个原子与另外____个不同种类的原子形成________结构 (2)密度:ρ(SiC)=________ g· cm-3; ρ(BP)=________ g·cm-3; ρ(AlN)=________ g· cm-3(a为晶胞边长,NA为阿伏加德罗常数的值)
2.常见分子晶体结构的分析
晶体 晶胞结构 结构分析
干冰 (1)____个CO2分子占据立方体顶角且在____个面的面心又各有1个CO2分子 (2)每个CO2分子周围紧邻的CO2分子有____个 (3)ρ=________ g·cm-3(a为晶胞边长,NA为阿伏加德罗常数的值)
白磷 ρ= g·cm-3(a为晶胞边长,NA为阿伏加德罗常数的值)
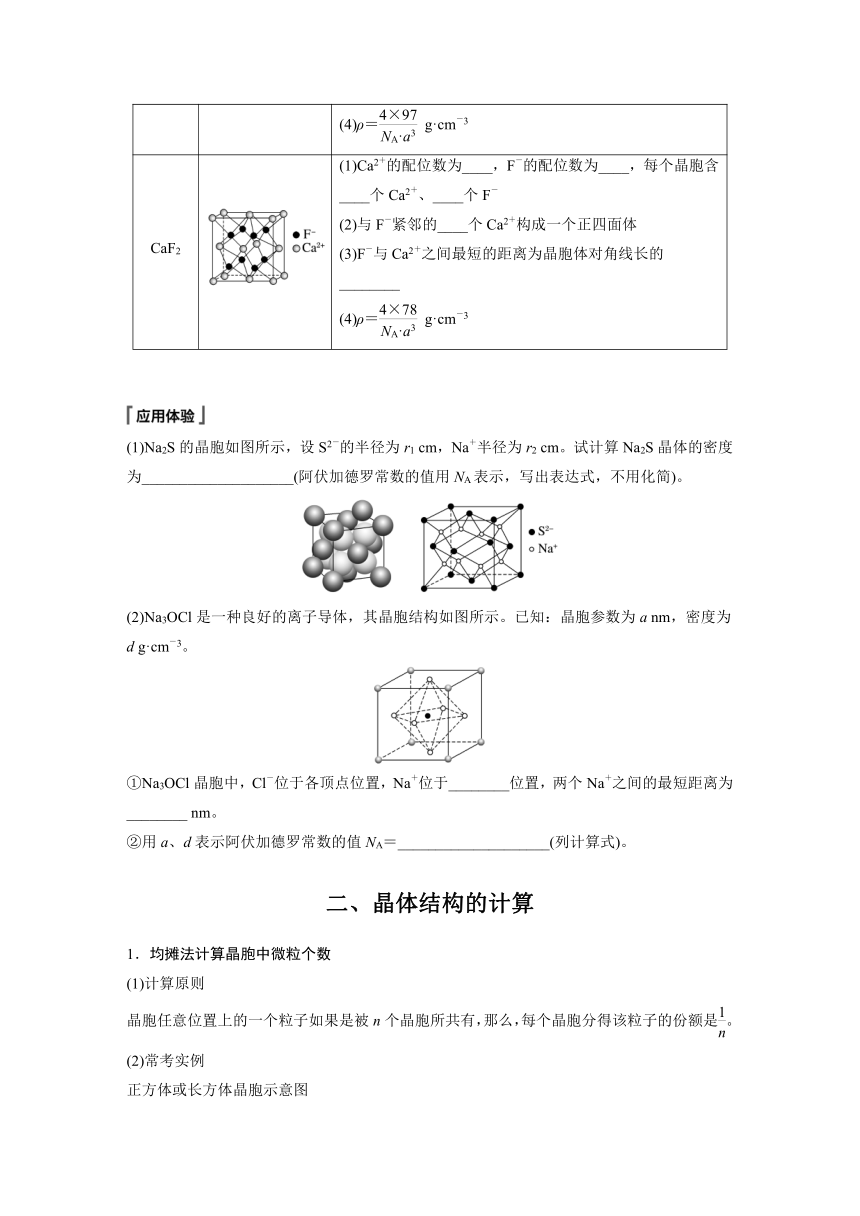
3.常见离子晶体结构的分析
晶体 晶胞结构 结构分析(a为晶胞边长)
NaCl (1)在晶体中,每个Na+同时吸引 个Cl-,每个Cl-同时吸引 个Na+,配位数为6。每个晶胞含 个Na+和 个Cl- (2)在每个Cl-周围最近且等距离(a)的Cl-有____个,在每个Cl-周围最近且等距离(a)的Na+有____个 (3)ρ= g·cm-3
CsCl (1)在晶体中,每个Cl-吸引____个Cs+,每个Cs+吸引____个Cl-,配位数为____。每个晶胞含____个Cs+和____个Cl- (2)在每个Cs+周围最近且等距离(a)的Cl-有____个,在每个Cl-周围最近且等距离(a)的Cl-有____个 (3)ρ= g·cm-3
ZnS (1)Zn2+、S2-的配位数均为____。每个晶胞含____个Zn2+、____个S2- (2)与Zn2+紧邻的____个S2-构成一个正四面体 (3)Zn2+与S2-之间最短的距离为晶胞体对角线长的 (4)ρ= g·cm-3
CaF2 (1)Ca2+的配位数为____,F-的配位数为____,每个晶胞含____个Ca2+、____个F- (2)与F-紧邻的____个Ca2+构成一个正四面体 (3)F-与Ca2+之间最短的距离为晶胞体对角线长的________ (4)ρ= g·cm-3
(1)Na2S的晶胞如图所示,设S2-的半径为r1 cm,Na+半径为r2 cm。试计算Na2S晶体的密度为____________________(阿伏加德罗常数的值用NA表示,写出表达式,不用化简)。
(2)Na3OCl是一种良好的离子导体,其晶胞结构如图所示。已知:晶胞参数为a nm,密度为d g·cm-3。
①Na3OCl晶胞中,Cl-位于各顶点位置,Na+位于________位置,两个Na+之间的最短距离为________ nm。
②用a、d表示阿伏加德罗常数的值NA=____________________(列计算式)。
二、晶体结构的计算
1.均摊法计算晶胞中微粒个数
(1)计算原则
晶胞任意位置上的一个粒子如果是被n个晶胞所共有,那么,每个晶胞分得该粒子的份额是。
(2)常考实例
正方体或长方体晶胞示意图
微粒位置 顶点 面上 棱上 内部
侧棱 上下棱
共用该微粒的晶胞数 8 2 4 4 1
每个晶胞分摊的微粒数 1
正六棱柱晶胞示意图
微粒位置 顶点 面上 棱上 内部
侧棱 上下棱
共用该微粒的晶胞数 6 2 3 4 1
每个晶胞分摊的微粒数 1
(3)审题时一定要注意是“分子结构”还是“晶体结构”,若是分子结构,其化学式由图中所有实际存在的原子个数决定,原子个数比不约简。
(4)计算晶胞中微粒的数目,进而求化学式
根据均摊法计算出一个晶胞中所含微粒数目,求出晶胞所含微粒个数的最简整数比,从而写出晶体的化学式。
2.原子分数坐标的确定方法
(1)依据已知原子的坐标确定坐标系取向。
(2)一般以坐标轴所在正方体的棱长为1个单位。
(3)从原子所在位置分别向x、y、z轴作垂线,所得坐标轴上的截距即为该原子的分数坐标。
如位于晶胞原点(顶点)的原子的分数坐标为(0,0,0);位于晶胞体心的原子的分数坐标为(,,);位于xOz面心的原子的分数坐标为(,0,)等(如图所示)。
3.晶体密度的计算
(1)晶体密度:
ρ==
(2)1个微粒的质量:m=(M为摩尔质量,NA为阿伏加德罗常数)
(3)晶胞的体积:
V=a3(立方体)=abc(长方体)
4.金属晶体中原子间距离和晶胞参数
(1)思维流程
根据密度求晶胞中原子之间的距离时,可首先由密度计算出晶胞体积(晶胞质量由晶胞含有的微粒数计算),再根据晶胞结构判断微粒间距与棱长的关系。
(2)立方晶胞参数a计算公式
a=
5.金属晶体中原子空间利用率
(1)思维流程
空间利用率是指构成晶体的原子在整个晶体空间中所占有的体积百分比,首先分析晶胞中原子个数和原子半径,计算出晶胞中所有原子的体积,其次根据立体几何知识计算出晶胞的棱长,计算出晶胞的体积,即可顺利解答此类问题。
(2)计算公式
空间利用率=×100%
CaF2的晶胞为立方晶胞,结构如下图所示:
(1)CaF2晶胞中,Ca2+的配位数为__________。
(2)“原子坐标参数”可表示晶胞内部各原子的相对位置,已知A、B两点的原子坐标参数如图所示,则C点的原子坐标参数为(______,______,)。
(3)晶胞中两个F-的最近距离为273.1 pm,用NA表示阿伏加德罗常数的值,则晶胞的密度为
________________________________________________________________________g·cm-3
(列出计算式即可)。
1.AB型化合物形成的晶体结构多种多样。如图所示的几种结构所表示的物质最有可能是分子晶体的是( )
A.①③ B.②⑤
C.⑤⑥ D.③④⑤⑥
2.金属晶体钠的晶胞如图所示,下列关于钠晶体的判断合理的是( )
A.其熔点比金属铝的熔点高
B.一个钠的晶胞中,平均含有4个钠原子
C.该晶体中的自由电子在外加电场作用下可发生定向移动
D.该晶体中的钠离子在外加电场的作用下可发生定向移动
3.(2022·云南昆明一中高二期中)在下列离子晶体的空间结构示意图中,代表阳离子,?代表阴离子。若M代表阳离子,N代表阴离子,则化学式为MN2的晶体结构是( )
4.(2022·山东高二期中)磷化硼(BP)是一种半导体材料,熔点:1 100 ℃,其结构与氮化硼相似,晶胞结构如图1,下列说法正确的是( )
A.熔点:BP>BN
B.晶体中P周围距离最近且相等的P有8个
C.若图中①处磷原子坐标为(0,0,0),则②处的B原子坐标为(,,)
D.磷化硼晶胞在y轴方向的投影图为图2
第3课时 常见晶体结构的比较与分析
晶体结构的计算
一、
1.4 8 109°28′ 6 4 1∶2 4 1∶2 12 6
6 4 正四面体
2.8 6 12
3.6 6 4 4 12 6 8 8 8 1 1 8 6 4 4 4 4
8 4 4 8 4
应用体验
(1) g·cm-3
(2)①面心 a ②
解析 (1)在每个晶胞中含有Na+的数目为8,S2-的数目为8×+6×=4,由题图可知,晶胞的体对角线为4(r1+r2) cm,则晶胞的边长为(r1+r2) cm,晶胞的密度ρ== g·cm-3。(2)①1个Na3OCl晶胞中白球个数为6×=3,灰球个数为8×=1,黑球个数为1,根据Na3OCl的化学式,可判断Na+应为白球,处在晶胞结构的面心,Na+之间的最短距离为晶体结构中两个面心的距离,即a nm。②已知:晶胞参数为a nm,密度为d g·cm-3,则d g·cm-3=,解得NA=。
二、
应用体验
(1)8 (2) (3)
解析 (1)以面心Ca2+为研究对象,在一个晶胞中连接4个F-,通过该Ca2+可形成2个晶胞,所以与该Ca2+距离相等且最近的F-共有8个,因此Ca2+的配位数是8。
(3)根据晶胞结构可知,在一个晶胞中含有Ca2+的个数:×8+×6=4,含有F-的个数:1×8=8,即一个晶胞中含有4个CaF2,根据C点的坐标可知:晶胞中F-之间的距离为晶胞边长的一半,所以晶胞参数L=2×273.1 pm=546.2 pm,则该晶胞的密度为
ρ== g·cm-3。
随堂演练 知识落实
1.B 2.C
3.B [A项,阳离子位于顶角和面心,晶胞中平均含有阳离子的数目为8×+6×=4,阴离子位于体心,晶胞中含有的阴离子数目为1,故该晶胞中阳离子和阴离子的个数比为4∶1,化学式为M4N,错误;B项,阳离子位于顶角,晶胞中平均含有阳离子的数目为4×=,阴离子位于体心,晶胞中含有的阴离子数目为1,故该晶胞中阳离子和阴离子的个数比为∶1=1∶2,化学式为MN2,正确;C项,阳离子位于顶角,晶胞中平均含有阳离子的数目为3×=,阴离子位于体心,晶胞中含有的阴离子数目为1,故该晶胞中阳离子和阴离子的个数比为∶1=3∶8,化学式为M3N8,错误;D项,阳离子位于顶角,晶胞中平均含有阳离子的数目为8×=1,阴离子位于体心,晶胞中含有的阴离子数目为1,故该晶胞中阳离子和阴离子的个数比为1∶1,化学式为MN,错误。]
4.D [磷化硼(BP)结构与氮化硼相似,均为共价晶体,N原子半径小,B—N键长短,键能大,故BN熔点高,A错误;若图中①处磷原子坐标为(0,0,0),将晶胞均分为8个小立方体,则②处的B原子在前左下角小立方体体心的位置,坐标为(,,),C错误;磷化硼晶胞中顶角和面心全部为P原子,在y轴方向的投影落在顶角和棱心;4个小立方体体心位置为B原子,在y轴方向的投影均匀落在内部,在y轴方向的投影图为图2,D正确。]
[核心素养发展目标] 1.熟知共价、分子、离子晶体的典型代表的结构。2.学会晶体结构的相关分析。
一、常见晶体结构的比较与分析
1.常见共价晶体结构的分析
晶体 晶胞结构 结构分析
金刚石 (1)每个C与相邻____个C以共价键结合,形成正四面体结构。每个晶胞中含____个C原子 (2)键角均为________ (3)最小碳环由____个C组成且6个C不在同一平面内,每个C原子被12个六元环共用 (4)每个C参与____个C—C的形成,C原子数与C—C数之比为________ (5)ρ=________ g·cm-3键长=a(a为晶胞边长,NA为阿伏加德罗常数的值)
SiO2 (1)每个Si与____个O以共价键结合,形成正四面体结构 (2)每个正四面体占有1个Si,4个“O”,因此二氧化硅晶体中Si与O的个数比为________ (3)最小环上有____个原子,即____个O,____个Si (4)ρ=________ g·cm-3(a为晶胞边长,NA为阿伏加德罗常数的值)
SiC、BP、AlN (1)每个原子与另外____个不同种类的原子形成________结构 (2)密度:ρ(SiC)=________ g· cm-3; ρ(BP)=________ g·cm-3; ρ(AlN)=________ g· cm-3(a为晶胞边长,NA为阿伏加德罗常数的值)
2.常见分子晶体结构的分析
晶体 晶胞结构 结构分析
干冰 (1)____个CO2分子占据立方体顶角且在____个面的面心又各有1个CO2分子 (2)每个CO2分子周围紧邻的CO2分子有____个 (3)ρ=________ g·cm-3(a为晶胞边长,NA为阿伏加德罗常数的值)
白磷 ρ= g·cm-3(a为晶胞边长,NA为阿伏加德罗常数的值)
3.常见离子晶体结构的分析
晶体 晶胞结构 结构分析(a为晶胞边长)
NaCl (1)在晶体中,每个Na+同时吸引 个Cl-,每个Cl-同时吸引 个Na+,配位数为6。每个晶胞含 个Na+和 个Cl- (2)在每个Cl-周围最近且等距离(a)的Cl-有____个,在每个Cl-周围最近且等距离(a)的Na+有____个 (3)ρ= g·cm-3
CsCl (1)在晶体中,每个Cl-吸引____个Cs+,每个Cs+吸引____个Cl-,配位数为____。每个晶胞含____个Cs+和____个Cl- (2)在每个Cs+周围最近且等距离(a)的Cl-有____个,在每个Cl-周围最近且等距离(a)的Cl-有____个 (3)ρ= g·cm-3
ZnS (1)Zn2+、S2-的配位数均为____。每个晶胞含____个Zn2+、____个S2- (2)与Zn2+紧邻的____个S2-构成一个正四面体 (3)Zn2+与S2-之间最短的距离为晶胞体对角线长的 (4)ρ= g·cm-3
CaF2 (1)Ca2+的配位数为____,F-的配位数为____,每个晶胞含____个Ca2+、____个F- (2)与F-紧邻的____个Ca2+构成一个正四面体 (3)F-与Ca2+之间最短的距离为晶胞体对角线长的________ (4)ρ= g·cm-3
(1)Na2S的晶胞如图所示,设S2-的半径为r1 cm,Na+半径为r2 cm。试计算Na2S晶体的密度为____________________(阿伏加德罗常数的值用NA表示,写出表达式,不用化简)。
(2)Na3OCl是一种良好的离子导体,其晶胞结构如图所示。已知:晶胞参数为a nm,密度为d g·cm-3。
①Na3OCl晶胞中,Cl-位于各顶点位置,Na+位于________位置,两个Na+之间的最短距离为________ nm。
②用a、d表示阿伏加德罗常数的值NA=____________________(列计算式)。
二、晶体结构的计算
1.均摊法计算晶胞中微粒个数
(1)计算原则
晶胞任意位置上的一个粒子如果是被n个晶胞所共有,那么,每个晶胞分得该粒子的份额是。
(2)常考实例
正方体或长方体晶胞示意图
微粒位置 顶点 面上 棱上 内部
侧棱 上下棱
共用该微粒的晶胞数 8 2 4 4 1
每个晶胞分摊的微粒数 1
正六棱柱晶胞示意图
微粒位置 顶点 面上 棱上 内部
侧棱 上下棱
共用该微粒的晶胞数 6 2 3 4 1
每个晶胞分摊的微粒数 1
(3)审题时一定要注意是“分子结构”还是“晶体结构”,若是分子结构,其化学式由图中所有实际存在的原子个数决定,原子个数比不约简。
(4)计算晶胞中微粒的数目,进而求化学式
根据均摊法计算出一个晶胞中所含微粒数目,求出晶胞所含微粒个数的最简整数比,从而写出晶体的化学式。
2.原子分数坐标的确定方法
(1)依据已知原子的坐标确定坐标系取向。
(2)一般以坐标轴所在正方体的棱长为1个单位。
(3)从原子所在位置分别向x、y、z轴作垂线,所得坐标轴上的截距即为该原子的分数坐标。
如位于晶胞原点(顶点)的原子的分数坐标为(0,0,0);位于晶胞体心的原子的分数坐标为(,,);位于xOz面心的原子的分数坐标为(,0,)等(如图所示)。
3.晶体密度的计算
(1)晶体密度:
ρ==
(2)1个微粒的质量:m=(M为摩尔质量,NA为阿伏加德罗常数)
(3)晶胞的体积:
V=a3(立方体)=abc(长方体)
4.金属晶体中原子间距离和晶胞参数
(1)思维流程
根据密度求晶胞中原子之间的距离时,可首先由密度计算出晶胞体积(晶胞质量由晶胞含有的微粒数计算),再根据晶胞结构判断微粒间距与棱长的关系。
(2)立方晶胞参数a计算公式
a=
5.金属晶体中原子空间利用率
(1)思维流程
空间利用率是指构成晶体的原子在整个晶体空间中所占有的体积百分比,首先分析晶胞中原子个数和原子半径,计算出晶胞中所有原子的体积,其次根据立体几何知识计算出晶胞的棱长,计算出晶胞的体积,即可顺利解答此类问题。
(2)计算公式
空间利用率=×100%
CaF2的晶胞为立方晶胞,结构如下图所示:
(1)CaF2晶胞中,Ca2+的配位数为__________。
(2)“原子坐标参数”可表示晶胞内部各原子的相对位置,已知A、B两点的原子坐标参数如图所示,则C点的原子坐标参数为(______,______,)。
(3)晶胞中两个F-的最近距离为273.1 pm,用NA表示阿伏加德罗常数的值,则晶胞的密度为
________________________________________________________________________g·cm-3
(列出计算式即可)。
1.AB型化合物形成的晶体结构多种多样。如图所示的几种结构所表示的物质最有可能是分子晶体的是( )
A.①③ B.②⑤
C.⑤⑥ D.③④⑤⑥
2.金属晶体钠的晶胞如图所示,下列关于钠晶体的判断合理的是( )
A.其熔点比金属铝的熔点高
B.一个钠的晶胞中,平均含有4个钠原子
C.该晶体中的自由电子在外加电场作用下可发生定向移动
D.该晶体中的钠离子在外加电场的作用下可发生定向移动
3.(2022·云南昆明一中高二期中)在下列离子晶体的空间结构示意图中,代表阳离子,?代表阴离子。若M代表阳离子,N代表阴离子,则化学式为MN2的晶体结构是( )
4.(2022·山东高二期中)磷化硼(BP)是一种半导体材料,熔点:1 100 ℃,其结构与氮化硼相似,晶胞结构如图1,下列说法正确的是( )
A.熔点:BP>BN
B.晶体中P周围距离最近且相等的P有8个
C.若图中①处磷原子坐标为(0,0,0),则②处的B原子坐标为(,,)
D.磷化硼晶胞在y轴方向的投影图为图2
第3课时 常见晶体结构的比较与分析
晶体结构的计算
一、
1.4 8 109°28′ 6 4 1∶2 4 1∶2 12 6
6 4 正四面体
2.8 6 12
3.6 6 4 4 12 6 8 8 8 1 1 8 6 4 4 4 4
8 4 4 8 4
应用体验
(1) g·cm-3
(2)①面心 a ②
解析 (1)在每个晶胞中含有Na+的数目为8,S2-的数目为8×+6×=4,由题图可知,晶胞的体对角线为4(r1+r2) cm,则晶胞的边长为(r1+r2) cm,晶胞的密度ρ== g·cm-3。(2)①1个Na3OCl晶胞中白球个数为6×=3,灰球个数为8×=1,黑球个数为1,根据Na3OCl的化学式,可判断Na+应为白球,处在晶胞结构的面心,Na+之间的最短距离为晶体结构中两个面心的距离,即a nm。②已知:晶胞参数为a nm,密度为d g·cm-3,则d g·cm-3=,解得NA=。
二、
应用体验
(1)8 (2) (3)
解析 (1)以面心Ca2+为研究对象,在一个晶胞中连接4个F-,通过该Ca2+可形成2个晶胞,所以与该Ca2+距离相等且最近的F-共有8个,因此Ca2+的配位数是8。
(3)根据晶胞结构可知,在一个晶胞中含有Ca2+的个数:×8+×6=4,含有F-的个数:1×8=8,即一个晶胞中含有4个CaF2,根据C点的坐标可知:晶胞中F-之间的距离为晶胞边长的一半,所以晶胞参数L=2×273.1 pm=546.2 pm,则该晶胞的密度为
ρ== g·cm-3。
随堂演练 知识落实
1.B 2.C
3.B [A项,阳离子位于顶角和面心,晶胞中平均含有阳离子的数目为8×+6×=4,阴离子位于体心,晶胞中含有的阴离子数目为1,故该晶胞中阳离子和阴离子的个数比为4∶1,化学式为M4N,错误;B项,阳离子位于顶角,晶胞中平均含有阳离子的数目为4×=,阴离子位于体心,晶胞中含有的阴离子数目为1,故该晶胞中阳离子和阴离子的个数比为∶1=1∶2,化学式为MN2,正确;C项,阳离子位于顶角,晶胞中平均含有阳离子的数目为3×=,阴离子位于体心,晶胞中含有的阴离子数目为1,故该晶胞中阳离子和阴离子的个数比为∶1=3∶8,化学式为M3N8,错误;D项,阳离子位于顶角,晶胞中平均含有阳离子的数目为8×=1,阴离子位于体心,晶胞中含有的阴离子数目为1,故该晶胞中阳离子和阴离子的个数比为1∶1,化学式为MN,错误。]
4.D [磷化硼(BP)结构与氮化硼相似,均为共价晶体,N原子半径小,B—N键长短,键能大,故BN熔点高,A错误;若图中①处磷原子坐标为(0,0,0),将晶胞均分为8个小立方体,则②处的B原子在前左下角小立方体体心的位置,坐标为(,,),C错误;磷化硼晶胞中顶角和面心全部为P原子,在y轴方向的投影落在顶角和棱心;4个小立方体体心位置为B原子,在y轴方向的投影均匀落在内部,在y轴方向的投影图为图2,D正确。]
