化学人教版(2019)选择性必修1 3.4.3沉淀溶解平衡的应用(共41张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 3.4.3沉淀溶解平衡的应用(共41张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 35.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-01 13:00:46 | ||
图片预览








文档简介
(共41张PPT)
第3课时
沉淀溶解平衡的应用
1、通过实验了解沉淀的生成、溶解与转化,能应用化学平衡理论解释沉淀的生成、溶解和转化。
2、学会通过比较Q与Ksp的大小判断难溶电解质的沉淀与溶解,学会从定量角度分析沉淀的生成与转化。
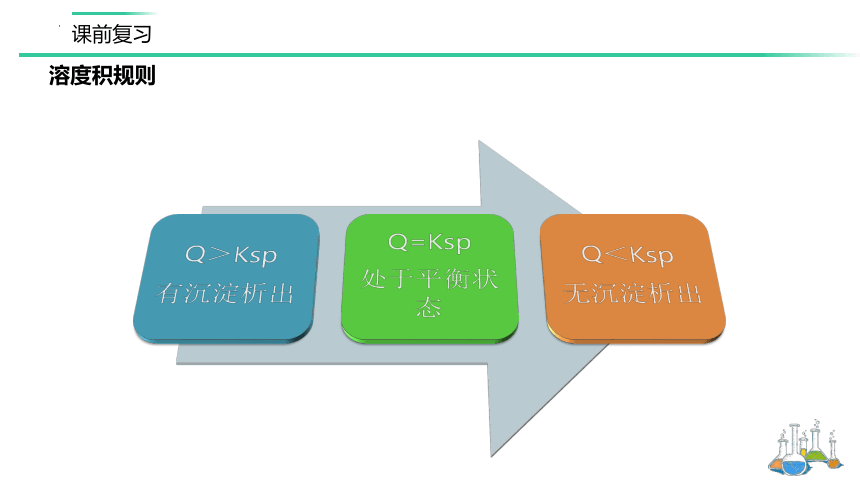
溶度积规则
难溶电解质的沉淀溶解平衡是动态平衡,我们可以通过改变条件,使平衡向着需要的方向移动。
1、溶液中离子转化为沉淀——沉淀的生成。
2、沉淀转化为溶液中离子——沉淀的溶解。
3、一种沉淀转化为另一种沉淀——沉淀的转化。
生成难溶电解质的沉淀,是工业生产、环保工程和科学研究中除杂或提纯物质的重要方法之一。
一、沉淀的生成——Q>Ksp
原理:
例1、除去NH4Cl溶液中含有的杂质FeCl3。
1、调pH值法——除某些易水解的金属阳离子。
加入试剂后,消耗H+使Fe3+的水解平衡正向移动。
Fe3++3H2O Fe(OH)3+3H+
试剂:
目的:
NH3·H2O
加入NH3·H2O会消耗Fe3+水解生成的H+,水解平衡向正向移动,即使Fe3+转化为Fe(OH)3而除去。
切忌:前门驱虎,后门引狼
例2、除去MgCl2溶液中的杂质FeCl3。
常加入难溶性的MO、M(OH)2、MCO3等除M2+溶液中易水解的阳离子。
加入MgO会消耗Fe3+水解生成的H+,水解平衡向正向移动,即使Fe3+转化为Fe(OH)3而除去。
加入试剂后,消耗H+使Fe3+的水解平衡正向移动。
Fe3++3H2O Fe(OH)3+3H+
一、沉淀的生成——Q>Ksp
MgO
切忌:前门驱虎,后门引狼
1、调pH值法——除某些易水解的金属阳离子。
原理:
试剂:
目的:
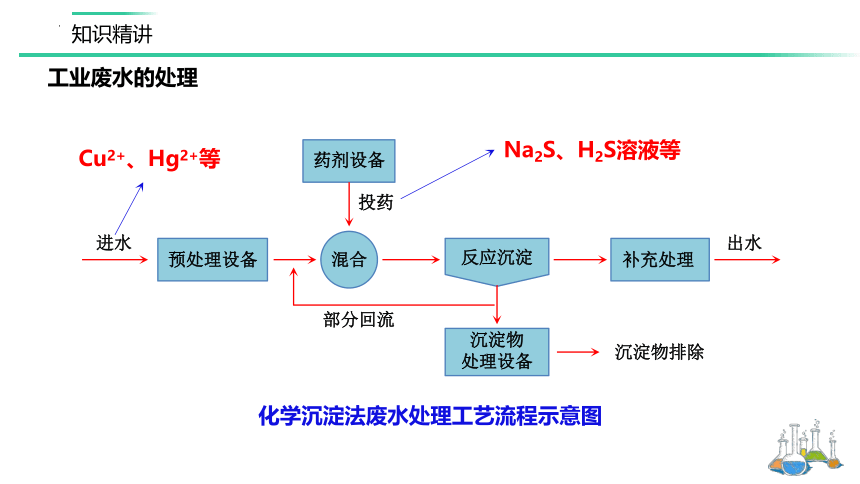
进水
预处理设备
混合
投药
药剂设备
部分回流
沉淀物
处理设备
沉淀物排除
反应沉淀
补充处理
出水
化学沉淀法废水处理工艺流程示意图
Na2S、H2S溶液等
Cu2+、Hg2+等
工业废水的处理
2、加沉淀剂法——生成极难溶的沉淀。
例3、工业废水中的金属离子Cu2+、Hg2+,如何除去?
一、沉淀的生成——Q>Ksp
离子方程式:
Na2S或H2S溶液
试剂:
Cu2++H2S=CuS↓+2H+
Cu2++S2-=CuS↓
Hg2++H2S=HgS↓+2H+
Hg2++S2-=HgS↓
思考与讨论
利用生成沉淀分离或除去某种离子,首先要使生成沉淀的反应能够发生;其次希望沉淀反应完成后,溶液中剩余离子的浓度能够尽量小。
2、如何使沉淀反应完成后,溶液中剩余离子的浓度能够尽量小?
1、如果要除去某溶液中的SO42-,你选择加入钙盐还钡盐?为什么?
增大所用沉淀剂的浓度。
在实际应用中,常常会遇到使难溶物质溶解的问题。根据平衡移动原理,对于在水中难溶电解质,如果想办法移去平衡体系中的离子,使平衡向沉淀溶解的方向移动,就可以使沉淀溶解。
加入钡盐。因为Ksp(BaSO4)>Ksp(CaSO4),向溶液中加入等物质的量的钡盐和钙盐,钡盐使溶液中剩余的c(SO42-)较小。
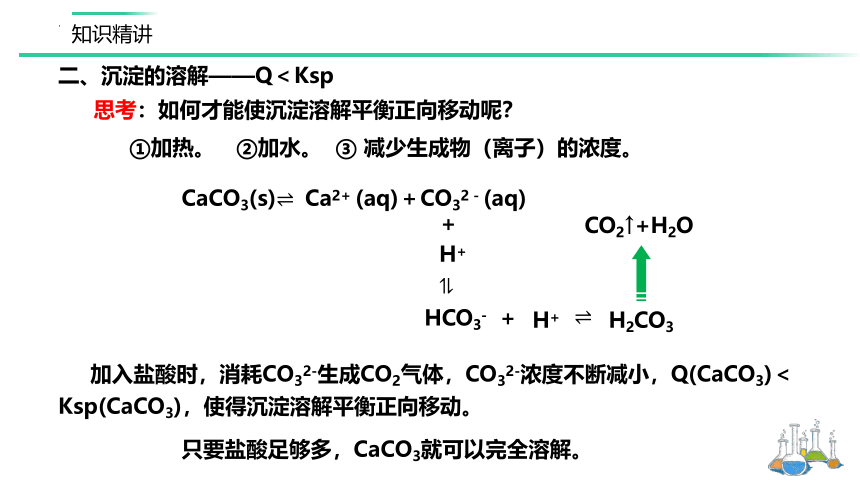
思考:如何才能使沉淀溶解平衡正向移动呢?
①加热。
②加水。
③ 减少生成物(离子)的浓度。
CaCO3(s)Ca2+ (aq)+CO32-(aq)
加入盐酸时,消耗CO32-生成CO2气体,CO32-浓度不断减小,Q(CaCO3)<Ksp(CaCO3),使得沉淀溶解平衡正向移动。
只要盐酸足够多,CaCO3就可以完全溶解。
H+
+
HCO3-
+
H+
H2CO3
CO2↑+H2O
二、沉淀的溶解——Q<Ksp
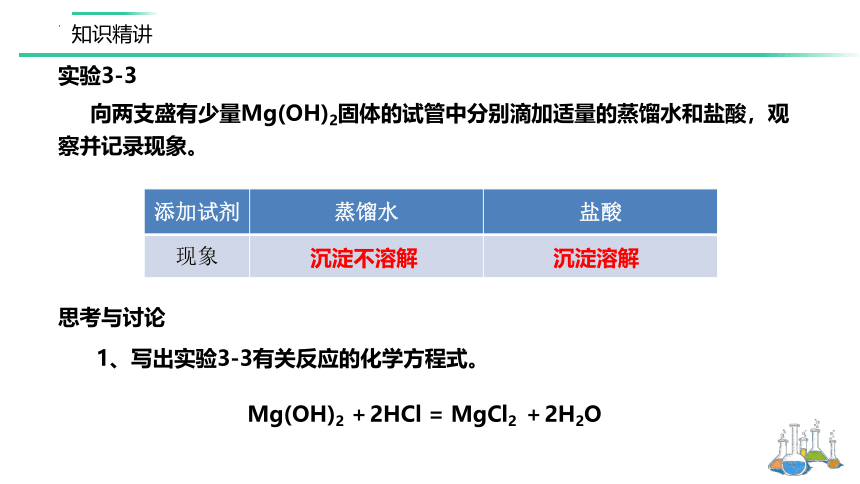
实验3-3
实验3-3
向两支盛有少量Mg(OH)2固体的试管中分别滴加适量的蒸馏水和盐酸,观察并记录现象。
添加试剂 蒸馏水 盐酸
现象
思考与讨论
1、写出实验3-3有关反应的化学方程式。
沉淀不溶解
沉淀溶解
Mg(OH)2 +2HCl = MgCl2 +2H2O
2、运用平衡移动原理分析、解释实验3-3发生的反应。
Mg(OH)2 (s)Mg2+ (aq)+2OH-(aq)
=
2H+
+
2H2O
加入盐酸时,消耗OH-生成H2O,OH-浓度不断减小,Q[Mg(OH)2]<Ksp[Mg(OH)2],使得沉淀溶解平衡正向移动。
3、除加水和盐酸外,你还有其他方法使Mg(OH)2沉淀溶解吗?
加热、加氯化铵溶液
思考与讨论
A、NH4NO3 B、NaOH C、MgSO4 D、Na2SO4
例4、当氢氧化镁固体在水中达到沉淀溶解平衡:Mg(OH)2(s) Mg2+(aq)+2OH-(aq)时,为使Mg(OH)2固体的量减少,需加入少量的( )
A
在实际应用中,有时需要将一种沉淀转化为另一种沉淀。那么,在什么条件下能够实现沉淀的转化呢?
实验3-4
1、向盛有2 mL 0.1 mol/L NaCl溶液的试管中滴加2滴0.1 mol/L AgNO3溶液,观察并记录现象。
2、振荡试管,然后向其中滴加4滴0.1 mol/L KI溶液,观察并记录现象。
3、振荡试管,然后向其中滴加8滴0.1 mol/L Na2S溶液,观察并记录现象。
步骤 1 2 3
现象
实验3-4
实验3-4
1、向盛有2 mL 0.1 mol/L NaCl溶液的试管中滴加2滴0.1 mol/L AgNO3溶液,观察并记录现象。
2、振荡试管,然后向其中滴加4滴0.1 mol/L KI溶液,观察并记录现象。
3、振荡试管,然后向其中滴加8滴0.1 mol/L Na2S溶液,观察并记录现象。
步骤 1 2 3
现象
白色沉淀
白色沉淀转化为黄色沉淀
黄色沉淀转化为黑色沉淀
思考与讨论
2、过量的NaCl溶液与少量的AgNO3溶液反应后,溶液中是否还存在Ag+?
3、向上述溶液中再滴加KI溶液,生成的黄色沉淀AgI中的Ag+从何而来?
√
AgCl(s)Ag+ (aq)+Cl-(aq)
1、AgCl与NaI溶液会发生反应吗?AgI与Na2S溶液呢
AgCl(s) + I- (aq) AgI(s) + Cl-(aq)
2AgI(s) + S2-(aq) Ag2S(s) + l-(aq)
当向AgCl沉淀中滴加入KI溶液时,溶液中 Q[AgI]>Ksp[AgI] ,因此生成Agl沉淀,使AgCl的沉淀溶解平衡正向移动。
4、AgCl的溶解度很小,溶液中Ag+的量很少,生成AgI的量应该也很少,为什么产生大量黄色AgI沉淀?
AgCl(s)Ag+ (aq)+Cl-(aq)
I- (aq)
+
AgI (s)
思考与讨论
难溶向更难溶转化
Ksp[AgCl]=1.8×10-10
Ksp[Agl]=8.5×10-17
>>
溶解性:
Agl比AgCl更难溶
思考与讨论
5、向试管中再加入Na2S溶液,为什么会有黑色沉淀生成?
Agl(s)Ag+ (aq)+l-(aq)
Ksp[Ag2S]=6.3×10-50
Ksp[Agl]=8.5×10-17
S[Ag2S]=1.3×10-16g
S[Agl]=2.1×10-7g
2Ag+ (aq) + S2- (aq) Ag2S(s)
溶解性:
Ag2S比Agl更难溶
当向Agl沉淀中滴加入Na2S溶液时,溶液中Q[Ag2S]>Ksp[Ag2S],因此生成Ag2S沉淀,使Agl的沉淀溶解平衡正向移动。
>>
不能直接判断
溶解度
2Agl(s) + S2-(aq) Ag2S(s) + 2l-(aq)
AgCl(s) + I-(aq)AgI(s) + 2Cl-(aq)
6、根据溶解度和Ksp来思考,沉淀间的转化有什么规律?
思考与讨论
S=1.5×10-4g
S=3.7×10-7g
S=1.3×10-16g
AgCl
白色
Agl
黄色
Ag2S
黑色
溶解度小的沉淀向溶解度更小的沉淀更易转化。
简言之,微溶向难溶、难溶向更难溶转化。
实验3-5
1、向盛有2 mL 0.1 mol/L MgCl2溶液的试管中滴加2 4滴2 mol/L NaOH溶液,观察并记录现象。
2、向上述试管中滴加4滴0.1 mol/L FeCl3溶液,静置,观察并记录现象。
步骤 1 2
现象
白色沉淀
白色沉淀转化为红褐色沉淀
实验3-5
三、沉淀的转化
1、微溶向难溶转化,难溶向更难溶转化。
AgCl(s)+Br-(aq)AgBr(s)+Cl-(aq)
由上可知,微溶向难溶、难溶向更难溶转化是非常容易实现的。
K=
c(Cl-)
c(Br-)
=
Ksp(AgCl)
Ksp(AgBr)
已知:25℃ Ksp(AgCl)=1.8×10-10,Ksp(AgBr)=5.0×10-13
=
1.8×10-10
5.0×10-13
360
1
=
当Q<K时,平衡正向移动。
1
360
>
c(Br-)
c(Cl-)
即
2、难溶向较难溶转化。
BaSO4(s)+CO32-(aq) BaCO3(s)+SO42- (aq)
已知:25℃ Ksp(BaSO4)=1.07×10-10,Ksp(BaCO3)=2.58×10-9
由上可知,只要c(CO32-)是c(SO42-)的25倍以上,经多次转化,还是能将BaSO4沉淀转化为BaCO3沉淀,只不过CO32-要足够多才能实现。
三、沉淀的转化
K=
=
1.07×10-10
2.58×10-9
c(SO42-)
c(CO32-)
Ksp(BaSO4)
Ksp(BaCO3)
=
=
1
25
当Q<K时,平衡正向移动。
>25
c(CO32-)
c(SO42-)
即
例5、已知:Ksp(ZnS)>Ksp(CuS),在有白色固体ZnS存在的饱和溶液中滴加适量CuSO4溶液,产生的实验现象是 ( )
A、固体逐渐溶解,最后消失 B、固体由白色变为黑色
C、固体颜色变化但质量不变 D、固体逐渐增多,但颜色不变
B
思考与讨论
1、如何去除水垢中的CaSO4?
难溶物 CaSO4 CaCO3
溶解度/g 2.1×10-1 1.5 ×10-3
水垢成分
CaCO3、CaSO4
Mg(OH)2
疏松的水垢
CaCO3
Mg(OH)2
除去
水垢
用饱和Na2CO3
溶液浸泡数天
用盐酸或
饱和氯化铵液
CaSO4(s) Ca2+(aq) +SO42-(aq)
CaSO4(s) +CO32- (aq) CaCO3(s) +SO42- (aq)
CaCO3+2H+=Ca2++CO2↑+H2O
Mg(OH)2+2H+=Mg2++2H2O
CO32-(aq)
CaCO3(s)
+
渗透、遇闪锌矿(ZnS)和方铅矿(PbS)
思考与讨论
2、如何解释自然界中矿物的转化?
CuSO4(aq)+ZnS(s) CuS(s)+ZnSO4(aq)
CuSO4(aq)+PbS(s) CuS(s)+PbSO4(aq)
原生铜的硫化物
CuSO4(aq)
铜蓝(CuS)
氧化、淋滤
+
H2O+CO2
2HCO3-
思考与讨论
3、你知道溶洞是怎么形成的吗?
CaCO3(s) Ca2+(aq) + CO32-(aq)
+ Ca2+ CaCO3 + CO2 + H2O
溶有碳酸氢钙的水从溶洞顶向溶洞底滴落时,水分蒸发,二氧化碳压强减小以及温度的变化都会使二氧化碳溶解度减小而析出碳酸钙沉淀。这些沉淀经过千百万年的积聚,渐渐形成了钟乳石、石笋等。
生活中的应用:龋齿的形成原因及防治方法
1、牙齿表面由一层硬的组成为Ca5(PO4)3OH的物质保护着,它在唾液中存在下列平衡:
进食后,细菌和酶作用于食物,产生有机酸,这时牙齿就会受到腐蚀,其原因是发酵生成的有机酸能中和OH-,使平衡向脱矿方向移动,加速腐蚀牙齿。
Ca5(PO4)3OH(s) 5Ca2+(aq)+3PO43-(aq)+OH-(aq) Ksp=2.5×10-59
2、已知Ca5(PO4)3F的Ksp=2.8×10-61,比Ca5(PO4)3OH更难溶,牙膏里的氟离子会与Ca5(PO4)3OH反应生成Ca5(PO4)3F。请用离子方程式表示使用含氟牙膏防止龋齿的原因。
5Ca2+ + 3PO43- + F-= Ca5(PO4)3F
更难溶沉淀
难溶
沉淀
离子
1、调pH值
2、加沉淀剂
减小离子浓度
更难溶——易
较难溶——难
沉淀溶解平衡的应用——平衡的移动
练习1、某pH=1的ZnCl2和HCl的混合溶液中含有FeCl3杂质,为了除去FeCl3杂质,需将溶液调至pH=4。在调节溶液pH时,应选用的试剂是 ( )
A、NaOH B、ZnO C、ZnSO4 D、Fe2O3
B
练习2、在AgCl悬浊液中存在平衡:AgCl(s) Ag+(aq)+Cl-(aq)。已知常温下,Ksp(AgCl)=1.6×10-10。下列叙述中正确的是( )
A、常温下,AgCl悬浊液中c(Cl-)=4×10-5.5 mol·L-1
B、温度不变,向AgCl悬浊液中加入少量NaCl粉末,平衡向左移动,Ksp(AgCl)减小
C、向AgCl悬浊液中加入少量NaBr溶液,白色沉淀转化为淡黄色沉淀,说明Ksp(AgCl)<Ksp(AgBr)
D、常温下,将0.001 mol·L-1 AgNO3溶液与0.001 mol·L-1的KCl溶液等体积混合,无沉淀析出
A
练习3、已知:25 ℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp(MgF2)=7.42×10-11。下列说法正确的是( )
A、25 ℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大
B、25 ℃时,Mg(OH)2的悬浊液加入少量的NH4Cl固体,c(Mg2+)增大
C、25 ℃时,Mg(OH)2固体在20 mL 0.01 mol·L-1氨水中的Ksp比在20 mL 0.01 mol·L-1 NH4Cl溶液中的Ksp小
D、25 ℃时,在Mg(OH)2的悬浊液中加入NaF溶液后,Mg(OH)2不可能转化为MgF2
B
练习4、化工生产中含Cu2+的废水常用MnS(s)作沉淀剂,其反应原理为Cu2+(aq)+MnS(s) CuS(s)+Mn2+(aq)。一定温度下,下列有关该反应的推理正确的是( )
A、该反应达到平衡时:c(Cu2+)=c(Mn2+)
B、平衡体系中加入少量CuS(s)后,c(Mn2+)变小
C、平衡体系中加入少量Cu(NO3)2(s)后,c(Mn2+)变大
D、该反应平衡常数表达式:K=Ksp(CuS)/Ksp(MnS)
C
练习5、工业上常先以MnO2为原料制得粗MnCl2溶液,通过添加过量难溶电解质MnS,使溶液中含有的Cu2+、Pb2+、Cd2+等金属离子形成硫化物沉淀,经过滤除去包括MnS在内的沉淀,再经蒸发、结晶,可得纯净的MnCl2,根据上述实验事实,下列分析正确的是( )
A、MnS的Ksp小于CuS、PbS、CdS等硫化物的Ksp
B、除杂试剂MnS也可用FeS代替
C、MnS与Cu2+反应的离子方程式是Cu2+(aq)+MnS(s) CuS(s)+Mn2+ (aq)
D、整个过程中涉及的反应类型只有复分解反应
C
练习6、要使工业废水中的重金属离子Pb2+沉淀,可用硫酸盐、碳酸盐、硫化物等作沉淀剂,已知Pb2+与这些离子形成的化合物的溶解度如下:
化合物 PbSO4 PbCO3 PbS
溶解度/g 1.03×10-4 1.81×10-7 1.84×10-14
由上述数据可知,选用的沉淀剂最好是( )
A.硫化物 B.硫酸盐 C.碳酸盐 D.以上沉淀剂均可
A
练习7、25 ℃时,已知下列三种金属硫化物的溶度积常数(Ksp)分别为Ksp(FeS)=6.3×10-18;Ksp(CuS)=6.3×10-36;Ksp(ZnS)=1.6×10-24。下列关于常温时的有关叙述正确的是( )
A.硫化锌、硫化铜、硫化亚铁的溶解度依次增大
B.将足量的ZnSO4晶体加入到0.1 mol·L-1的Na2S溶液中,Zn2+的浓度最大只能达到1.6×10-23 mol·L-1
C.除去工业废水中含有的Cu2+,可采用FeS固体作为沉淀剂
D.向饱和的FeS溶液中加入FeSO4溶液后,混合液中c(Fe2+)变大、c(S2-)变小,但Ksp(FeS)变大
C
练习8、25℃时,5种银盐的溶度积常数(Ksp)分别是:
AgCl Ag2SO4 Ag2S AgBr AgI
1.8×10-10 1.4×10-5 6.3×10-50 7.7×10-13 8.51×10-16
下列说法正确的是( )
A.氯化银、溴化银和碘化银的溶解度依次增大
B.将硫酸银溶于水,向其中加入少量硫化钠溶液,不可能得到黑色沉淀
C.在5 mL 1.8×10-5 mol·L-1的NaCl溶液中,加入1滴(1 mL约20滴)0.1 mol·L-1的AgNO3溶液,不能观察到白色沉淀
D.将浅黄色溴化银固体浸泡在饱和氯化钠溶液中,有少量白色固体生成
D
练习9、有以下3个实验:①将0.1 mol/L MgCl2 溶液和0.5 mol/L NaOH 溶液等体积混合得到浊液;
②取少量①中浊液,滴加0.1 mol/L FeCl3 溶液,出现红褐色沉淀;
③将①中浊液过滤,取少量白色沉淀,滴加0.1 mol/L FeCl3溶液,白色沉淀变为红褐色;
④另取少量白色沉淀,滴加饱和NH4Cl溶液,沉淀溶解。
根据上述实验,下列说法不正确的是( )
A、将①中所得浊液过滤,所得滤液中含少量Mg2+
B、浊液中存在沉淀溶解平衡:Mg(OH)2(s) Mg2+(aq)+2OH-(aq)
C、实验②和③均能说明Fe(OH)3比Mg(OH)2难溶
D、NH4Cl溶液中的NH4+可能是④中沉淀溶解的原因
C
第3课时
沉淀溶解平衡的应用
1、通过实验了解沉淀的生成、溶解与转化,能应用化学平衡理论解释沉淀的生成、溶解和转化。
2、学会通过比较Q与Ksp的大小判断难溶电解质的沉淀与溶解,学会从定量角度分析沉淀的生成与转化。
溶度积规则
难溶电解质的沉淀溶解平衡是动态平衡,我们可以通过改变条件,使平衡向着需要的方向移动。
1、溶液中离子转化为沉淀——沉淀的生成。
2、沉淀转化为溶液中离子——沉淀的溶解。
3、一种沉淀转化为另一种沉淀——沉淀的转化。
生成难溶电解质的沉淀,是工业生产、环保工程和科学研究中除杂或提纯物质的重要方法之一。
一、沉淀的生成——Q>Ksp
原理:
例1、除去NH4Cl溶液中含有的杂质FeCl3。
1、调pH值法——除某些易水解的金属阳离子。
加入试剂后,消耗H+使Fe3+的水解平衡正向移动。
Fe3++3H2O Fe(OH)3+3H+
试剂:
目的:
NH3·H2O
加入NH3·H2O会消耗Fe3+水解生成的H+,水解平衡向正向移动,即使Fe3+转化为Fe(OH)3而除去。
切忌:前门驱虎,后门引狼
例2、除去MgCl2溶液中的杂质FeCl3。
常加入难溶性的MO、M(OH)2、MCO3等除M2+溶液中易水解的阳离子。
加入MgO会消耗Fe3+水解生成的H+,水解平衡向正向移动,即使Fe3+转化为Fe(OH)3而除去。
加入试剂后,消耗H+使Fe3+的水解平衡正向移动。
Fe3++3H2O Fe(OH)3+3H+
一、沉淀的生成——Q>Ksp
MgO
切忌:前门驱虎,后门引狼
1、调pH值法——除某些易水解的金属阳离子。
原理:
试剂:
目的:
进水
预处理设备
混合
投药
药剂设备
部分回流
沉淀物
处理设备
沉淀物排除
反应沉淀
补充处理
出水
化学沉淀法废水处理工艺流程示意图
Na2S、H2S溶液等
Cu2+、Hg2+等
工业废水的处理
2、加沉淀剂法——生成极难溶的沉淀。
例3、工业废水中的金属离子Cu2+、Hg2+,如何除去?
一、沉淀的生成——Q>Ksp
离子方程式:
Na2S或H2S溶液
试剂:
Cu2++H2S=CuS↓+2H+
Cu2++S2-=CuS↓
Hg2++H2S=HgS↓+2H+
Hg2++S2-=HgS↓
思考与讨论
利用生成沉淀分离或除去某种离子,首先要使生成沉淀的反应能够发生;其次希望沉淀反应完成后,溶液中剩余离子的浓度能够尽量小。
2、如何使沉淀反应完成后,溶液中剩余离子的浓度能够尽量小?
1、如果要除去某溶液中的SO42-,你选择加入钙盐还钡盐?为什么?
增大所用沉淀剂的浓度。
在实际应用中,常常会遇到使难溶物质溶解的问题。根据平衡移动原理,对于在水中难溶电解质,如果想办法移去平衡体系中的离子,使平衡向沉淀溶解的方向移动,就可以使沉淀溶解。
加入钡盐。因为Ksp(BaSO4)>Ksp(CaSO4),向溶液中加入等物质的量的钡盐和钙盐,钡盐使溶液中剩余的c(SO42-)较小。
思考:如何才能使沉淀溶解平衡正向移动呢?
①加热。
②加水。
③ 减少生成物(离子)的浓度。
CaCO3(s)Ca2+ (aq)+CO32-(aq)
加入盐酸时,消耗CO32-生成CO2气体,CO32-浓度不断减小,Q(CaCO3)<Ksp(CaCO3),使得沉淀溶解平衡正向移动。
只要盐酸足够多,CaCO3就可以完全溶解。
H+
+
HCO3-
+
H+
H2CO3
CO2↑+H2O
二、沉淀的溶解——Q<Ksp
实验3-3
实验3-3
向两支盛有少量Mg(OH)2固体的试管中分别滴加适量的蒸馏水和盐酸,观察并记录现象。
添加试剂 蒸馏水 盐酸
现象
思考与讨论
1、写出实验3-3有关反应的化学方程式。
沉淀不溶解
沉淀溶解
Mg(OH)2 +2HCl = MgCl2 +2H2O
2、运用平衡移动原理分析、解释实验3-3发生的反应。
Mg(OH)2 (s)Mg2+ (aq)+2OH-(aq)
=
2H+
+
2H2O
加入盐酸时,消耗OH-生成H2O,OH-浓度不断减小,Q[Mg(OH)2]<Ksp[Mg(OH)2],使得沉淀溶解平衡正向移动。
3、除加水和盐酸外,你还有其他方法使Mg(OH)2沉淀溶解吗?
加热、加氯化铵溶液
思考与讨论
A、NH4NO3 B、NaOH C、MgSO4 D、Na2SO4
例4、当氢氧化镁固体在水中达到沉淀溶解平衡:Mg(OH)2(s) Mg2+(aq)+2OH-(aq)时,为使Mg(OH)2固体的量减少,需加入少量的( )
A
在实际应用中,有时需要将一种沉淀转化为另一种沉淀。那么,在什么条件下能够实现沉淀的转化呢?
实验3-4
1、向盛有2 mL 0.1 mol/L NaCl溶液的试管中滴加2滴0.1 mol/L AgNO3溶液,观察并记录现象。
2、振荡试管,然后向其中滴加4滴0.1 mol/L KI溶液,观察并记录现象。
3、振荡试管,然后向其中滴加8滴0.1 mol/L Na2S溶液,观察并记录现象。
步骤 1 2 3
现象
实验3-4
实验3-4
1、向盛有2 mL 0.1 mol/L NaCl溶液的试管中滴加2滴0.1 mol/L AgNO3溶液,观察并记录现象。
2、振荡试管,然后向其中滴加4滴0.1 mol/L KI溶液,观察并记录现象。
3、振荡试管,然后向其中滴加8滴0.1 mol/L Na2S溶液,观察并记录现象。
步骤 1 2 3
现象
白色沉淀
白色沉淀转化为黄色沉淀
黄色沉淀转化为黑色沉淀
思考与讨论
2、过量的NaCl溶液与少量的AgNO3溶液反应后,溶液中是否还存在Ag+?
3、向上述溶液中再滴加KI溶液,生成的黄色沉淀AgI中的Ag+从何而来?
√
AgCl(s)Ag+ (aq)+Cl-(aq)
1、AgCl与NaI溶液会发生反应吗?AgI与Na2S溶液呢
AgCl(s) + I- (aq) AgI(s) + Cl-(aq)
2AgI(s) + S2-(aq) Ag2S(s) + l-(aq)
当向AgCl沉淀中滴加入KI溶液时,溶液中 Q[AgI]>Ksp[AgI] ,因此生成Agl沉淀,使AgCl的沉淀溶解平衡正向移动。
4、AgCl的溶解度很小,溶液中Ag+的量很少,生成AgI的量应该也很少,为什么产生大量黄色AgI沉淀?
AgCl(s)Ag+ (aq)+Cl-(aq)
I- (aq)
+
AgI (s)
思考与讨论
难溶向更难溶转化
Ksp[AgCl]=1.8×10-10
Ksp[Agl]=8.5×10-17
>>
溶解性:
Agl比AgCl更难溶
思考与讨论
5、向试管中再加入Na2S溶液,为什么会有黑色沉淀生成?
Agl(s)Ag+ (aq)+l-(aq)
Ksp[Ag2S]=6.3×10-50
Ksp[Agl]=8.5×10-17
S[Ag2S]=1.3×10-16g
S[Agl]=2.1×10-7g
2Ag+ (aq) + S2- (aq) Ag2S(s)
溶解性:
Ag2S比Agl更难溶
当向Agl沉淀中滴加入Na2S溶液时,溶液中Q[Ag2S]>Ksp[Ag2S],因此生成Ag2S沉淀,使Agl的沉淀溶解平衡正向移动。
>>
不能直接判断
溶解度
2Agl(s) + S2-(aq) Ag2S(s) + 2l-(aq)
AgCl(s) + I-(aq)AgI(s) + 2Cl-(aq)
6、根据溶解度和Ksp来思考,沉淀间的转化有什么规律?
思考与讨论
S=1.5×10-4g
S=3.7×10-7g
S=1.3×10-16g
AgCl
白色
Agl
黄色
Ag2S
黑色
溶解度小的沉淀向溶解度更小的沉淀更易转化。
简言之,微溶向难溶、难溶向更难溶转化。
实验3-5
1、向盛有2 mL 0.1 mol/L MgCl2溶液的试管中滴加2 4滴2 mol/L NaOH溶液,观察并记录现象。
2、向上述试管中滴加4滴0.1 mol/L FeCl3溶液,静置,观察并记录现象。
步骤 1 2
现象
白色沉淀
白色沉淀转化为红褐色沉淀
实验3-5
三、沉淀的转化
1、微溶向难溶转化,难溶向更难溶转化。
AgCl(s)+Br-(aq)AgBr(s)+Cl-(aq)
由上可知,微溶向难溶、难溶向更难溶转化是非常容易实现的。
K=
c(Cl-)
c(Br-)
=
Ksp(AgCl)
Ksp(AgBr)
已知:25℃ Ksp(AgCl)=1.8×10-10,Ksp(AgBr)=5.0×10-13
=
1.8×10-10
5.0×10-13
360
1
=
当Q<K时,平衡正向移动。
1
360
>
c(Br-)
c(Cl-)
即
2、难溶向较难溶转化。
BaSO4(s)+CO32-(aq) BaCO3(s)+SO42- (aq)
已知:25℃ Ksp(BaSO4)=1.07×10-10,Ksp(BaCO3)=2.58×10-9
由上可知,只要c(CO32-)是c(SO42-)的25倍以上,经多次转化,还是能将BaSO4沉淀转化为BaCO3沉淀,只不过CO32-要足够多才能实现。
三、沉淀的转化
K=
=
1.07×10-10
2.58×10-9
c(SO42-)
c(CO32-)
Ksp(BaSO4)
Ksp(BaCO3)
=
=
1
25
当Q<K时,平衡正向移动。
>25
c(CO32-)
c(SO42-)
即
例5、已知:Ksp(ZnS)>Ksp(CuS),在有白色固体ZnS存在的饱和溶液中滴加适量CuSO4溶液,产生的实验现象是 ( )
A、固体逐渐溶解,最后消失 B、固体由白色变为黑色
C、固体颜色变化但质量不变 D、固体逐渐增多,但颜色不变
B
思考与讨论
1、如何去除水垢中的CaSO4?
难溶物 CaSO4 CaCO3
溶解度/g 2.1×10-1 1.5 ×10-3
水垢成分
CaCO3、CaSO4
Mg(OH)2
疏松的水垢
CaCO3
Mg(OH)2
除去
水垢
用饱和Na2CO3
溶液浸泡数天
用盐酸或
饱和氯化铵液
CaSO4(s) Ca2+(aq) +SO42-(aq)
CaSO4(s) +CO32- (aq) CaCO3(s) +SO42- (aq)
CaCO3+2H+=Ca2++CO2↑+H2O
Mg(OH)2+2H+=Mg2++2H2O
CO32-(aq)
CaCO3(s)
+
渗透、遇闪锌矿(ZnS)和方铅矿(PbS)
思考与讨论
2、如何解释自然界中矿物的转化?
CuSO4(aq)+ZnS(s) CuS(s)+ZnSO4(aq)
CuSO4(aq)+PbS(s) CuS(s)+PbSO4(aq)
原生铜的硫化物
CuSO4(aq)
铜蓝(CuS)
氧化、淋滤
+
H2O+CO2
2HCO3-
思考与讨论
3、你知道溶洞是怎么形成的吗?
CaCO3(s) Ca2+(aq) + CO32-(aq)
+ Ca2+ CaCO3 + CO2 + H2O
溶有碳酸氢钙的水从溶洞顶向溶洞底滴落时,水分蒸发,二氧化碳压强减小以及温度的变化都会使二氧化碳溶解度减小而析出碳酸钙沉淀。这些沉淀经过千百万年的积聚,渐渐形成了钟乳石、石笋等。
生活中的应用:龋齿的形成原因及防治方法
1、牙齿表面由一层硬的组成为Ca5(PO4)3OH的物质保护着,它在唾液中存在下列平衡:
进食后,细菌和酶作用于食物,产生有机酸,这时牙齿就会受到腐蚀,其原因是发酵生成的有机酸能中和OH-,使平衡向脱矿方向移动,加速腐蚀牙齿。
Ca5(PO4)3OH(s) 5Ca2+(aq)+3PO43-(aq)+OH-(aq) Ksp=2.5×10-59
2、已知Ca5(PO4)3F的Ksp=2.8×10-61,比Ca5(PO4)3OH更难溶,牙膏里的氟离子会与Ca5(PO4)3OH反应生成Ca5(PO4)3F。请用离子方程式表示使用含氟牙膏防止龋齿的原因。
5Ca2+ + 3PO43- + F-= Ca5(PO4)3F
更难溶沉淀
难溶
沉淀
离子
1、调pH值
2、加沉淀剂
减小离子浓度
更难溶——易
较难溶——难
沉淀溶解平衡的应用——平衡的移动
练习1、某pH=1的ZnCl2和HCl的混合溶液中含有FeCl3杂质,为了除去FeCl3杂质,需将溶液调至pH=4。在调节溶液pH时,应选用的试剂是 ( )
A、NaOH B、ZnO C、ZnSO4 D、Fe2O3
B
练习2、在AgCl悬浊液中存在平衡:AgCl(s) Ag+(aq)+Cl-(aq)。已知常温下,Ksp(AgCl)=1.6×10-10。下列叙述中正确的是( )
A、常温下,AgCl悬浊液中c(Cl-)=4×10-5.5 mol·L-1
B、温度不变,向AgCl悬浊液中加入少量NaCl粉末,平衡向左移动,Ksp(AgCl)减小
C、向AgCl悬浊液中加入少量NaBr溶液,白色沉淀转化为淡黄色沉淀,说明Ksp(AgCl)<Ksp(AgBr)
D、常温下,将0.001 mol·L-1 AgNO3溶液与0.001 mol·L-1的KCl溶液等体积混合,无沉淀析出
A
练习3、已知:25 ℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp(MgF2)=7.42×10-11。下列说法正确的是( )
A、25 ℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大
B、25 ℃时,Mg(OH)2的悬浊液加入少量的NH4Cl固体,c(Mg2+)增大
C、25 ℃时,Mg(OH)2固体在20 mL 0.01 mol·L-1氨水中的Ksp比在20 mL 0.01 mol·L-1 NH4Cl溶液中的Ksp小
D、25 ℃时,在Mg(OH)2的悬浊液中加入NaF溶液后,Mg(OH)2不可能转化为MgF2
B
练习4、化工生产中含Cu2+的废水常用MnS(s)作沉淀剂,其反应原理为Cu2+(aq)+MnS(s) CuS(s)+Mn2+(aq)。一定温度下,下列有关该反应的推理正确的是( )
A、该反应达到平衡时:c(Cu2+)=c(Mn2+)
B、平衡体系中加入少量CuS(s)后,c(Mn2+)变小
C、平衡体系中加入少量Cu(NO3)2(s)后,c(Mn2+)变大
D、该反应平衡常数表达式:K=Ksp(CuS)/Ksp(MnS)
C
练习5、工业上常先以MnO2为原料制得粗MnCl2溶液,通过添加过量难溶电解质MnS,使溶液中含有的Cu2+、Pb2+、Cd2+等金属离子形成硫化物沉淀,经过滤除去包括MnS在内的沉淀,再经蒸发、结晶,可得纯净的MnCl2,根据上述实验事实,下列分析正确的是( )
A、MnS的Ksp小于CuS、PbS、CdS等硫化物的Ksp
B、除杂试剂MnS也可用FeS代替
C、MnS与Cu2+反应的离子方程式是Cu2+(aq)+MnS(s) CuS(s)+Mn2+ (aq)
D、整个过程中涉及的反应类型只有复分解反应
C
练习6、要使工业废水中的重金属离子Pb2+沉淀,可用硫酸盐、碳酸盐、硫化物等作沉淀剂,已知Pb2+与这些离子形成的化合物的溶解度如下:
化合物 PbSO4 PbCO3 PbS
溶解度/g 1.03×10-4 1.81×10-7 1.84×10-14
由上述数据可知,选用的沉淀剂最好是( )
A.硫化物 B.硫酸盐 C.碳酸盐 D.以上沉淀剂均可
A
练习7、25 ℃时,已知下列三种金属硫化物的溶度积常数(Ksp)分别为Ksp(FeS)=6.3×10-18;Ksp(CuS)=6.3×10-36;Ksp(ZnS)=1.6×10-24。下列关于常温时的有关叙述正确的是( )
A.硫化锌、硫化铜、硫化亚铁的溶解度依次增大
B.将足量的ZnSO4晶体加入到0.1 mol·L-1的Na2S溶液中,Zn2+的浓度最大只能达到1.6×10-23 mol·L-1
C.除去工业废水中含有的Cu2+,可采用FeS固体作为沉淀剂
D.向饱和的FeS溶液中加入FeSO4溶液后,混合液中c(Fe2+)变大、c(S2-)变小,但Ksp(FeS)变大
C
练习8、25℃时,5种银盐的溶度积常数(Ksp)分别是:
AgCl Ag2SO4 Ag2S AgBr AgI
1.8×10-10 1.4×10-5 6.3×10-50 7.7×10-13 8.51×10-16
下列说法正确的是( )
A.氯化银、溴化银和碘化银的溶解度依次增大
B.将硫酸银溶于水,向其中加入少量硫化钠溶液,不可能得到黑色沉淀
C.在5 mL 1.8×10-5 mol·L-1的NaCl溶液中,加入1滴(1 mL约20滴)0.1 mol·L-1的AgNO3溶液,不能观察到白色沉淀
D.将浅黄色溴化银固体浸泡在饱和氯化钠溶液中,有少量白色固体生成
D
练习9、有以下3个实验:①将0.1 mol/L MgCl2 溶液和0.5 mol/L NaOH 溶液等体积混合得到浊液;
②取少量①中浊液,滴加0.1 mol/L FeCl3 溶液,出现红褐色沉淀;
③将①中浊液过滤,取少量白色沉淀,滴加0.1 mol/L FeCl3溶液,白色沉淀变为红褐色;
④另取少量白色沉淀,滴加饱和NH4Cl溶液,沉淀溶解。
根据上述实验,下列说法不正确的是( )
A、将①中所得浊液过滤,所得滤液中含少量Mg2+
B、浊液中存在沉淀溶解平衡:Mg(OH)2(s) Mg2+(aq)+2OH-(aq)
C、实验②和③均能说明Fe(OH)3比Mg(OH)2难溶
D、NH4Cl溶液中的NH4+可能是④中沉淀溶解的原因
C
