课题3_溶液的浓度(24张ppt)
文档属性
| 名称 | 课题3_溶液的浓度(24张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 85.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2013-12-24 00:00:00 | ||
图片预览







文档简介
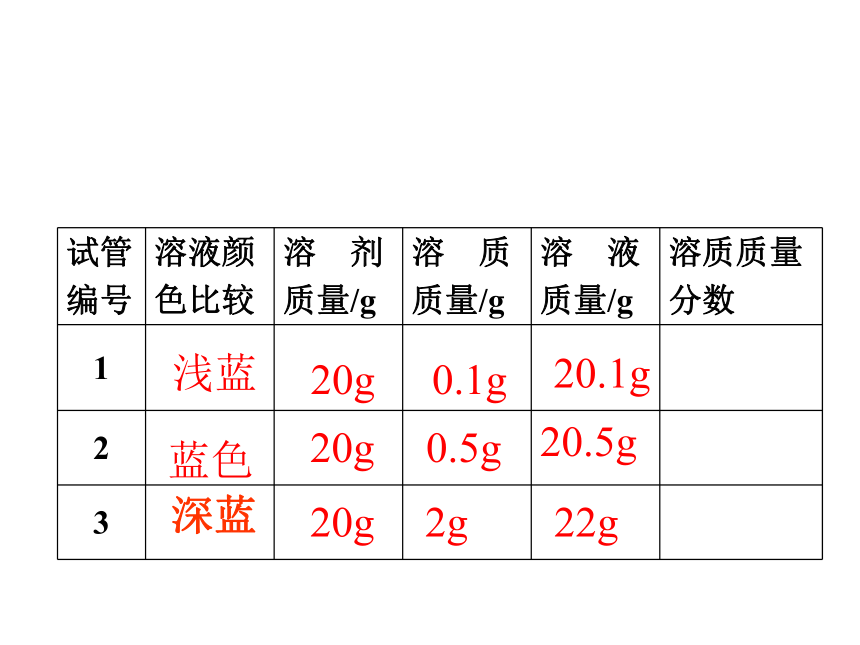
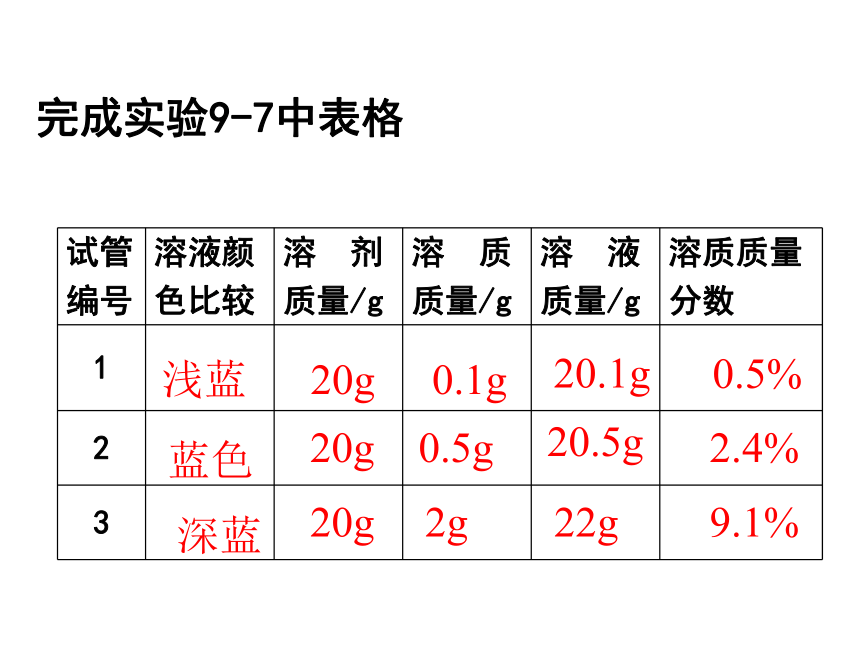
课件24张PPT。课题3 溶液的浓度浓溶液和稀溶液判断依据:一定量溶液里,所含溶质的多少思考:溶液的浓稀 和 溶液的饱和与否的关系区分依据不同☆同一温度时,同一溶质的饱和溶液肯定比不饱和溶液浓复 习实验9-7在三支试管中各加入20mL水,然后分别加入约0.1g、0.5g、2g无水硫酸铜,振荡,使其全部溶解,比较三种溶液的颜色。颜色:淡蓝 蓝色 深蓝 浅蓝蓝色20g20g20g0.1g 0.5g2g20.1g20.5g22g完成实验9-7中表格浅蓝蓝色 深蓝20g20g20g0.1g0.5g2g20.1g20.5g22g0.5%2.4%9.1%注意:1、溶质的质量是指溶解在溶剂中形成溶液的溶质的质量,不包括未溶解或析出的溶质。
2、一定温度下,饱和溶液中溶质质量分数为:
S100+S×100%课本43页讨论: 例1: 在农业生产中,常需要用质量分数为16%的氯化钠溶液来选种。现要配制150Kg这种溶液,需要氯化钠和水的质量各是多少?解: 练习 1. 配制500mL质量分数为10%的氢氧化钠溶液(密度为1.1g/cm3),需要氢氧化钠和水各多少克?解: 我们平时可能身边只有浓度较大的物质,那么怎样得到浓度较小的物质呢?二、溶液的稀释:
1、溶液稀释的方法:加入溶剂或加入低浓度溶液
2、计算依据:溶液稀释前后,溶质的质量不变
3、关系式:(1)
(2)
例题2 化学实验室现在有98%的浓硫酸,但在实验中常需要用较稀的硫酸溶液。要把50g质量分数为98%的浓硫酸稀释为质量分数为20%的硫酸溶液,需要多少克水?分析:解决这道题的关键是什么?解:溶液稀释前后溶质的质量不变如果把50g换成50mL,还需要什么条件?设 稀释后溶液的质量为x。50g× 98%=X × 20% X=245g
需要水的质量=245g-50g=195g答:需要水的质量为195g。 练习 1、某工厂化验室要得到5000g 20%的盐酸,那么需要38%的盐酸(密度为1.19g/mL)多少毫升?解:设3、在100克溶质质量分数为20%的NaCl溶液中加入50克溶质质量分数为5%的NaCl溶液,求所得溶液中溶质质量分数。三、与化学方程式相结合的综合计算注:1、代入纯净物的质量进行计算 (有溶液参加的反应,一定要注意代入方程式计算的是溶液中溶质的质量)
2、反应后所得溶液的质量=反应前物质的总质量—生成气体的质量(生成沉淀的质量)
3、溶液质量=溶质质量+溶剂质量
溶质质量=溶液质量×溶质质量分数 例1、已知20℃时食盐的溶解度为36g,求20℃时食盐饱和溶液的溶质质量分数。 解:20℃时食盐饱和溶液的溶质质量分数为=26.5%36g100g+36g答:略
2、50g盐酸5与锌完全反应,得0.2g氢气,求盐酸的溶质的质量分数? 3、某盐酸溶液100g,与13g含杂质5%的锌完全反应,这种盐酸的溶质质量分数是多少?4、200C时,NaCl的溶解度是36克。现有50克水放入20克NaCl,求:所得溶液的溶质质量分数 分析:50克水若溶不下20克NaCl,则溶液中NaCl的质量分数即为饱和溶液的浓度 36 /(100+36)。解:x = 18g < 20g则:溶质在溶液中的质量分数为:×100% ≈ 26.5% 100g36g=50gx18g50g+18g或36g100g+36g3、配制溶质质量分数一定的溶液⑴计算 ⑵称量 ⑶溶解 ⑷装瓶药匙 天平 烧杯 量筒 滴管 玻璃棒1、步骤:1、计算 2、称量 3、溶解例1: (溶质为固体)配制150g16%的食盐水 计算:需食盐:150 g× 16% = 24 g 需水: 150 g– 24 g= 126 g称量:用天平称量 24 g食盐 用量筒量取126mL水溶解:烧杯、玻璃棒 实验仪器:天平(砝码)、药匙、量筒、
胶头滴管、烧杯、玻璃棒四、一定溶质质量分数的溶液的配制练习:下面是一位同学配制一定溶质质量分数的氯化钠溶液时的流程图,请找出其中的错误,并说明理由。 饱和溶液的
溶质质量分数= 溶解度100g+溶解度 溶质的质量分数36% 是指: 100g溶液中含有36g溶质。
溶质T0C时溶解度36g是指: 在T0C 时,100g水最多溶解该溶质36g。溶质质量分数与溶解度的比较
2、一定温度下,饱和溶液中溶质质量分数为:
S100+S×100%课本43页讨论: 例1: 在农业生产中,常需要用质量分数为16%的氯化钠溶液来选种。现要配制150Kg这种溶液,需要氯化钠和水的质量各是多少?解: 练习 1. 配制500mL质量分数为10%的氢氧化钠溶液(密度为1.1g/cm3),需要氢氧化钠和水各多少克?解: 我们平时可能身边只有浓度较大的物质,那么怎样得到浓度较小的物质呢?二、溶液的稀释:
1、溶液稀释的方法:加入溶剂或加入低浓度溶液
2、计算依据:溶液稀释前后,溶质的质量不变
3、关系式:(1)
(2)
例题2 化学实验室现在有98%的浓硫酸,但在实验中常需要用较稀的硫酸溶液。要把50g质量分数为98%的浓硫酸稀释为质量分数为20%的硫酸溶液,需要多少克水?分析:解决这道题的关键是什么?解:溶液稀释前后溶质的质量不变如果把50g换成50mL,还需要什么条件?设 稀释后溶液的质量为x。50g× 98%=X × 20% X=245g
需要水的质量=245g-50g=195g答:需要水的质量为195g。 练习 1、某工厂化验室要得到5000g 20%的盐酸,那么需要38%的盐酸(密度为1.19g/mL)多少毫升?解:设3、在100克溶质质量分数为20%的NaCl溶液中加入50克溶质质量分数为5%的NaCl溶液,求所得溶液中溶质质量分数。三、与化学方程式相结合的综合计算注:1、代入纯净物的质量进行计算 (有溶液参加的反应,一定要注意代入方程式计算的是溶液中溶质的质量)
2、反应后所得溶液的质量=反应前物质的总质量—生成气体的质量(生成沉淀的质量)
3、溶液质量=溶质质量+溶剂质量
溶质质量=溶液质量×溶质质量分数 例1、已知20℃时食盐的溶解度为36g,求20℃时食盐饱和溶液的溶质质量分数。 解:20℃时食盐饱和溶液的溶质质量分数为=26.5%36g100g+36g答:略
2、50g盐酸5与锌完全反应,得0.2g氢气,求盐酸的溶质的质量分数? 3、某盐酸溶液100g,与13g含杂质5%的锌完全反应,这种盐酸的溶质质量分数是多少?4、200C时,NaCl的溶解度是36克。现有50克水放入20克NaCl,求:所得溶液的溶质质量分数 分析:50克水若溶不下20克NaCl,则溶液中NaCl的质量分数即为饱和溶液的浓度 36 /(100+36)。解:x = 18g < 20g则:溶质在溶液中的质量分数为:×100% ≈ 26.5% 100g36g=50gx18g50g+18g或36g100g+36g3、配制溶质质量分数一定的溶液⑴计算 ⑵称量 ⑶溶解 ⑷装瓶药匙 天平 烧杯 量筒 滴管 玻璃棒1、步骤:1、计算 2、称量 3、溶解例1: (溶质为固体)配制150g16%的食盐水 计算:需食盐:150 g× 16% = 24 g 需水: 150 g– 24 g= 126 g称量:用天平称量 24 g食盐 用量筒量取126mL水溶解:烧杯、玻璃棒 实验仪器:天平(砝码)、药匙、量筒、
胶头滴管、烧杯、玻璃棒四、一定溶质质量分数的溶液的配制练习:下面是一位同学配制一定溶质质量分数的氯化钠溶液时的流程图,请找出其中的错误,并说明理由。 饱和溶液的
溶质质量分数= 溶解度100g+溶解度 溶质的质量分数36% 是指: 100g溶液中含有36g溶质。
溶质T0C时溶解度36g是指: 在T0C 时,100g水最多溶解该溶质36g。溶质质量分数与溶解度的比较
同课章节目录
