《无机非金属材料的主角—硅》教学课件
文档属性
| 名称 | 《无机非金属材料的主角—硅》教学课件 |

|
|
| 格式 | zip | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2013-12-25 00:00:00 | ||
图片预览











文档简介
课件70张PPT。第一节 无机非金属
材料的主角——硅第四章非金属及其化合物第二课时
硅酸盐和单质硅第一课时
二氧化硅和硅酸第一节
无机非金属材料的主角-硅第一节无机非金属材料 的主角——硅 第一课时
二氧化硅和硅酸 硅及二氧化硅的性质 (一)硅元素在自然界中的存在和含量
(二)硅元素的位置与结构
(三)二氧化硅和硅酸
1.二氧化硅的结构和性质
2.硅酸制取原理和性质和硅胶的用途
3.探究硅酸的酸性比碳酸弱的实验事实
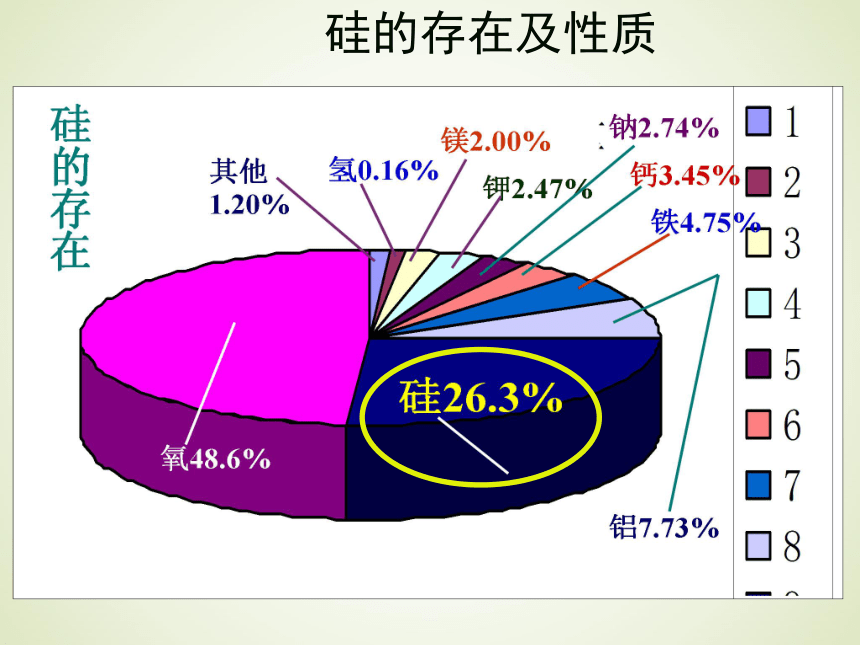
本课知识点硅单质(Si)硅太阳能电池硅芯片是各种计算机、微电子产品的核心晶体硅的存在及用途 美国的硅谷——“斯坦福科研工业区”是美国电子和计算机工业中心,位于美国西海岸加利福尼亚州北部旧金山南郊,圣克拉拉县和圣胡安两城之间的一条长48公里,宽16公里的长条形地带上。由于它集中了全世界90%以上的著名半导体公司,而半导体的基本元件是硅片,所以该地区被称为“硅谷”。 硅谷 Silicon Valley 通过下列图片你能总结归纳出硅元素在自然界中的存在形式吗?观察与思考硅的存在及性质1.自然界硅元素主要存在于:岩石、沙子和土壤2.地壳中的含量:排在第二位,氧的后面.3.自然界硅存在的形态 :硅无游离单质状态,
只有化合态。常常有硅的氧化物和硅酸盐(一)硅元素在自然界中的存在和含量硅的存在及性质 你能画出碳和硅的原子结构示意图,并归纳出硅与碳在元素周期表中的位置与结构吗?(二) 硅在周期表中的位置与结构CSi硅的结构及性质 碳在第三周期、硅在第四周期且都在周期表中的第四主族,最外层有四个电子,既不易失去电子,也不易得到电子。所以硅的化学性质不如碳活泼,主要形成正四价化合物,碳和硅都是亲氧元素,但是硅的亲氧能力更强。因此碳和硅在自然界中存在形式有所不同。(二) 硅在周期表中的位置与结构硅的结构及性质 美丽的玻璃雕花艺术水
晶水 晶 制 品玛瑙瓷器是中国最伟大的创造之一,所以中国被誉为“瓷国”秦砖汉瓦秦始皇陵兵马俑 秦始皇陵兵马俑三峡大坝二氧化硅的存在1、二氧化硅( SiO2)结晶形(石英晶体)
无定形——硅藻土二氧化硅的存在 什么是石英、水晶、玛瑙?? 具有彩色环状或层状的石英称为玛瑙资料卡片 在25℃和101kPa的条件下,由单质碳生成1mol CO2时放热393.5kJ;而在同样条件下,1mol硅生成1mol SiO2时放热910.9kJ。放热越多,其生成物通常越稳定,可见SiO2比CO2更容易生成,而且更稳定。二氧化硅的晶体结构SiO2的晶体结构晶体Si的结构科
学
视
野单质硅和SiO2都是正四面体结构。性质很稳定二氧化硅的结构 二氧化硅的晶体结构二氧化硅的结构 每 1个Si原子周围结合4个O原子,Si在中心,O 在四个顶角,同时每1个O原子周围结合2个Si原子 二氧化硅中氧
原子与硅原子
个数比为2:1
用SiO2来表示
二氧化硅的组
成,表示 O与
Si的原子个数
比,不是分子
式,是化学式 二氧化硅的晶体结构二氧化硅的结构 根据上述二氧化硅的结构及学过的二氧化碳的性质你能否判断SiO2的物理性质和化学性质呢?主要用作装饰物、石英坩埚、光导纤维等二氧化硅的性质(2)SiO2的物理性质 坚硬难熔固体,不溶于水CO2+H2O=H2CO3CO2+2NaOH=Na2CO3+H2OCO2+Na2O=Na2CO3CO2+CaO=CaCO3不反应SiO2+2NaOH=Na2SiO3+H2OSiO2+CaO=CaSiO3固 态熔点低气 态熔点高、硬度大SiO2+4HF=SiF4↑+2H2O 人工降雨,灭火等 装饰、石英坩埚、光纤二氧化硅和二氧化碳性质比较 二氧化硅和二氧化碳性质比较 从表中可以看出,二氧化硅能与碱反应生成相应的盐和水,是一种酸性氧化物,它不能通过溶于水得到相应的酸——硅酸。
酸性氧化物一般不与酸发生化学反应,而二氧化硅却能与氢氟酸发生反应,这也是工业上用氢氟酸雕刻玻璃的反应原理。以上两点,属二氧化硅的特性。
由此,我们总结出二氧化硅的主要化学性质为:
不溶于水的酸性氧化物,能与氢氟酸反应。二氧化硅的化学性质1.是酸性氧化物
2.能与碱反应
3.能与碱性氧化物反应
4.能与氢氟酸反应(特性)【小结】二氧化硅与生产生活 1,实验室盛装NaOH溶液的试剂瓶为什么用橡胶塞而不用玻璃塞? NaOH溶液能与玻璃中的SiO2反应生成 可溶于水的Na2SiO3,使瓶塞部分粘结而无法打开。因此盛装NaOH溶液的试剂瓶不能用玻璃塞而要用橡胶塞。
SiO2 + 2NaOH = Na2SiO3 +H2O 实验室盛放氢氧化钠溶液的试剂瓶你知道吗?二氧化硅的性质和用途 HF能腐蚀玻璃,因此,盛装氢氟酸不能用玻璃试剂瓶而要用塑料瓶。
SiO2 + 4HF =SiF4↑+ 2H2O 3.某同学根据SiO2既可与碱反应,也能与氢氟酸反应,推断SiO2为两性氧化物.是否正确? 2.实验室为什么不用玻璃瓶盛装氢氟酸?此反应常用于雕刻玻璃 不正确。因为二氧化硅跟氢氟酸反应产物不是盐和水,所以不属于两性氧化物,但是属于酸性氧化物。SiO2 + 4HF =SiF4↑+ 2H2O 二氧化硅的性质和用途 高纯度的硅是常见的最重要的半导体材料,水泥、陶瓷、玻璃等是常见的重要的含硅无机非金属材料。沙子――硅――芯片――计算机
沙子――………―――光导纤维计算机光通信 你能在沙子与计算机之间、沙子与计算机光通信之间建立起某种联系吗?Si 价值5000元的芯片光导纤维手术头灯用光导纤维做无开刀手术光学纤维胃镜二氧化硅的现代应用 二氧化硅难溶于水,那么如何制得硅酸呢? 硅酸凝胶经干燥脱水后得到多孔的硅酸干凝胶,称为“硅胶”。 硅酸是一种弱酸,不溶于水,不能使 指示剂变色,是一种白色粉末状的固体。 ——常用做干燥剂 2、硅酸 (H2SiO3)想一想(1)性质:(2)制备: 【用途】:生成的硅酸逐渐聚合而形成硅酸溶胶,经干燥脱水就形成硅酸干胶,称为 “硅胶”。常常用做干燥剂。 如何制取硅酸? 硅酸钠溶液、酚酞、稀盐酸、稀硫酸 实验原理:实验探究Na2SiO3+ ______H2SiO3实验试剂:硅酸的性质和用途制取原理:强酸制弱酸 滴入酚酞后溶液变红,再滴入稀盐酸,溶液红色变浅至无色,同时有白色胶状沉淀产生a.Na2SiO3溶液呈碱性。
b.可溶性硅酸盐与盐酸反应生成不溶于水的硅酸,
c.先形成硅酸溶胶,后形成硅酸凝胶.
d.静置则形成硅酸沉淀。Na2SiO3 + 2HCl == 2NaCl + H2SiO3(胶体)SiO32- + 2H+ == H2SiO3 (胶体)硅酸的性质和用途 【方法步骤】:向饱和Na2SiO3溶液中滴入酚酞,再滴入稀盐酸阅读课本P76
探究实验4-1 硅胶泳帽 硅胶干燥剂说明硅胶具有哪些性质? 1.了解硅元素在自然界中的存在和含量,从硅元素的位置与结构推知其亲氧性存在的两种化合物———二氧化硅和硅酸。
2.二氧化硅的结构和性质
3.硅酸制取原理、性质和硅胶的用途
4.硅酸的酸性比碳酸弱的实验事实2.教学重点、难点教学重点教学难点 二氧化硅的结构
二氧化硅的性质和硅酸的制备 作业:课本P80
——1、2、7、9、10第四章非金属及其化合物 第二课时
硅酸盐、硅单质三、硅酸盐和硅单质 第一节
无机非金属材料的主角——硅 本课学习内容
1.硅酸盐的定义、性质和表示方法及工业产品
2.硅酸钠的性质和用途
3.硅酸钠水溶液久置在空气中会出现白色浑浊的原因。
4.硅单质的性质及广泛应用
硅酸盐的丰富性和多样性人面鱼纹盆科学视野 普通玻璃: Na2O·CaO·6SiO2 陶瓷 日用器皿、建筑饰材、卫生洁具 具有均匀微孔结构的铝硅酸盐——分子筛 生物陶瓷——人造骨硅酸盐1、定义: 硅酸盐是由硅、氧、金属元素组成的化合物的总称 2、性质: 硅酸盐种类很多,大多数难溶于水,化学性质稳定。最常见的可溶性硅酸盐是Na2SiO3,K2SiO3三、硅酸盐
硅酸盐的存在形式、性质、工业制备和 用途1、硅酸盐组成的表示方法:(1)化学式法: 适用于简单的硅酸盐
如:Na2SiO3,K2SiO3、CaSiO3等。 活泼金属氧化物→较活泼金属氧化物→二氧化硅→水。氧化物前系数配置原则:除氧元素外,其他元素按配置前后原子个数守恒原则配置系数。
硅酸钠:Na2SiO3 —— Na2O·SiO2
硅酸钙:CaSiO3 —— CaO·SiO2
高岭石:Al2(Si2O5)(OH)4 —— Al2O3·2SiO2·2H2O
正长石:KAlSiO3 不能写成K2O·Al2O3·3SiO2 ,应写成 K2O·Al2O3·6SiO2(2)氧化物法资料卡片 2、硅酸盐在自然界的转化 硅酸盐矿石长期受到空气中的二氧化碳和水的侵蚀后,逐渐风化分解,生成的可溶物质随雨水流入江河、海洋,留下大量的黏土形成土壤胶体,因其表面巨大且一般带负电,能吸附NH4+,K+等营养离子,从而具有保肥能力。硅酸盐是如何具有保肥能力的?思考3、硅酸钠(Na2SiO3) 硅酸钠是白色固体,易溶于水,其水溶液俗称水玻璃,又称泡花碱,是一种无色粘稠的液体,是一种矿物胶,黏性很强,可以作黏胶剂和木材防火剂。阅读课本P65并
探究实验4-2 水分蒸发后燃烧水分蒸干后不燃烧硅酸钠能防火水不能防火(1)物理性质 1.硅酸钠水溶液久置在空气中会出现什么现象?为什么?
2.将用水玻璃浸过的、长期存放的鲜蛋敲碎,你会看到什么现象? 硅酸钠水溶液久置在空气中会出现白色浑浊。因为发生下列反应: Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓ 能说明硅酸的酸性比二氧化碳酸性弱 观察到鲜蛋没有坏——用作防腐剂 (2)硅酸钠的化学性质 硅酸钠的化学性质相对稳定,不能燃烧,不易被腐蚀,热稳定性好。①与酸反应 Na2SiO3 + 2HCl =2NaCl + H2SiO3↓②与盐反应 CaCl2+Na2SiO3=CaSiO3 ↓ +2NaCl(3)硅酸钠的用途 可以作肥皂填料,
可以用做建筑、纸张的黏合剂和
木材、织物的防腐剂及防火剂6.硅酸盐工业产品 传统硅酸盐工业三大产品有:
——玻璃、陶瓷、水泥。你认识这些常见的硅酸盐产品吗 应用广泛的硅酸盐产品四、硅单质四、硅单质(Si) 2.物理性质: 3.化学性质 有金属光泽的灰黑色固体, 1.存在形式晶体硅无定形硅 你能根据硅的原子结构推测硅单质可能具有的化学性质 晶体硅的结构模型熔点高,硬度大。 ②在高温条件下,单质硅能与O2和Cl2等非
金属单质反应。 ①常温下化学性质不活泼,只能跟F2、HF和NaOH溶液反应。 Si+2F2=SiF4
Si+4HF=SiF4↑+2H2↑ Si+2NaOH+H2O=Na2SiO3+2H2↑Si+O2 SiO23、化学性质 工业上,用焦炭在高温下还原石英砂可制得粗硅,粗硅跟氯气反应经提纯得到 SiCl4后,再用氢气还原制得纯硅:4.硅的工业制备硅单质SiO2+2C=Si(粗)+2CO↑①Si(粗)+2Cl2=SiCl4 ②SiCl4+2H2=Si(纯)+4HCl③ 5、用途:太阳能电池、计算机芯片以及半导体材料信息技术等材料和人造卫星、登月车、火星探测器等动力设备新能源。 硅太阳能电池硅芯片是各种计算机、微电子产品的核心 观看下列图片总结单质硅的用途科学视野新型陶瓷人造关节高压钠灯 高温结构陶瓷 1.氧化铝陶瓷陶瓷机械零件 1.硅酸盐的定义、表示方法及工业产品.
2.硅酸钠的性质和用途
3.硅单质的存在形式、性质、工业制备和用途
4.硅酸钠水溶液久置在空气中会出现白色浑浊的原因。 作业:
课本P61——4、5、7、9
硅酸盐和单质硅第一课时
二氧化硅和硅酸第一节
无机非金属材料的主角-硅第一节无机非金属材料 的主角——硅 第一课时
二氧化硅和硅酸 硅及二氧化硅的性质 (一)硅元素在自然界中的存在和含量
(二)硅元素的位置与结构
(三)二氧化硅和硅酸
1.二氧化硅的结构和性质
2.硅酸制取原理和性质和硅胶的用途
3.探究硅酸的酸性比碳酸弱的实验事实
本课知识点硅单质(Si)硅太阳能电池硅芯片是各种计算机、微电子产品的核心晶体硅的存在及用途 美国的硅谷——“斯坦福科研工业区”是美国电子和计算机工业中心,位于美国西海岸加利福尼亚州北部旧金山南郊,圣克拉拉县和圣胡安两城之间的一条长48公里,宽16公里的长条形地带上。由于它集中了全世界90%以上的著名半导体公司,而半导体的基本元件是硅片,所以该地区被称为“硅谷”。 硅谷 Silicon Valley 通过下列图片你能总结归纳出硅元素在自然界中的存在形式吗?观察与思考硅的存在及性质1.自然界硅元素主要存在于:岩石、沙子和土壤2.地壳中的含量:排在第二位,氧的后面.3.自然界硅存在的形态 :硅无游离单质状态,
只有化合态。常常有硅的氧化物和硅酸盐(一)硅元素在自然界中的存在和含量硅的存在及性质 你能画出碳和硅的原子结构示意图,并归纳出硅与碳在元素周期表中的位置与结构吗?(二) 硅在周期表中的位置与结构CSi硅的结构及性质 碳在第三周期、硅在第四周期且都在周期表中的第四主族,最外层有四个电子,既不易失去电子,也不易得到电子。所以硅的化学性质不如碳活泼,主要形成正四价化合物,碳和硅都是亲氧元素,但是硅的亲氧能力更强。因此碳和硅在自然界中存在形式有所不同。(二) 硅在周期表中的位置与结构硅的结构及性质 美丽的玻璃雕花艺术水
晶水 晶 制 品玛瑙瓷器是中国最伟大的创造之一,所以中国被誉为“瓷国”秦砖汉瓦秦始皇陵兵马俑 秦始皇陵兵马俑三峡大坝二氧化硅的存在1、二氧化硅( SiO2)结晶形(石英晶体)
无定形——硅藻土二氧化硅的存在 什么是石英、水晶、玛瑙?? 具有彩色环状或层状的石英称为玛瑙资料卡片 在25℃和101kPa的条件下,由单质碳生成1mol CO2时放热393.5kJ;而在同样条件下,1mol硅生成1mol SiO2时放热910.9kJ。放热越多,其生成物通常越稳定,可见SiO2比CO2更容易生成,而且更稳定。二氧化硅的晶体结构SiO2的晶体结构晶体Si的结构科
学
视
野单质硅和SiO2都是正四面体结构。性质很稳定二氧化硅的结构 二氧化硅的晶体结构二氧化硅的结构 每 1个Si原子周围结合4个O原子,Si在中心,O 在四个顶角,同时每1个O原子周围结合2个Si原子 二氧化硅中氧
原子与硅原子
个数比为2:1
用SiO2来表示
二氧化硅的组
成,表示 O与
Si的原子个数
比,不是分子
式,是化学式 二氧化硅的晶体结构二氧化硅的结构 根据上述二氧化硅的结构及学过的二氧化碳的性质你能否判断SiO2的物理性质和化学性质呢?主要用作装饰物、石英坩埚、光导纤维等二氧化硅的性质(2)SiO2的物理性质 坚硬难熔固体,不溶于水CO2+H2O=H2CO3CO2+2NaOH=Na2CO3+H2OCO2+Na2O=Na2CO3CO2+CaO=CaCO3不反应SiO2+2NaOH=Na2SiO3+H2OSiO2+CaO=CaSiO3固 态熔点低气 态熔点高、硬度大SiO2+4HF=SiF4↑+2H2O 人工降雨,灭火等 装饰、石英坩埚、光纤二氧化硅和二氧化碳性质比较 二氧化硅和二氧化碳性质比较 从表中可以看出,二氧化硅能与碱反应生成相应的盐和水,是一种酸性氧化物,它不能通过溶于水得到相应的酸——硅酸。
酸性氧化物一般不与酸发生化学反应,而二氧化硅却能与氢氟酸发生反应,这也是工业上用氢氟酸雕刻玻璃的反应原理。以上两点,属二氧化硅的特性。
由此,我们总结出二氧化硅的主要化学性质为:
不溶于水的酸性氧化物,能与氢氟酸反应。二氧化硅的化学性质1.是酸性氧化物
2.能与碱反应
3.能与碱性氧化物反应
4.能与氢氟酸反应(特性)【小结】二氧化硅与生产生活 1,实验室盛装NaOH溶液的试剂瓶为什么用橡胶塞而不用玻璃塞? NaOH溶液能与玻璃中的SiO2反应生成 可溶于水的Na2SiO3,使瓶塞部分粘结而无法打开。因此盛装NaOH溶液的试剂瓶不能用玻璃塞而要用橡胶塞。
SiO2 + 2NaOH = Na2SiO3 +H2O 实验室盛放氢氧化钠溶液的试剂瓶你知道吗?二氧化硅的性质和用途 HF能腐蚀玻璃,因此,盛装氢氟酸不能用玻璃试剂瓶而要用塑料瓶。
SiO2 + 4HF =SiF4↑+ 2H2O 3.某同学根据SiO2既可与碱反应,也能与氢氟酸反应,推断SiO2为两性氧化物.是否正确? 2.实验室为什么不用玻璃瓶盛装氢氟酸?此反应常用于雕刻玻璃 不正确。因为二氧化硅跟氢氟酸反应产物不是盐和水,所以不属于两性氧化物,但是属于酸性氧化物。SiO2 + 4HF =SiF4↑+ 2H2O 二氧化硅的性质和用途 高纯度的硅是常见的最重要的半导体材料,水泥、陶瓷、玻璃等是常见的重要的含硅无机非金属材料。沙子――硅――芯片――计算机
沙子――………―――光导纤维计算机光通信 你能在沙子与计算机之间、沙子与计算机光通信之间建立起某种联系吗?Si 价值5000元的芯片光导纤维手术头灯用光导纤维做无开刀手术光学纤维胃镜二氧化硅的现代应用 二氧化硅难溶于水,那么如何制得硅酸呢? 硅酸凝胶经干燥脱水后得到多孔的硅酸干凝胶,称为“硅胶”。 硅酸是一种弱酸,不溶于水,不能使 指示剂变色,是一种白色粉末状的固体。 ——常用做干燥剂 2、硅酸 (H2SiO3)想一想(1)性质:(2)制备: 【用途】:生成的硅酸逐渐聚合而形成硅酸溶胶,经干燥脱水就形成硅酸干胶,称为 “硅胶”。常常用做干燥剂。 如何制取硅酸? 硅酸钠溶液、酚酞、稀盐酸、稀硫酸 实验原理:实验探究Na2SiO3+ ______H2SiO3实验试剂:硅酸的性质和用途制取原理:强酸制弱酸 滴入酚酞后溶液变红,再滴入稀盐酸,溶液红色变浅至无色,同时有白色胶状沉淀产生a.Na2SiO3溶液呈碱性。
b.可溶性硅酸盐与盐酸反应生成不溶于水的硅酸,
c.先形成硅酸溶胶,后形成硅酸凝胶.
d.静置则形成硅酸沉淀。Na2SiO3 + 2HCl == 2NaCl + H2SiO3(胶体)SiO32- + 2H+ == H2SiO3 (胶体)硅酸的性质和用途 【方法步骤】:向饱和Na2SiO3溶液中滴入酚酞,再滴入稀盐酸阅读课本P76
探究实验4-1 硅胶泳帽 硅胶干燥剂说明硅胶具有哪些性质? 1.了解硅元素在自然界中的存在和含量,从硅元素的位置与结构推知其亲氧性存在的两种化合物———二氧化硅和硅酸。
2.二氧化硅的结构和性质
3.硅酸制取原理、性质和硅胶的用途
4.硅酸的酸性比碳酸弱的实验事实2.教学重点、难点教学重点教学难点 二氧化硅的结构
二氧化硅的性质和硅酸的制备 作业:课本P80
——1、2、7、9、10第四章非金属及其化合物 第二课时
硅酸盐、硅单质三、硅酸盐和硅单质 第一节
无机非金属材料的主角——硅 本课学习内容
1.硅酸盐的定义、性质和表示方法及工业产品
2.硅酸钠的性质和用途
3.硅酸钠水溶液久置在空气中会出现白色浑浊的原因。
4.硅单质的性质及广泛应用
硅酸盐的丰富性和多样性人面鱼纹盆科学视野 普通玻璃: Na2O·CaO·6SiO2 陶瓷 日用器皿、建筑饰材、卫生洁具 具有均匀微孔结构的铝硅酸盐——分子筛 生物陶瓷——人造骨硅酸盐1、定义: 硅酸盐是由硅、氧、金属元素组成的化合物的总称 2、性质: 硅酸盐种类很多,大多数难溶于水,化学性质稳定。最常见的可溶性硅酸盐是Na2SiO3,K2SiO3三、硅酸盐
硅酸盐的存在形式、性质、工业制备和 用途1、硅酸盐组成的表示方法:(1)化学式法: 适用于简单的硅酸盐
如:Na2SiO3,K2SiO3、CaSiO3等。 活泼金属氧化物→较活泼金属氧化物→二氧化硅→水。氧化物前系数配置原则:除氧元素外,其他元素按配置前后原子个数守恒原则配置系数。
硅酸钠:Na2SiO3 —— Na2O·SiO2
硅酸钙:CaSiO3 —— CaO·SiO2
高岭石:Al2(Si2O5)(OH)4 —— Al2O3·2SiO2·2H2O
正长石:KAlSiO3 不能写成K2O·Al2O3·3SiO2 ,应写成 K2O·Al2O3·6SiO2(2)氧化物法资料卡片 2、硅酸盐在自然界的转化 硅酸盐矿石长期受到空气中的二氧化碳和水的侵蚀后,逐渐风化分解,生成的可溶物质随雨水流入江河、海洋,留下大量的黏土形成土壤胶体,因其表面巨大且一般带负电,能吸附NH4+,K+等营养离子,从而具有保肥能力。硅酸盐是如何具有保肥能力的?思考3、硅酸钠(Na2SiO3) 硅酸钠是白色固体,易溶于水,其水溶液俗称水玻璃,又称泡花碱,是一种无色粘稠的液体,是一种矿物胶,黏性很强,可以作黏胶剂和木材防火剂。阅读课本P65并
探究实验4-2 水分蒸发后燃烧水分蒸干后不燃烧硅酸钠能防火水不能防火(1)物理性质 1.硅酸钠水溶液久置在空气中会出现什么现象?为什么?
2.将用水玻璃浸过的、长期存放的鲜蛋敲碎,你会看到什么现象? 硅酸钠水溶液久置在空气中会出现白色浑浊。因为发生下列反应: Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓ 能说明硅酸的酸性比二氧化碳酸性弱 观察到鲜蛋没有坏——用作防腐剂 (2)硅酸钠的化学性质 硅酸钠的化学性质相对稳定,不能燃烧,不易被腐蚀,热稳定性好。①与酸反应 Na2SiO3 + 2HCl =2NaCl + H2SiO3↓②与盐反应 CaCl2+Na2SiO3=CaSiO3 ↓ +2NaCl(3)硅酸钠的用途 可以作肥皂填料,
可以用做建筑、纸张的黏合剂和
木材、织物的防腐剂及防火剂6.硅酸盐工业产品 传统硅酸盐工业三大产品有:
——玻璃、陶瓷、水泥。你认识这些常见的硅酸盐产品吗 应用广泛的硅酸盐产品四、硅单质四、硅单质(Si) 2.物理性质: 3.化学性质 有金属光泽的灰黑色固体, 1.存在形式晶体硅无定形硅 你能根据硅的原子结构推测硅单质可能具有的化学性质 晶体硅的结构模型熔点高,硬度大。 ②在高温条件下,单质硅能与O2和Cl2等非
金属单质反应。 ①常温下化学性质不活泼,只能跟F2、HF和NaOH溶液反应。 Si+2F2=SiF4
Si+4HF=SiF4↑+2H2↑ Si+2NaOH+H2O=Na2SiO3+2H2↑Si+O2 SiO23、化学性质 工业上,用焦炭在高温下还原石英砂可制得粗硅,粗硅跟氯气反应经提纯得到 SiCl4后,再用氢气还原制得纯硅:4.硅的工业制备硅单质SiO2+2C=Si(粗)+2CO↑①Si(粗)+2Cl2=SiCl4 ②SiCl4+2H2=Si(纯)+4HCl③ 5、用途:太阳能电池、计算机芯片以及半导体材料信息技术等材料和人造卫星、登月车、火星探测器等动力设备新能源。 硅太阳能电池硅芯片是各种计算机、微电子产品的核心 观看下列图片总结单质硅的用途科学视野新型陶瓷人造关节高压钠灯 高温结构陶瓷 1.氧化铝陶瓷陶瓷机械零件 1.硅酸盐的定义、表示方法及工业产品.
2.硅酸钠的性质和用途
3.硅单质的存在形式、性质、工业制备和用途
4.硅酸钠水溶液久置在空气中会出现白色浑浊的原因。 作业:
课本P61——4、5、7、9
