化学人教版(2019)选择性必修2 2.3.2分子间作用力 课件(共28张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修2 2.3.2分子间作用力 课件(共28张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-02 10:55:19 | ||
图片预览







文档简介
(共28张PPT)
第二章 分子结构与性质
第三节 分子结构与物质的性质
第二课时 分子间的作用力
1/51
思考与讨论
2/28
冰山融化现象是物理变化还是化学变化?
冰山融化过程中有没有破坏其中的化学键?
那为什么冰山融化过程仍要吸收能量呢?
这说明水分子之间存在着相互作用力。
一
分子间的作用力
3/28
1. 概念:把分子聚集在一起的作用力,叫分子间作用力。(它是许多种物质能以一定的凝聚态如固态和液态存在的重要因素)
常见的有范德华力和氢键两类
2. 本质:属于分子间作用力的一种,本质是一种分子之间的静电作用。
3. 存在:广泛存在于各种分子之间。
一
分子间的作用力
4/28
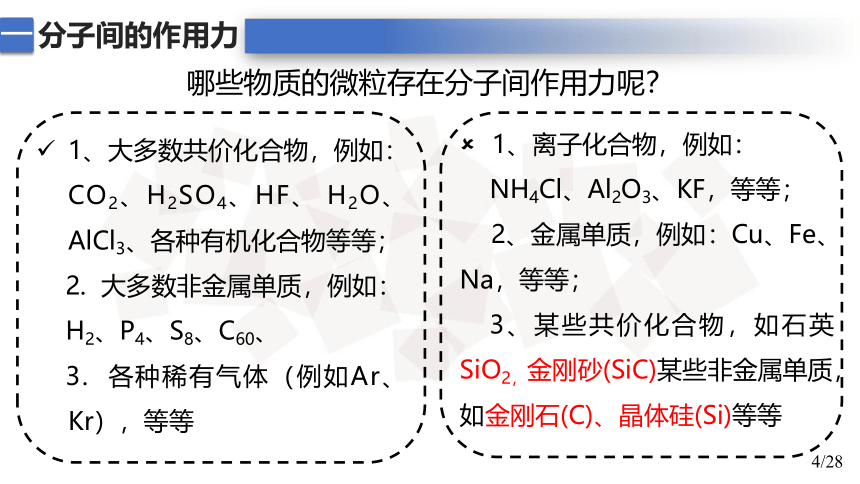
哪些物质的微粒存在分子间作用力呢?
1、大多数共价化合物,例如: CO2、H2SO4、HF、 H2O、 AlCl3、各种有机化合物等等;
2. 大多数非金属单质,例如:
H2、P4、S8、C60、
3. 各种稀有气体(例如Ar、Kr),等等
1、离子化合物,例如:
NH4Cl、Al2O3、KF,等等;
2、金属单质,例如:Cu、Fe、Na,等等;
3、某些共价化合物,如石英SiO2,金刚砂(SiC)某些非金属单质,如金刚石(C)、晶体硅(Si)等等
二
范德华力
5/28
是一种普遍存在于固体、液体和气体中分子间的作用力。
2、存在:非金属单质(除C、Si)分子、稀有气体分子、共价化合物(除SiO2、SiC)分子之间;石墨片层之间。
3、范德华力与共价键的区别
(1)范德华力很弱,比化学键的键能小1~2个数量级。
(2)范德华力一般没有方向性和饱和性
1、定义:
二
范德华力
6/28
4、影响范德华力的因素
分子 Ar CO HI HBr HCl
范德华力 (kJ/mol) 8.50 8.75 26.00 23.11 21.14
表2-7-1 某些分子间的范德华力
(1)对于组成和结构相似的物质,相对分子质量越大,范德华力越大。
(2)分子极性越大、范德华力越大。
二
范德华力
7/28
4、影响范德华力的因素
表2-7-2 某些分子间的范德华力
(3)相对分子质量相同或相近时,分子的极性越大,范德华力越大。
思考与讨论
8/28
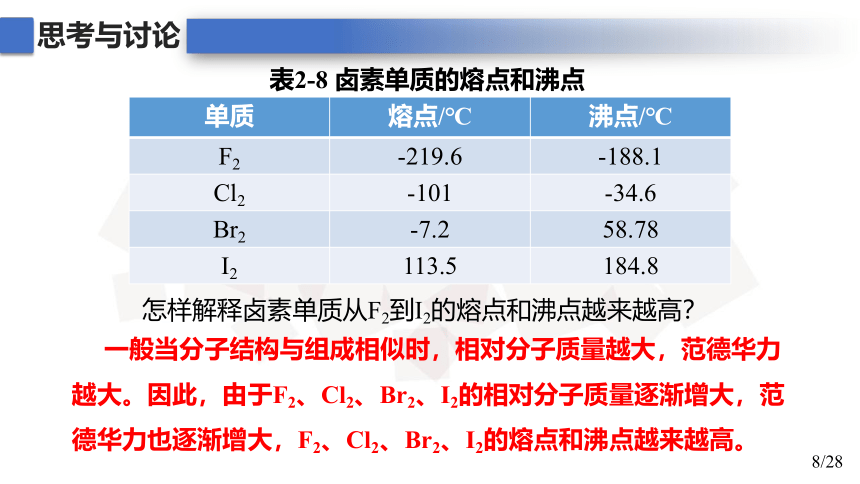
单质 熔点/℃ 沸点/℃
F2 -219.6 -188.1
Cl2 -101 -34.6
Br2 -7.2 58.78
I2 113.5 184.8
表2-8 卤素单质的熔点和沸点
怎样解释卤素单质从F2到I2的熔点和沸点越来越高?
一般当分子结构与组成相似时,相对分子质量越大,范德华力越大。因此,由于F2、Cl2、Br2、I2的相对分子质量逐渐增大,范德华力也逐渐增大,F2、Cl2、Br2、I2的熔点和沸点越来越高。
小结
9/28
判断分子的熔沸点高低的方法
(1)相对分子质量(越大)→范德华力(越大)→熔沸点(越高)
(2)如果两物质的相对分子质量相近,则看分子的极性。
分子的极性(越大)→范德华力(越大)→熔沸点(越高)
例:将下列物质按熔沸点由高到低的顺序排列:
D2O_____H2O I2_____Br2 CO_____N2 CH4_____SiH4
>
>
>
<
思考与讨论
10/28
-150
-125
-100
-75
-50
-25
0
25
50
75
100
2
3
4
5
×
×
×
×
CH4
SiH4
GeH4
SnH4
NH3
PH3
AsH3
SbH3
HF
HCl
HBr
HI
H2O
H2S
H2Se
H2Te
沸点/℃
周期
一些氢化物的沸点
一般:同一主族非金属氢化物,从上到下,Mr逐渐增大,熔沸点应逐渐升高.
而HF、H2O、NH3却出现反常,为什么?
说明在HF、H2O、NH3分子间还存在除范德华力之外的其他分子间作用力—氢键.
三
氢键
11/28
氢键是由已经与_____________的原子形成共价键的_______(如水分子中的H)与另一个电负性很大的原子(如水分子中的O)之间形成的作用力。
电负性很大
氢原子
1、定义:除了范德华力之外的另一种分子间作用力
3、形成条件:① X、Y为N、O、F
②X、Y可以相同,也可以不同
③“—”表示共价键,“ ”表示形成的氢键
2、表示方法:X—H Y
三
氢键
12/28
无内层电子,几乎成为“裸露”的质子
电负性大,半径小
氢键
O
H
H
δ+
δ+
δ-
δ-
…
H—O键极性很强
O
H
H
氢键具有方向性和饱和性
特征
三
氢键
13/28
4、特征:氢键具有方向性和饱和性
①方向性 X—H…Y三个原子一般在同一方向上
原因是在这样的方向上成键两原子电子云之间的排斥力最小,形成的氢键最强,体系最稳定
原因是H原子半径很小,再有一个原子接近时,会受到X、Y原子电子云的排斥。
②饱和性 每一个X—H只能与1个Y原子形成氢键
三
氢键
14/28
5、本质:是静电吸引作用,分子间作用力
比化学键的键能小1~2个数量级,
是一种比范德华力强的分子间作用力。
②分子间氢键
6、分类:①分子内氢键
邻羟基苯甲醛
对羟基苯甲醛
三
氢键
15/28
7.键长: A—H···B ,指A B之间的距离。
8.键能: A—H···B 分解为A—H和B所需要的能量。
X—H···Y强弱 与X和Y的电负性有关.
电负性越大,原子半径越小,则氢键越强。
如F原子电负性最大,因而F-H…F是最强的氢键; 原子吸引电子能力不同,所以氢键强弱变化顺序为:
F-H…F > O-H…O > O-H…N > N-H…N
C原子吸引电子能力较弱,一般不形成氢键。
9. 氢键强弱
三
氢键
16/28
10、氢键对物质性质的影响
分子间存在氢键时,物质在熔化或汽化时,除需破坏范德华力外,还需破坏分子间氢键,消耗更多的能量,所以存在分子间氢键的物质一般具有较高的熔、沸点。
ⅤA~ⅦA族元素的氢化物中,NH3、H2O和HF的熔、沸点比同主族相邻元素氢化物的熔、沸点高,这种反常现象是由于它们各自的分子间形成了氢键。
(1) 对物质熔、沸点的影响
三
氢键
17/28
10、氢键对物质性质的影响
(1) 对物质熔、沸点的影响
①存在分子间氢键的物质一般具有较高的熔、沸点。
②存在分子内氢键使物质熔、沸点降低。
邻羟基苯甲醛的沸点低于对羟基苯甲醛
邻羟基苯甲醛
对羟基苯甲醛
三
氢键
18/28
10、氢键对物质性质的影响
①水结冰时,体积膨胀,密度降低
(2) 对水分子性质的影响
用氢键解释这种异常性:接近水的沸点的水蒸气中存在相当量的水分子因氢键而相互缔合,形成所谓的缔合分子。
氢键的存在迫使在四面体中心的水分子与四面体顶角方向的4个相邻水分子相互吸引,这一排列使冰晶体中的水分子的空间利用率不高,留有相当大的空隙,其密度比液态水小。
②接近水的沸点的水蒸气的相对分子质量的测定值比按化学式H2O计算出来的相对分子质量大。
四
溶解性
19/28
非极性溶质一般能溶于 ,
极性溶质一般能溶于 。
非极性溶剂
极性溶剂
易
难
易
难
1、相似相溶
如蔗糖和氨 溶于水, 溶于四氯化碳。
萘和碘 溶于四氯化碳, 溶于水。
(1)分子极性相似
溶质和溶剂的分子结构相似程度越大,其溶解性越 。
(2)分子结构相似
大
如乙醇与水 ;而戊醇中烃基较大在水中的溶解度明显减小。
互溶
四
溶解性
20/28
主要有 等。
温度和压强
溶剂和溶质之间的氢键作用力越大,溶解性越好;
无氢键相互作用的溶质在有氢键的水中溶解度就比较小
注意:如果溶质与水能发生化学反应,也会增大溶质的溶解度。
2、氢键
3、外界因素
思考与讨论
21/28
(1)比较NH3和CH4在水中的溶解度。怎样用相似相溶规律理解它们的溶解度不同?
NH3为极性分子,CH4为非极性分子,而水为极性分子,根据相似相溶规律,NH3易溶于水,而CH4不易溶于水。且NH3与水分子之间可形成氢键,使得NH3更易溶于水。
(2)为什么在日常生活中用有机溶剂(如乙酸乙酯)溶解油漆而不用水?
油漆是非极性分子,有机溶剂(如乙酸乙酯)也是非极性溶剂,而水为极性溶剂,根据相似相溶”规律,应当用有机溶剂溶解油漆而不能用水溶解油漆。
思考与讨论
22/28
实验表明碘在四氯化碳溶液中的溶解性较好。这是因为碘和四氯化碳都是非极性分子,非极性溶质一般能溶于非极性溶剂,而水是极性分子。
碘在水和四氯化碳中的溶解性
(3)在一个小试管里放入一小粒碘晶体,加入约5 mL蒸馏水,观察碘在水中的溶解性(若有不溶的碘,可将碘水溶液倾倒在另一个试管里继续下面的实验)。在碘水溶液中加入约1 mL四氯化碳(CCl4),振荡试管,观察碘被四氯化碳萃取,形成紫红色的碘的四氯化碳溶液。再向试管里加入1 mL浓碘化钾(KI)水溶液,振荡试管,溶液紫色变浅,这是由于在水溶液里可发生如下反应:I2+I- I3-。实验表明碘在纯水还是在四氯化碳中溶解性较好?为什么?
小结
23/28
范德华力、氢键、共价键的比较
概念 范德华力 氢键 共价键
定义 物质分子之间普遍存在的一种作用力 已经与电负性很大的原子形成共价键的氢原子与另一个电负性很大的原子之间的静电作用 原子间通过共用电子对所形成的相互作用
作用微粒 分子 H与N、O、F 原子
特征 无方向性和饱和性 有方向性和饱和性 有方向性和饱和性
强度 共价键>氢键>范德华力
小结
24/28
概念 范德华力 氢键 共价键
影响 强度的 因素 ①随分子极性的增大而增大 ②分子组成和结构相似的物质,相对分子质量越大,范德华力越大 对于X—H…Y,X、Y的电负性越大,Y原子的半径越小,作用越强 成键原子半径和共用电子对数目。键长越小,键能越大,共价键越稳定
对物质 性质的 影响 ①影响物质的熔点、沸点、溶解度等物理性质 ②组成和结构相似的物质,随相对分子质量的增大,物质的熔、沸点升高,如CF4H2S ②分子内氢键降低物质的熔、沸点 共价键键能越大,分子稳定性越强
六
25/28
分子的手性
1.手性异构体
有 的分子。
组成
原子排列
镜像
叠合
手性异构体
具有完全相同的 和 的一对分子,如同左手和右手一样互为 ,却在三维空间里不能 ,互称手性异构体(或对映异构体)
2.手性分子
六
26/28
分子的手性
3.分子的手性判断
(1)判断方法:有机物分子中是否存在 。
(2)手性碳原子:连接四个互不相同的原子或基团的碳原子称为手性碳原子。用*C来标记。具有手性的有机物,是因为其含有手性碳原子。
手性碳原子
六
27/28
分子的手性
4.分子的手性意义
手性分子在生命科学和药物生产方面有广泛的应用。对于手性药物,一个异构体可能是有效的,而另一个异构体可能是无效甚至是有害的。
Thank You
28/49
第二章 分子结构与性质
第三节 分子结构与物质的性质
第二课时 分子间的作用力
1/51
思考与讨论
2/28
冰山融化现象是物理变化还是化学变化?
冰山融化过程中有没有破坏其中的化学键?
那为什么冰山融化过程仍要吸收能量呢?
这说明水分子之间存在着相互作用力。
一
分子间的作用力
3/28
1. 概念:把分子聚集在一起的作用力,叫分子间作用力。(它是许多种物质能以一定的凝聚态如固态和液态存在的重要因素)
常见的有范德华力和氢键两类
2. 本质:属于分子间作用力的一种,本质是一种分子之间的静电作用。
3. 存在:广泛存在于各种分子之间。
一
分子间的作用力
4/28
哪些物质的微粒存在分子间作用力呢?
1、大多数共价化合物,例如: CO2、H2SO4、HF、 H2O、 AlCl3、各种有机化合物等等;
2. 大多数非金属单质,例如:
H2、P4、S8、C60、
3. 各种稀有气体(例如Ar、Kr),等等
1、离子化合物,例如:
NH4Cl、Al2O3、KF,等等;
2、金属单质,例如:Cu、Fe、Na,等等;
3、某些共价化合物,如石英SiO2,金刚砂(SiC)某些非金属单质,如金刚石(C)、晶体硅(Si)等等
二
范德华力
5/28
是一种普遍存在于固体、液体和气体中分子间的作用力。
2、存在:非金属单质(除C、Si)分子、稀有气体分子、共价化合物(除SiO2、SiC)分子之间;石墨片层之间。
3、范德华力与共价键的区别
(1)范德华力很弱,比化学键的键能小1~2个数量级。
(2)范德华力一般没有方向性和饱和性
1、定义:
二
范德华力
6/28
4、影响范德华力的因素
分子 Ar CO HI HBr HCl
范德华力 (kJ/mol) 8.50 8.75 26.00 23.11 21.14
表2-7-1 某些分子间的范德华力
(1)对于组成和结构相似的物质,相对分子质量越大,范德华力越大。
(2)分子极性越大、范德华力越大。
二
范德华力
7/28
4、影响范德华力的因素
表2-7-2 某些分子间的范德华力
(3)相对分子质量相同或相近时,分子的极性越大,范德华力越大。
思考与讨论
8/28
单质 熔点/℃ 沸点/℃
F2 -219.6 -188.1
Cl2 -101 -34.6
Br2 -7.2 58.78
I2 113.5 184.8
表2-8 卤素单质的熔点和沸点
怎样解释卤素单质从F2到I2的熔点和沸点越来越高?
一般当分子结构与组成相似时,相对分子质量越大,范德华力越大。因此,由于F2、Cl2、Br2、I2的相对分子质量逐渐增大,范德华力也逐渐增大,F2、Cl2、Br2、I2的熔点和沸点越来越高。
小结
9/28
判断分子的熔沸点高低的方法
(1)相对分子质量(越大)→范德华力(越大)→熔沸点(越高)
(2)如果两物质的相对分子质量相近,则看分子的极性。
分子的极性(越大)→范德华力(越大)→熔沸点(越高)
例:将下列物质按熔沸点由高到低的顺序排列:
D2O_____H2O I2_____Br2 CO_____N2 CH4_____SiH4
>
>
>
<
思考与讨论
10/28
-150
-125
-100
-75
-50
-25
0
25
50
75
100
2
3
4
5
×
×
×
×
CH4
SiH4
GeH4
SnH4
NH3
PH3
AsH3
SbH3
HF
HCl
HBr
HI
H2O
H2S
H2Se
H2Te
沸点/℃
周期
一些氢化物的沸点
一般:同一主族非金属氢化物,从上到下,Mr逐渐增大,熔沸点应逐渐升高.
而HF、H2O、NH3却出现反常,为什么?
说明在HF、H2O、NH3分子间还存在除范德华力之外的其他分子间作用力—氢键.
三
氢键
11/28
氢键是由已经与_____________的原子形成共价键的_______(如水分子中的H)与另一个电负性很大的原子(如水分子中的O)之间形成的作用力。
电负性很大
氢原子
1、定义:除了范德华力之外的另一种分子间作用力
3、形成条件:① X、Y为N、O、F
②X、Y可以相同,也可以不同
③“—”表示共价键,“ ”表示形成的氢键
2、表示方法:X—H Y
三
氢键
12/28
无内层电子,几乎成为“裸露”的质子
电负性大,半径小
氢键
O
H
H
δ+
δ+
δ-
δ-
…
H—O键极性很强
O
H
H
氢键具有方向性和饱和性
特征
三
氢键
13/28
4、特征:氢键具有方向性和饱和性
①方向性 X—H…Y三个原子一般在同一方向上
原因是在这样的方向上成键两原子电子云之间的排斥力最小,形成的氢键最强,体系最稳定
原因是H原子半径很小,再有一个原子接近时,会受到X、Y原子电子云的排斥。
②饱和性 每一个X—H只能与1个Y原子形成氢键
三
氢键
14/28
5、本质:是静电吸引作用,分子间作用力
比化学键的键能小1~2个数量级,
是一种比范德华力强的分子间作用力。
②分子间氢键
6、分类:①分子内氢键
邻羟基苯甲醛
对羟基苯甲醛
三
氢键
15/28
7.键长: A—H···B ,指A B之间的距离。
8.键能: A—H···B 分解为A—H和B所需要的能量。
X—H···Y强弱 与X和Y的电负性有关.
电负性越大,原子半径越小,则氢键越强。
如F原子电负性最大,因而F-H…F是最强的氢键; 原子吸引电子能力不同,所以氢键强弱变化顺序为:
F-H…F > O-H…O > O-H…N > N-H…N
C原子吸引电子能力较弱,一般不形成氢键。
9. 氢键强弱
三
氢键
16/28
10、氢键对物质性质的影响
分子间存在氢键时,物质在熔化或汽化时,除需破坏范德华力外,还需破坏分子间氢键,消耗更多的能量,所以存在分子间氢键的物质一般具有较高的熔、沸点。
ⅤA~ⅦA族元素的氢化物中,NH3、H2O和HF的熔、沸点比同主族相邻元素氢化物的熔、沸点高,这种反常现象是由于它们各自的分子间形成了氢键。
(1) 对物质熔、沸点的影响
三
氢键
17/28
10、氢键对物质性质的影响
(1) 对物质熔、沸点的影响
①存在分子间氢键的物质一般具有较高的熔、沸点。
②存在分子内氢键使物质熔、沸点降低。
邻羟基苯甲醛的沸点低于对羟基苯甲醛
邻羟基苯甲醛
对羟基苯甲醛
三
氢键
18/28
10、氢键对物质性质的影响
①水结冰时,体积膨胀,密度降低
(2) 对水分子性质的影响
用氢键解释这种异常性:接近水的沸点的水蒸气中存在相当量的水分子因氢键而相互缔合,形成所谓的缔合分子。
氢键的存在迫使在四面体中心的水分子与四面体顶角方向的4个相邻水分子相互吸引,这一排列使冰晶体中的水分子的空间利用率不高,留有相当大的空隙,其密度比液态水小。
②接近水的沸点的水蒸气的相对分子质量的测定值比按化学式H2O计算出来的相对分子质量大。
四
溶解性
19/28
非极性溶质一般能溶于 ,
极性溶质一般能溶于 。
非极性溶剂
极性溶剂
易
难
易
难
1、相似相溶
如蔗糖和氨 溶于水, 溶于四氯化碳。
萘和碘 溶于四氯化碳, 溶于水。
(1)分子极性相似
溶质和溶剂的分子结构相似程度越大,其溶解性越 。
(2)分子结构相似
大
如乙醇与水 ;而戊醇中烃基较大在水中的溶解度明显减小。
互溶
四
溶解性
20/28
主要有 等。
温度和压强
溶剂和溶质之间的氢键作用力越大,溶解性越好;
无氢键相互作用的溶质在有氢键的水中溶解度就比较小
注意:如果溶质与水能发生化学反应,也会增大溶质的溶解度。
2、氢键
3、外界因素
思考与讨论
21/28
(1)比较NH3和CH4在水中的溶解度。怎样用相似相溶规律理解它们的溶解度不同?
NH3为极性分子,CH4为非极性分子,而水为极性分子,根据相似相溶规律,NH3易溶于水,而CH4不易溶于水。且NH3与水分子之间可形成氢键,使得NH3更易溶于水。
(2)为什么在日常生活中用有机溶剂(如乙酸乙酯)溶解油漆而不用水?
油漆是非极性分子,有机溶剂(如乙酸乙酯)也是非极性溶剂,而水为极性溶剂,根据相似相溶”规律,应当用有机溶剂溶解油漆而不能用水溶解油漆。
思考与讨论
22/28
实验表明碘在四氯化碳溶液中的溶解性较好。这是因为碘和四氯化碳都是非极性分子,非极性溶质一般能溶于非极性溶剂,而水是极性分子。
碘在水和四氯化碳中的溶解性
(3)在一个小试管里放入一小粒碘晶体,加入约5 mL蒸馏水,观察碘在水中的溶解性(若有不溶的碘,可将碘水溶液倾倒在另一个试管里继续下面的实验)。在碘水溶液中加入约1 mL四氯化碳(CCl4),振荡试管,观察碘被四氯化碳萃取,形成紫红色的碘的四氯化碳溶液。再向试管里加入1 mL浓碘化钾(KI)水溶液,振荡试管,溶液紫色变浅,这是由于在水溶液里可发生如下反应:I2+I- I3-。实验表明碘在纯水还是在四氯化碳中溶解性较好?为什么?
小结
23/28
范德华力、氢键、共价键的比较
概念 范德华力 氢键 共价键
定义 物质分子之间普遍存在的一种作用力 已经与电负性很大的原子形成共价键的氢原子与另一个电负性很大的原子之间的静电作用 原子间通过共用电子对所形成的相互作用
作用微粒 分子 H与N、O、F 原子
特征 无方向性和饱和性 有方向性和饱和性 有方向性和饱和性
强度 共价键>氢键>范德华力
小结
24/28
概念 范德华力 氢键 共价键
影响 强度的 因素 ①随分子极性的增大而增大 ②分子组成和结构相似的物质,相对分子质量越大,范德华力越大 对于X—H…Y,X、Y的电负性越大,Y原子的半径越小,作用越强 成键原子半径和共用电子对数目。键长越小,键能越大,共价键越稳定
对物质 性质的 影响 ①影响物质的熔点、沸点、溶解度等物理性质 ②组成和结构相似的物质,随相对分子质量的增大,物质的熔、沸点升高,如CF4
六
25/28
分子的手性
1.手性异构体
有 的分子。
组成
原子排列
镜像
叠合
手性异构体
具有完全相同的 和 的一对分子,如同左手和右手一样互为 ,却在三维空间里不能 ,互称手性异构体(或对映异构体)
2.手性分子
六
26/28
分子的手性
3.分子的手性判断
(1)判断方法:有机物分子中是否存在 。
(2)手性碳原子:连接四个互不相同的原子或基团的碳原子称为手性碳原子。用*C来标记。具有手性的有机物,是因为其含有手性碳原子。
手性碳原子
六
27/28
分子的手性
4.分子的手性意义
手性分子在生命科学和药物生产方面有广泛的应用。对于手性药物,一个异构体可能是有效的,而另一个异构体可能是无效甚至是有害的。
Thank You
28/49
