2022-2023学年人教版(2019)化学高一必修一第二章第二节课时1氯气的性质练习题(Word含解析)
文档属性
| 名称 | 2022-2023学年人教版(2019)化学高一必修一第二章第二节课时1氯气的性质练习题(Word含解析) |  | |
| 格式 | zip | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-03 12:09:09 | ||
图片预览




文档简介
2022-2023学年人教版(2019)化学高一必修一第二章第二节课时1氯气的性质练习题
学校:___________姓名:___________班级:_____________
一、单选题
1.可将氯气用软管通到田鼠洞中用于消灭田鼠,这是利用了氯气下列性质中的( )
①有毒②密度比空气大③黄绿色④易液化⑤溶于水
A.①② B.②③ C.①②③ D.③④⑤
2.除去氯气中混有的氯化氢气体,可将气体通过 ( )
A.澄清石灰水 B.饱和碳酸氢钠溶液 C.饱和食盐水 D.苛性钠溶液
3.在氯水中存在多种分子和离子,它们在不同的反应中表现各自的性质,下列关于氯水的说法正确的是( )
A.氯水放置数天后,pH将变大
B.加入有色布条,布条褪色,说明溶液中有HClO
C.光照氯水有气泡冒出,该气体是氯气
D.新制氯水能使蓝色石蕊试纸变红但不褪色
4.在pH 试纸上滴一滴新制的氯水,现象如图所示。下列说法正确的是 ( )
A.该实验说明Cl2分子具有漂白性
B.该实验说明H+扩散速度比HClO分子快
C.若用久置的氯水进行实验,也能产生相同的实验现象
D.将实验后的pH试纸在酒精灯上微热,试纸又恢复为原来的颜色
5.向新制氯水中加入下列物质,产生的现象、解释或离子方程式均正确的是( )
选项 加入物质 现象 解释或离子方程式
A 溶液 有白色沉淀生成
B 石蕊试液 显红色 氯水中有、
C 有气体放出
D 有色布条 有色布条褪色 Cl2有漂白性
A.A B.B C.C D.D
6.向盛有紫色石蕊溶液的试管中持续通入氯气至过量,溶液颜色可能出现无色、浅黄绿色、红色等变化。
下列叙述正确的是 ( )
A.过程I溶液由紫色变成红色,起作用的微粒是
B.过程II溶液由红色变成无色,证明试管②中溶液不再呈酸性
C.过程III溶液由无色变成浅黄绿色,证明溶液中有
D.若向紫色石蕊试液中持续加入粉末,也会出现相同的颜色变化
7.下列变化过程不能直接实现的是 ( )
HCl Cl2 Ca(ClO)2HClOCO2
A.① B.② C.③ D.④
8.是重要的工业原料,可用于生产盐酸、漂白粉及制氯仿等有机溶剂。的制备可用下列反应:NaClO+2HCl(浓)=NaCl+Cl2↑+H2O,下列关于氯及其化合物的性质与用途具有对应关系的是 ( )
A.易液化,可用于生产盐酸
B.NaCl熔点较高,可用作防腐剂
C.盐酸具有挥发性,可用于除铁锈
D.NaClO具有强氧化性,可用作漂白剂
9.化学来源于生活,也服务于生活。下列有关生活中的化学知识叙述错误的是( )
A.氯气与烧碱溶液或石灰乳反应都能得到含氯漂白剂
B.“84”消毒液的有效成分是次氯酸钠
C.《神农本草经》中提到:“白青(Cu2(OH)2CO3)得铁化为铜”,其中白青属于盐
D.漂白粉在空气中久置变质,是因为其中的CaCl2与空气中的CO2反应生成CaCO3
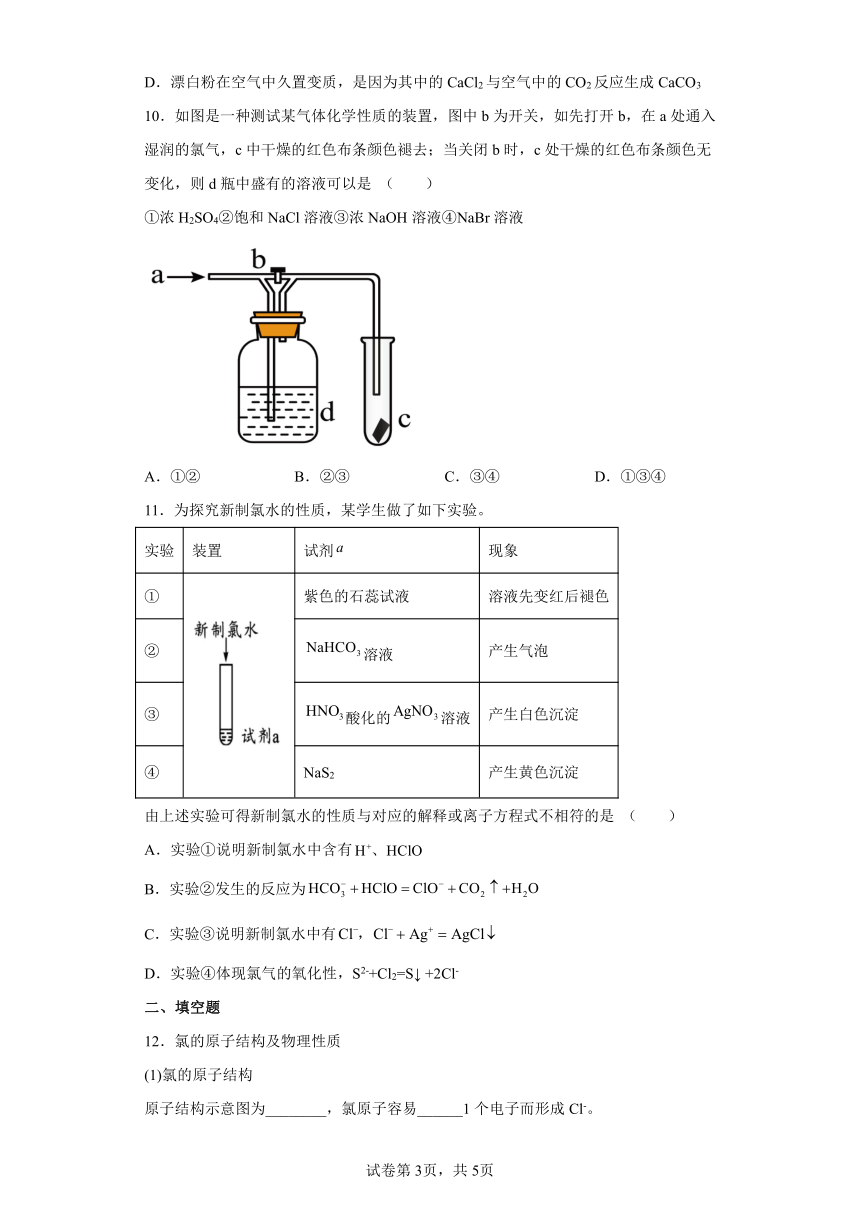
10.如图是一种测试某气体化学性质的装置,图中b为开关,如先打开b,在a处通入湿润的氯气,c中干燥的红色布条颜色褪去;当关闭b时,c处干燥的红色布条颜色无变化,则d瓶中盛有的溶液可以是 ( )
①浓H2SO4②饱和NaCl溶液③浓NaOH溶液④NaBr溶液
A.①② B.②③ C.③④ D.①③④
11.为探究新制氯水的性质,某学生做了如下实验。
实验 装置 试剂 现象
① 紫色的石蕊试液 溶液先变红后褪色
② 溶液 产生气泡
③ 酸化的溶液 产生白色沉淀
④ NaS2 产生黄色沉淀
由上述实验可得新制氯水的性质与对应的解释或离子方程式不相符的是 ( )
A.实验①说明新制氯水中含有
B.实验②发生的反应为
C.实验③说明新制氯水中有
D.实验④体现氯气的氧化性,S2-+Cl2=S↓ +2Cl-
二、填空题
12.氯的原子结构及物理性质
(1)氯的原子结构
原子结构示意图为________,氯原子容易______1个电子而形成Cl-。
(2)氯气的物理性质
氯气是一种________色、密度比空气_______、有______气味的________气体。氯气易________,在加压条件下,氯气转化为_________,可储存在________中。
13.新制氯水成分复杂,可发生多种不同的反应。向新制的氯水中分别加入下列物质,写出反应的离子方程式:
(1)金属镁________________________________。
(2)氯化亚铁溶液______________________________。
(3)碳酸钠溶液______________________________。
(4)硝酸银溶液_____________________________。
14.下图表示在没有通风橱时制取纯净的氯气设计的装置图,图中A、B是可控制的弹簧铁夹。
(1)烧杯中盛放的液体是___________,其作用是___________,水槽中盛放的液体是___________。
(2)简述操作过程:(从氯气已经产生开始)在收集氯气之前,应___________;当氯气纯度合乎要求时,应___________;当氯气收集完毕时,应___________。
三、实验题
15.实验室用如下装置制取氯气,并用氯气进行实验。回答下列问题:
(1)A中盛有浓盐酸,B中盛有MnO2,写出反应的化学方程式:_____。
(2)E中为红色干布条,F中为红色湿布条,可观察到的现象是_____。对比E和F中现象的差异可得出的结论及解释是_____。
(3)试管C和D中试剂各为_____。
(4)装置G处发生反应的化学方程式为_____。
(5)用化学方程式表示试剂X的作用:_____。
参考答案:
1.A
【详解】将氯气用软管通到田鼠洞中用于消灭田鼠,这是由于氯气有毒,密度比空气大,而与其是否有颜色及是否易溶于水、是否易液化的性质无关,即有关的性质序号为①②,故合理选项是A。
2.C
B.饱和碳酸氢钠溶液与氯化氢反应后生成二氧化碳气体,引入新杂质,其亦会促进氯气的溶解,B错误;
C.氯化氢极易饱和食盐水中,且溶液抑制氯气的溶解,C正确;
D.苛性钠溶液能与氯气反应,D错误;
故选C。
3.B
【详解】A.HClO是弱酸,HCl是强酸,HClO见光易分解为HCl和,所以氯水放置数天后,pH将变小,A不正确
B.HClO具有漂白性,加入有色布条,布条褪色,说明溶液中有HClO,B项正确;
C.HClO不稳定,见光易分解为HCl和,冒出的气泡是,C项不正确;
D.溶于水时,部分与水反应生成HCl和HClO,因此新制氯水具有酸性,可使蓝色石蕊试纸先变红,由于HClO具有漂白性,后又使其褪色,D项不正确。
4.B
【详解】A.氯气与水发生Cl2+H2O HCl+HClO反应,所以新制的氯水存在HClO,HClO具有漂白性,Cl2无漂白性,故A错误;
B.由实验可知,滴加氯水的中间区域变白色,而周围变成红色,可说明H+的扩散速度比HClO分子快,故B正确;
C.氯水中HClO会发生2HClO2HCl+O2↑反应,久置的氯水主要成分为稀盐酸无漂白性,若用久置的氯水进行实验,只变红不漂白,所以现象会不同,故C错误;
D.次氯酸的漂白性属于氧化性漂白,不具有可逆性,加热不能恢复到原来的颜色,故D错误;
故选:B。
5.A
【详解】A.氯水中存在Cl-,Cl-与Ag+反应生成白色沉淀,离子方程式为Ag+ + Cl- = AgCl,A正确;
B.氯水中有较多量的H+,能使石蕊试液显红色,存在HClO分子,HClO具有漂白性,所以溶液先变红后褪色,B错误;
C.氯水中有较多量的H+,能与CaCO3反应生成氯化钙、水和二氧化碳,离子方程式为CaCO3+2H+=Ca2++H2O+CO2,C错误;
D.氯水中存在HClO具有漂白性,能够使有色布条褪色,而Cl2不具有漂白性,D错误。
6.A
【分析】氯气与水反应方程式:Cl2+H2O HCl+HClO,生成HCl、HClO,HCl、HClO具有酸性,HClO具有漂白性,氯气能溶于水形成氯水溶液,过氧化钠和水反应生成氢氧化钠,过氧化钠具有强氧化性。
【详解】A.过程Ⅰ溶液由紫色变成红色,起作用的微粒是,A正确;
B.过程Ⅱ溶液由红色变成无色,是因为具有漂白性,溶液仍然呈酸性,B错误;
C.过程Ⅲ溶液由无色变成浅黄绿色,是因为溶液中溶有氯气,C错误;
D.若向紫色石蕊试液中持续加入粉末,则溶液先变蓝色,后褪色,D错误;
故选A。
7.D
【详解】A.浓HCl和二氧化锰固体加热时可以生成氯气,故①可以实现,A不符合;
B.氯气与氢氧化钙反应生成次氯酸钙、氯化钙和水,故②可以实现,B不符合;
C.次氯酸钙溶液中通入二氧化碳即可生成次氯酸,故③可以实现,C不符合;
D.次氯酸的酸性小于碳酸,次氯酸不能制备二氧化碳,故④不可以实现,D符合;
故选D。
8.D
【详解】A.生产盐酸,是用氯气与氢气反应,与氯气易液化无关,故A错误;
B.高盐能使细胞脱水死亡,氯化钠抑制微生物的生长,作防腐剂,与氯化钠熔点高低无关,故B错误;
C.盐酸除去铁锈,利用盐酸的酸性,与挥发性无关,故C错误;
D.次氯酸钠具有强氧化性,可作漂白剂,故D正确;
答案为D。
9.D
【详解】
A. 氯气与烧碱溶液或石灰乳反应生成次氯酸钠或次氯酸钙,次氯酸钠或次氯酸钙具有强氧化性,可作消毒剂,故A不选;
B. “84”消毒液的有效成分是次氯酸钠,故B不选;
C.Cu2(OH)2CO3是盐,故C不选;
D.漂白粉在空气中久置变质,是因为其中的Ca(ClO)2与空气中的CO2反应生成HClO和CaCO3,次氯酸不稳定分解成氯化氢和氧气,故D选;
故选:D。
10.D
【详解】当关闭b时,c处干燥的红色布条颜色无变化,说明d中试剂吸收了水蒸气或将Cl2反应。
①浓硫酸可以吸收水蒸气,①符合题意;
②饱和NaCl溶液,不与氯气反应、也不能吸收水蒸气,②不符合题意;
③NaOH溶液可以与Cl2反应,Cl2+2NaOH=NaCl+NaClO+H2O,③符合题意;
④NaBr溶液可以与Cl2反应,Cl2+2NaBr=2NaCl+Br2,④符合题意;
综上所述①③④符合题意,故选D。
11.B
【详解】新制氯水存在平衡Cl2+H2O HCl+HClO,主要成分有:Cl2、H+、HClO、Cl-等;
A.有H+存在,紫色的石蕊试液变红,氯水中有HClO具有漂白性,则溶液先变红后褪色,故A正确;
B.碳酸的酸性比HClO的酸性强,根据强酸制弱酸原理,离子方程式书写错误,正确为 +H+=CO2↑+H2O,故B错误;
C.新制氯水中有Cl-,和Ag+反应生成白色沉淀,离子方程式为Cl-+Ag+═AgCl↓,故C正确;
D.新制氯水中Cl2具有强氧化性,可以氧化S2-,离子方程式为S2-+Cl2=S↓+2Cl-,故D正确;
故答案为B。
12.(1) 得到
(2) 黄绿 大 刺激性 有毒 液化 液态 钢瓶
【解析】略
13. Mg+2H+=Mg2++H2↑ 2Fe2++Cl2=2Fe3++2Cl- CO32-+2H+=CO2↑+H2O Cl-+Ag+=AgCl↓
【分析】(1)Mg与氯水中的HCl反应生成氯化镁和氢气;
(2)氯气与氯化亚铁反应生成氯化铁;
(3)Na2CO3与盐酸反应生成氯化钠和二氧化碳、水;
(4)氯离子与银离子反应生成AgCl沉淀。
【详解】(1)向新制氯水中加入金属Mg,Mg与氯水中的HCl反应生成氯化镁和氢气,其反应的离子方程式为:Mg+2H+=Mg2++H2↑;
(2)氯水中加入FeCl2溶液,发生反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-;
(3)向新制氯水中加入Na2CO3,Na2CO3与盐酸反应生成氯化钠和二氧化碳、水,其离子方程式为:CO32-+2H+=CO2↑+H2O;
(4)氯水中加入AgNO3溶液,氯离子与银离子反应生成AgCl沉淀,发生反应的离子方程式为Cl-+Ag+=AgCl↓。
14.(1) NaOH溶液 吸收多余的Cl2 饱和食盐水
(2) 打开B夹,关闭A夹 打开A夹,关闭B夹 打开B夹,关闭A夹
【分析】(1)
因为氯气有毒,可污染空气,要进行尾气吸收,并且氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水,所以常用氢氧化钠溶液吸收尾气,烧杯中盛放氢氧化钠溶液收;氯气在饱和氯化钠溶液中的溶解度较小,实验室常用排饱和食盐水法收集氨气,即水槽中盛放的液体是饱和食盐水。
(2)
氯气在饱和氯化钠溶液中的溶解度很小,实验室常用排饱和食盐水法收集氯气,收集时,为得到较为纯净的氯气,应先排除装置内的空气,则应打开B夹,关闭A夹;收集时,应打开A夹,关闭B夹,收集完毕,关闭A夹,打开B夹,多余的气体通入氢氧化钠溶液进行吸收,防止污染空气。
15.(1)MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
(2) E中不褪色,F中褪色 干燥的氯气没有漂白性,氯气和水反应生成的次氯酸有漂白性
(3)饱和食盐水和浓硫酸
(4)2KI+Cl2═2KCl+I2
(5)Cl2+2NaOH=NaCl+NaClO+H2O
试卷第1页,共3页
试卷第1页,共3页
学校:___________姓名:___________班级:_____________
一、单选题
1.可将氯气用软管通到田鼠洞中用于消灭田鼠,这是利用了氯气下列性质中的( )
①有毒②密度比空气大③黄绿色④易液化⑤溶于水
A.①② B.②③ C.①②③ D.③④⑤
2.除去氯气中混有的氯化氢气体,可将气体通过 ( )
A.澄清石灰水 B.饱和碳酸氢钠溶液 C.饱和食盐水 D.苛性钠溶液
3.在氯水中存在多种分子和离子,它们在不同的反应中表现各自的性质,下列关于氯水的说法正确的是( )
A.氯水放置数天后,pH将变大
B.加入有色布条,布条褪色,说明溶液中有HClO
C.光照氯水有气泡冒出,该气体是氯气
D.新制氯水能使蓝色石蕊试纸变红但不褪色
4.在pH 试纸上滴一滴新制的氯水,现象如图所示。下列说法正确的是 ( )
A.该实验说明Cl2分子具有漂白性
B.该实验说明H+扩散速度比HClO分子快
C.若用久置的氯水进行实验,也能产生相同的实验现象
D.将实验后的pH试纸在酒精灯上微热,试纸又恢复为原来的颜色
5.向新制氯水中加入下列物质,产生的现象、解释或离子方程式均正确的是( )
选项 加入物质 现象 解释或离子方程式
A 溶液 有白色沉淀生成
B 石蕊试液 显红色 氯水中有、
C 有气体放出
D 有色布条 有色布条褪色 Cl2有漂白性
A.A B.B C.C D.D
6.向盛有紫色石蕊溶液的试管中持续通入氯气至过量,溶液颜色可能出现无色、浅黄绿色、红色等变化。
下列叙述正确的是 ( )
A.过程I溶液由紫色变成红色,起作用的微粒是
B.过程II溶液由红色变成无色,证明试管②中溶液不再呈酸性
C.过程III溶液由无色变成浅黄绿色,证明溶液中有
D.若向紫色石蕊试液中持续加入粉末,也会出现相同的颜色变化
7.下列变化过程不能直接实现的是 ( )
HCl Cl2 Ca(ClO)2HClOCO2
A.① B.② C.③ D.④
8.是重要的工业原料,可用于生产盐酸、漂白粉及制氯仿等有机溶剂。的制备可用下列反应:NaClO+2HCl(浓)=NaCl+Cl2↑+H2O,下列关于氯及其化合物的性质与用途具有对应关系的是 ( )
A.易液化,可用于生产盐酸
B.NaCl熔点较高,可用作防腐剂
C.盐酸具有挥发性,可用于除铁锈
D.NaClO具有强氧化性,可用作漂白剂
9.化学来源于生活,也服务于生活。下列有关生活中的化学知识叙述错误的是( )
A.氯气与烧碱溶液或石灰乳反应都能得到含氯漂白剂
B.“84”消毒液的有效成分是次氯酸钠
C.《神农本草经》中提到:“白青(Cu2(OH)2CO3)得铁化为铜”,其中白青属于盐
D.漂白粉在空气中久置变质,是因为其中的CaCl2与空气中的CO2反应生成CaCO3
10.如图是一种测试某气体化学性质的装置,图中b为开关,如先打开b,在a处通入湿润的氯气,c中干燥的红色布条颜色褪去;当关闭b时,c处干燥的红色布条颜色无变化,则d瓶中盛有的溶液可以是 ( )
①浓H2SO4②饱和NaCl溶液③浓NaOH溶液④NaBr溶液
A.①② B.②③ C.③④ D.①③④
11.为探究新制氯水的性质,某学生做了如下实验。
实验 装置 试剂 现象
① 紫色的石蕊试液 溶液先变红后褪色
② 溶液 产生气泡
③ 酸化的溶液 产生白色沉淀
④ NaS2 产生黄色沉淀
由上述实验可得新制氯水的性质与对应的解释或离子方程式不相符的是 ( )
A.实验①说明新制氯水中含有
B.实验②发生的反应为
C.实验③说明新制氯水中有
D.实验④体现氯气的氧化性,S2-+Cl2=S↓ +2Cl-
二、填空题
12.氯的原子结构及物理性质
(1)氯的原子结构
原子结构示意图为________,氯原子容易______1个电子而形成Cl-。
(2)氯气的物理性质
氯气是一种________色、密度比空气_______、有______气味的________气体。氯气易________,在加压条件下,氯气转化为_________,可储存在________中。
13.新制氯水成分复杂,可发生多种不同的反应。向新制的氯水中分别加入下列物质,写出反应的离子方程式:
(1)金属镁________________________________。
(2)氯化亚铁溶液______________________________。
(3)碳酸钠溶液______________________________。
(4)硝酸银溶液_____________________________。
14.下图表示在没有通风橱时制取纯净的氯气设计的装置图,图中A、B是可控制的弹簧铁夹。
(1)烧杯中盛放的液体是___________,其作用是___________,水槽中盛放的液体是___________。
(2)简述操作过程:(从氯气已经产生开始)在收集氯气之前,应___________;当氯气纯度合乎要求时,应___________;当氯气收集完毕时,应___________。
三、实验题
15.实验室用如下装置制取氯气,并用氯气进行实验。回答下列问题:
(1)A中盛有浓盐酸,B中盛有MnO2,写出反应的化学方程式:_____。
(2)E中为红色干布条,F中为红色湿布条,可观察到的现象是_____。对比E和F中现象的差异可得出的结论及解释是_____。
(3)试管C和D中试剂各为_____。
(4)装置G处发生反应的化学方程式为_____。
(5)用化学方程式表示试剂X的作用:_____。
参考答案:
1.A
【详解】将氯气用软管通到田鼠洞中用于消灭田鼠,这是由于氯气有毒,密度比空气大,而与其是否有颜色及是否易溶于水、是否易液化的性质无关,即有关的性质序号为①②,故合理选项是A。
2.C
B.饱和碳酸氢钠溶液与氯化氢反应后生成二氧化碳气体,引入新杂质,其亦会促进氯气的溶解,B错误;
C.氯化氢极易饱和食盐水中,且溶液抑制氯气的溶解,C正确;
D.苛性钠溶液能与氯气反应,D错误;
故选C。
3.B
【详解】A.HClO是弱酸,HCl是强酸,HClO见光易分解为HCl和,所以氯水放置数天后,pH将变小,A不正确
B.HClO具有漂白性,加入有色布条,布条褪色,说明溶液中有HClO,B项正确;
C.HClO不稳定,见光易分解为HCl和,冒出的气泡是,C项不正确;
D.溶于水时,部分与水反应生成HCl和HClO,因此新制氯水具有酸性,可使蓝色石蕊试纸先变红,由于HClO具有漂白性,后又使其褪色,D项不正确。
4.B
【详解】A.氯气与水发生Cl2+H2O HCl+HClO反应,所以新制的氯水存在HClO,HClO具有漂白性,Cl2无漂白性,故A错误;
B.由实验可知,滴加氯水的中间区域变白色,而周围变成红色,可说明H+的扩散速度比HClO分子快,故B正确;
C.氯水中HClO会发生2HClO2HCl+O2↑反应,久置的氯水主要成分为稀盐酸无漂白性,若用久置的氯水进行实验,只变红不漂白,所以现象会不同,故C错误;
D.次氯酸的漂白性属于氧化性漂白,不具有可逆性,加热不能恢复到原来的颜色,故D错误;
故选:B。
5.A
【详解】A.氯水中存在Cl-,Cl-与Ag+反应生成白色沉淀,离子方程式为Ag+ + Cl- = AgCl,A正确;
B.氯水中有较多量的H+,能使石蕊试液显红色,存在HClO分子,HClO具有漂白性,所以溶液先变红后褪色,B错误;
C.氯水中有较多量的H+,能与CaCO3反应生成氯化钙、水和二氧化碳,离子方程式为CaCO3+2H+=Ca2++H2O+CO2,C错误;
D.氯水中存在HClO具有漂白性,能够使有色布条褪色,而Cl2不具有漂白性,D错误。
6.A
【分析】氯气与水反应方程式:Cl2+H2O HCl+HClO,生成HCl、HClO,HCl、HClO具有酸性,HClO具有漂白性,氯气能溶于水形成氯水溶液,过氧化钠和水反应生成氢氧化钠,过氧化钠具有强氧化性。
【详解】A.过程Ⅰ溶液由紫色变成红色,起作用的微粒是,A正确;
B.过程Ⅱ溶液由红色变成无色,是因为具有漂白性,溶液仍然呈酸性,B错误;
C.过程Ⅲ溶液由无色变成浅黄绿色,是因为溶液中溶有氯气,C错误;
D.若向紫色石蕊试液中持续加入粉末,则溶液先变蓝色,后褪色,D错误;
故选A。
7.D
【详解】A.浓HCl和二氧化锰固体加热时可以生成氯气,故①可以实现,A不符合;
B.氯气与氢氧化钙反应生成次氯酸钙、氯化钙和水,故②可以实现,B不符合;
C.次氯酸钙溶液中通入二氧化碳即可生成次氯酸,故③可以实现,C不符合;
D.次氯酸的酸性小于碳酸,次氯酸不能制备二氧化碳,故④不可以实现,D符合;
故选D。
8.D
【详解】A.生产盐酸,是用氯气与氢气反应,与氯气易液化无关,故A错误;
B.高盐能使细胞脱水死亡,氯化钠抑制微生物的生长,作防腐剂,与氯化钠熔点高低无关,故B错误;
C.盐酸除去铁锈,利用盐酸的酸性,与挥发性无关,故C错误;
D.次氯酸钠具有强氧化性,可作漂白剂,故D正确;
答案为D。
9.D
【详解】
A. 氯气与烧碱溶液或石灰乳反应生成次氯酸钠或次氯酸钙,次氯酸钠或次氯酸钙具有强氧化性,可作消毒剂,故A不选;
B. “84”消毒液的有效成分是次氯酸钠,故B不选;
C.Cu2(OH)2CO3是盐,故C不选;
D.漂白粉在空气中久置变质,是因为其中的Ca(ClO)2与空气中的CO2反应生成HClO和CaCO3,次氯酸不稳定分解成氯化氢和氧气,故D选;
故选:D。
10.D
【详解】当关闭b时,c处干燥的红色布条颜色无变化,说明d中试剂吸收了水蒸气或将Cl2反应。
①浓硫酸可以吸收水蒸气,①符合题意;
②饱和NaCl溶液,不与氯气反应、也不能吸收水蒸气,②不符合题意;
③NaOH溶液可以与Cl2反应,Cl2+2NaOH=NaCl+NaClO+H2O,③符合题意;
④NaBr溶液可以与Cl2反应,Cl2+2NaBr=2NaCl+Br2,④符合题意;
综上所述①③④符合题意,故选D。
11.B
【详解】新制氯水存在平衡Cl2+H2O HCl+HClO,主要成分有:Cl2、H+、HClO、Cl-等;
A.有H+存在,紫色的石蕊试液变红,氯水中有HClO具有漂白性,则溶液先变红后褪色,故A正确;
B.碳酸的酸性比HClO的酸性强,根据强酸制弱酸原理,离子方程式书写错误,正确为 +H+=CO2↑+H2O,故B错误;
C.新制氯水中有Cl-,和Ag+反应生成白色沉淀,离子方程式为Cl-+Ag+═AgCl↓,故C正确;
D.新制氯水中Cl2具有强氧化性,可以氧化S2-,离子方程式为S2-+Cl2=S↓+2Cl-,故D正确;
故答案为B。
12.(1) 得到
(2) 黄绿 大 刺激性 有毒 液化 液态 钢瓶
【解析】略
13. Mg+2H+=Mg2++H2↑ 2Fe2++Cl2=2Fe3++2Cl- CO32-+2H+=CO2↑+H2O Cl-+Ag+=AgCl↓
【分析】(1)Mg与氯水中的HCl反应生成氯化镁和氢气;
(2)氯气与氯化亚铁反应生成氯化铁;
(3)Na2CO3与盐酸反应生成氯化钠和二氧化碳、水;
(4)氯离子与银离子反应生成AgCl沉淀。
【详解】(1)向新制氯水中加入金属Mg,Mg与氯水中的HCl反应生成氯化镁和氢气,其反应的离子方程式为:Mg+2H+=Mg2++H2↑;
(2)氯水中加入FeCl2溶液,发生反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-;
(3)向新制氯水中加入Na2CO3,Na2CO3与盐酸反应生成氯化钠和二氧化碳、水,其离子方程式为:CO32-+2H+=CO2↑+H2O;
(4)氯水中加入AgNO3溶液,氯离子与银离子反应生成AgCl沉淀,发生反应的离子方程式为Cl-+Ag+=AgCl↓。
14.(1) NaOH溶液 吸收多余的Cl2 饱和食盐水
(2) 打开B夹,关闭A夹 打开A夹,关闭B夹 打开B夹,关闭A夹
【分析】(1)
因为氯气有毒,可污染空气,要进行尾气吸收,并且氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水,所以常用氢氧化钠溶液吸收尾气,烧杯中盛放氢氧化钠溶液收;氯气在饱和氯化钠溶液中的溶解度较小,实验室常用排饱和食盐水法收集氨气,即水槽中盛放的液体是饱和食盐水。
(2)
氯气在饱和氯化钠溶液中的溶解度很小,实验室常用排饱和食盐水法收集氯气,收集时,为得到较为纯净的氯气,应先排除装置内的空气,则应打开B夹,关闭A夹;收集时,应打开A夹,关闭B夹,收集完毕,关闭A夹,打开B夹,多余的气体通入氢氧化钠溶液进行吸收,防止污染空气。
15.(1)MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
(2) E中不褪色,F中褪色 干燥的氯气没有漂白性,氯气和水反应生成的次氯酸有漂白性
(3)饱和食盐水和浓硫酸
(4)2KI+Cl2═2KCl+I2
(5)Cl2+2NaOH=NaCl+NaClO+H2O
试卷第1页,共3页
试卷第1页,共3页
