专题3第三单元 盐类的水解 第1课时 盐类水解的原理(共68张ppt)
文档属性
| 名称 | 专题3第三单元 盐类的水解 第1课时 盐类水解的原理(共68张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-02 19:26:44 | ||
图片预览








文档简介
(共68张PPT)
DIYIKESHI
盐溶液的酸碱性及原因 / 盐类水解方程式的书写 / 课时对点练
盐类水解的原理
专题3
第1课时
1.变化观念与平衡思想:
认识盐类水解有一定限度,理解盐类水解的概念,能正确书写盐类水解的离子方程式和化学方程式。
2.证据推理与模型认知:
通过实验分析、推理等方法认识盐类水解的实质,掌握盐溶液呈现酸、碱性的原因和规律,能根据盐的组成判断溶液的酸、碱性。
内容索引
一、盐溶液的酸碱性及原因
二、盐类水解方程式的书写
课时对点练
盐溶液的酸碱性及原因
一
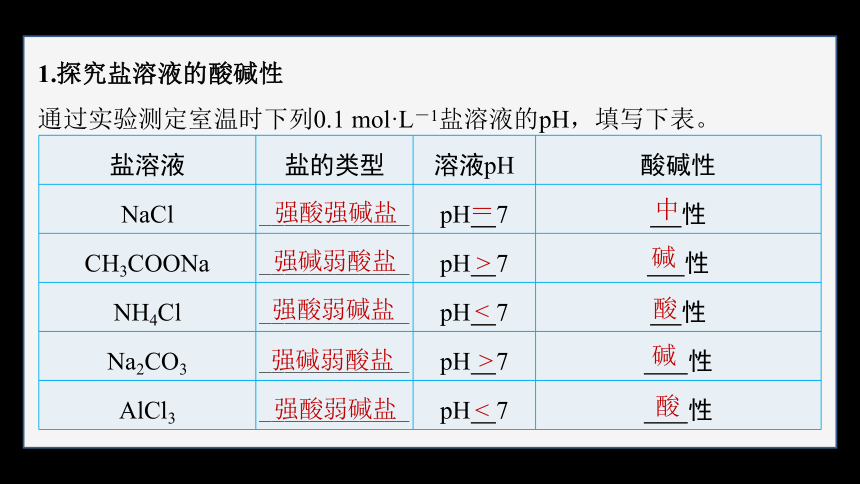
1.探究盐溶液的酸碱性
通过实验测定室温时下列0.1 mol·L-1盐溶液的pH,填写下表。
盐溶液 盐的类型 溶液pH 酸碱性
NaCl ____________ pH 7 性
CH3COONa ____________ pH 7 性
NH4Cl ____________ pH 7 性
Na2CO3 ____________ pH 7 性
AlCl3 ____________ pH 7 性
强酸强碱盐
强碱弱酸盐
强酸弱碱盐
强碱弱酸盐
强酸弱碱盐
=
>
<
>
<
中
碱
酸
碱
酸
2.盐溶液呈现酸碱性的理论分析
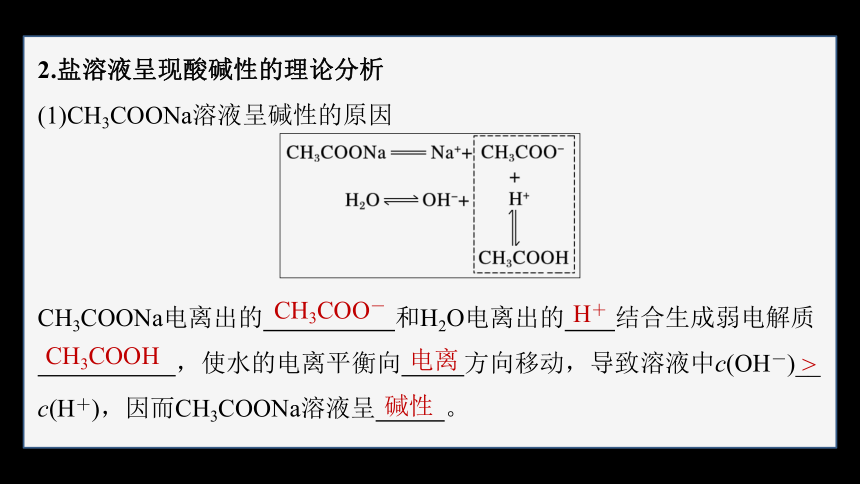
(1)CH3COONa溶液呈碱性的原因
CH3COONa电离出的 和H2O电离出的 结合生成弱电解质
,使水的电离平衡向 方向移动,导致溶液中c(OH-)__
c(H+),因而CH3COONa溶液呈 。
CH3COO-
H+
CH3COOH
电离
>
碱性
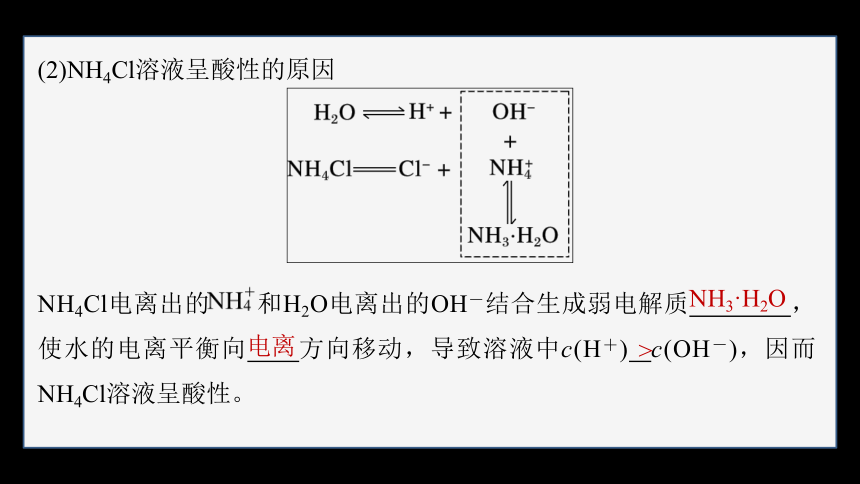
(2)NH4Cl溶液呈酸性的原因
NH4Cl电离出的 和H2O电离出的OH-结合生成弱电解质 ,使水的电离平衡向 方向移动,导致溶液中c(H+) c(OH-),因而NH4Cl溶液呈酸性。
NH3·H2O
电离
>
(3)NaCl溶液呈中性的原因
NaCl溶于水后电离出的Na+和Cl-均不能与水电离出的OH-或H+结合,水的电离平衡不发生移动,溶液中c(H+)=c(OH-),因而NaCl溶液呈中性。
3.盐类的水解
(1)概念:盐在水溶液中电离出的离子与水电离出的 结合生成
的反应。
H+或OH-
弱电解质
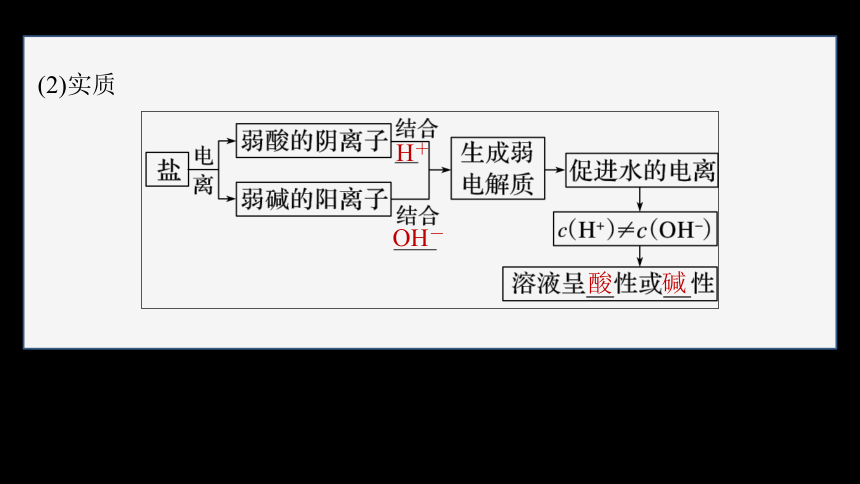
(2)实质
H+
OH-
酸
碱
(3)盐类水解的特点
可逆
逆过程
分步进行的
第一步
(1)盐类的水解过程促进了水的电离( )
(2)酸碱恰好中和生成的盐溶液一定显中性( )
(3)盐溶液显酸性、碱性还是中性,取决于溶液中c(H+)与c(OH-)的相对大小( )
(4)盐水解后,溶液不是呈酸性就是呈碱性( )
正误判断
×
√
√
×
1.碳酸钠溶液和氢氧化钠溶液都呈碱性,它们对水的电离影响是否相同?
2.根据酸碱中和滴定中指示剂的选择原则,判断强酸强碱间的滴定、强酸弱碱间的滴定(如盐酸与氨水)、强碱弱酸间的滴定(如醋酸与氢氧化钠)所用的指示剂?
提示 强酸强碱间的滴定:酚酞、甲基橙;强酸弱碱间的滴定:甲基橙;强碱弱酸间的滴定:酚酞。
3.室温下,测得等浓度的CH3COONa和NaClO的pH,发现NaClO溶液的pH大,试分析原因。
提示 因为酸性:CH3COOH>HClO,故ClO-在溶液中的水解能力较强,因此NaClO溶液的pH大。
应用体验
(1)在水溶液中,水解呈碱性的离子是_____________________。
(2)在水溶液中,水解呈酸性的离子是_________________。
(3)既能在酸性较强的溶液里大量存在,又能在碱性较强的溶液里大量存在的离子有_________________。
2.常温下,某浓度的NH4Cl溶液的pH为4,回答下列问题。
(1)该氯化铵溶液中含氮元素的微粒有_______________。
(2)比较该溶液中的c(Cl-)____(填“>”“<”或“=”,下同)c( )。
>
(3)该氯化铵溶液中水电离的氢离子浓度___pH=4的盐酸中水电离的氢离子浓度。
(4)该氯化铵溶液中水电离的c(H+)与pH=4的盐酸中水电离的c(H+)比值为____。
>
106
pH=4的NH4Cl溶液中水电离的c(H+)=10-4mol·L-1,pH=4的盐酸中水电离的c(H+)=10-10 mol·L-1,则该NH4Cl溶液中c水(H+)与pH=4的盐酸中c水(H+)的比值为 =106。
归纳总结
盐类水解的规律
(1)
(2)常见的“弱”离子
①弱碱阳离子: 、金属活动性顺序表Na之后的金属阳离子,如
Mg2+、Al3+、Fe3+等。
归纳总结
返回
盐类水解方程式的书写
二
1.盐类水解程度一般很小,水解时通常不生成沉淀和气体,书写水解的离子方程式时,一般用“ ”连接,产物不标“↑”或“↓”。如:
(1)NaClO: ;
(2)(NH4)2SO4: 。
2.多元弱酸酸根离子的水解分步进行,以第一步为主。如Na2CO3:
、 。
3.多元弱碱阳离子水解反应过程复杂,要求一步写到底。如AlCl3:
。
正误判断
×
√
×
×
×
特别提醒
应用体验
1.写出下列物质发生水解反应的离子方程式,并指明溶液的酸碱性:
(1)Na2S:____________________________________________________。
(2)CuSO4:__________________________________________________。
(3)NH4NO3:________________________________________________。
(4)CH3COONa:_____________________________________________。
Na2S、CH3COONa为强碱弱酸盐,溶液呈碱性;CuSO4、NH4NO3为强酸弱碱盐,溶液呈酸性。
水解程度
归纳总结
弱酸的酸式酸根离子在水溶液中存在电离平衡和水解平衡,弱酸酸式盐溶液的酸碱性取决于其电离程度和水解程度的相对大小。
(1)水解程度大于电离程度:如呈碱性的NaHCO3、NaHS、Na2HPO4溶液。
(2)电离程度大于水解程度:如呈酸性的NaHSO3、KHC2O4、NaH2PO4溶液。
返回
课时对点练
题组一 盐类水解的实质及规律
1.下列物质的水溶液呈碱性的是
A.KNO3 B.NaHCO3
C.NH4Cl D.NaHSO4
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
KNO3在溶液中完全电离产生钾离子和硝酸根离子,二者均不水解,溶液呈中性,故A不符合;
2.(2020·浙江7月选考,1改编)水溶液呈酸性的是
A.NaCl B.(NH4)2SO4
C.HCOONa D.NaHCO3
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
NaCl是强酸强碱盐,不能水解,其水溶液呈中性,A不符合题意;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
HCOONa属于强碱弱酸盐,在水溶液中可以完全电离,电离产生的HCOO-可以发生水解,其水解的离子方程式为HCOO-+H2O
HCOOH+OH-,故其水溶液呈碱性,C不符合题意;
NaHCO3是弱酸的酸式盐,既能发生电离又能发生水解,但其水解程度大于电离程度,故其水溶液呈碱性,D不符合题意。
3.pH=4的醋酸和氯化铵溶液中,水的电离程度
A.前者大于后者 B.前者小于后者
C.前者等于后者 D.无法确定
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
4.下列有关盐类水解的叙述正确的是
A.溶液呈中性的盐一定是强酸、强碱反应生成的盐
B.含有弱酸酸根离子的盐的水溶液一定呈碱性
C.盐溶液的酸碱性主要取决于形成盐的酸和碱的相对强弱
D.强酸强碱盐的水溶液一定呈中性
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
如果弱酸阴离子、弱碱阳离子的水解程度相当,生成盐的水溶液呈中性,如CH3COONH4溶液呈中性,A错误;
含有弱酸酸根离子的盐的水溶液不一定呈碱性,如NaHSO3溶液呈酸性,B错误;
强酸强碱盐的水溶液不一定呈中性,如NaHSO4溶液呈酸性,D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
HS-+H+===H2S表示HS-与H+反应生成硫化氢,B错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
Na2S水溶液呈碱性主要是因为硫离子的水解,硫离子的水解分步进行,且以第一步为主,离子方程式为S2-+H2O HS-+OH-,故A错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
题组三 溶液中微粒数目的简单比较
7.物质的量相等的下列物质形成的等体积溶液中,所含微粒种类最多的是
A.CaCl2 B.CH3COONa
C.NH3 D.K2S
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
CaCl2不水解,其溶液中存在的微粒有5种:Ca2+、Cl-、OH-、H+、H2O;CH3COONa发生水解,其溶液中存在的微粒有6种:Na+、CH3COO-、CH3COOH、H+、OH-、H2O;氨水中存在的微粒有6种:
NH3、NH3·H2O、 、OH-、H+、H2O;K2S中S2-发生两步水解,其溶液中存在7种微粒:K+、S2-、HS-、H2S、OH-、H+、H2O。
8.物质的量浓度相同的下列各物质的溶液,由水电离出的c(H+)由大到小的顺序是
①NaHSO4 ②NaHCO3 ③Na2CO3 ④Na2SO4
A.④③②① B.①②③④
C.③②④① D.③④②①
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
NaHSO4抑制水的电离,Na2CO3、NaHCO3均能促进水的电离且Na2CO3比NaHCO3的促进程度更大,Na2SO4不影响水的电离。
9.室温下,0.5 mol·L-1相同体积的下列四种溶液①KCl、②FeCl3、③HF、④Na2CO3,其中所含阳离子数由多到少的顺序是
A.④>①=②>③ B.①>④>②>③
C.④>①>③>② D.④>②>①>③
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
由于电解质在水中以电离为主,水解是极其微弱的,所以四种物质中Na2CO3电离的阳离子数一定最多,HF为弱电解质,电离出的H+一定最少,先排除B、C项,再观察KCl和FeCl3,如果只考虑电离,二者电离的阳离子数应相等,但Fe3+存在水解且一个Fe3+水解可生成三个H+,导致其溶液中阳离子数增多,故选D项。
10.一元酸HA的溶液中,加入一定量的一元强碱MOH的溶液后,恰好完全反应,则关于反应后的溶液,下列判断一定正确的是
A.c(A-)≥c(M+)
B.c(A-)=c(M+)
C.若MA不水解,则c(OH-)D.若MA水解,则c(OH-)>c(H+)
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
若MA不水解,则溶液呈中性,c(OH-)=c(H+),再根据电荷守恒可知,c(A-)=c(M+);若MA水解,说明HA为一元弱酸,则MA溶液中c(OH-)>c(H+),再根据电荷守恒可知,c(A-)1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
11.下列说法错误的是
A.在Na2S溶液中滴入酚酞试液,溶液呈红色
B.硫酸铵溶液显酸性
C.一切钾盐、钠盐、硝酸盐都不发生水解
D.醋酸盐溶于水能发生水解
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
Na2S属于强碱弱酸盐,在水溶液中水解显碱性,所以在Na2S溶液中滴入酚酞试液,呈红色,故A正确;
硫酸铵属于强酸弱碱盐,在水溶液中水解显酸性,故B正确;
钾盐、钠盐、硝酸盐中如果含有弱酸酸根离子也会水解,如Na2CO3在水溶液中水解显碱性,故C错误;
醋酸盐属于弱酸盐,溶于水后电离产生的醋酸根离子能水解,故D正确。
12.常温下,物质的量浓度相同的下列溶液,按pH由大到小的顺序排列正确的是
A.Ba(OH)2、Na2CO3、FeCl3、KCl
B.NaOH、Na2CO3、KNO3、NH4Cl
C.NH3·H2O、HCl、Na2SO4、H2SO4
D.NaHCO3、醋酸、NaCl、HCl
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
A项,FeCl3为强酸弱碱盐,水解后溶液显酸性,KCl溶液为中性,则溶液pH:KCl>FeCl3,错误;
C项,Na2SO4溶液呈中性,HCl为一元强酸,H2SO4为二元强酸,等浓度的HCl溶液与H2SO4溶液中c(H+)较大的是H2SO4溶液,则溶液pH:Na2SO4>HCl>H2SO4,错误;
D项,醋酸为一元弱酸,在水中部分电离,则相同条件下溶液pH:NaCl>醋酸>HCl,错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
13.由一价离子组成的四种盐溶液:AC、BD、AD、BC各1 mol·L-1,在室温下,前两种溶液的pH=7,第三种溶液的pH>7,最后一种溶液的pH<7,则下列说法正确的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
A B C D
碱性 AOH>BOH AOH<BOH AOH>BOH AOH<BOH
酸性 HC>HD HC>HD HC<HD HC<HD
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
根据盐的水解规律可知:弱离子越弱,水解程度越大,可进行如下归类分析:
综上可知,电离程度:HC=AOH>HD=BOH,即酸性:HC>HD,碱性:AOH>BOH。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
14.在室温下,有下列五种溶液:
①0.1 mol·L-1 NH4Cl
②0.1 mol·L-1 CH3COONH4
③0.1 mol·L-1 NH4HSO4
④0.1 mol·L-1 NH3·H2O和0.1 mol·L-1 NH4Cl混合液
⑤0.1 mol·L-1 NH3·H2O
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
请根据要求填写下列空白:
(1)溶液①呈_____(填“酸”“碱”或“中”)性,其原因是___________
_________________(用离子方程式表示)。
酸
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(2)比较溶液②③中c( )的大小关系是②_____(填“>”“<”或
“=”)③。
<
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(3)在溶液④中,_____的浓度为0.1 mol·L-1。NH3·H2O和_______的物质的量浓度之和为0.2 mol·L-1。
Cl-
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(4)室温下,测得溶液②的pH=7,则说明CH3COO-的水解程度______(填“>”“<”或“=”,下同) 的水解程度,CH3COO-与
浓度的大小关系是c(CH3COO-)____c( )。
=
=
15.(2021·山东滨州高二月考)25 ℃时,pH=2的某酸HnA(An-为酸根离子)与pH=12的某碱B(OH)m等体积混合,混合液的pH=5。
(1)写出生成的正盐的化学式:_______。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
BnAm
HnA中酸根离子带n个单位的负电荷(An-),B(OH)m中阳离子带m个单位的正电荷(Bm+),则正盐的化学式为BnAm。
(2)该盐中存在着一定水解的离子,该水解反应的离子方程式为___________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
pH=2的酸HnA中c(H+)=10-2 mol·L-1,pH=12的碱B(OH)m中c(OH)-=10-2 mol·L-1,当二者等体积混合后溶液的pH=5,说明酸过量,则HnA一定为弱酸,故An-一定水解。
(3)简述该混合液呈酸性的原因:__________________________________
____________________。
(4)写出HnA的电离方程式:_____________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
HnA为弱酸,当HnA与B(OH)m等体积
混合后,酸有剩余
16.(1)浓度均为0.1 mol·L-1的8种溶液:①HNO3;②H2SO4;③CH3COOH;
④Ba(OH)2;⑤NaOH;⑥CH3COONa;⑦KCl;⑧NH4Cl。其溶液的pH由小到大的顺序是__________________(填序号)。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
②①③⑧⑦⑥⑤④
先对物质分类,pH:碱>盐>酸。
同类物质的pH的一般规律:
碱:二元强碱>一元强碱>一元弱碱;
酸:一元弱酸>一元强酸>二元强酸;
盐:强碱弱酸盐>强酸强碱盐>强酸弱碱盐。
(2)室温时,pH=6的盐酸和pH=8的Na2CO3溶液中,水电离出的c(OH-)分别为x mol·L-1和y mol·L-1,两者的关系正确的是____(填字母)。
a.x=10-2y b.x=102y
c.x=y d.x>y
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
a
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(3)常温下,0.1 mol·L-1 HA溶液中 =108。现取0.1 mol·L-1 HA溶液与pH=13的NaOH溶液等体积混合(忽略混合后溶液体积的变化)。试回答下列问题:
①混合溶液呈____(填“酸”“中”或“碱”)性,理由是_____________
___________(用离子方程式表示)。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
碱
HA+OH-
②混合溶液中由水电离出的c(H+)_____(填“大于”“小于”或“等于”)0.1 mol·L-1 NaOH溶液中由水电离出的c(H+)。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
大于
NaA溶液促进水的电离,而NaOH溶液抑制水的电离。
返回
专题3
本课结束
DIYIKESHI
盐溶液的酸碱性及原因 / 盐类水解方程式的书写 / 课时对点练
盐类水解的原理
专题3
第1课时
1.变化观念与平衡思想:
认识盐类水解有一定限度,理解盐类水解的概念,能正确书写盐类水解的离子方程式和化学方程式。
2.证据推理与模型认知:
通过实验分析、推理等方法认识盐类水解的实质,掌握盐溶液呈现酸、碱性的原因和规律,能根据盐的组成判断溶液的酸、碱性。
内容索引
一、盐溶液的酸碱性及原因
二、盐类水解方程式的书写
课时对点练
盐溶液的酸碱性及原因
一
1.探究盐溶液的酸碱性
通过实验测定室温时下列0.1 mol·L-1盐溶液的pH,填写下表。
盐溶液 盐的类型 溶液pH 酸碱性
NaCl ____________ pH 7 性
CH3COONa ____________ pH 7 性
NH4Cl ____________ pH 7 性
Na2CO3 ____________ pH 7 性
AlCl3 ____________ pH 7 性
强酸强碱盐
强碱弱酸盐
强酸弱碱盐
强碱弱酸盐
强酸弱碱盐
=
>
<
>
<
中
碱
酸
碱
酸
2.盐溶液呈现酸碱性的理论分析
(1)CH3COONa溶液呈碱性的原因
CH3COONa电离出的 和H2O电离出的 结合生成弱电解质
,使水的电离平衡向 方向移动,导致溶液中c(OH-)__
c(H+),因而CH3COONa溶液呈 。
CH3COO-
H+
CH3COOH
电离
>
碱性
(2)NH4Cl溶液呈酸性的原因
NH4Cl电离出的 和H2O电离出的OH-结合生成弱电解质 ,使水的电离平衡向 方向移动,导致溶液中c(H+) c(OH-),因而NH4Cl溶液呈酸性。
NH3·H2O
电离
>
(3)NaCl溶液呈中性的原因
NaCl溶于水后电离出的Na+和Cl-均不能与水电离出的OH-或H+结合,水的电离平衡不发生移动,溶液中c(H+)=c(OH-),因而NaCl溶液呈中性。
3.盐类的水解
(1)概念:盐在水溶液中电离出的离子与水电离出的 结合生成
的反应。
H+或OH-
弱电解质
(2)实质
H+
OH-
酸
碱
(3)盐类水解的特点
可逆
逆过程
分步进行的
第一步
(1)盐类的水解过程促进了水的电离( )
(2)酸碱恰好中和生成的盐溶液一定显中性( )
(3)盐溶液显酸性、碱性还是中性,取决于溶液中c(H+)与c(OH-)的相对大小( )
(4)盐水解后,溶液不是呈酸性就是呈碱性( )
正误判断
×
√
√
×
1.碳酸钠溶液和氢氧化钠溶液都呈碱性,它们对水的电离影响是否相同?
2.根据酸碱中和滴定中指示剂的选择原则,判断强酸强碱间的滴定、强酸弱碱间的滴定(如盐酸与氨水)、强碱弱酸间的滴定(如醋酸与氢氧化钠)所用的指示剂?
提示 强酸强碱间的滴定:酚酞、甲基橙;强酸弱碱间的滴定:甲基橙;强碱弱酸间的滴定:酚酞。
3.室温下,测得等浓度的CH3COONa和NaClO的pH,发现NaClO溶液的pH大,试分析原因。
提示 因为酸性:CH3COOH>HClO,故ClO-在溶液中的水解能力较强,因此NaClO溶液的pH大。
应用体验
(1)在水溶液中,水解呈碱性的离子是_____________________。
(2)在水溶液中,水解呈酸性的离子是_________________。
(3)既能在酸性较强的溶液里大量存在,又能在碱性较强的溶液里大量存在的离子有_________________。
2.常温下,某浓度的NH4Cl溶液的pH为4,回答下列问题。
(1)该氯化铵溶液中含氮元素的微粒有_______________。
(2)比较该溶液中的c(Cl-)____(填“>”“<”或“=”,下同)c( )。
>
(3)该氯化铵溶液中水电离的氢离子浓度___pH=4的盐酸中水电离的氢离子浓度。
(4)该氯化铵溶液中水电离的c(H+)与pH=4的盐酸中水电离的c(H+)比值为____。
>
106
pH=4的NH4Cl溶液中水电离的c(H+)=10-4mol·L-1,pH=4的盐酸中水电离的c(H+)=10-10 mol·L-1,则该NH4Cl溶液中c水(H+)与pH=4的盐酸中c水(H+)的比值为 =106。
归纳总结
盐类水解的规律
(1)
(2)常见的“弱”离子
①弱碱阳离子: 、金属活动性顺序表Na之后的金属阳离子,如
Mg2+、Al3+、Fe3+等。
归纳总结
返回
盐类水解方程式的书写
二
1.盐类水解程度一般很小,水解时通常不生成沉淀和气体,书写水解的离子方程式时,一般用“ ”连接,产物不标“↑”或“↓”。如:
(1)NaClO: ;
(2)(NH4)2SO4: 。
2.多元弱酸酸根离子的水解分步进行,以第一步为主。如Na2CO3:
、 。
3.多元弱碱阳离子水解反应过程复杂,要求一步写到底。如AlCl3:
。
正误判断
×
√
×
×
×
特别提醒
应用体验
1.写出下列物质发生水解反应的离子方程式,并指明溶液的酸碱性:
(1)Na2S:____________________________________________________。
(2)CuSO4:__________________________________________________。
(3)NH4NO3:________________________________________________。
(4)CH3COONa:_____________________________________________。
Na2S、CH3COONa为强碱弱酸盐,溶液呈碱性;CuSO4、NH4NO3为强酸弱碱盐,溶液呈酸性。
水解程度
归纳总结
弱酸的酸式酸根离子在水溶液中存在电离平衡和水解平衡,弱酸酸式盐溶液的酸碱性取决于其电离程度和水解程度的相对大小。
(1)水解程度大于电离程度:如呈碱性的NaHCO3、NaHS、Na2HPO4溶液。
(2)电离程度大于水解程度:如呈酸性的NaHSO3、KHC2O4、NaH2PO4溶液。
返回
课时对点练
题组一 盐类水解的实质及规律
1.下列物质的水溶液呈碱性的是
A.KNO3 B.NaHCO3
C.NH4Cl D.NaHSO4
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
KNO3在溶液中完全电离产生钾离子和硝酸根离子,二者均不水解,溶液呈中性,故A不符合;
2.(2020·浙江7月选考,1改编)水溶液呈酸性的是
A.NaCl B.(NH4)2SO4
C.HCOONa D.NaHCO3
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
NaCl是强酸强碱盐,不能水解,其水溶液呈中性,A不符合题意;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
HCOONa属于强碱弱酸盐,在水溶液中可以完全电离,电离产生的HCOO-可以发生水解,其水解的离子方程式为HCOO-+H2O
HCOOH+OH-,故其水溶液呈碱性,C不符合题意;
NaHCO3是弱酸的酸式盐,既能发生电离又能发生水解,但其水解程度大于电离程度,故其水溶液呈碱性,D不符合题意。
3.pH=4的醋酸和氯化铵溶液中,水的电离程度
A.前者大于后者 B.前者小于后者
C.前者等于后者 D.无法确定
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
4.下列有关盐类水解的叙述正确的是
A.溶液呈中性的盐一定是强酸、强碱反应生成的盐
B.含有弱酸酸根离子的盐的水溶液一定呈碱性
C.盐溶液的酸碱性主要取决于形成盐的酸和碱的相对强弱
D.强酸强碱盐的水溶液一定呈中性
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
如果弱酸阴离子、弱碱阳离子的水解程度相当,生成盐的水溶液呈中性,如CH3COONH4溶液呈中性,A错误;
含有弱酸酸根离子的盐的水溶液不一定呈碱性,如NaHSO3溶液呈酸性,B错误;
强酸强碱盐的水溶液不一定呈中性,如NaHSO4溶液呈酸性,D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
HS-+H+===H2S表示HS-与H+反应生成硫化氢,B错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
Na2S水溶液呈碱性主要是因为硫离子的水解,硫离子的水解分步进行,且以第一步为主,离子方程式为S2-+H2O HS-+OH-,故A错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
题组三 溶液中微粒数目的简单比较
7.物质的量相等的下列物质形成的等体积溶液中,所含微粒种类最多的是
A.CaCl2 B.CH3COONa
C.NH3 D.K2S
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
CaCl2不水解,其溶液中存在的微粒有5种:Ca2+、Cl-、OH-、H+、H2O;CH3COONa发生水解,其溶液中存在的微粒有6种:Na+、CH3COO-、CH3COOH、H+、OH-、H2O;氨水中存在的微粒有6种:
NH3、NH3·H2O、 、OH-、H+、H2O;K2S中S2-发生两步水解,其溶液中存在7种微粒:K+、S2-、HS-、H2S、OH-、H+、H2O。
8.物质的量浓度相同的下列各物质的溶液,由水电离出的c(H+)由大到小的顺序是
①NaHSO4 ②NaHCO3 ③Na2CO3 ④Na2SO4
A.④③②① B.①②③④
C.③②④① D.③④②①
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
NaHSO4抑制水的电离,Na2CO3、NaHCO3均能促进水的电离且Na2CO3比NaHCO3的促进程度更大,Na2SO4不影响水的电离。
9.室温下,0.5 mol·L-1相同体积的下列四种溶液①KCl、②FeCl3、③HF、④Na2CO3,其中所含阳离子数由多到少的顺序是
A.④>①=②>③ B.①>④>②>③
C.④>①>③>② D.④>②>①>③
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
由于电解质在水中以电离为主,水解是极其微弱的,所以四种物质中Na2CO3电离的阳离子数一定最多,HF为弱电解质,电离出的H+一定最少,先排除B、C项,再观察KCl和FeCl3,如果只考虑电离,二者电离的阳离子数应相等,但Fe3+存在水解且一个Fe3+水解可生成三个H+,导致其溶液中阳离子数增多,故选D项。
10.一元酸HA的溶液中,加入一定量的一元强碱MOH的溶液后,恰好完全反应,则关于反应后的溶液,下列判断一定正确的是
A.c(A-)≥c(M+)
B.c(A-)=c(M+)
C.若MA不水解,则c(OH-)
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
若MA不水解,则溶液呈中性,c(OH-)=c(H+),再根据电荷守恒可知,c(A-)=c(M+);若MA水解,说明HA为一元弱酸,则MA溶液中c(OH-)>c(H+),再根据电荷守恒可知,c(A-)
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
11.下列说法错误的是
A.在Na2S溶液中滴入酚酞试液,溶液呈红色
B.硫酸铵溶液显酸性
C.一切钾盐、钠盐、硝酸盐都不发生水解
D.醋酸盐溶于水能发生水解
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
Na2S属于强碱弱酸盐,在水溶液中水解显碱性,所以在Na2S溶液中滴入酚酞试液,呈红色,故A正确;
硫酸铵属于强酸弱碱盐,在水溶液中水解显酸性,故B正确;
钾盐、钠盐、硝酸盐中如果含有弱酸酸根离子也会水解,如Na2CO3在水溶液中水解显碱性,故C错误;
醋酸盐属于弱酸盐,溶于水后电离产生的醋酸根离子能水解,故D正确。
12.常温下,物质的量浓度相同的下列溶液,按pH由大到小的顺序排列正确的是
A.Ba(OH)2、Na2CO3、FeCl3、KCl
B.NaOH、Na2CO3、KNO3、NH4Cl
C.NH3·H2O、HCl、Na2SO4、H2SO4
D.NaHCO3、醋酸、NaCl、HCl
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
A项,FeCl3为强酸弱碱盐,水解后溶液显酸性,KCl溶液为中性,则溶液pH:KCl>FeCl3,错误;
C项,Na2SO4溶液呈中性,HCl为一元强酸,H2SO4为二元强酸,等浓度的HCl溶液与H2SO4溶液中c(H+)较大的是H2SO4溶液,则溶液pH:Na2SO4>HCl>H2SO4,错误;
D项,醋酸为一元弱酸,在水中部分电离,则相同条件下溶液pH:NaCl>醋酸>HCl,错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
13.由一价离子组成的四种盐溶液:AC、BD、AD、BC各1 mol·L-1,在室温下,前两种溶液的pH=7,第三种溶液的pH>7,最后一种溶液的pH<7,则下列说法正确的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
A B C D
碱性 AOH>BOH AOH<BOH AOH>BOH AOH<BOH
酸性 HC>HD HC>HD HC<HD HC<HD
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
根据盐的水解规律可知:弱离子越弱,水解程度越大,可进行如下归类分析:
综上可知,电离程度:HC=AOH>HD=BOH,即酸性:HC>HD,碱性:AOH>BOH。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
14.在室温下,有下列五种溶液:
①0.1 mol·L-1 NH4Cl
②0.1 mol·L-1 CH3COONH4
③0.1 mol·L-1 NH4HSO4
④0.1 mol·L-1 NH3·H2O和0.1 mol·L-1 NH4Cl混合液
⑤0.1 mol·L-1 NH3·H2O
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
请根据要求填写下列空白:
(1)溶液①呈_____(填“酸”“碱”或“中”)性,其原因是___________
_________________(用离子方程式表示)。
酸
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(2)比较溶液②③中c( )的大小关系是②_____(填“>”“<”或
“=”)③。
<
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(3)在溶液④中,_____的浓度为0.1 mol·L-1。NH3·H2O和_______的物质的量浓度之和为0.2 mol·L-1。
Cl-
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(4)室温下,测得溶液②的pH=7,则说明CH3COO-的水解程度______(填“>”“<”或“=”,下同) 的水解程度,CH3COO-与
浓度的大小关系是c(CH3COO-)____c( )。
=
=
15.(2021·山东滨州高二月考)25 ℃时,pH=2的某酸HnA(An-为酸根离子)与pH=12的某碱B(OH)m等体积混合,混合液的pH=5。
(1)写出生成的正盐的化学式:_______。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
BnAm
HnA中酸根离子带n个单位的负电荷(An-),B(OH)m中阳离子带m个单位的正电荷(Bm+),则正盐的化学式为BnAm。
(2)该盐中存在着一定水解的离子,该水解反应的离子方程式为___________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
pH=2的酸HnA中c(H+)=10-2 mol·L-1,pH=12的碱B(OH)m中c(OH)-=10-2 mol·L-1,当二者等体积混合后溶液的pH=5,说明酸过量,则HnA一定为弱酸,故An-一定水解。
(3)简述该混合液呈酸性的原因:__________________________________
____________________。
(4)写出HnA的电离方程式:_____________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
HnA为弱酸,当HnA与B(OH)m等体积
混合后,酸有剩余
16.(1)浓度均为0.1 mol·L-1的8种溶液:①HNO3;②H2SO4;③CH3COOH;
④Ba(OH)2;⑤NaOH;⑥CH3COONa;⑦KCl;⑧NH4Cl。其溶液的pH由小到大的顺序是__________________(填序号)。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
②①③⑧⑦⑥⑤④
先对物质分类,pH:碱>盐>酸。
同类物质的pH的一般规律:
碱:二元强碱>一元强碱>一元弱碱;
酸:一元弱酸>一元强酸>二元强酸;
盐:强碱弱酸盐>强酸强碱盐>强酸弱碱盐。
(2)室温时,pH=6的盐酸和pH=8的Na2CO3溶液中,水电离出的c(OH-)分别为x mol·L-1和y mol·L-1,两者的关系正确的是____(填字母)。
a.x=10-2y b.x=102y
c.x=y d.x>y
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
a
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(3)常温下,0.1 mol·L-1 HA溶液中 =108。现取0.1 mol·L-1 HA溶液与pH=13的NaOH溶液等体积混合(忽略混合后溶液体积的变化)。试回答下列问题:
①混合溶液呈____(填“酸”“中”或“碱”)性,理由是_____________
___________(用离子方程式表示)。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
碱
HA+OH-
②混合溶液中由水电离出的c(H+)_____(填“大于”“小于”或“等于”)0.1 mol·L-1 NaOH溶液中由水电离出的c(H+)。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
大于
NaA溶液促进水的电离,而NaOH溶液抑制水的电离。
返回
专题3
本课结束
