专题3第三单元 盐类的水解 第3课时 溶液中微粒浓度大小的比较(共83张ppt)
文档属性
| 名称 | 专题3第三单元 盐类的水解 第3课时 溶液中微粒浓度大小的比较(共83张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-02 19:33:39 | ||
图片预览











文档简介
(共83张PPT)
第3课时
DISANKESHI
“两大理论”与“三种守恒” / 溶液中粒子浓度比较的四种类型 / 课时对点练
溶液中微粒浓度大小的比较
专题3
1.知道弱电解质的电离和盐类水解均存在平衡,会判断溶液中微粒种类及微粒间的定量关系,培养变化观念与平衡思想。
2.建立溶液中粒子浓度大小比较的思维模型,掌握溶液中粒子浓度大小的比较方法,培养证据推理与模型认知能力。
内容索引
一、“两大理论”与“三种守恒”
二、溶液中粒子浓度比较的四种类型
课时对点练
“两大理论”与“三种守恒”
一
1.两大理论引领思维建模
(1)电离理论
①弱电解质的电离是微弱的,电离产生的微粒非常少,还要考虑水的电离。如氨水中:
c(NH3·H2O)>c(OH-)>c( )。
②多元弱酸的电离是分步进行的,其主要是第一步电离。如在H2S溶液中:c(H2S)>c(H+)>c(HS-)>c(S2-)。
(2)水解理论
①离子的水解损失是微量的(相互促进的水解除外),但由于水的电离,水解后酸性溶液中c(H+)或碱性溶液中c(OH-)总是大于水解生成的弱电解质的浓度。如NH4Cl溶液中:c(Cl-)>c( )>c(H+)>c(NH3·H2O)。
②多元弱酸酸根阴离子的水解是分步进行的,其主要是第一步水解,如在Na2CO3溶液中:c( )>c( )>c(H2CO3)。
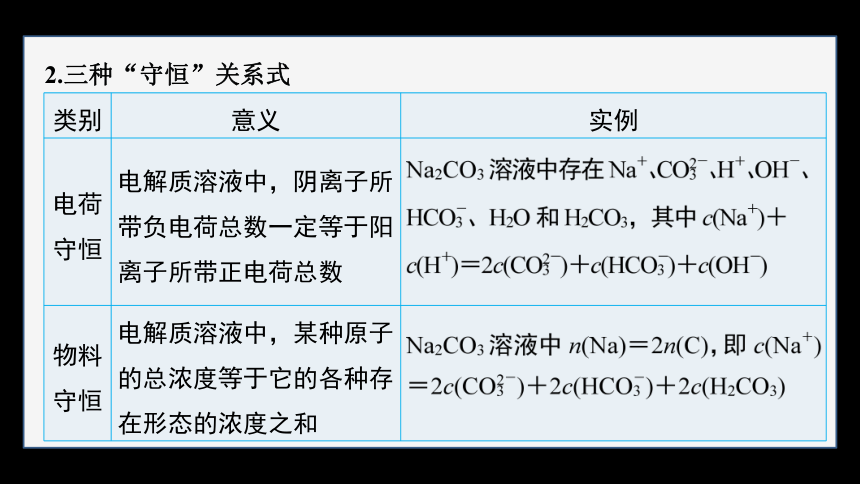
2.三种“守恒”关系式
类别 意义 实例
电荷守恒 电解质溶液中,阴离子所带负电荷总数一定等于阳离子所带正电荷总数
物料守恒 电解质溶液中,某种原子的总浓度等于它的各种存在形态的浓度之和
质子守恒 任何水溶液中,由水电离产生的H+和OH-的物质的量均相等 Na2CO3溶液中:c(OH-)=c(H+)+c( )+2c(H2CO3)
应用体验
1.判断下列电解质溶液中的守恒关系哪些正确,哪些错误?(已知H2C2O4为二元弱酸。)
(1)0.1 mol·L-1 Na2SO3溶液中:
(2)0.1 mol·L-1 Na2S溶液中:
c(H+)=c(OH-)-2c(H2S)-c(HS-)
(3)0.1 mol·L-1 Na2C2O4溶液与0.1 mol·L-1 HCl溶液等体积混合:
(7)0.1 mol·L-1 CH3COOH溶液与0.1 mol·L-1 NaOH溶液等体积混合后的溶液中:c(OH-)>c(H+)+c(CH3COOH)
答案 正确的有(2)(4)(6),其余不正确。
(2)符合质子守恒,c(OH-)=c(H+)+2c(H2S)+c(HS-),移项即可。
(7)不符合质子守恒,正确的关系式为c(OH-)=c(H+)+c(CH3COOH)。
2.(2021·郑州高二月考)常温下,下列溶液中,有关微粒的浓度关系错误的是
√
0.01 mol·L-1NaOH溶液与等体积pH=2的醋酸溶液的浓度大小关系为c(CH3COOH) c(NaOH),二者等体积混合后,溶液中的溶质是CH3COONa和CH3COOH,c(CH3COOH) c(CH3COONa),故溶液呈酸性,则c(H+)>
c(OH-),根据电荷守恒得c(CH3COO-)>c(Na+),又醋酸的电离程度很小,所以c(Na+)>c(H+),则c(CH3COO-)>c(Na+)>c(H+)>c(OH-),C项正确;
特别提示
(1)分析电解质的电离和水解情况,找全溶液中的离子和分子。
(2)分清题目考查的哪种守恒关系,可以是单一守恒关系式,也可以是它们的变形关系式,也可以是两种守恒关系式导出的新的守恒关系式。
(3)注意选择题常涉及的易错点
①守恒关系式中多写或漏写离子或分子;②守恒关系式浓度前的化学计量数设错;③在混合后忽视溶液体积变化上设错。
返回
溶液中粒子浓度比较的四种类型
二
1.不同溶液中同一离子浓度比较
要考虑溶液中其他离子对该离子的影响,如在相同浓度的下列溶液中①NH4Cl,②CH3COONH4,③NH4HSO4,④(NH4)2SO4,⑤(NH4)2CO3,c( )由大到小的顺序: 。
2.弱酸溶液中粒子浓度大小比较
(1)HClO溶液中存在的平衡有: ,溶液中微粒有 ,由于HClO的电离程度小,且H2O的电离程度更小,所以溶液中粒子浓度由大到小的顺序(H2O除外)是 。
④>⑤>③>①>②
H2O、HClO、H+、OH-、ClO-
c(HClO)>c(H+)>c(ClO-)>c(OH-)
(2)碳酸的电离方程式是 。碳酸溶液中存在的微粒有 。碳酸是弱酸,第一步电离很微弱,第二步电离更微弱。推测其溶液中粒子浓度由大到小的顺序(H2O除外)是_________________________________
。
>c(OH-)
3.单一溶液中离子浓度大小的比较
(1)氯化铵溶液
①先分析NH4Cl溶液中的电离、水解过程。
电离: 。
水解: 。
判断溶液中存在的离子有 。
②再根据其电离和水解程度的相对大小,比较确定氯化铵溶液中离子浓度由大到小的顺序是 。
(2)碳酸钠溶液
①分析Na2CO3溶液中的电离、水解过程。
电离: 。
水解: 。
溶液中存在的离子有 。
②溶液中离子浓度由大到小的顺序是________________________________
。
>c(H+)
(3)碳酸氢钠溶液
①分析NaHCO3溶液中的电离、水解过程:
电离: 。
水解: 。
溶液中存在的离子有 。
②由于 的电离程度 的水解程度,所以溶液中离子浓度由大到小的顺序是 。
小于
(4)亚硫酸氢钠溶液
①分析NaHSO3溶液中的电离、水解过程。
电离: 。
水解: 。
溶液中存在的离子有 。
②由于 的电离程度大于 的水解程度,所以溶液中离子浓度由大到小的顺序为 。
4.混合溶液中各离子浓度大小比较,根据电离程度、水解程度的相对大小综合分析
(1)分子的电离程度大于对应离子的水解程度
在0.1 mol·L-1 NH4Cl和0.1 mol·L-1的氨水混合溶液中,由于NH3·H2O的电离程度大于 的水解程度,导致溶液呈碱性。溶液中各离子浓度的大小顺序为 。
(2)分子的电离程度小于对应离子的水解程度
在0.1 mol·L-1的HCN和0.1 mol·L-1的NaCN混合溶液中,由于HCN的电离程度小于CN-的水解程度,导致溶液呈碱性。溶液中各离子浓度的大小顺序为 ,且c(HCN)>c(Na+)=0.1 mol·
L-1。
c(Na+)>c(CN-)>c(OH-)>c(H+)
常温下,将0.1 mol·L-1 NaOH溶液逐滴加入到20.0 mL 0.1 mol·L-1的CH3COOH溶液中所得溶液pH与加入NaOH溶液体积关系如图,结合图示,回答下列问题。
(1)图示中①②③点对应的溶液溶质是什么?
提示 ①点溶液中溶质为等物质的量的CH3COOH和CH3COONa,②点溶液中溶质为少量剩余的CH3COOH和生成的CH3COONa,③点溶液中溶质为CH3COONa。
(2)请结合电离程度和水解程度,解释为什么①点溶液呈酸性?
提示 ①点溶液的溶质为等物质的量的CH3COOH和CH3COONa,CH3COOH在溶液中发生电离:CH3COOH CH3COO-+H+,CH3COONa在溶液中发生水解:CH3COO-+H2O CH3COOH+OH-,但CH3COOH的电离程度大于CH3COO-的水解程度,故溶液中c(H+)>c(OH-),呈酸性。
(3)分别写出①②③点溶液中离子浓度的大小关系?
提示 ①点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-);②点:c(Na+)=c(CH3COO-)>c(H+)=c(OH-);③点:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)。
归纳总结
判断酸碱混合溶液中粒子浓度大小的一般思路
(1)判断生成物,确定溶液组成。
(2)明确溶液中存在的所有平衡(电离平衡、水解平衡)。
(3)根据题给信息,确定程度大小(是以电离为主还是以水解为主)。
(4)比较粒子浓度大小,在比较中,要充分运用电荷守恒、物料守恒关系。
应用体验
1.某酸的酸式盐NaHY的水溶液中,HY-的电离程度小于HY-的水解程度,下列有关叙述正确的是
A.H2Y的电离方程式为H2Y HY-+H+
B.在NaHY溶液中,离子浓度由大到小的顺序为c(Na+)>c(Y2-)>c(HY-)
>c(OH-)>c(H+)
C.在NaHY溶液中,离子浓度由大到小的顺序为c(Na+)>c(HY-)>c(Y2-)
>c(OH-)>c(H+)
D.HY-的水解方程式为HY-+H2O H3O++Y2-
√
2.(2021·湖北1月选考模拟,15)25 ℃时,按下表配制两份溶液。
一元弱酸溶液 加入的NaOH溶液 混合后所得溶液
HA 10.0 mL 0.20 mol·L-1 5.0 mL 0.20 mol·L-1 溶液Ⅰ
pH=5.0
HB 10.0 mL 0.20 mol·L-1 5.0 mL 0.20 mol·L-1 溶液Ⅱ
pH=4.0
下列说法错误的是
A.溶液Ⅰ中,c(A-)>c(Na+)>c(H+)>c(OH-)
B.Ⅰ和Ⅱ的pH相差1.0,说明
C.混合Ⅰ和Ⅱ:c(Na+)+c(H+)=c(A-)+c(B-)+c(OH-)
D.混合Ⅰ和Ⅱ:c(HA)>c(HB)
√
A项,根据电荷守恒,Ⅰ中c(Na+)+c(H+)=c(OH-)+c(A-),由于pH=5.0,溶液呈酸性,c(H+)>c(OH-),因此,c(A-)>c(Na+)>c(H+)>c(OH-),正确;
C项,由电荷守恒可知,Ⅰ和Ⅱ的混合溶液中:c(Na+)+c(H+)=c(A-)+c(B-)+c(OH-),正确;
D项,由B的分析可知,Ka(HA)<Ka(HB),则Ⅰ、Ⅱ混合后必有c(HA)>c(HB),正确。
返回
课时对点练
题组一 单一溶液中粒子浓度大小比较
1.(2021·山东临沂第一中学高二月考)对于常温下pH=3的醋酸溶液,下列有关叙述正确的是
A.加水稀释100倍后,pH=5
B.该溶液中离子浓度大小关系:c(H+)>c(CH3COO-)>c(OH-)
C.加入等体积、pH=11的NaOH溶液后,混合溶液中c(Na+)=c(CH3COO-)
D.滴加0.1 mol·L-1 CH3COONa溶液至c(CH3COO-)pH<7
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
加水稀释,平衡CH3COOH CH3COO-+H+正向移动,pH<5,故A错误;
溶液中存在电荷守恒:c(H+)=c(CH3COO-)+c(OH-),醋酸的电离程度强于水的电离程度,c(CH3COO-)>c(OH-),则c(H+)>c(CH3COO-)>c(OH-),故B正确;
加入等体积pH=11的NaOH溶液后,由于醋酸是弱酸,浓度大于NaOH溶液,混合后溶液呈酸性,c(H+)>c(OH-),根据电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),则c(Na+)1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
当c(CH3COO-)7,故D错误。
2.已知,常温下某浓度的NaHSO3稀溶液的pH<7。则该稀溶液中下列粒子浓度关系正确的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
3.下列物质所配制的0.1 mol·L-1溶液中,离子浓度由大到小的顺序排列正确的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
题组二 不同溶液中粒子浓度大小比较
4.均为100 mL 1.0 mol·L-1的盐酸和醋酸溶液,下列说法正确的是
A.c(Cl-)=c(CH3COO-)
B.醋酸的电离方程式为CH3COOH===CH3COO-+H+
C.往两溶液中加入等物质的量浓度的NaOH溶液恰好中和,消耗NaOH溶
液的体积醋酸溶液多
D.c(Cl-)=c(CH3COO-)+c(CH3COOH)
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
HCl是强电解质,完全电离,醋酸是弱电解质,部分电离,两溶液中c(Cl-)
>c(CH3COO-),A错误;
CH3COOH的电离方程式为CH3COOH CH3COO-+H+,B错误;
两溶液中HCl和CH3COOH的物质的量相等,消耗NaOH溶液的体积也相等,C错误;
根据物料守恒,c(CH3COO-)+c(CH3COOH)等于起始醋酸的浓度,也等于c(Cl-),D正确。
5.有关①100 mL 0.1 mol·L-1的NaHCO3溶液、②100 mL 0.1 mol·L-1的Na2CO3溶液的叙述不正确的是
A.溶液中水电离出的H+个数:②>①
B.溶液中阴离子的物质的量浓度之和:②>①
C.①溶液中:c( )>c(H2CO3)
D.②溶液中:c( )>c(H2CO3)
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
题组三 混合溶液中粒子浓度大小比较
6.已知某温度下CH3COOH和NH3·H2O的电离常数相等,现向10 mL浓度为0.1 mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中
A.水的电离程度始终增大
B. 先增大再减小
C.c(CH3COOH)与c(CH3COO-)之和始终保持不变
D.当加入氨水的体积为10 mL时,c( )=c(CH3COO-)
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
A项,醋酸显酸性,水的电离平衡受到抑制,在滴加NH3·H2O的过程中,酸性减弱,水的电离程度受到抑制的程度减小,电离程度增大,当CH3COOH反应完后,加入的NH3·H2O会抑制水的电离,电离程度减小,错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
C项,n(CH3COOH)和n(CH3COO-)之和保持不变,但溶液的体积是增大的,故c(CH3COOH)与c(CH3COO-)之和逐渐减小,错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
7.常温下,0.2 mol·L-1的一元酸HA溶液与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是
A.HA为强酸
B.该混合液的pH=7
C.该混合溶液中:c(A-)+c(Y)=c(Na+)
D.图中X表示HA,Y表示OH-,Z表示H+
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
题给HA溶液与NaOH溶液反应生成0.1 mol·L-1的NaA溶液。由图知A-的浓度小于0.1 mol·L-1,说明A-发生了水解,即HA是弱酸,A项错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
A-水解后溶液呈碱性,B项错误;
混合溶液中粒子浓度的大小关系为c(Na+)>c(A-)>c(OH-)>c(HA)>c(H+),因此X表示OH-,Y表示HA,Z表示H+,D项错误;
根据物料守恒可知,c(A-)+c(HA)=c(Na+),即c(A-)+c(Y)=c(Na+),C项正确。
8.室温下将pH=2的盐酸与pH=12的氨水等体积混合,在所得的混合溶液中,下列关系正确的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
9.把0.02 mol·L-1醋酸钠溶液与0.01 mol·L-1盐酸等体积混合,混合后溶液显酸性,则溶液中有关微粒的浓度关系错误的是
A.c(CH3COOH)+c(CH3COO-)=0.01 mol·L-1
B.c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)
C.2c(Na+)=c(CH3COOH)+c(CH3COO-)
D.c(Na+)+c(H+)=c(CH3COO-)+c(Cl-)+c(OH-)
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
反应后的溶液中溶质为等物质的量浓度的NaCl、CH3COONa和CH3COOH,因为溶液呈酸性,说明CH3COOH的电离程度大于CH3COO-的水解程度,根据物料守恒得:c(CH3COOH)+c(CH3COO-)=c(Na+)= mol·L-1=0.01 mol·L-1,A正确、C错误;
反应后溶液呈酸性,说明CH3COOH的电离程度大于CH3COO-的水解程度,因此c(CH3COO-)>c(Cl-)>c(CH3COOH),因CH3COOH为弱酸,只发生部分电离,故c(CH3COOH)>c(H+),所以有c(CH3COO-)>c(Cl-)
>c(CH3COOH)>c(H+),B正确;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
据溶液中电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(Cl-)+c(OH-),D正确。
10.已知某一温度下,在0.1 mol·L-1的强电解质NaHA溶液中,c(H+)
A.c(Na+)=c(HA-)+2c(A2-)+c(OH-)
B.c(H2A)+c(HA-)+c(A2-)=0.1 mol·L-1
C.将上述溶液稀释至0.01 mol·L-1,c(H+)·c(OH-)不变
D.c(A2-)+c(OH-)=c(H+)+c(H2A)
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
根据电荷守恒得c(H+)+c(Na+)=c(HA-)+2c(A2-)+c(OH-),故A项不正确;
由物料守恒知c(Na+)=c(H2A)+c(HA-)+c(A2-)=0.1 mol·L-1,故B项正确;
温度不变,则c(H+)·c(OH-)不变,故C项正确;
由质子守恒关系式可得c(H+)+c(H2A)=c(A2-)+c(OH-),故D项正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
11.有4种混合溶液,分别由等体积0.1 mol·L-1的2种溶液混合而成:
①CH3COONa与HCl,②CH3COONa与NaOH,③CH3COONa与NaCl,④CH3COONa与NaHCO3。下列关系正确的是
A.pH:②>③>④>① B.c(CH3COO-):②>④>③>①
C.c(H+):①>③>②>④ D.c(CH3COOH):①>④>③>②
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
A项,pH:②>④>③>①;
C项,应为①>③>④>②;
D项,应为①>③>④>②。
12.常温下,将Na2A和NaHA溶液分别进行稀释,若-lg c(Na+)=pNa、-lg c(OH-)=pOH,则测得两种溶液中pNa与pOH的关系曲线如图。下列说法正确的是
A.X点所在的直线表示NaHA溶液的稀释
B.在Y点加入适量NaOH固体可以达到X点
C.将X点和Y点溶液等体积混合,则有c(Na+)>c(A2-)>c(HA-)>c(OH-)
>c(H+)
D.常温下,H2A的Ka1数量级为10-5
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
浓度相同的Na2A和NaHA溶液中,NaHA的水解程度小,溶液碱性弱,故Y点所在的直线表示NaHA溶液的稀释,A项错误;
X点和Y点处pNa相同,即c(Na+)相同,在Y点加入适量NaOH固体,c(Na+)增大,故不可能达到X点,B项错误;
pNa=2时,c(Na+)=10-2 mol·L-1,故X点Na2A的浓度为0.5×10-2 mol·L-1,Y点NaHA的浓度为1×10-2 mol·L-1,未开始发生水解时A2-的浓度就是HA-的一半,且A2-水解程度大于HA-,故c(HA-)>c(A2-),C项错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
根据Y点所在直线,pNa=1、pOH=5时,可知c(Na+)=10-1 mol·L-1
(近似为水解后HA-的浓度),c(OH-)=10-5 mol·L-1,根据HA-+H2O
H2A+OH-,HA-的水解常数Kh= =10-9,则H2A的电离常数Ka1= =10-5,可知数量级为10-5,D项正确。
13.已知乙酸(HA)的酸性比甲酸(HB)弱,在物质的量浓度均为0.1 mol·L-1的NaA和NaB混合溶液中,下列排序正确的是
A.c(OH-)>c(HA)>c(HB)>c(H+)
B.c(OH-)>c(A-)>c(B-)>c(H+)
C.c(OH-)>c(B-)>c(A-)>c(H+)
D.c(OH-)>c(HB)>c(HA)>c(H+)
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
在NaA和NaB的混合溶液中存在A-和B-的水解平衡:A-+H2O HA
+OH-、B-+H2O HB+OH-,由于HA比HB酸性弱,因此A-的水解程度大于B-的水解程度,故c(HA)>c(HB)、c(B-)>c(A-)>c(OH-)。
14.(2020·江苏,14改编)室温下,将两种浓度均为0.10 mol·L-1的溶液等体积混合,若溶液混合引起的体积变化可忽略,下列各混合溶液中微粒物质的量浓度关系正确的是
A.NaHCO3-Na2CO3混合溶液(pH=10.30):c(Na+)>c( )>c(OH-)>c( )
B.氨水-NH4Cl混合溶液(pH=9.25):c( )+c(H+)=c(NH3·H2O)+c(OH-)
C.CH3COOH-CH3COONa混合溶液(pH=4.76):c(Na+)>c(CH3COOH)>
c(CH3COO-)>c(H+)
D.H2C2O4-NaHC2O4混合溶液(pH=1.68,H2C2O4为二元弱酸):c(H+)+
c(H2C2O4)=c(Na+)+c( )+c(OH-)
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
C项,溶液呈酸性,说明CH3COOH的电离程度大于CH3COO-的水解程度,则溶液中微粒浓度关系为c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+),错误;
15.常温下,向100 mL 0.01 mol·L-1 HA溶液中逐滴加入0.02 mol·L-1 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(1)由图中信息可知HA为____(填“强”或“弱”)酸,理由是_________
_______________________________ 。
强
0.01 mol·
L-1 HA溶液中c(H+)=0.01 mol·L-1
(2)常温下一定浓度的MA稀溶液的pH=a,则a____(填“>”“<”或“=”)7,用离子方程式表示其原因:______________________,此时溶液中由水电离出的c(OH-)=________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
<
1×10-a mol·L-1
由题目图像可知向100 mL 0.01 mol·L-1 HA溶液中滴加51 mL 0.02 mol·L-1 MOH溶液,pH=7,说明MOH是弱碱,故其所对应的MA是强酸弱碱盐,水解显酸性,溶液中的H+全部是水电离出来的,故水电离出的c(OH-)=1×10-a mol·L-1。
(3)请写出K点所对应的溶液中离子浓度的大小关系:________________
_____________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
c(M+)>c(A-)>
c(OH-)>c(H+)
K点是由100 mL0.01 mol·L-1 HA溶液与100 mL 0.02 mol·L-1 MOH溶液混合而成的,反应后的溶液为等物质的量浓度的MA和MOH溶液,故c(M+)>c(A-)>c(OH-)>c(H+)。
(4)K点对应的溶液中,c(M+)+c(MOH)_____(填“>”“<”或“=”)
2c(A-);若此时溶液的pH=10,则c(MOH)+c(OH-)=______mol·L-1。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
=
0.005
由物料守恒得c(M+)+c(MOH)=2c(A-),由电荷守恒得c(M+)+c(H+)=c(A-)+c(OH-),故c(MOH)+c(OH-)=c(A-)+c(H+)≈0.005 mol·L-1。
16.按要求回答下列问题:
(1)实验室中常用NaOH溶液来进行洗气和提纯,当用100 mL 3 mol·L-1的NaOH溶液吸收标准状况下4.48 L CO2时,所得溶液中各离子浓度由大到小的顺序为______________________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(2)土壤的pH一般在4~9之间。土壤中Na2CO3含量较高时,pH可高达10.5,试用离子方程式解释土壤呈碱性的原因:___________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(3)常温下在20 mL 0.1 mol·L-1 Na2CO3溶液中逐滴加入0.1 mol·L-1盐酸40 mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
不能
②当pH=7时,溶液中含碳元素的主要微粒为_______________,溶液中各种离子的物质的量浓度的大小关系为_____________________________
___________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
=c(OH-)
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
常温下在20 mL 0.1 mol·L-1 Na2CO3溶液中逐滴加入0.1 mol·L-1盐酸40 mL,先反应生成碳酸氢钠,再与盐酸反应生成二氧化碳、水和氯化钠。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
10
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
返回
专题3
本课结束
第3课时
DISANKESHI
“两大理论”与“三种守恒” / 溶液中粒子浓度比较的四种类型 / 课时对点练
溶液中微粒浓度大小的比较
专题3
1.知道弱电解质的电离和盐类水解均存在平衡,会判断溶液中微粒种类及微粒间的定量关系,培养变化观念与平衡思想。
2.建立溶液中粒子浓度大小比较的思维模型,掌握溶液中粒子浓度大小的比较方法,培养证据推理与模型认知能力。
内容索引
一、“两大理论”与“三种守恒”
二、溶液中粒子浓度比较的四种类型
课时对点练
“两大理论”与“三种守恒”
一
1.两大理论引领思维建模
(1)电离理论
①弱电解质的电离是微弱的,电离产生的微粒非常少,还要考虑水的电离。如氨水中:
c(NH3·H2O)>c(OH-)>c( )。
②多元弱酸的电离是分步进行的,其主要是第一步电离。如在H2S溶液中:c(H2S)>c(H+)>c(HS-)>c(S2-)。
(2)水解理论
①离子的水解损失是微量的(相互促进的水解除外),但由于水的电离,水解后酸性溶液中c(H+)或碱性溶液中c(OH-)总是大于水解生成的弱电解质的浓度。如NH4Cl溶液中:c(Cl-)>c( )>c(H+)>c(NH3·H2O)。
②多元弱酸酸根阴离子的水解是分步进行的,其主要是第一步水解,如在Na2CO3溶液中:c( )>c( )>c(H2CO3)。
2.三种“守恒”关系式
类别 意义 实例
电荷守恒 电解质溶液中,阴离子所带负电荷总数一定等于阳离子所带正电荷总数
物料守恒 电解质溶液中,某种原子的总浓度等于它的各种存在形态的浓度之和
质子守恒 任何水溶液中,由水电离产生的H+和OH-的物质的量均相等 Na2CO3溶液中:c(OH-)=c(H+)+c( )+2c(H2CO3)
应用体验
1.判断下列电解质溶液中的守恒关系哪些正确,哪些错误?(已知H2C2O4为二元弱酸。)
(1)0.1 mol·L-1 Na2SO3溶液中:
(2)0.1 mol·L-1 Na2S溶液中:
c(H+)=c(OH-)-2c(H2S)-c(HS-)
(3)0.1 mol·L-1 Na2C2O4溶液与0.1 mol·L-1 HCl溶液等体积混合:
(7)0.1 mol·L-1 CH3COOH溶液与0.1 mol·L-1 NaOH溶液等体积混合后的溶液中:c(OH-)>c(H+)+c(CH3COOH)
答案 正确的有(2)(4)(6),其余不正确。
(2)符合质子守恒,c(OH-)=c(H+)+2c(H2S)+c(HS-),移项即可。
(7)不符合质子守恒,正确的关系式为c(OH-)=c(H+)+c(CH3COOH)。
2.(2021·郑州高二月考)常温下,下列溶液中,有关微粒的浓度关系错误的是
√
0.01 mol·L-1NaOH溶液与等体积pH=2的醋酸溶液的浓度大小关系为c(CH3COOH) c(NaOH),二者等体积混合后,溶液中的溶质是CH3COONa和CH3COOH,c(CH3COOH) c(CH3COONa),故溶液呈酸性,则c(H+)>
c(OH-),根据电荷守恒得c(CH3COO-)>c(Na+),又醋酸的电离程度很小,所以c(Na+)>c(H+),则c(CH3COO-)>c(Na+)>c(H+)>c(OH-),C项正确;
特别提示
(1)分析电解质的电离和水解情况,找全溶液中的离子和分子。
(2)分清题目考查的哪种守恒关系,可以是单一守恒关系式,也可以是它们的变形关系式,也可以是两种守恒关系式导出的新的守恒关系式。
(3)注意选择题常涉及的易错点
①守恒关系式中多写或漏写离子或分子;②守恒关系式浓度前的化学计量数设错;③在混合后忽视溶液体积变化上设错。
返回
溶液中粒子浓度比较的四种类型
二
1.不同溶液中同一离子浓度比较
要考虑溶液中其他离子对该离子的影响,如在相同浓度的下列溶液中①NH4Cl,②CH3COONH4,③NH4HSO4,④(NH4)2SO4,⑤(NH4)2CO3,c( )由大到小的顺序: 。
2.弱酸溶液中粒子浓度大小比较
(1)HClO溶液中存在的平衡有: ,溶液中微粒有 ,由于HClO的电离程度小,且H2O的电离程度更小,所以溶液中粒子浓度由大到小的顺序(H2O除外)是 。
④>⑤>③>①>②
H2O、HClO、H+、OH-、ClO-
c(HClO)>c(H+)>c(ClO-)>c(OH-)
(2)碳酸的电离方程式是 。碳酸溶液中存在的微粒有 。碳酸是弱酸,第一步电离很微弱,第二步电离更微弱。推测其溶液中粒子浓度由大到小的顺序(H2O除外)是_________________________________
。
>c(OH-)
3.单一溶液中离子浓度大小的比较
(1)氯化铵溶液
①先分析NH4Cl溶液中的电离、水解过程。
电离: 。
水解: 。
判断溶液中存在的离子有 。
②再根据其电离和水解程度的相对大小,比较确定氯化铵溶液中离子浓度由大到小的顺序是 。
(2)碳酸钠溶液
①分析Na2CO3溶液中的电离、水解过程。
电离: 。
水解: 。
溶液中存在的离子有 。
②溶液中离子浓度由大到小的顺序是________________________________
。
>c(H+)
(3)碳酸氢钠溶液
①分析NaHCO3溶液中的电离、水解过程:
电离: 。
水解: 。
溶液中存在的离子有 。
②由于 的电离程度 的水解程度,所以溶液中离子浓度由大到小的顺序是 。
小于
(4)亚硫酸氢钠溶液
①分析NaHSO3溶液中的电离、水解过程。
电离: 。
水解: 。
溶液中存在的离子有 。
②由于 的电离程度大于 的水解程度,所以溶液中离子浓度由大到小的顺序为 。
4.混合溶液中各离子浓度大小比较,根据电离程度、水解程度的相对大小综合分析
(1)分子的电离程度大于对应离子的水解程度
在0.1 mol·L-1 NH4Cl和0.1 mol·L-1的氨水混合溶液中,由于NH3·H2O的电离程度大于 的水解程度,导致溶液呈碱性。溶液中各离子浓度的大小顺序为 。
(2)分子的电离程度小于对应离子的水解程度
在0.1 mol·L-1的HCN和0.1 mol·L-1的NaCN混合溶液中,由于HCN的电离程度小于CN-的水解程度,导致溶液呈碱性。溶液中各离子浓度的大小顺序为 ,且c(HCN)>c(Na+)=0.1 mol·
L-1。
c(Na+)>c(CN-)>c(OH-)>c(H+)
常温下,将0.1 mol·L-1 NaOH溶液逐滴加入到20.0 mL 0.1 mol·L-1的CH3COOH溶液中所得溶液pH与加入NaOH溶液体积关系如图,结合图示,回答下列问题。
(1)图示中①②③点对应的溶液溶质是什么?
提示 ①点溶液中溶质为等物质的量的CH3COOH和CH3COONa,②点溶液中溶质为少量剩余的CH3COOH和生成的CH3COONa,③点溶液中溶质为CH3COONa。
(2)请结合电离程度和水解程度,解释为什么①点溶液呈酸性?
提示 ①点溶液的溶质为等物质的量的CH3COOH和CH3COONa,CH3COOH在溶液中发生电离:CH3COOH CH3COO-+H+,CH3COONa在溶液中发生水解:CH3COO-+H2O CH3COOH+OH-,但CH3COOH的电离程度大于CH3COO-的水解程度,故溶液中c(H+)>c(OH-),呈酸性。
(3)分别写出①②③点溶液中离子浓度的大小关系?
提示 ①点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-);②点:c(Na+)=c(CH3COO-)>c(H+)=c(OH-);③点:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)。
归纳总结
判断酸碱混合溶液中粒子浓度大小的一般思路
(1)判断生成物,确定溶液组成。
(2)明确溶液中存在的所有平衡(电离平衡、水解平衡)。
(3)根据题给信息,确定程度大小(是以电离为主还是以水解为主)。
(4)比较粒子浓度大小,在比较中,要充分运用电荷守恒、物料守恒关系。
应用体验
1.某酸的酸式盐NaHY的水溶液中,HY-的电离程度小于HY-的水解程度,下列有关叙述正确的是
A.H2Y的电离方程式为H2Y HY-+H+
B.在NaHY溶液中,离子浓度由大到小的顺序为c(Na+)>c(Y2-)>c(HY-)
>c(OH-)>c(H+)
C.在NaHY溶液中,离子浓度由大到小的顺序为c(Na+)>c(HY-)>c(Y2-)
>c(OH-)>c(H+)
D.HY-的水解方程式为HY-+H2O H3O++Y2-
√
2.(2021·湖北1月选考模拟,15)25 ℃时,按下表配制两份溶液。
一元弱酸溶液 加入的NaOH溶液 混合后所得溶液
HA 10.0 mL 0.20 mol·L-1 5.0 mL 0.20 mol·L-1 溶液Ⅰ
pH=5.0
HB 10.0 mL 0.20 mol·L-1 5.0 mL 0.20 mol·L-1 溶液Ⅱ
pH=4.0
下列说法错误的是
A.溶液Ⅰ中,c(A-)>c(Na+)>c(H+)>c(OH-)
B.Ⅰ和Ⅱ的pH相差1.0,说明
C.混合Ⅰ和Ⅱ:c(Na+)+c(H+)=c(A-)+c(B-)+c(OH-)
D.混合Ⅰ和Ⅱ:c(HA)>c(HB)
√
A项,根据电荷守恒,Ⅰ中c(Na+)+c(H+)=c(OH-)+c(A-),由于pH=5.0,溶液呈酸性,c(H+)>c(OH-),因此,c(A-)>c(Na+)>c(H+)>c(OH-),正确;
C项,由电荷守恒可知,Ⅰ和Ⅱ的混合溶液中:c(Na+)+c(H+)=c(A-)+c(B-)+c(OH-),正确;
D项,由B的分析可知,Ka(HA)<Ka(HB),则Ⅰ、Ⅱ混合后必有c(HA)>c(HB),正确。
返回
课时对点练
题组一 单一溶液中粒子浓度大小比较
1.(2021·山东临沂第一中学高二月考)对于常温下pH=3的醋酸溶液,下列有关叙述正确的是
A.加水稀释100倍后,pH=5
B.该溶液中离子浓度大小关系:c(H+)>c(CH3COO-)>c(OH-)
C.加入等体积、pH=11的NaOH溶液后,混合溶液中c(Na+)=c(CH3COO-)
D.滴加0.1 mol·L-1 CH3COONa溶液至c(CH3COO-)
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
加水稀释,平衡CH3COOH CH3COO-+H+正向移动,pH<5,故A错误;
溶液中存在电荷守恒:c(H+)=c(CH3COO-)+c(OH-),醋酸的电离程度强于水的电离程度,c(CH3COO-)>c(OH-),则c(H+)>c(CH3COO-)>c(OH-),故B正确;
加入等体积pH=11的NaOH溶液后,由于醋酸是弱酸,浓度大于NaOH溶液,混合后溶液呈酸性,c(H+)>c(OH-),根据电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),则c(Na+)
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
当c(CH3COO-)
2.已知,常温下某浓度的NaHSO3稀溶液的pH<7。则该稀溶液中下列粒子浓度关系正确的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
3.下列物质所配制的0.1 mol·L-1溶液中,离子浓度由大到小的顺序排列正确的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
题组二 不同溶液中粒子浓度大小比较
4.均为100 mL 1.0 mol·L-1的盐酸和醋酸溶液,下列说法正确的是
A.c(Cl-)=c(CH3COO-)
B.醋酸的电离方程式为CH3COOH===CH3COO-+H+
C.往两溶液中加入等物质的量浓度的NaOH溶液恰好中和,消耗NaOH溶
液的体积醋酸溶液多
D.c(Cl-)=c(CH3COO-)+c(CH3COOH)
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
HCl是强电解质,完全电离,醋酸是弱电解质,部分电离,两溶液中c(Cl-)
>c(CH3COO-),A错误;
CH3COOH的电离方程式为CH3COOH CH3COO-+H+,B错误;
两溶液中HCl和CH3COOH的物质的量相等,消耗NaOH溶液的体积也相等,C错误;
根据物料守恒,c(CH3COO-)+c(CH3COOH)等于起始醋酸的浓度,也等于c(Cl-),D正确。
5.有关①100 mL 0.1 mol·L-1的NaHCO3溶液、②100 mL 0.1 mol·L-1的Na2CO3溶液的叙述不正确的是
A.溶液中水电离出的H+个数:②>①
B.溶液中阴离子的物质的量浓度之和:②>①
C.①溶液中:c( )>c(H2CO3)
D.②溶液中:c( )>c(H2CO3)
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
题组三 混合溶液中粒子浓度大小比较
6.已知某温度下CH3COOH和NH3·H2O的电离常数相等,现向10 mL浓度为0.1 mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中
A.水的电离程度始终增大
B. 先增大再减小
C.c(CH3COOH)与c(CH3COO-)之和始终保持不变
D.当加入氨水的体积为10 mL时,c( )=c(CH3COO-)
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
A项,醋酸显酸性,水的电离平衡受到抑制,在滴加NH3·H2O的过程中,酸性减弱,水的电离程度受到抑制的程度减小,电离程度增大,当CH3COOH反应完后,加入的NH3·H2O会抑制水的电离,电离程度减小,错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
C项,n(CH3COOH)和n(CH3COO-)之和保持不变,但溶液的体积是增大的,故c(CH3COOH)与c(CH3COO-)之和逐渐减小,错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
7.常温下,0.2 mol·L-1的一元酸HA溶液与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是
A.HA为强酸
B.该混合液的pH=7
C.该混合溶液中:c(A-)+c(Y)=c(Na+)
D.图中X表示HA,Y表示OH-,Z表示H+
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
题给HA溶液与NaOH溶液反应生成0.1 mol·L-1的NaA溶液。由图知A-的浓度小于0.1 mol·L-1,说明A-发生了水解,即HA是弱酸,A项错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
A-水解后溶液呈碱性,B项错误;
混合溶液中粒子浓度的大小关系为c(Na+)>c(A-)>c(OH-)>c(HA)>c(H+),因此X表示OH-,Y表示HA,Z表示H+,D项错误;
根据物料守恒可知,c(A-)+c(HA)=c(Na+),即c(A-)+c(Y)=c(Na+),C项正确。
8.室温下将pH=2的盐酸与pH=12的氨水等体积混合,在所得的混合溶液中,下列关系正确的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
9.把0.02 mol·L-1醋酸钠溶液与0.01 mol·L-1盐酸等体积混合,混合后溶液显酸性,则溶液中有关微粒的浓度关系错误的是
A.c(CH3COOH)+c(CH3COO-)=0.01 mol·L-1
B.c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)
C.2c(Na+)=c(CH3COOH)+c(CH3COO-)
D.c(Na+)+c(H+)=c(CH3COO-)+c(Cl-)+c(OH-)
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
反应后的溶液中溶质为等物质的量浓度的NaCl、CH3COONa和CH3COOH,因为溶液呈酸性,说明CH3COOH的电离程度大于CH3COO-的水解程度,根据物料守恒得:c(CH3COOH)+c(CH3COO-)=c(Na+)= mol·L-1=0.01 mol·L-1,A正确、C错误;
反应后溶液呈酸性,说明CH3COOH的电离程度大于CH3COO-的水解程度,因此c(CH3COO-)>c(Cl-)>c(CH3COOH),因CH3COOH为弱酸,只发生部分电离,故c(CH3COOH)>c(H+),所以有c(CH3COO-)>c(Cl-)
>c(CH3COOH)>c(H+),B正确;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
据溶液中电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(Cl-)+c(OH-),D正确。
10.已知某一温度下,在0.1 mol·L-1的强电解质NaHA溶液中,c(H+)
B.c(H2A)+c(HA-)+c(A2-)=0.1 mol·L-1
C.将上述溶液稀释至0.01 mol·L-1,c(H+)·c(OH-)不变
D.c(A2-)+c(OH-)=c(H+)+c(H2A)
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
根据电荷守恒得c(H+)+c(Na+)=c(HA-)+2c(A2-)+c(OH-),故A项不正确;
由物料守恒知c(Na+)=c(H2A)+c(HA-)+c(A2-)=0.1 mol·L-1,故B项正确;
温度不变,则c(H+)·c(OH-)不变,故C项正确;
由质子守恒关系式可得c(H+)+c(H2A)=c(A2-)+c(OH-),故D项正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
11.有4种混合溶液,分别由等体积0.1 mol·L-1的2种溶液混合而成:
①CH3COONa与HCl,②CH3COONa与NaOH,③CH3COONa与NaCl,④CH3COONa与NaHCO3。下列关系正确的是
A.pH:②>③>④>① B.c(CH3COO-):②>④>③>①
C.c(H+):①>③>②>④ D.c(CH3COOH):①>④>③>②
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
A项,pH:②>④>③>①;
C项,应为①>③>④>②;
D项,应为①>③>④>②。
12.常温下,将Na2A和NaHA溶液分别进行稀释,若-lg c(Na+)=pNa、-lg c(OH-)=pOH,则测得两种溶液中pNa与pOH的关系曲线如图。下列说法正确的是
A.X点所在的直线表示NaHA溶液的稀释
B.在Y点加入适量NaOH固体可以达到X点
C.将X点和Y点溶液等体积混合,则有c(Na+)>c(A2-)>c(HA-)>c(OH-)
>c(H+)
D.常温下,H2A的Ka1数量级为10-5
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
浓度相同的Na2A和NaHA溶液中,NaHA的水解程度小,溶液碱性弱,故Y点所在的直线表示NaHA溶液的稀释,A项错误;
X点和Y点处pNa相同,即c(Na+)相同,在Y点加入适量NaOH固体,c(Na+)增大,故不可能达到X点,B项错误;
pNa=2时,c(Na+)=10-2 mol·L-1,故X点Na2A的浓度为0.5×10-2 mol·L-1,Y点NaHA的浓度为1×10-2 mol·L-1,未开始发生水解时A2-的浓度就是HA-的一半,且A2-水解程度大于HA-,故c(HA-)>c(A2-),C项错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
根据Y点所在直线,pNa=1、pOH=5时,可知c(Na+)=10-1 mol·L-1
(近似为水解后HA-的浓度),c(OH-)=10-5 mol·L-1,根据HA-+H2O
H2A+OH-,HA-的水解常数Kh= =10-9,则H2A的电离常数Ka1= =10-5,可知数量级为10-5,D项正确。
13.已知乙酸(HA)的酸性比甲酸(HB)弱,在物质的量浓度均为0.1 mol·L-1的NaA和NaB混合溶液中,下列排序正确的是
A.c(OH-)>c(HA)>c(HB)>c(H+)
B.c(OH-)>c(A-)>c(B-)>c(H+)
C.c(OH-)>c(B-)>c(A-)>c(H+)
D.c(OH-)>c(HB)>c(HA)>c(H+)
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
在NaA和NaB的混合溶液中存在A-和B-的水解平衡:A-+H2O HA
+OH-、B-+H2O HB+OH-,由于HA比HB酸性弱,因此A-的水解程度大于B-的水解程度,故c(HA)>c(HB)、c(B-)>c(A-)>c(OH-)。
14.(2020·江苏,14改编)室温下,将两种浓度均为0.10 mol·L-1的溶液等体积混合,若溶液混合引起的体积变化可忽略,下列各混合溶液中微粒物质的量浓度关系正确的是
A.NaHCO3-Na2CO3混合溶液(pH=10.30):c(Na+)>c( )>c(OH-)>c( )
B.氨水-NH4Cl混合溶液(pH=9.25):c( )+c(H+)=c(NH3·H2O)+c(OH-)
C.CH3COOH-CH3COONa混合溶液(pH=4.76):c(Na+)>c(CH3COOH)>
c(CH3COO-)>c(H+)
D.H2C2O4-NaHC2O4混合溶液(pH=1.68,H2C2O4为二元弱酸):c(H+)+
c(H2C2O4)=c(Na+)+c( )+c(OH-)
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
C项,溶液呈酸性,说明CH3COOH的电离程度大于CH3COO-的水解程度,则溶液中微粒浓度关系为c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+),错误;
15.常温下,向100 mL 0.01 mol·L-1 HA溶液中逐滴加入0.02 mol·L-1 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(1)由图中信息可知HA为____(填“强”或“弱”)酸,理由是_________
_______________________________ 。
强
0.01 mol·
L-1 HA溶液中c(H+)=0.01 mol·L-1
(2)常温下一定浓度的MA稀溶液的pH=a,则a____(填“>”“<”或“=”)7,用离子方程式表示其原因:______________________,此时溶液中由水电离出的c(OH-)=________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
<
1×10-a mol·L-1
由题目图像可知向100 mL 0.01 mol·L-1 HA溶液中滴加51 mL 0.02 mol·L-1 MOH溶液,pH=7,说明MOH是弱碱,故其所对应的MA是强酸弱碱盐,水解显酸性,溶液中的H+全部是水电离出来的,故水电离出的c(OH-)=1×10-a mol·L-1。
(3)请写出K点所对应的溶液中离子浓度的大小关系:________________
_____________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
c(M+)>c(A-)>
c(OH-)>c(H+)
K点是由100 mL0.01 mol·L-1 HA溶液与100 mL 0.02 mol·L-1 MOH溶液混合而成的,反应后的溶液为等物质的量浓度的MA和MOH溶液,故c(M+)>c(A-)>c(OH-)>c(H+)。
(4)K点对应的溶液中,c(M+)+c(MOH)_____(填“>”“<”或“=”)
2c(A-);若此时溶液的pH=10,则c(MOH)+c(OH-)=______mol·L-1。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
=
0.005
由物料守恒得c(M+)+c(MOH)=2c(A-),由电荷守恒得c(M+)+c(H+)=c(A-)+c(OH-),故c(MOH)+c(OH-)=c(A-)+c(H+)≈0.005 mol·L-1。
16.按要求回答下列问题:
(1)实验室中常用NaOH溶液来进行洗气和提纯,当用100 mL 3 mol·L-1的NaOH溶液吸收标准状况下4.48 L CO2时,所得溶液中各离子浓度由大到小的顺序为______________________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(2)土壤的pH一般在4~9之间。土壤中Na2CO3含量较高时,pH可高达10.5,试用离子方程式解释土壤呈碱性的原因:___________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
(3)常温下在20 mL 0.1 mol·L-1 Na2CO3溶液中逐滴加入0.1 mol·L-1盐酸40 mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
不能
②当pH=7时,溶液中含碳元素的主要微粒为_______________,溶液中各种离子的物质的量浓度的大小关系为_____________________________
___________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
=c(OH-)
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
常温下在20 mL 0.1 mol·L-1 Na2CO3溶液中逐滴加入0.1 mol·L-1盐酸40 mL,先反应生成碳酸氢钠,再与盐酸反应生成二氧化碳、水和氯化钠。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
10
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
返回
专题3
本课结束
