专题3第一单元 弱电解质的电离平衡 微专题8 电解质溶液的导电性(共31张ppt)
文档属性
| 名称 | 专题3第一单元 弱电解质的电离平衡 微专题8 电解质溶液的导电性(共31张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 470.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-02 00:00:00 | ||
图片预览











文档简介
(共31张PPT)
专题3
微专题8
WEIZHUANTIBA
电解质溶液的导电性
1.电解质溶液的导电原理
电解质在溶液中 的阴、阳离子,在电源(电场)的作用下沿某一方向 移动,形成电流。
2.影响电解质溶液导电能力的因素
电解质溶液的导电能力与溶液中 及离子所带 有关,离子浓度越大,离子所带电荷越多,导电能力越强。
注意 一般温度升高金属的导电能力减弱,弱电解质溶液的导电能力增强。
电离成自由移动
定向
离子浓度
电荷多少
1.盐酸是强酸,醋酸是弱酸,所以盐酸的导电能力一定比醋酸溶液的强,这种说法对吗?
提示 不一定。电解质溶液的导电能力与溶液中自由移动离子的浓度有关,当盐酸中离子的浓度大于醋酸中离子的浓度时,盐酸的导电能力比醋酸溶液的强;当盐酸中离子的浓度小于醋酸中离子的浓度时,盐酸的导电能力则比醋酸溶液的弱。
2.向1 L 1 mol·L-1的HCl溶液中加入1 mol NaOH固体(假设溶液体积无变化),溶液的导电性怎么变化?
提示 无明显变化。1 L 1 mol·L-1的HCl溶液与1 mol NaOH恰好完全反应生成1 mol NaCl,由于溶液体积不变,NaCl溶液的浓度为1 mol·L-1,所以反应前后溶液中离子浓度和所带电荷数目相同,溶液的导电性没有明显变化。
3.向500 mL 1 mol·L-1的醋酸溶液中加入等体积等浓度的氨水后,溶液的导电性怎样变化?
提示 导电性增强。醋酸溶液、氨水都是弱电解质溶液,导电性都较弱,但二者反应后生成的醋酸铵是强电解质,溶液的导电性增强。
1.下列物质中导电性最差的是
A.30%的硫酸 B.15%的盐酸
C.熔融的氯化钠 D.硝酸钾晶体
√
1
2
3
4
5
6
7
8
9
30%的硫酸中自由移动的离子浓度大于15%的盐酸,所以导电能力强,熔融的氯化钠可以导电,硝酸钾晶体中钾离子和硝酸根离子不可以自由移动,不能导电,导电性最差。
2.下列措施不能使0.1 mol·L-1的醋酸溶液导电性增强的是
A.加水 B.加无水醋酸
C.加NaOH固体 D.通NH3
√
1
2
3
4
5
6
7
8
9
加水稀释促进醋酸电离,但溶液中离子浓度降低,溶液的导电性减弱,故A符合题意;
加无水醋酸,使醋酸浓度增大,溶液中离子浓度变大,所以溶液导电性增强,故B不符合题意;
加入NaOH固体,生成强电解质醋酸钠,促进醋酸电离,溶液中离子浓度增大,溶液导电性增强,故C不符合题意;
通入氨气,氨气和醋酸反应生成醋酸铵和水,醋酸铵是强电解质,在水溶液里完全电离,溶液中离子浓度增大,溶液导电性增强,故D不符合题意。
1
2
3
4
5
6
7
8
9
3.(2021·徐州高二检测)电解质溶液的导电能力(用电导率表示,且电导率越大溶液的导电能力越强)与很多因素有关,其中之一是离子的种类,如图所示(HAc代表醋酸)。下列说法正确的是
A.强酸的电导率最大,强碱次之,盐类较低
B.浓度相同时,H2SO4溶液的导电能力可能大于
Na2SO4溶液
C.强电解质溶液的导电能力一定比弱电解质溶液强
D.氨水加水稀释或加酸中和后,溶液的导电能力均下降
√
1
2
3
4
5
6
7
8
9
1
2
3
4
5
6
7
8
9
当浓度相同时,强酸的电导率最大,强碱次之,盐类较低,故A错误;
由图可知,当浓度相同时,盐酸的电导率大于氯化钠溶液,由于其阴离子都是氯离子,说明同浓度时,氢离子电导率大于钠离子,因此,同浓度的硫酸的电导率大于硫酸钠溶液,电导率越大,导电能力越强,故B正确;
1
2
3
4
5
6
7
8
9
由题意知,溶液导电能力与离子浓度和离子种类有关,离子浓度较高的弱电解质溶液,导电能力可能高于离子浓度较低的强电解质溶液,故C错误;
氨水加水稀释,溶液中离子浓度减小,导电能力下降,加酸中和后生成盐,电离程度增大,则离子浓度增大,溶液的导电性增强,故D错误。
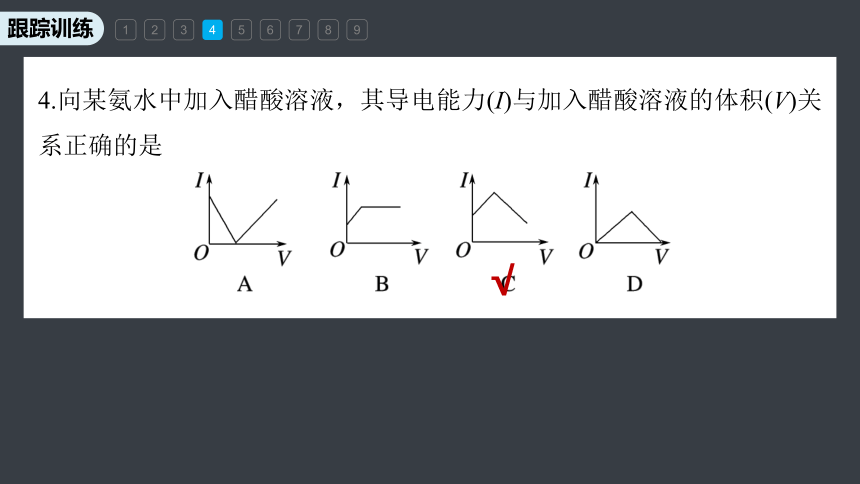
4.向某氨水中加入醋酸溶液,其导电能力(I)与加入醋酸溶液的体积(V)关系正确的是
1
2
3
4
5
6
7
8
9
√
1
2
3
4
5
6
7
8
9
氨水是弱电解质的水溶液,导电能力较弱,随着醋酸的加入,发生反应:CH3COOH+NH3·H2O===CH3COONH4+H2O,生成了强电解质CH3COONH4,导电能力增强,恰好反应完全时,溶液导电能力最强;继续加入醋酸,随着溶液体积的增大,离子浓度减小,溶液导电能力减弱,但溶液中存在离子,导电能力不可能为0,所以C项正确。
5.用如图所示装置分别进行下列各组物质的导电性实验,小灯泡的亮度比反应前明显减弱的是
A.向亚硫酸钠溶液中通入氯气
B.向硝酸银溶液中通入少量氯化氢
C.向氢碘酸饱和溶液中通入少量氧气
D.向氢氧化钠溶液中通入少量氯气
√
1
2
3
4
5
6
7
8
9
1
2
3
4
5
6
7
8
9
A项中发生的反应为Na2SO3+Cl2+H2O===Na2SO4+2HCl,生成了两种强电解质,溶液的导电能力增强,故灯泡变亮;
B项中发生的反应为AgNO3+HCl===AgCl↓+HNO3,溶液的导电能力没有明显变化,灯泡的亮度没有明显变化;
C项中发生的反应为4HI+O2===2H2O+2I2,溶液的导电能力下降,灯泡变暗;
D项中发生的反应为2NaOH+Cl2===NaCl+NaClO+H2O,溶液的导电能力没有明显变化,灯泡的亮度没有明显变化。
6.向一定体积的Ba(OH)2溶液中逐滴加入稀硫酸,测得混合溶液的导电能力随时间变化的曲线如图所示,下列说法正确的是
A.XY段溶液的导电能力不断减弱,说明H2SO4
不是电解质
B.a时刻表明参加反应的两种溶液的体积相等
C.Y处溶液的导电能力约为0,说明溶液中几乎没有自由移动的离子
D.YZ段溶液的导电能力不断增强,主要是由于Ba(OH)2电离出的离子导电
√
1
2
3
4
5
6
7
8
9
XY段溶液的导电能力不断减弱,是因为Ba(OH)2+H2SO4===BaSO4↓+2H2O,溶液中的离子浓度不断减小,H2SO4是强电解质,A项错误;
1
2
3
4
5
6
7
8
9
a时刻表明参加反应的两种溶液中Ba(OH)2和H2SO4的物质的量相等,两种溶液的体积不一定相等,B项错误;
YZ段溶液的导电能力不断增强,主要是由于过量硫酸电离出的离子导电,D项错误。
7.把0.05 mol NaOH固体分别加入下列100 mL溶液中,导电能力变化较大的是
A.0.5 mol·L-1 MgSO4溶液
B.0.5 mol·L-1盐酸
C.0.5 mol·L-1的CH3COOH溶液
D.0.5 mol·L-1 NH4Cl溶液
1
2
3
4
5
6
7
8
9
√
首先考虑物质间的反应,只有CH3COOH是弱电解质,原来的导电能力较弱,加入NaOH后,反应生成了强电解质,导电能力变化较大。
8.(1)在如图所示的串联装置中,发现灯泡不亮,但若向其中一个烧杯中加水,则灯泡会亮起来。
1
2
3
4
5
6
7
8
9
请问:
①向哪个烧杯中加水灯泡会亮起来,为什么?
_________________________________________________________________________________________________________________________________________。
向C烧杯中加水,灯泡就会亮起来;理由是纯醋酸中没有自由移动的离子,所以不导电,加水后纯醋酸就会发生电离,从而产生自由移动的离子,能够导电
1
2
3
4
5
6
7
8
9
②哪两个烧杯中的液体混合后导电能力会减弱?为什么?
________________________________________________________________________________。
A和D;因为两者混合发生反应:H2SO4+Ba(OH)2===BaSO4↓+2H2O,离子浓度降低
1
2
3
4
5
6
7
8
9
(2)在一定温度下,向电解质溶液中加入新物质时溶液的导电能力可能发生变化,实验过程中电流(I)随所加新物质的质量(m)变化的曲线如图所示。
1
2
3
4
5
6
7
8
9
下列各项中与A图变化趋势一致的是________(填字母,下同),与B图变化趋势一致的是________,与
C图变化趋势一致的是____。
a.向Ba(OH)2溶液中滴入H2SO4溶液至过量
b.向CH3COOH溶液中滴入氨水至过量
c.向澄清石灰水中通入CO2至过量
d.向NH4Cl溶液中逐渐加入适量NaOH固体
b
ac
d
1
2
3
4
5
6
7
8
9
a中发生反应的离子方程式为Ba2++2OH-+2H++ ===BaSO4↓+2H2O,溶液中离子浓度先减小,当Ba(OH)2和H2SO4恰好完全反应时,体系中只有BaSO4沉淀和水,导电能力接近于0,继续滴加H2SO4溶液,溶液中离子浓度增大,溶液的导电能力又逐渐增强,与B图变化趋势一致;
1
2
3
4
5
6
7
8
9
b中发生反应的离子方程式为CH3COOH+NH3·H2O===CH3COO-+
+H2O,随着反应的进行,溶液中离子浓度逐渐增大,溶液的导电能力逐渐增强,当CH3COOH和NH3·H2O恰好完全反应时,再滴加氨水,离子的数量没有明显增加,但溶液的体积增大,则离子浓度减小,溶液的导电能力减弱,与A图变化趋势一致;
1
2
3
4
5
6
7
8
9
c中刚通入CO2时发生反应的离子方程式为Ca2++2OH-+CO2===CaCO3↓
+H2O,CO2过量后发生的反应为CaCO3+H2O+CO2===Ca2++2 ,故溶液中离子浓度先减小后增大,导电能力的变化趋势与B图变化趋势一致;
1
2
3
4
5
6
7
8
9
d中发生反应的离子方程式为 +OH-===NH3·H2O,溶液中减少的
的物质的量和增加的Na+的物质的量几乎相等,溶液的体积变化不大,故溶液的导电能力几乎不变,与C图变化趋势一致。
9.在一定温度下,对冰醋酸加水稀释的过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示。
请回答下列问题:
(1)a、b、c三点对应的溶液中,c(H+)由
小到大的顺序为_________。
1
2
3
4
5
6
7
8
9
c<a<b
导电能力越强,c(H+)、c(CH3COO-)越大,故a、b、c三点对应的溶液中,c(H+)由小到大的顺序为c<a<b。
(2)若使c点对应的溶液中的c(CH3COO-)增大,则下列措施中,可行的是________(填字母,下同)。
A.加热
B.加入NaOH稀溶液
C.加入K2CO3固体
D.加水
E.加入CH3COONa固体
F.加入锌粒
1
2
3
4
5
6
7
8
9
ACEF
加热可以使CH3COOH的电离平衡右移,c(CH3COO-)增大,A正确;
加入NaOH稀溶液,虽然可使CH3COOH的电离平衡右移,但c(CH3COO-)因稀释而减小,B错误;
1
2
3
4
5
6
7
8
9
加入K2CO3固体, 与H+反应使平衡右移,c(CH3COO-)增大,C正确;
加水虽然会使平衡右移,但c(CH3COO-)减小,D错误;
加入CH3COONa固体虽然会使平衡左移,但c(CH3COO-)增大,E正确;
加入锌粒会消耗H+,使平衡右移,c(CH3COO-)增大,F正确。
(3)在稀释过程中,随着醋酸浓度的减小,下列始终保持增大趋势的是_____。
A.c(H+)
B.n(H+)
C.CH3COOH分子数
D.
1
2
3
4
5
6
7
8
9
BD
专题3
本课结束
专题3
微专题8
WEIZHUANTIBA
电解质溶液的导电性
1.电解质溶液的导电原理
电解质在溶液中 的阴、阳离子,在电源(电场)的作用下沿某一方向 移动,形成电流。
2.影响电解质溶液导电能力的因素
电解质溶液的导电能力与溶液中 及离子所带 有关,离子浓度越大,离子所带电荷越多,导电能力越强。
注意 一般温度升高金属的导电能力减弱,弱电解质溶液的导电能力增强。
电离成自由移动
定向
离子浓度
电荷多少
1.盐酸是强酸,醋酸是弱酸,所以盐酸的导电能力一定比醋酸溶液的强,这种说法对吗?
提示 不一定。电解质溶液的导电能力与溶液中自由移动离子的浓度有关,当盐酸中离子的浓度大于醋酸中离子的浓度时,盐酸的导电能力比醋酸溶液的强;当盐酸中离子的浓度小于醋酸中离子的浓度时,盐酸的导电能力则比醋酸溶液的弱。
2.向1 L 1 mol·L-1的HCl溶液中加入1 mol NaOH固体(假设溶液体积无变化),溶液的导电性怎么变化?
提示 无明显变化。1 L 1 mol·L-1的HCl溶液与1 mol NaOH恰好完全反应生成1 mol NaCl,由于溶液体积不变,NaCl溶液的浓度为1 mol·L-1,所以反应前后溶液中离子浓度和所带电荷数目相同,溶液的导电性没有明显变化。
3.向500 mL 1 mol·L-1的醋酸溶液中加入等体积等浓度的氨水后,溶液的导电性怎样变化?
提示 导电性增强。醋酸溶液、氨水都是弱电解质溶液,导电性都较弱,但二者反应后生成的醋酸铵是强电解质,溶液的导电性增强。
1.下列物质中导电性最差的是
A.30%的硫酸 B.15%的盐酸
C.熔融的氯化钠 D.硝酸钾晶体
√
1
2
3
4
5
6
7
8
9
30%的硫酸中自由移动的离子浓度大于15%的盐酸,所以导电能力强,熔融的氯化钠可以导电,硝酸钾晶体中钾离子和硝酸根离子不可以自由移动,不能导电,导电性最差。
2.下列措施不能使0.1 mol·L-1的醋酸溶液导电性增强的是
A.加水 B.加无水醋酸
C.加NaOH固体 D.通NH3
√
1
2
3
4
5
6
7
8
9
加水稀释促进醋酸电离,但溶液中离子浓度降低,溶液的导电性减弱,故A符合题意;
加无水醋酸,使醋酸浓度增大,溶液中离子浓度变大,所以溶液导电性增强,故B不符合题意;
加入NaOH固体,生成强电解质醋酸钠,促进醋酸电离,溶液中离子浓度增大,溶液导电性增强,故C不符合题意;
通入氨气,氨气和醋酸反应生成醋酸铵和水,醋酸铵是强电解质,在水溶液里完全电离,溶液中离子浓度增大,溶液导电性增强,故D不符合题意。
1
2
3
4
5
6
7
8
9
3.(2021·徐州高二检测)电解质溶液的导电能力(用电导率表示,且电导率越大溶液的导电能力越强)与很多因素有关,其中之一是离子的种类,如图所示(HAc代表醋酸)。下列说法正确的是
A.强酸的电导率最大,强碱次之,盐类较低
B.浓度相同时,H2SO4溶液的导电能力可能大于
Na2SO4溶液
C.强电解质溶液的导电能力一定比弱电解质溶液强
D.氨水加水稀释或加酸中和后,溶液的导电能力均下降
√
1
2
3
4
5
6
7
8
9
1
2
3
4
5
6
7
8
9
当浓度相同时,强酸的电导率最大,强碱次之,盐类较低,故A错误;
由图可知,当浓度相同时,盐酸的电导率大于氯化钠溶液,由于其阴离子都是氯离子,说明同浓度时,氢离子电导率大于钠离子,因此,同浓度的硫酸的电导率大于硫酸钠溶液,电导率越大,导电能力越强,故B正确;
1
2
3
4
5
6
7
8
9
由题意知,溶液导电能力与离子浓度和离子种类有关,离子浓度较高的弱电解质溶液,导电能力可能高于离子浓度较低的强电解质溶液,故C错误;
氨水加水稀释,溶液中离子浓度减小,导电能力下降,加酸中和后生成盐,电离程度增大,则离子浓度增大,溶液的导电性增强,故D错误。
4.向某氨水中加入醋酸溶液,其导电能力(I)与加入醋酸溶液的体积(V)关系正确的是
1
2
3
4
5
6
7
8
9
√
1
2
3
4
5
6
7
8
9
氨水是弱电解质的水溶液,导电能力较弱,随着醋酸的加入,发生反应:CH3COOH+NH3·H2O===CH3COONH4+H2O,生成了强电解质CH3COONH4,导电能力增强,恰好反应完全时,溶液导电能力最强;继续加入醋酸,随着溶液体积的增大,离子浓度减小,溶液导电能力减弱,但溶液中存在离子,导电能力不可能为0,所以C项正确。
5.用如图所示装置分别进行下列各组物质的导电性实验,小灯泡的亮度比反应前明显减弱的是
A.向亚硫酸钠溶液中通入氯气
B.向硝酸银溶液中通入少量氯化氢
C.向氢碘酸饱和溶液中通入少量氧气
D.向氢氧化钠溶液中通入少量氯气
√
1
2
3
4
5
6
7
8
9
1
2
3
4
5
6
7
8
9
A项中发生的反应为Na2SO3+Cl2+H2O===Na2SO4+2HCl,生成了两种强电解质,溶液的导电能力增强,故灯泡变亮;
B项中发生的反应为AgNO3+HCl===AgCl↓+HNO3,溶液的导电能力没有明显变化,灯泡的亮度没有明显变化;
C项中发生的反应为4HI+O2===2H2O+2I2,溶液的导电能力下降,灯泡变暗;
D项中发生的反应为2NaOH+Cl2===NaCl+NaClO+H2O,溶液的导电能力没有明显变化,灯泡的亮度没有明显变化。
6.向一定体积的Ba(OH)2溶液中逐滴加入稀硫酸,测得混合溶液的导电能力随时间变化的曲线如图所示,下列说法正确的是
A.XY段溶液的导电能力不断减弱,说明H2SO4
不是电解质
B.a时刻表明参加反应的两种溶液的体积相等
C.Y处溶液的导电能力约为0,说明溶液中几乎没有自由移动的离子
D.YZ段溶液的导电能力不断增强,主要是由于Ba(OH)2电离出的离子导电
√
1
2
3
4
5
6
7
8
9
XY段溶液的导电能力不断减弱,是因为Ba(OH)2+H2SO4===BaSO4↓+2H2O,溶液中的离子浓度不断减小,H2SO4是强电解质,A项错误;
1
2
3
4
5
6
7
8
9
a时刻表明参加反应的两种溶液中Ba(OH)2和H2SO4的物质的量相等,两种溶液的体积不一定相等,B项错误;
YZ段溶液的导电能力不断增强,主要是由于过量硫酸电离出的离子导电,D项错误。
7.把0.05 mol NaOH固体分别加入下列100 mL溶液中,导电能力变化较大的是
A.0.5 mol·L-1 MgSO4溶液
B.0.5 mol·L-1盐酸
C.0.5 mol·L-1的CH3COOH溶液
D.0.5 mol·L-1 NH4Cl溶液
1
2
3
4
5
6
7
8
9
√
首先考虑物质间的反应,只有CH3COOH是弱电解质,原来的导电能力较弱,加入NaOH后,反应生成了强电解质,导电能力变化较大。
8.(1)在如图所示的串联装置中,发现灯泡不亮,但若向其中一个烧杯中加水,则灯泡会亮起来。
1
2
3
4
5
6
7
8
9
请问:
①向哪个烧杯中加水灯泡会亮起来,为什么?
_________________________________________________________________________________________________________________________________________。
向C烧杯中加水,灯泡就会亮起来;理由是纯醋酸中没有自由移动的离子,所以不导电,加水后纯醋酸就会发生电离,从而产生自由移动的离子,能够导电
1
2
3
4
5
6
7
8
9
②哪两个烧杯中的液体混合后导电能力会减弱?为什么?
________________________________________________________________________________。
A和D;因为两者混合发生反应:H2SO4+Ba(OH)2===BaSO4↓+2H2O,离子浓度降低
1
2
3
4
5
6
7
8
9
(2)在一定温度下,向电解质溶液中加入新物质时溶液的导电能力可能发生变化,实验过程中电流(I)随所加新物质的质量(m)变化的曲线如图所示。
1
2
3
4
5
6
7
8
9
下列各项中与A图变化趋势一致的是________(填字母,下同),与B图变化趋势一致的是________,与
C图变化趋势一致的是____。
a.向Ba(OH)2溶液中滴入H2SO4溶液至过量
b.向CH3COOH溶液中滴入氨水至过量
c.向澄清石灰水中通入CO2至过量
d.向NH4Cl溶液中逐渐加入适量NaOH固体
b
ac
d
1
2
3
4
5
6
7
8
9
a中发生反应的离子方程式为Ba2++2OH-+2H++ ===BaSO4↓+2H2O,溶液中离子浓度先减小,当Ba(OH)2和H2SO4恰好完全反应时,体系中只有BaSO4沉淀和水,导电能力接近于0,继续滴加H2SO4溶液,溶液中离子浓度增大,溶液的导电能力又逐渐增强,与B图变化趋势一致;
1
2
3
4
5
6
7
8
9
b中发生反应的离子方程式为CH3COOH+NH3·H2O===CH3COO-+
+H2O,随着反应的进行,溶液中离子浓度逐渐增大,溶液的导电能力逐渐增强,当CH3COOH和NH3·H2O恰好完全反应时,再滴加氨水,离子的数量没有明显增加,但溶液的体积增大,则离子浓度减小,溶液的导电能力减弱,与A图变化趋势一致;
1
2
3
4
5
6
7
8
9
c中刚通入CO2时发生反应的离子方程式为Ca2++2OH-+CO2===CaCO3↓
+H2O,CO2过量后发生的反应为CaCO3+H2O+CO2===Ca2++2 ,故溶液中离子浓度先减小后增大,导电能力的变化趋势与B图变化趋势一致;
1
2
3
4
5
6
7
8
9
d中发生反应的离子方程式为 +OH-===NH3·H2O,溶液中减少的
的物质的量和增加的Na+的物质的量几乎相等,溶液的体积变化不大,故溶液的导电能力几乎不变,与C图变化趋势一致。
9.在一定温度下,对冰醋酸加水稀释的过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示。
请回答下列问题:
(1)a、b、c三点对应的溶液中,c(H+)由
小到大的顺序为_________。
1
2
3
4
5
6
7
8
9
c<a<b
导电能力越强,c(H+)、c(CH3COO-)越大,故a、b、c三点对应的溶液中,c(H+)由小到大的顺序为c<a<b。
(2)若使c点对应的溶液中的c(CH3COO-)增大,则下列措施中,可行的是________(填字母,下同)。
A.加热
B.加入NaOH稀溶液
C.加入K2CO3固体
D.加水
E.加入CH3COONa固体
F.加入锌粒
1
2
3
4
5
6
7
8
9
ACEF
加热可以使CH3COOH的电离平衡右移,c(CH3COO-)增大,A正确;
加入NaOH稀溶液,虽然可使CH3COOH的电离平衡右移,但c(CH3COO-)因稀释而减小,B错误;
1
2
3
4
5
6
7
8
9
加入K2CO3固体, 与H+反应使平衡右移,c(CH3COO-)增大,C正确;
加水虽然会使平衡右移,但c(CH3COO-)减小,D错误;
加入CH3COONa固体虽然会使平衡左移,但c(CH3COO-)增大,E正确;
加入锌粒会消耗H+,使平衡右移,c(CH3COO-)增大,F正确。
(3)在稀释过程中,随着醋酸浓度的减小,下列始终保持增大趋势的是_____。
A.c(H+)
B.n(H+)
C.CH3COOH分子数
D.
1
2
3
4
5
6
7
8
9
BD
专题3
本课结束
