化学人教版(2019)选择性必修1 4.3 金属的腐蚀与防护(共24张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 4.3 金属的腐蚀与防护(共24张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 4.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-03 15:23:39 | ||
图片预览






文档简介
(共24张PPT)
第四章 化学反应与电能
1.知道金属腐蚀的两种类型(化学腐蚀和电化学腐蚀)。
2.能解释金属发生电化学腐蚀的原因,认识金属腐蚀的危害。
3.知道防护金属腐蚀的方法。
学习目标:
教材内容:P107-112
第三节 金属的腐蚀与防护
情境引入
化学与生活:金属的腐蚀在生活中非常普遍
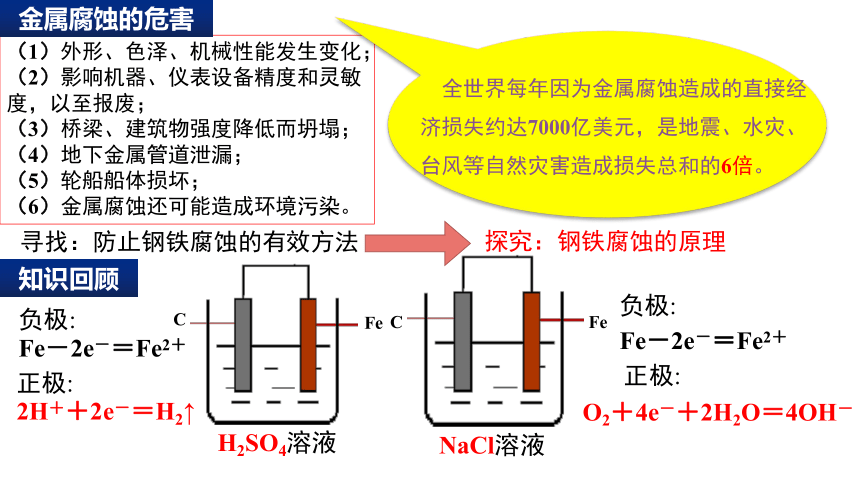
(1)外形、色泽、机械性能发生变化;
(2)影响机器、仪表设备精度和灵敏度,以至报废;
(3)桥梁、建筑物强度降低而坍塌;
(4)地下金属管道泄漏;
(5)轮船船体损坏;
(6)金属腐蚀还可能造成环境污染。
全世界每年因为金属腐蚀造成的直接经济损失约达7000亿美元,是地震、水灾、台风等自然灾害造成损失总和的6倍。
探究:钢铁腐蚀的原理
寻找:防止钢铁腐蚀的有效方法
知识回顾
NaCl溶液
C
Fe
H2SO4溶液
C
Fe
Fe-2e-=Fe2+
O2+4e-+2H2O=4OH-
Fe-2e-=Fe2+
2H++2e-=H2↑
负极:
正极:
负极:
正极:
金属腐蚀的危害
1. 定义:指金属或合金与周围接触到的______或________发和生_________反应而腐蚀损耗的过程。
2.金属腐蚀的本质是什么
是金属本身失去电子变成_______的过程(发生______反应)。
M - ne- = Mn+
气体
液体
氧化还原
阳离子
氧化
3.金属腐蚀的类型有哪些?
金属跟接触到的物质(如SO2、Cl2、O2等)____发生化学反应而引起的腐蚀。
_____金属跟____________接触时,发生_______反应,比较________的金属失去电子发生氧化而被腐蚀。
化学腐蚀:
(例:铁与氯气直接反应而腐蚀;输油、输气的钢管被原油、天然气中的含硫化合物腐蚀)
——根据与金属接触的介质不同分:
电化学腐蚀:
不纯
电解质溶液
原电池
活泼
直接
(例:钢铁制品在潮湿空气中的锈蚀就是电化学腐蚀)
一、金属腐蚀
化学腐蚀与电化学腐蚀的比较
化学腐蚀 电化学腐蚀
条件
特征
速率
结果
金属与氧化性物质直接接触
不纯金属与电解质溶液
及氧化剂接触
无电流产生
有微弱电流产生
金属被氧化
相对活泼的金属被氧化
小
大
通常情况下,两者同时存在,以电化学腐蚀为主
对比分析
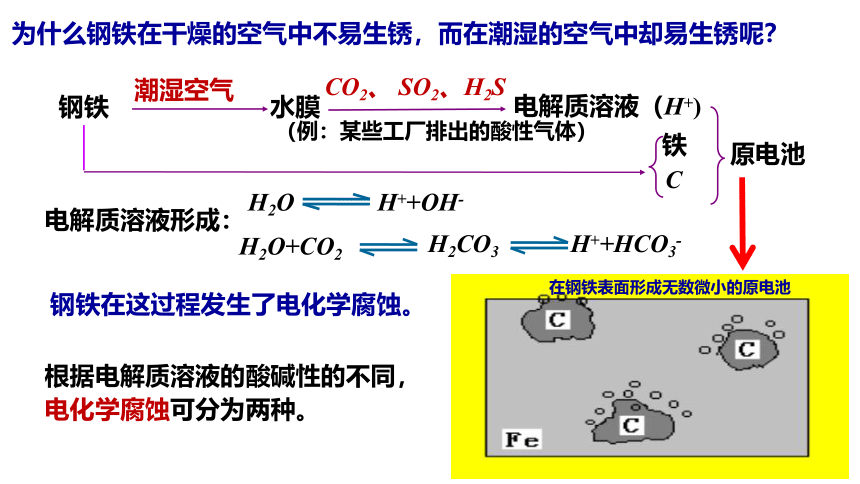
为什么钢铁在干燥的空气中不易生锈,而在潮湿的空气中却易生锈呢?
钢铁
潮湿空气
水膜
CO2、 SO2、H2S
电解质溶液(H+)
铁
C
原电池
电解质溶液形成:
钢铁在这过程发生了电化学腐蚀。
根据电解质溶液的酸碱性的不同,
电化学腐蚀可分为两种。
H++OH-
H2O
H2O+CO2
H++HCO3-
H2CO3
(例:某些工厂排出的酸性气体)
在钢铁表面形成无数微小的原电池
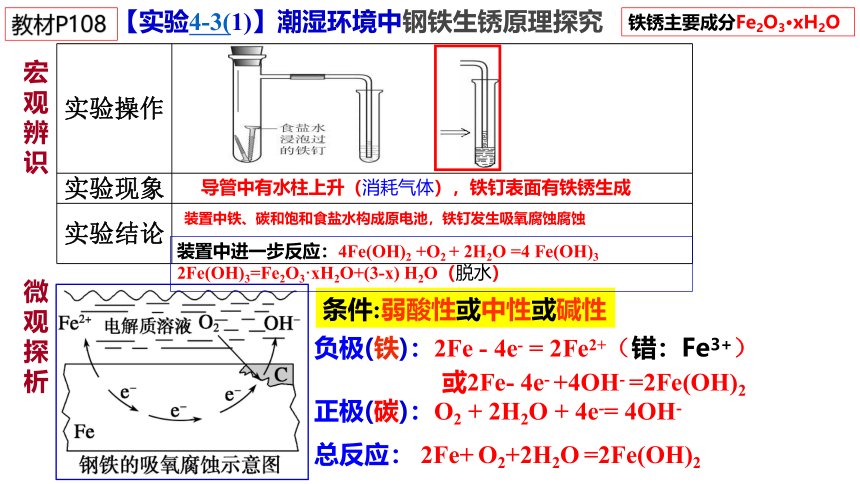
【实验4-3(1)】潮湿环境中钢铁生锈原理探究
实验操作
实验现象
实验结论
盐酸浸泡过的铁钉
装置中铁、碳和盐酸构成原电池,
铁钉发生析氢腐蚀腐蚀
导管中有水柱下降(生成气体),铁钉表面有铁锈生成
条件:水膜酸性较强
正极(碳): 2H++ 2e- =H2 ↑
负极(铁): Fe - 2e- = Fe2+(错:Fe3+)
总反应:Fe + 2H+ =Fe2+ + H2 ↑
宏观辨识
微观探析
实验操作
实验现象
实验结论
装置中铁、碳和饱和食盐水构成原电池,铁钉发生吸氧腐蚀腐蚀
导管中有水柱上升(消耗气体),铁钉表面有铁锈生成
【实验4-3(1)】潮湿环境中钢铁生锈原理探究
负极(铁):2Fe - 4e- = 2Fe2+(错:Fe3+)
正极(碳):O2 + 2H2O + 4e-= 4OH-
总反应: 2Fe+ O2+2H2O =2Fe(OH)2
条件:弱酸性或中性或碱性
或2Fe- 4e- +4OH- =2Fe(OH)2
装置中进一步反应:4Fe(OH)2 +O2 + 2H2O =4 Fe(OH)3 2Fe(OH)3=Fe2O3·xH2O+(3-x) H2O(脱水)
铁锈主要成分Fe2O3·xH2O
宏观辨识
微观探析
教材P108
(1)化学腐蚀和电化学腐蚀往往同时发生,只是电化学腐蚀比化学 腐蚀更普遍,速率也大得多危害更大。
(2) 析氢腐蚀和吸氧腐蚀都属于电化学腐蚀,钢铁发生析氢腐蚀或吸氧腐蚀时,负极都是铁,失电子生成Fe2+,而非Fe3+。
注:1、只有位于金属活动性顺序中氢前的金属才可能发生析氢
腐蚀,氢后的金属不能发生
2、氢前和氢后的金属都可发生吸氧腐蚀
(3)析氢腐蚀和吸氧腐蚀取决于金属表面电解质溶液的酸碱性,实际情况中以吸氧腐蚀为主。主要原因有两个,
第一:水膜一般不显强酸性;第二:多数金属都可发生
对比分析
析氢腐蚀 吸氧腐蚀
条件
电极反应 负极Fe(-)
正极C(+)
总反应
联系
水膜呈强酸性
水膜呈弱酸性或中性或碱性
Fe-2e-=Fe2+
2Fe- 4e- = 2Fe2+或
O2+2H2O+4e- =4OH-
2H++2e-=H2↑
2H++Fe=Fe2++H2 ↑
2Fe+2H2O+O2=2Fe(OH)2
4Fe(OH)2+2H2O+O2=4Fe(OH)3
金属的腐蚀以电化学腐蚀为主,
电化学腐蚀又以吸氧腐蚀为主。
钢铁的析氢腐蚀和吸氧腐蚀比较
2Fe(OH)3=Fe2O3·xH2O+(3-x) H2O
2Fe- 4e-+4OH- =2Fe(OH)2
对比分析
1.铁锅放置后什么位置容易生锈,为什么?
炒菜的铁锅有残存的氯化钠,放置后水滴容易聚集到锅底,与水接触的界面构成吸氧腐蚀,形成铁锈。
2.铁锅(铁碳合金)日久天长越用越薄,结合所学知识探讨?
1.炒菜的铁锅有残存的氯化钠,放置后水滴容易聚集到锅底,与水接触的界面构成吸氧腐蚀,形成铁锈。
2. 铁与氧气高温生成四氧化三铁。
3.铁锅倒醋等酸性的汤汁,发生析氢腐蚀。
分析讨论
1、改变金属材料的组成,例如:
2、在金属表面覆盖保护层
不锈钢
例如:①喷涂漆;②涂油脂;③表面钝化;④发蓝处理(致密的Fe3O4膜);⑤电镀(在钢铁表面形成铬等耐腐蚀性较强的金属镀层)等。
喷漆
镀铬
搪瓷
发蓝处理
制成不锈钢
钛合金
搪瓷(táng cí),是将无机玻璃质材料通过熔融凝于基体金属上并与金属牢固结合在一起的一种复合材料。
所谓发蓝是钢铁零件表面处理的一种防腐蚀的工艺。其原理就是在钢铁表面生成一定厚度和强度的致密的氧化层,成分主要是Fe3O4
二、金属的防护
白铁皮:锌比铁活泼,破损时与水膜构成原电池时,锌作负极失电子被氧化而腐蚀,铁作正被保护。
马口铁:铁比锡活泼,破损时与水膜构成原电池时,铁作负极失电子被氧化而易腐蚀。
马口铁:食品罐
白皮铁:屋面、卷管
教材P109
Zn>Fe>Sn
①牺牲阳极法(负极)
原电池原理
牺牲阳极保护法示意图
连接有镁块的地下钢管
氧化反应
找替“失”阳
船身上装锌块
形成原电池反应时,让被保护金属做正极,不反应,起到保护作用;
而活泼金属反应受到腐蚀。
3、电化学保护法
金属在发生电化学腐蚀时,总是作为原电池负极(阳极)的金属被腐蚀,作为正极(阴极)的金属不被腐蚀,如果能使被保护的金属成为阴极,则该金属就不易被腐蚀。
教材P110实验4-4牺牲阳极法实验(1)
实验装置 电流表 阳极 阴极
现象
有关反应
2H++2e=H2↑
Zn-2e-=Zn2+
偏转
锌片逐渐溶解
铁电极上有气泡冒出
试管中滴入2滴K3[Fe(CN)6] (铁氰化钾)溶液,无明显变化
结论:
锌片、铁片酸化的氯化钠溶液构成原电池,锌为阳极(负极)失电子,被腐蚀,
铁为阴极(正极)被保护。
Fe2++K3[Fe(CN)6]=KFe [Fe(CN)6]↓+2K+
黄色溶液
复分解反应
教材P111
蓝色沉淀
实验现象:裹有锌片的铁钉,锌片逐渐溶解,铁钉附近溶液变红色;
实验结论:
负极(锌):Zn-2e-=Zn2+;
正极(铁):O2+2H2O+4e-=4OH-
铁作正极,不反应,被保护
实验现象:裹有铜丝的铁钉,铁钉逐渐溶解,铁钉附近溶液中产生蓝色固体;
实验结论:
负极(铁):Fe-2e-=Fe2+;
正极(铜):O2+2H2O+4e-=4OH-
Fe2+与[Fe(CN)6]3-反应生成带有特征蓝色的铁氰化亚铁沉淀
铁作负极,发生氧化反应,被腐蚀
结论:不同金属构成原电池发生电化学腐蚀时,较活泼金属的被腐蚀,相对不活泼的金属被保护。
教材P110实验4-4牺牲阳极法实验(2)
②外加电流法
将要保护的钢铁设备作为___极,用惰性电极作为辅助___极,两者均存在于_ _____溶液里,接外加_____电源。通电后,____被强制流向被保护的钢铁设备,使钢铁表面腐蚀_____降至零或接近于零,钢铁设备被迫成为阴而受到保护。
电解原理
外加电流法示意图
阴
阳
电解质
直流
电子
电流
牺牲阳极法:
外加电流法:
辅助阳极
比被保护金属活泼(本身不断被腐蚀)
惰性材料(只起导电作用,惰性电极和金属均可作辅助阳极,但最好选用惰性电极,本身不被腐蚀而消耗)
相同:氧化反应
一般而言,外加电流法比牺牲阳极法保护效果更好。
教材P111
(2017全国Ⅰ卷11)支撑海港码头基础的钢管桩, 常用外加电流的阴极保护法进行防腐, 工作原理如图所示, 其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是
A .通入保护电流使钢管桩表面腐蚀电流接近于零
B.通电后外电路电子被强制从高硅铸铁流向钢管桩
C.高硅铸铁的作用是作为损耗阳极材料和传递电流
D.通入的保护电流应该根据环境条件变化进行调整
C
发散源
保护电流应根据环境(pH值,离子浓度,温度)变化
教材P113-7
对点训练
2.金属腐蚀快慢规律
(1)与构成微电池两极的材料有关。两极材料的活动性差别越大,氧化还原反应的速率越快,活泼金属被腐蚀的速度越快。
(2)同一金属在相同电解质溶液中,腐蚀快慢如下:
注意:在钢铁的腐蚀过程中,其电化学腐蚀更严重,在电化学腐蚀中,吸氧腐蚀更普遍。
1.影响金属化学腐蚀速率的因素:
①本性:金属越活泼,越易被腐蚀;
②温度:环境温度越高,腐蚀速率越快;
③浓度:氧化剂浓度越大,腐蚀速率越快。
拓展延伸
吸氧腐蚀
牺牲阳极(Zn)
保护阴极(Fe)
牺牲阳极(Fe)
保护阴极(Sn)
外加电流,
腐蚀阳极(Cu)
保护阴极(Fe)
外加电流,
腐蚀阳极(Fe)
保护阴极(Cu)
原电池原理
原电池原理
原电池原理
电解原理
电解原理
下列各情况,在其中Fe片腐蚀由快到慢的顺序是: 。
(5)>(2)>(1)>(3)>(4)
对点训练
1965年冬天,在湖北省望山楚墓群中,出土了传说中的越王勾践剑。这把青铜宝剑穿越了两千多年的历史长河,但剑身几乎不见锈斑。它千年不锈的原因到底是什么呢?
越王勾践剑的含铜量约为80%-83%、含锡量约为16%-17%。该剑出土时插在髹漆的木质剑鞘内。这座墓葬深埋在数米的地下,墓室四周用白膏泥填塞,白膏泥致密性更好。
化学与古文化
尝试思考并回答下列问题:
1. 保暖贴在发热过程中,
其主要成分起什么作用?
负极材料
正极材料
离子导体
保温材料
持续提供水,控制出水量
负极:Fe - 2e-=Fe2+
正极:2H2O + O2 + 4e- = 4OH-
总反应:2Fe + O2 +2H2O = 2Fe(OH)2
保暖贴的设计与制作
教材P112
研究与实践
尝试思考并回答下列问题:
2. 为什么保暖贴能持久而又 稳定地提供热量?
氧气与铁粉通过无数个微型原电池发生反应且速率很快,反应放出热量。产品使用了矿物材料蛭石来保温。
3. 保暖贴使用的是双层包装。外层由不透气的明胶层制成,内层由微孔透气膜制成。为什么要这样设计?
放热的时间和温度可以通过透气膜的透氧速率进行控制。
4. 为什么保暖贴使用后变得较硬?
使用后,内袋中的物质主要成分为炭粉、氯化钠固体、三氧化二铁固体以及含镁、铝的盐。
研究与实践
第四章 化学反应与电能
1.知道金属腐蚀的两种类型(化学腐蚀和电化学腐蚀)。
2.能解释金属发生电化学腐蚀的原因,认识金属腐蚀的危害。
3.知道防护金属腐蚀的方法。
学习目标:
教材内容:P107-112
第三节 金属的腐蚀与防护
情境引入
化学与生活:金属的腐蚀在生活中非常普遍
(1)外形、色泽、机械性能发生变化;
(2)影响机器、仪表设备精度和灵敏度,以至报废;
(3)桥梁、建筑物强度降低而坍塌;
(4)地下金属管道泄漏;
(5)轮船船体损坏;
(6)金属腐蚀还可能造成环境污染。
全世界每年因为金属腐蚀造成的直接经济损失约达7000亿美元,是地震、水灾、台风等自然灾害造成损失总和的6倍。
探究:钢铁腐蚀的原理
寻找:防止钢铁腐蚀的有效方法
知识回顾
NaCl溶液
C
Fe
H2SO4溶液
C
Fe
Fe-2e-=Fe2+
O2+4e-+2H2O=4OH-
Fe-2e-=Fe2+
2H++2e-=H2↑
负极:
正极:
负极:
正极:
金属腐蚀的危害
1. 定义:指金属或合金与周围接触到的______或________发和生_________反应而腐蚀损耗的过程。
2.金属腐蚀的本质是什么
是金属本身失去电子变成_______的过程(发生______反应)。
M - ne- = Mn+
气体
液体
氧化还原
阳离子
氧化
3.金属腐蚀的类型有哪些?
金属跟接触到的物质(如SO2、Cl2、O2等)____发生化学反应而引起的腐蚀。
_____金属跟____________接触时,发生_______反应,比较________的金属失去电子发生氧化而被腐蚀。
化学腐蚀:
(例:铁与氯气直接反应而腐蚀;输油、输气的钢管被原油、天然气中的含硫化合物腐蚀)
——根据与金属接触的介质不同分:
电化学腐蚀:
不纯
电解质溶液
原电池
活泼
直接
(例:钢铁制品在潮湿空气中的锈蚀就是电化学腐蚀)
一、金属腐蚀
化学腐蚀与电化学腐蚀的比较
化学腐蚀 电化学腐蚀
条件
特征
速率
结果
金属与氧化性物质直接接触
不纯金属与电解质溶液
及氧化剂接触
无电流产生
有微弱电流产生
金属被氧化
相对活泼的金属被氧化
小
大
通常情况下,两者同时存在,以电化学腐蚀为主
对比分析
为什么钢铁在干燥的空气中不易生锈,而在潮湿的空气中却易生锈呢?
钢铁
潮湿空气
水膜
CO2、 SO2、H2S
电解质溶液(H+)
铁
C
原电池
电解质溶液形成:
钢铁在这过程发生了电化学腐蚀。
根据电解质溶液的酸碱性的不同,
电化学腐蚀可分为两种。
H++OH-
H2O
H2O+CO2
H++HCO3-
H2CO3
(例:某些工厂排出的酸性气体)
在钢铁表面形成无数微小的原电池
【实验4-3(1)】潮湿环境中钢铁生锈原理探究
实验操作
实验现象
实验结论
盐酸浸泡过的铁钉
装置中铁、碳和盐酸构成原电池,
铁钉发生析氢腐蚀腐蚀
导管中有水柱下降(生成气体),铁钉表面有铁锈生成
条件:水膜酸性较强
正极(碳): 2H++ 2e- =H2 ↑
负极(铁): Fe - 2e- = Fe2+(错:Fe3+)
总反应:Fe + 2H+ =Fe2+ + H2 ↑
宏观辨识
微观探析
实验操作
实验现象
实验结论
装置中铁、碳和饱和食盐水构成原电池,铁钉发生吸氧腐蚀腐蚀
导管中有水柱上升(消耗气体),铁钉表面有铁锈生成
【实验4-3(1)】潮湿环境中钢铁生锈原理探究
负极(铁):2Fe - 4e- = 2Fe2+(错:Fe3+)
正极(碳):O2 + 2H2O + 4e-= 4OH-
总反应: 2Fe+ O2+2H2O =2Fe(OH)2
条件:弱酸性或中性或碱性
或2Fe- 4e- +4OH- =2Fe(OH)2
装置中进一步反应:4Fe(OH)2 +O2 + 2H2O =4 Fe(OH)3 2Fe(OH)3=Fe2O3·xH2O+(3-x) H2O(脱水)
铁锈主要成分Fe2O3·xH2O
宏观辨识
微观探析
教材P108
(1)化学腐蚀和电化学腐蚀往往同时发生,只是电化学腐蚀比化学 腐蚀更普遍,速率也大得多危害更大。
(2) 析氢腐蚀和吸氧腐蚀都属于电化学腐蚀,钢铁发生析氢腐蚀或吸氧腐蚀时,负极都是铁,失电子生成Fe2+,而非Fe3+。
注:1、只有位于金属活动性顺序中氢前的金属才可能发生析氢
腐蚀,氢后的金属不能发生
2、氢前和氢后的金属都可发生吸氧腐蚀
(3)析氢腐蚀和吸氧腐蚀取决于金属表面电解质溶液的酸碱性,实际情况中以吸氧腐蚀为主。主要原因有两个,
第一:水膜一般不显强酸性;第二:多数金属都可发生
对比分析
析氢腐蚀 吸氧腐蚀
条件
电极反应 负极Fe(-)
正极C(+)
总反应
联系
水膜呈强酸性
水膜呈弱酸性或中性或碱性
Fe-2e-=Fe2+
2Fe- 4e- = 2Fe2+或
O2+2H2O+4e- =4OH-
2H++2e-=H2↑
2H++Fe=Fe2++H2 ↑
2Fe+2H2O+O2=2Fe(OH)2
4Fe(OH)2+2H2O+O2=4Fe(OH)3
金属的腐蚀以电化学腐蚀为主,
电化学腐蚀又以吸氧腐蚀为主。
钢铁的析氢腐蚀和吸氧腐蚀比较
2Fe(OH)3=Fe2O3·xH2O+(3-x) H2O
2Fe- 4e-+4OH- =2Fe(OH)2
对比分析
1.铁锅放置后什么位置容易生锈,为什么?
炒菜的铁锅有残存的氯化钠,放置后水滴容易聚集到锅底,与水接触的界面构成吸氧腐蚀,形成铁锈。
2.铁锅(铁碳合金)日久天长越用越薄,结合所学知识探讨?
1.炒菜的铁锅有残存的氯化钠,放置后水滴容易聚集到锅底,与水接触的界面构成吸氧腐蚀,形成铁锈。
2. 铁与氧气高温生成四氧化三铁。
3.铁锅倒醋等酸性的汤汁,发生析氢腐蚀。
分析讨论
1、改变金属材料的组成,例如:
2、在金属表面覆盖保护层
不锈钢
例如:①喷涂漆;②涂油脂;③表面钝化;④发蓝处理(致密的Fe3O4膜);⑤电镀(在钢铁表面形成铬等耐腐蚀性较强的金属镀层)等。
喷漆
镀铬
搪瓷
发蓝处理
制成不锈钢
钛合金
搪瓷(táng cí),是将无机玻璃质材料通过熔融凝于基体金属上并与金属牢固结合在一起的一种复合材料。
所谓发蓝是钢铁零件表面处理的一种防腐蚀的工艺。其原理就是在钢铁表面生成一定厚度和强度的致密的氧化层,成分主要是Fe3O4
二、金属的防护
白铁皮:锌比铁活泼,破损时与水膜构成原电池时,锌作负极失电子被氧化而腐蚀,铁作正被保护。
马口铁:铁比锡活泼,破损时与水膜构成原电池时,铁作负极失电子被氧化而易腐蚀。
马口铁:食品罐
白皮铁:屋面、卷管
教材P109
Zn>Fe>Sn
①牺牲阳极法(负极)
原电池原理
牺牲阳极保护法示意图
连接有镁块的地下钢管
氧化反应
找替“失”阳
船身上装锌块
形成原电池反应时,让被保护金属做正极,不反应,起到保护作用;
而活泼金属反应受到腐蚀。
3、电化学保护法
金属在发生电化学腐蚀时,总是作为原电池负极(阳极)的金属被腐蚀,作为正极(阴极)的金属不被腐蚀,如果能使被保护的金属成为阴极,则该金属就不易被腐蚀。
教材P110实验4-4牺牲阳极法实验(1)
实验装置 电流表 阳极 阴极
现象
有关反应
2H++2e=H2↑
Zn-2e-=Zn2+
偏转
锌片逐渐溶解
铁电极上有气泡冒出
试管中滴入2滴K3[Fe(CN)6] (铁氰化钾)溶液,无明显变化
结论:
锌片、铁片酸化的氯化钠溶液构成原电池,锌为阳极(负极)失电子,被腐蚀,
铁为阴极(正极)被保护。
Fe2++K3[Fe(CN)6]=KFe [Fe(CN)6]↓+2K+
黄色溶液
复分解反应
教材P111
蓝色沉淀
实验现象:裹有锌片的铁钉,锌片逐渐溶解,铁钉附近溶液变红色;
实验结论:
负极(锌):Zn-2e-=Zn2+;
正极(铁):O2+2H2O+4e-=4OH-
铁作正极,不反应,被保护
实验现象:裹有铜丝的铁钉,铁钉逐渐溶解,铁钉附近溶液中产生蓝色固体;
实验结论:
负极(铁):Fe-2e-=Fe2+;
正极(铜):O2+2H2O+4e-=4OH-
Fe2+与[Fe(CN)6]3-反应生成带有特征蓝色的铁氰化亚铁沉淀
铁作负极,发生氧化反应,被腐蚀
结论:不同金属构成原电池发生电化学腐蚀时,较活泼金属的被腐蚀,相对不活泼的金属被保护。
教材P110实验4-4牺牲阳极法实验(2)
②外加电流法
将要保护的钢铁设备作为___极,用惰性电极作为辅助___极,两者均存在于_ _____溶液里,接外加_____电源。通电后,____被强制流向被保护的钢铁设备,使钢铁表面腐蚀_____降至零或接近于零,钢铁设备被迫成为阴而受到保护。
电解原理
外加电流法示意图
阴
阳
电解质
直流
电子
电流
牺牲阳极法:
外加电流法:
辅助阳极
比被保护金属活泼(本身不断被腐蚀)
惰性材料(只起导电作用,惰性电极和金属均可作辅助阳极,但最好选用惰性电极,本身不被腐蚀而消耗)
相同:氧化反应
一般而言,外加电流法比牺牲阳极法保护效果更好。
教材P111
(2017全国Ⅰ卷11)支撑海港码头基础的钢管桩, 常用外加电流的阴极保护法进行防腐, 工作原理如图所示, 其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是
A .通入保护电流使钢管桩表面腐蚀电流接近于零
B.通电后外电路电子被强制从高硅铸铁流向钢管桩
C.高硅铸铁的作用是作为损耗阳极材料和传递电流
D.通入的保护电流应该根据环境条件变化进行调整
C
发散源
保护电流应根据环境(pH值,离子浓度,温度)变化
教材P113-7
对点训练
2.金属腐蚀快慢规律
(1)与构成微电池两极的材料有关。两极材料的活动性差别越大,氧化还原反应的速率越快,活泼金属被腐蚀的速度越快。
(2)同一金属在相同电解质溶液中,腐蚀快慢如下:
注意:在钢铁的腐蚀过程中,其电化学腐蚀更严重,在电化学腐蚀中,吸氧腐蚀更普遍。
1.影响金属化学腐蚀速率的因素:
①本性:金属越活泼,越易被腐蚀;
②温度:环境温度越高,腐蚀速率越快;
③浓度:氧化剂浓度越大,腐蚀速率越快。
拓展延伸
吸氧腐蚀
牺牲阳极(Zn)
保护阴极(Fe)
牺牲阳极(Fe)
保护阴极(Sn)
外加电流,
腐蚀阳极(Cu)
保护阴极(Fe)
外加电流,
腐蚀阳极(Fe)
保护阴极(Cu)
原电池原理
原电池原理
原电池原理
电解原理
电解原理
下列各情况,在其中Fe片腐蚀由快到慢的顺序是: 。
(5)>(2)>(1)>(3)>(4)
对点训练
1965年冬天,在湖北省望山楚墓群中,出土了传说中的越王勾践剑。这把青铜宝剑穿越了两千多年的历史长河,但剑身几乎不见锈斑。它千年不锈的原因到底是什么呢?
越王勾践剑的含铜量约为80%-83%、含锡量约为16%-17%。该剑出土时插在髹漆的木质剑鞘内。这座墓葬深埋在数米的地下,墓室四周用白膏泥填塞,白膏泥致密性更好。
化学与古文化
尝试思考并回答下列问题:
1. 保暖贴在发热过程中,
其主要成分起什么作用?
负极材料
正极材料
离子导体
保温材料
持续提供水,控制出水量
负极:Fe - 2e-=Fe2+
正极:2H2O + O2 + 4e- = 4OH-
总反应:2Fe + O2 +2H2O = 2Fe(OH)2
保暖贴的设计与制作
教材P112
研究与实践
尝试思考并回答下列问题:
2. 为什么保暖贴能持久而又 稳定地提供热量?
氧气与铁粉通过无数个微型原电池发生反应且速率很快,反应放出热量。产品使用了矿物材料蛭石来保温。
3. 保暖贴使用的是双层包装。外层由不透气的明胶层制成,内层由微孔透气膜制成。为什么要这样设计?
放热的时间和温度可以通过透气膜的透氧速率进行控制。
4. 为什么保暖贴使用后变得较硬?
使用后,内袋中的物质主要成分为炭粉、氯化钠固体、三氧化二铁固体以及含镁、铝的盐。
研究与实践
