化学人教版(2019)选择性必修2第二章 分子结构与性质复习(共24张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修2第二章 分子结构与性质复习(共24张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 641.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-03 15:25:22 | ||
图片预览






文档简介
(共24张PPT)
第二章 分子结构与性质
章末复习
人教版(2019)选择性必修二
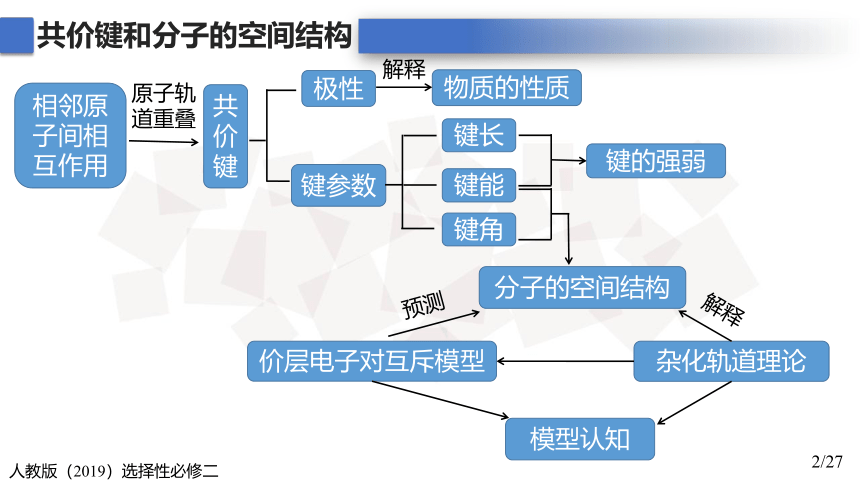
共价键和分子的空间结构
2/27
键参数
相邻原子间相互作用
共价键
原子轨
道重叠
极性
物质的性质
解释
键长
键能
键角
键的强弱
分子的空间结构
价层电子对互斥模型
杂化轨道理论
模型认知
解释
预测
人教版(2019)选择性必修二
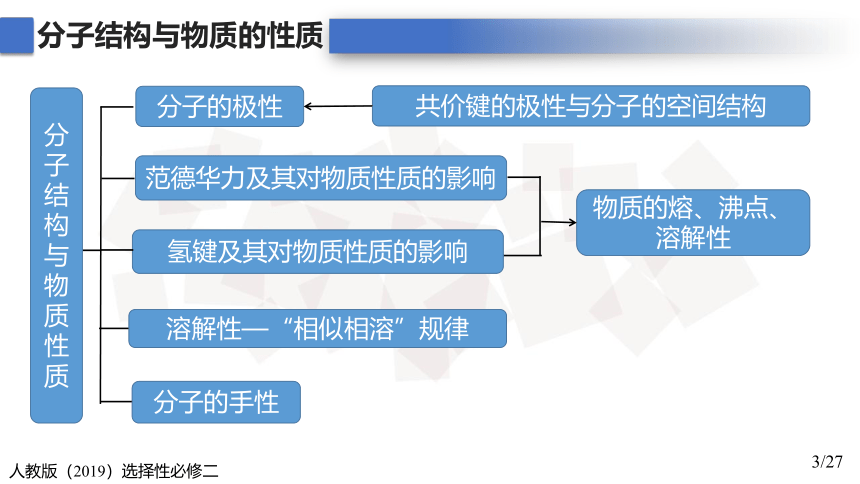
分子结构与物质的性质
3/27
分子结构与物质性质
范德华力及其对物质性质的影响
分子的极性
物质的熔、沸点、溶解性
氢键及其对物质性质的影响
溶解性—“相似相溶”规律
分子的手性
共价键的极性与分子的空间结构
人教版(2019)选择性必修二
一
共价键
4/27
间通 所形成的 叫做共价键。
原子
共用电子对
相互作用
1.共价键的定义
原子间通过 (即原子轨道重叠)产生的强烈作用。
2.共价键的本质
共用电子对
3.共价键的特征
分子组成
立体构型
人教版(2019)选择性必修二
饱和性
方向性
一
共价键
5/27
4.共价键的分类
(1)按共用电子对数
(2)按极性
(3)按成键方式
共价键极性强弱比较:电负性差值越大,极性越强
头碰头;轴对称;形成σ键的原子轨道重叠程度较大,故σ键有较强的稳定性
肩并肩;镜面对称;π键与σ键的强度不同
单键
共价单键是σ键
双键
共价双键是1个σ键,1个π键
三键
共价三键是1个σ键,2个π键
极性键
非极性键
σ键
π键
人教版(2019)选择性必修二
一
共价键
6/27
5.共价键的参数
一般地,形成的共价键的键能越大,键长越短,共价键越稳定,含有该键的分子越稳定,化学性质越稳定
键长和键角的数值可以通过X射线衍射实验获得
人教版(2019)选择性必修二
一
共价键
7/27
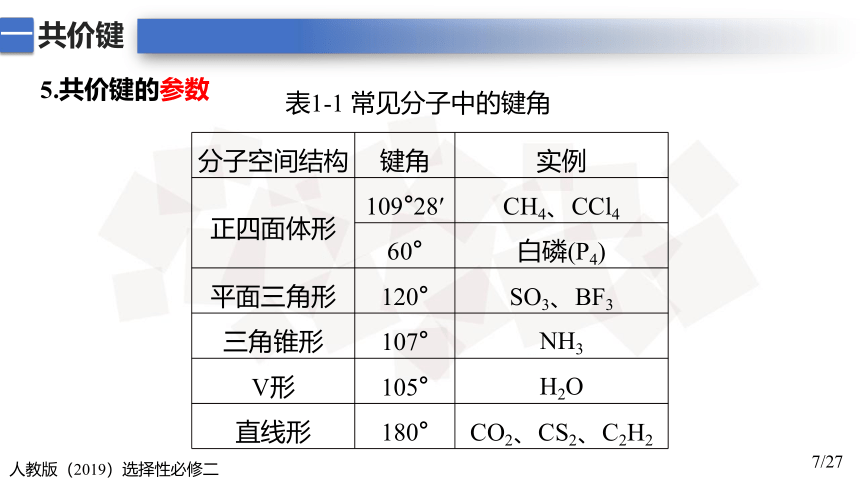
分子空间结构 键角 实例
正四面体形 109°28′ CH4、CCl4
60° 白磷(P4)
平面三角形 120° SO3、BF3
三角锥形 107° NH3
V形 105° H2O
直线形 180° CO2、CS2、C2H2
表1-1 常见分子中的键角
5.共价键的参数
人教版(2019)选择性必修二
二
价层电子对互斥理论
8/27
1.ABn型分子或离子的中心原子价层电子对数的计算方法
价层电子对数
σ键电子对数
中心原子上的孤电子对数
中心原子结合的原子数
=
(a-xb)
—
2
1
=
其中:a为中心原子的价电子数,
对主族元素,a=最外层电子数;
对于阳离子,a=价电子数-离子电荷数;
对于阴离子,a=价电子数+|离子电荷数|。
x为与中心原子结合的原子数;
b为与中心原子结合的原子最多能接受的电子数,H为1。
人教版(2019)选择性必修二
二
价层电子对互斥理论
9/27
2.根据价层电子对互斥模型推测分子或离子的空间结构
计算价层电子对数
确定VSEPR模型
略去孤电子对
分子或离子的空间结构
认识中心原子
σ键电子对数
孤电子对数
人教版(2019)选择性必修二
三
杂化轨道
10/27
a.杂化轨道数 = 参与杂化的原子轨道数
b.杂化改变了原子轨道的形状
c.杂化使原子的成键能力增强
d.杂化轨道用于形成σ键或容纳孤电子对
人教版(2019)选择性必修二
三
杂化轨道
11/27
表3-1 杂化轨道类型及分子的空间结构
杂化类型 sp sp2 sp3
参与杂化的原 子轨道及数目 1个s轨道和 1个p轨道 1个s轨道和 2个p轨道 1个s轨道和
3个p轨道
杂化轨道的数目 2 3 4
杂化轨道间的夹角 180° 120° 109°28'
空间结构名称 直线形 平面三角形 正四面体形
实例 CO2、C2H2 BF3、CH2O CH4、CCl4
人教版(2019)选择性必修二
三
杂化轨道
12/27
对于ABn型分子或离子,其中心原子A的杂化轨道数恰好与A的价电子对数相等。
A的价电子对数 2 3 4
A的杂化轨道数
杂化类型
A的价电子空间构型(VSEPR模型)
A的杂化轨道空间构型
ABn型分子或离子空间构型
2
3
4
sp
sp2
sp3
直线形
平面三角形
正四面体
直线形
平面三角形
正四面体
直线形
平面三角形BF3或
V形SO2
正四面体、三角锥形或V形
表3-2 杂化轨道类型的判断
人教版(2019)选择性必修二
四
共价键的极性
13/27
1.键的极性——极性键与非极性键
共价键
分类 极性共价键 非极性共价键
成键原子 不同元素的原子 同种元素的原子
共用电子对 发生偏移 不发生偏移
成键原子 的电性 电负性较小的原子呈正电性(δ+), 电负性较大的原子呈负电性(δ-) 电中性
人教版(2019)选择性必修二
四
共价键的极性
14/27
2.键的极性判断方法
键的极性只取决于成键原子的元素种类或电负性的差异,与其他因素无关。
人教版(2019)选择性必修二
四
共价键的极性
15/27
3.分子的极性
(1)非极性分子
电荷分布均匀、空间结构对称的分子
或者:正电荷中心与负电荷中心重合,即键的极性的向量和为0
(2)极性分子
电荷分布不均匀、空间结构不对称的分子
或者:正电荷中心与负电荷中心不重合,即键的极性的向量和不为0
要对分子极性进行判断,也可用极性向量。极性向量的矢量和指向的一端,说明该处负电荷更为集中,为极性分子。若矢量和为零,为非极性分子。
人教版(2019)选择性必修二
四
共价键的极性
16/27
4.分子极性的判断方法
(1)单原子分子
(稀有气体)——非极性分子
(2)双原子分子
化合物——极性分子
单 质——非极性分子
取决于原子间的共价键是否有极性
(3)根据极性键的极性的向量和是否为零判断
当分子中各个键的极性向量和等于0时,是非极性分子;
当分子中各个键的极性向量和不等于0时,是极性分子。
人教版(2019)选择性必修二
四
共价键的极性
17/27
4.分子极性的判断方法
(4)化合价法
ABn型分子中
中心原子化合价的绝对值
该元素的价电子数
=
该分子为非极性分子
分子的空间结构中心对称
直线形
平面正三角形
正四面体
人教版(2019)选择性必修二
四
共价键的极性
18/27
4.分子极性的判断方法
(4)化合价法
ABn型分子中
中心原子化合价的绝对值
该元素的价电子数
该分子为极性分子
分子的空间结构不中心对称
≠
V形
三角锥形
四面体
人教版(2019)选择性必修二
五
分子间作用力
19/27
表5-1 范德华力、氢键、共价键的比较
概念 范德华力 氢键 共价键
定义 物质分子之间普遍存在的一种作用力 已经与电负性很大的原子形成共价键的氢原子与另一个电负性很大的原子之间的静电作用 原子间通过共用电子对所形成的相互作用
作用微粒 分子 H与N、O、F 原子
特征 无方向性和饱和性 有方向性和饱和性 有方向性和饱和性
强度 共价键>氢键>范德华力
人教版(2019)选择性必修二
五
分子间作用力
20/27
表5-1 范德华力、氢键、共价键的比较
概念 范德华力 氢键 共价键
影响 强度的 因素 ①随分子极性的增大而增大 ②分子组成和结构相似的物质,相对分子质量越大,范德华力越大 对于X—H…Y,X、Y的电负性越大,Y原子的半径越小,作用越强 成键原子半径和共用电子对数目。键长越小,键能越大,共价键越稳定
对物质 性质的 影响 ①影响物质的熔点、沸点 ②组成和结构相似的物质,随相对分子质量的增大,物质的熔、沸点升高,如CF4人教版(2019)选择性必修二
六
溶解性
21/27
非极性溶质一般能溶于 ,
极性溶质一般能溶于 。
非极性溶剂
极性溶剂
1.相似相溶
(1)分子极性相似
溶质和溶剂的分子结构相似程度越大,其溶解性越 。
(2)分子结构相似
大
注:相似相溶是一条经验规律,也会有不符合的例子:CO、NO等极性分子均难溶于水;H2、N2难溶于水也难溶于苯。
人教版(2019)选择性必修二
六
溶解性
22/27
主要有 等。
温度和压强
溶剂和溶质之间的氢键作用力越大,溶解性越好;
无氢键相互作用的溶质在有氢键的水中溶解度就比较小
注:如果溶质与水能发生化学反应,也会增大溶质的溶解度。
2、氢键
3、外界因素
人教版(2019)选择性必修二
七
23/27
分子的手性
1.分子的手性判断
(1)判断方法:有机物分子中是否存在 。
(2)手性碳原子:连接四个互不相同的原子或基团的碳原子称为手性碳原子。用*C来标记。具有手性的有机物,是因为其含有手性碳原子。
手性碳原子
人教版(2019)选择性必修二
Thank You
第二章 分子结构与性质
章末复习
人教版(2019)选择性必修二
共价键和分子的空间结构
2/27
键参数
相邻原子间相互作用
共价键
原子轨
道重叠
极性
物质的性质
解释
键长
键能
键角
键的强弱
分子的空间结构
价层电子对互斥模型
杂化轨道理论
模型认知
解释
预测
人教版(2019)选择性必修二
分子结构与物质的性质
3/27
分子结构与物质性质
范德华力及其对物质性质的影响
分子的极性
物质的熔、沸点、溶解性
氢键及其对物质性质的影响
溶解性—“相似相溶”规律
分子的手性
共价键的极性与分子的空间结构
人教版(2019)选择性必修二
一
共价键
4/27
间通 所形成的 叫做共价键。
原子
共用电子对
相互作用
1.共价键的定义
原子间通过 (即原子轨道重叠)产生的强烈作用。
2.共价键的本质
共用电子对
3.共价键的特征
分子组成
立体构型
人教版(2019)选择性必修二
饱和性
方向性
一
共价键
5/27
4.共价键的分类
(1)按共用电子对数
(2)按极性
(3)按成键方式
共价键极性强弱比较:电负性差值越大,极性越强
头碰头;轴对称;形成σ键的原子轨道重叠程度较大,故σ键有较强的稳定性
肩并肩;镜面对称;π键与σ键的强度不同
单键
共价单键是σ键
双键
共价双键是1个σ键,1个π键
三键
共价三键是1个σ键,2个π键
极性键
非极性键
σ键
π键
人教版(2019)选择性必修二
一
共价键
6/27
5.共价键的参数
一般地,形成的共价键的键能越大,键长越短,共价键越稳定,含有该键的分子越稳定,化学性质越稳定
键长和键角的数值可以通过X射线衍射实验获得
人教版(2019)选择性必修二
一
共价键
7/27
分子空间结构 键角 实例
正四面体形 109°28′ CH4、CCl4
60° 白磷(P4)
平面三角形 120° SO3、BF3
三角锥形 107° NH3
V形 105° H2O
直线形 180° CO2、CS2、C2H2
表1-1 常见分子中的键角
5.共价键的参数
人教版(2019)选择性必修二
二
价层电子对互斥理论
8/27
1.ABn型分子或离子的中心原子价层电子对数的计算方法
价层电子对数
σ键电子对数
中心原子上的孤电子对数
中心原子结合的原子数
=
(a-xb)
—
2
1
=
其中:a为中心原子的价电子数,
对主族元素,a=最外层电子数;
对于阳离子,a=价电子数-离子电荷数;
对于阴离子,a=价电子数+|离子电荷数|。
x为与中心原子结合的原子数;
b为与中心原子结合的原子最多能接受的电子数,H为1。
人教版(2019)选择性必修二
二
价层电子对互斥理论
9/27
2.根据价层电子对互斥模型推测分子或离子的空间结构
计算价层电子对数
确定VSEPR模型
略去孤电子对
分子或离子的空间结构
认识中心原子
σ键电子对数
孤电子对数
人教版(2019)选择性必修二
三
杂化轨道
10/27
a.杂化轨道数 = 参与杂化的原子轨道数
b.杂化改变了原子轨道的形状
c.杂化使原子的成键能力增强
d.杂化轨道用于形成σ键或容纳孤电子对
人教版(2019)选择性必修二
三
杂化轨道
11/27
表3-1 杂化轨道类型及分子的空间结构
杂化类型 sp sp2 sp3
参与杂化的原 子轨道及数目 1个s轨道和 1个p轨道 1个s轨道和 2个p轨道 1个s轨道和
3个p轨道
杂化轨道的数目 2 3 4
杂化轨道间的夹角 180° 120° 109°28'
空间结构名称 直线形 平面三角形 正四面体形
实例 CO2、C2H2 BF3、CH2O CH4、CCl4
人教版(2019)选择性必修二
三
杂化轨道
12/27
对于ABn型分子或离子,其中心原子A的杂化轨道数恰好与A的价电子对数相等。
A的价电子对数 2 3 4
A的杂化轨道数
杂化类型
A的价电子空间构型(VSEPR模型)
A的杂化轨道空间构型
ABn型分子或离子空间构型
2
3
4
sp
sp2
sp3
直线形
平面三角形
正四面体
直线形
平面三角形
正四面体
直线形
平面三角形BF3或
V形SO2
正四面体、三角锥形或V形
表3-2 杂化轨道类型的判断
人教版(2019)选择性必修二
四
共价键的极性
13/27
1.键的极性——极性键与非极性键
共价键
分类 极性共价键 非极性共价键
成键原子 不同元素的原子 同种元素的原子
共用电子对 发生偏移 不发生偏移
成键原子 的电性 电负性较小的原子呈正电性(δ+), 电负性较大的原子呈负电性(δ-) 电中性
人教版(2019)选择性必修二
四
共价键的极性
14/27
2.键的极性判断方法
键的极性只取决于成键原子的元素种类或电负性的差异,与其他因素无关。
人教版(2019)选择性必修二
四
共价键的极性
15/27
3.分子的极性
(1)非极性分子
电荷分布均匀、空间结构对称的分子
或者:正电荷中心与负电荷中心重合,即键的极性的向量和为0
(2)极性分子
电荷分布不均匀、空间结构不对称的分子
或者:正电荷中心与负电荷中心不重合,即键的极性的向量和不为0
要对分子极性进行判断,也可用极性向量。极性向量的矢量和指向的一端,说明该处负电荷更为集中,为极性分子。若矢量和为零,为非极性分子。
人教版(2019)选择性必修二
四
共价键的极性
16/27
4.分子极性的判断方法
(1)单原子分子
(稀有气体)——非极性分子
(2)双原子分子
化合物——极性分子
单 质——非极性分子
取决于原子间的共价键是否有极性
(3)根据极性键的极性的向量和是否为零判断
当分子中各个键的极性向量和等于0时,是非极性分子;
当分子中各个键的极性向量和不等于0时,是极性分子。
人教版(2019)选择性必修二
四
共价键的极性
17/27
4.分子极性的判断方法
(4)化合价法
ABn型分子中
中心原子化合价的绝对值
该元素的价电子数
=
该分子为非极性分子
分子的空间结构中心对称
直线形
平面正三角形
正四面体
人教版(2019)选择性必修二
四
共价键的极性
18/27
4.分子极性的判断方法
(4)化合价法
ABn型分子中
中心原子化合价的绝对值
该元素的价电子数
该分子为极性分子
分子的空间结构不中心对称
≠
V形
三角锥形
四面体
人教版(2019)选择性必修二
五
分子间作用力
19/27
表5-1 范德华力、氢键、共价键的比较
概念 范德华力 氢键 共价键
定义 物质分子之间普遍存在的一种作用力 已经与电负性很大的原子形成共价键的氢原子与另一个电负性很大的原子之间的静电作用 原子间通过共用电子对所形成的相互作用
作用微粒 分子 H与N、O、F 原子
特征 无方向性和饱和性 有方向性和饱和性 有方向性和饱和性
强度 共价键>氢键>范德华力
人教版(2019)选择性必修二
五
分子间作用力
20/27
表5-1 范德华力、氢键、共价键的比较
概念 范德华力 氢键 共价键
影响 强度的 因素 ①随分子极性的增大而增大 ②分子组成和结构相似的物质,相对分子质量越大,范德华力越大 对于X—H…Y,X、Y的电负性越大,Y原子的半径越小,作用越强 成键原子半径和共用电子对数目。键长越小,键能越大,共价键越稳定
对物质 性质的 影响 ①影响物质的熔点、沸点 ②组成和结构相似的物质,随相对分子质量的增大,物质的熔、沸点升高,如CF4
六
溶解性
21/27
非极性溶质一般能溶于 ,
极性溶质一般能溶于 。
非极性溶剂
极性溶剂
1.相似相溶
(1)分子极性相似
溶质和溶剂的分子结构相似程度越大,其溶解性越 。
(2)分子结构相似
大
注:相似相溶是一条经验规律,也会有不符合的例子:CO、NO等极性分子均难溶于水;H2、N2难溶于水也难溶于苯。
人教版(2019)选择性必修二
六
溶解性
22/27
主要有 等。
温度和压强
溶剂和溶质之间的氢键作用力越大,溶解性越好;
无氢键相互作用的溶质在有氢键的水中溶解度就比较小
注:如果溶质与水能发生化学反应,也会增大溶质的溶解度。
2、氢键
3、外界因素
人教版(2019)选择性必修二
七
23/27
分子的手性
1.分子的手性判断
(1)判断方法:有机物分子中是否存在 。
(2)手性碳原子:连接四个互不相同的原子或基团的碳原子称为手性碳原子。用*C来标记。具有手性的有机物,是因为其含有手性碳原子。
手性碳原子
人教版(2019)选择性必修二
Thank You
