2023春高中化学选择性必修2 (苏教2019)专题3第四单元 分子间作用力 分子晶体 第2课时 分子晶体 混合型晶体 课时练(含答案)
文档属性
| 名称 | 2023春高中化学选择性必修2 (苏教2019)专题3第四单元 分子间作用力 分子晶体 第2课时 分子晶体 混合型晶体 课时练(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 582.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-03 21:50:59 | ||
图片预览



文档简介
第2课时 分子晶体 混合型晶体
题组一 分子晶体性质及常见结构
1.下列有关分子晶体的叙述正确的是( )
A.分子内均存在共价键
B.非金属氧化物呈固态时,一定属于分子晶体
C.分子晶体中一定存在氢键
D.分子晶体熔化时一定破坏了范德华力
2.下列性质符合分子晶体的是( )
A.熔点是1 070 ℃,易溶于水,水溶液能导电
B.熔点是10.31 ℃,液态不导电,水溶液能导电
C.不能溶于水,熔点是1 723 ℃,沸点是2 230 ℃
D.熔点是97.81 ℃,质软、导电,密度是0.97 g·cm-3
3.现代无机化学对硫—氮化合物的研究是最为活跃的领域之一。其中如图所示是已经合成的最著名的硫—氮化合物的分子结构。下列说法正确的是( )
A.该物质的分子式为S4N4
B.该物质具有很大的硬度
C.该物质具有很高的熔、沸点
D.该物质与化合物S2N2互为同素异形体
4.冰晶胞中水分子的空间排列方式与金刚石晶胞类似,其晶胞结构如图所示。下列有关说法正确的是( )
A.冰晶胞内水分子间以共价键结合
B.每个冰晶胞平均含有4个水分子
C.水分子间的氢键具有方向性和饱和性,也是σ键的一种
D.冰变成水,氢键部分被破坏
5.晶胞是晶体结构中可重复出现的最小的结构单位,C60晶胞结构如图所示,下列说法正确的是( )
A.C60的摩尔质量是720
B.C60与苯互为同素异形体
C.在C60晶胞中有14个C60分子
D.每个C60分子周围与它距离最近且等距离的C60分子有12个
6.正硼酸(H3BO3)是一种片层状结构白色晶体,层内的H3BO3分子通过氢键相连(如下图)。下列有关说法正确的是( )
A.正硼酸晶体属于共价晶体
B.H3BO3分子的稳定性与氢键有关
C.分子中硼原子最外层为8电子稳定结构
D.含1 mol H3BO3的晶体中有3 mol氢键
题组二 混合型晶体
7.中科院的科学家已研制出一种高性能超级电容器电极材料——氮掺杂有序介孔石墨烯。该材料可用作电动车的“超强电池”:充电只需7秒钟,即可续航35公里。下面有关石墨晶体的说法不正确的是( )
A.石墨晶体内既有共价键又有分子间作用力
B.石墨晶体熔、沸点很高,硬度很大
C.石墨晶体内每个六边形平均含完整碳原子2个
D.石墨晶体中,每个C原子连接3个六元环
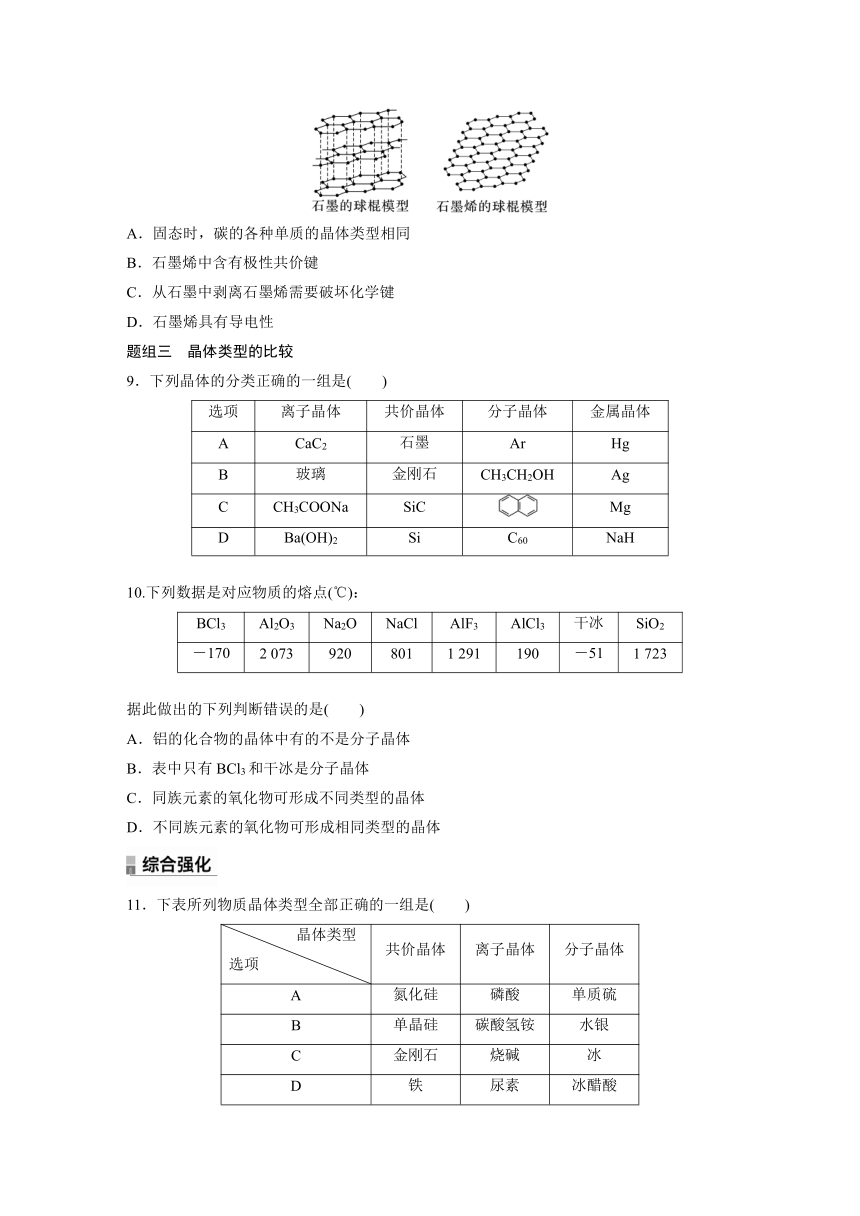
8.石墨烯是从石墨材料中剥离出来、由碳原子组成的只有一层原子厚度的二维晶体,其结构如图。有关说法正确的是( )
A.固态时,碳的各种单质的晶体类型相同
B.石墨烯中含有极性共价键
C.从石墨中剥离石墨烯需要破坏化学键
D.石墨烯具有导电性
题组三 晶体类型的比较
9.下列晶体的分类正确的一组是( )
选项 离子晶体 共价晶体 分子晶体 金属晶体
A CaC2 石墨 Ar Hg
B 玻璃 金刚石 CH3CH2OH Ag
C CH3COONa SiC Mg
D Ba(OH)2 Si C60 NaH
10.下列数据是对应物质的熔点(℃):
BCl3 Al2O3 Na2O NaCl AlF3 AlCl3 干冰 SiO2
-170 2 073 920 801 1 291 190 -51 1 723
据此做出的下列判断错误的是( )
A.铝的化合物的晶体中有的不是分子晶体
B.表中只有BCl3和干冰是分子晶体
C.同族元素的氧化物可形成不同类型的晶体
D.不同族元素的氧化物可形成相同类型的晶体
11.下表所列物质晶体类型全部正确的一组是( )
晶体类型 选项 共价晶体 离子晶体 分子晶体
A 氮化硅 磷酸 单质硫
B 单晶硅 碳酸氢铵 水银
C 金刚石 烧碱 冰
D 铁 尿素 冰醋酸
12.科学家艾哈迈德·泽维尔使“运用激光技术观测化学反应时原子的运动”成为可能。泽维尔研究发现,当激光脉冲照射NaI时,Na+和I-两核间距在10~15 (埃,1 =1×10-10 m),呈现离子键;当两核靠近约2.8 时,呈现共价键。根据泽维尔的研究成果能得出的结论是( )
A.NaI晶体是离子晶体和分子晶体的混合物
B.共价键和离子键没有明显的界限
C.NaI晶体中既有离子键,又有共价键
D.离子晶体可能含有共价键
13.如图是某无机化合物的二聚分子结构示意图,该分子中A、B两种元素都是第3周期的元素,分子中所有原子的最外层都达到8电子稳定结构。下列说法不正确的是( )
A.该物质的化学式是Al2Cl6
B.该物质是离子化合物,在熔融状态下能导电
C.该物质在固态时所形成的晶体是分子晶体
D.该物质中不存在离子键,也不含有非极性键
14.下列关于微粒间作用力与晶体的说法不正确的是( )
A.某物质呈固体时不导电,熔融状态下能导电,则该物质一定是离子晶体
B.H2O和CCl4的晶体类型相同,且每个原子的最外层都达到8电子稳定结构
C.F2、Cl2、Br2、I2的沸点逐渐升高,是因为分子间作用力逐渐增大
D.干冰溶于水中,既有分子间作用力的破坏,也有共价键的断裂
15.观察C60分子结构和晶胞示意图(如图所示),回答下列问题:
(1)一个C60分子中含有σ键的个数为______个。与每个C60分子距离最近且相等的C60分子有______个,其距离为____________________ cm(列出计算式即可)。
(2)C60晶体中,C60和C60之间的作用力属于______________________(填“离子键”“共价键”或“分子间作用力”)。
16.(1)苯胺()的晶体类型是__________。苯胺与甲苯()的相对分子质量相近,但苯胺的熔点(-5.9 ℃)、沸点(184.4 ℃)分别高于甲苯的熔点(-95.0 ℃)、沸点(110.6 ℃),原因是_______________________________________________________
________________________________________________________________________。
(2)CO能与金属Fe形成Fe(CO)5,该化合物熔点为253 K,沸点为376 K,其固体属于________晶体。
(3)碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示:
①在石墨烯晶体中,每个C原子连接________个六元环,每个六元环占有______个C原子。
②在金刚石晶体中,C原子所连接的最小环也为六元环,每个C原子连接____个六元环,六元环中最多有______个C原子在同一平面。
17.据报道科研人员应用计算机模拟出结构类似C60的物质N60。
已知:①N60分子中每个氮原子均以N—N键结合3个N原子而形成8电子稳定结构;
②N—N键的键能为167 kJ·mol-1。
请回答下列问题:
(1)N60分子组成的晶体为__________晶体,其熔、沸点比N2__________(填“高”或“低”),原因是________________________________________________________________________
________________________________________________________________________。
(2)1 mol N60分解成N2时__________(填“吸收”或“放出”)的热量是_____________ kJ(已知N≡N键的键能为942 kJ·mol-1),表明稳定性:N60__________(填“>”“<”或“=”)N2。
(3)由(2)列举N60的用途(举一种):____________________________________________
________________________________________________________________________。
第2课时 分子晶体 混合型晶体
1.D [稀有气体分子内无化学键,A项错误;非金属氧化物中的SiO2为共价晶体,B项错误;分子晶体中不一定存在氢键,如CO2晶体,C项错误;分子晶体中分子间一定存在范德华力,可能存在氢键,所以分子晶体熔化时一定破坏了范德华力,D项正确。]
2.B
3.A [根据分子结构可知,该物质的分子式为S4N4,选项A正确;该物质形成的晶体是分子晶体,分子晶体的硬度一般较小,熔、沸点一般较低,选项B、C错误;由同一种元素形成的不同单质互为同素异形体,该物质是化合物,不是单质,选项D错误。]
4.D [冰晶胞内水分子间以氢键结合,氢键不是化学键,故A错误;由冰晶胞的结构可知,根据均摊法计算,每个冰晶胞平均含有4+8×+6×=8个水分子,故B错误;水分子间的氢键具有方向性和饱和性,但氢键不是化学键,故C错误;冰变成液态水时只是破坏了一部分氢键,液态水中仍存在氢键,故D正确。]
5.D
6.D [A项,正硼酸属于分子晶体;B项,H3BO3分子的稳定性与分子内部的共价键有关,与分子间的氢键无关;C项,分子中的硼原子不符合8电子稳定结构。]
7.B [石墨晶体是混合型晶体,在层内存在共价键,在层之间有分子间作用力,A项正确;由于石墨晶体的层内原子之间以共价键结合,所以石墨的熔、沸点很高,但是由于层与层之间以微弱的分子间作用力结合,所以其硬度很小,B项错误;石墨晶体内每个碳原子属于三个六边形,所以每个六边形平均含完整碳原子数是6×=2,C项正确;石墨晶体中,每个C原子与三个碳原子形成共价键,键角是120°,因此连接3个六元环,D项正确。]
8.D [碳形成的晶体有多种,如石墨、金刚石、C60等,金刚石为共价晶体,C60为分子晶体,故A错误;石墨烯中只含有C—C键,为非极性共价键,故B错误;石墨晶体中,层与层之间的作用力为分子间作用力,从石墨中剥离石墨烯需要破坏分子间作用力,故C错误;石墨烯具有石墨的性质,具有导电性,故D正确。]
9.C [石墨属于混合型晶体,故A不符合题意;玻璃是混合物,不是纯净物,不属于离子晶体,故B不符合题意;CH3COONa是由醋酸根离子和钠离子组成的离子晶体,碳化硅是由碳原子和硅原子组成的共价晶体,属于有机物,属于分子晶体,镁是由金属阳离子和自由电子组成的金属晶体,故C符合题意;NaH是钠离子和氢负离子形成的离子晶体,不属于金属晶体,故D不符合题意。]
10.B [由表中数据分析,氧化铝和氟化铝的熔点很高,两者不是分子晶体,故A正确;表中氯化铝、氯化硼和干冰的熔点都较低,是分子晶体,故B错误;碳和硅同主族,但氧化物的晶体类型不同,分别属于分子晶体和共价晶体,故C正确;钠和铝不同族,但对应的氧化物都为离子晶体,说明不同族元素的氧化物可形成相同类型的晶体,故D正确。]
11.C [A项,磷酸的构成微粒是分子,属于分子晶体;C项,金刚石的构成微粒是原子,属于共价晶体,烧碱的构成微粒是阴、阳离子,属于离子晶体,冰的构成微粒是分子,属于分子晶体;D项,铁的构成微粒是金属阳离子和自由电子,属于金属晶体,尿素的构成微粒是分子,属于分子晶体。]
12.B [NaI是离子化合物,如改变离子的核间距,可能为共价化合物,但为纯净物,不是混合物,故A错误;当激光脉冲照射NaI时,Na+和I-两核间距在10~15 ,呈现离子键,当两核靠近约2.8 时,呈现共价键,由此可知共价键和离子键没有严格的界限,但NaL晶体中不存在既有离子键,又有共价键的情形,故B正确、C错误;NaOH晶体中就有离子键和共价键,但不是泽维尔的研究成果,故D错误。]
13.B [由A、B元素都在第3周期,并且所有原子最外层都达到8电子稳定结构,可知A为Cl元素,B为Al元素,A项正确;因该物质是二聚分子,故其固态时形成分子晶体,该物质是共价化合物,在熔融状态下不导电,B项错误、C项正确;该物质中不含离子键,只含极性键和配位键,D项正确。]
14.B [离子化合物固态时不导电,熔融状态下能导电,故A正确;水中的氢原子达到2电子稳定结构,故B不正确;结构相似且不含氢键的分子晶体相对分子质量越大,分子间作用力越大,晶体的沸点越高,故C正确;干冰变为CO2气体破坏了分子间作用力,二氧化碳与水反应生成碳酸,共价键发生了断裂,故D正确。]
15.(1)90 12 ×1.42×10-7 (2)分子间作用力
解析 (1)根据C60分子结构可知,每个碳原子形成3个σ键,每个σ键被2个碳原子共用,因此,一个C60分子中σ键数目为60×1.5=90。由C60晶胞示意图可知,与每个C60分子距离最近且相等的C60分子有12个,其距离为晶胞面对角线的一半。(2)C60晶体中,C60和C60之间的作用力属于分子间作用力。
16.(1)分子晶体 苯胺分子之间存在氢键
(2)分子 (3)①3 2 ②12 4
解析 (1)大多数有机物都是分子晶体,除了一部分有机酸盐和有机碱盐是离子晶体。苯胺中存在电负性较强的N,可以形成氢键,因此苯胺比甲苯的熔、沸点高。
(3)①每个C原子参与形成3个六元环,每个碳原子对六元环的贡献为,则每个六元环占有6×=2个C原子。②每个C原子周围形成4个共价键,最小的环为6元环,每个单键为3个环共有,则每个C原子连接4×3=12个六元环;根据数学知识,3个C原子可形成一个平面,而每个C原子都可构成1个正四面体,所以六元环中最多有4个C原子共面。
17.(1)分子 高 N60、N2均为分子晶体,且N60的相对分子质量大,分子间作用力大 (2)放出 13 230 < (3)高能炸药(或火箭推进剂)
解析 (1)N60晶体的构成微粒为分子,所以属于分子晶体;N60和N2都是分子晶体, N60的相对分子质量大于N2 ,所以N60的熔、沸点比N2高。
(2)每个N原子均以氮氮单键结合三个氮原子,每个氮氮单键被2个氮原子共用,每个氮原子有1.5个氮氮单键,1个N60分子的结构中含有60×1.5=90个N—N键,则1 mol N60的总键能为167 kJ·mol-1×90 mol=15 030 kJ,生成30 mol N≡N键的键能为942 kJ·mol-1×30 mol=28 260 kJ,则反应放出的能量为28 260 kJ-15 030 kJ=13 230 kJ,1 mol N60分解成N2时放出热量13 230 kJ,N60能量高,所以稳定性:N60(3)N60分解为N2时释放大量的能量,可用作高能炸药和火箭推进剂等。
题组一 分子晶体性质及常见结构
1.下列有关分子晶体的叙述正确的是( )
A.分子内均存在共价键
B.非金属氧化物呈固态时,一定属于分子晶体
C.分子晶体中一定存在氢键
D.分子晶体熔化时一定破坏了范德华力
2.下列性质符合分子晶体的是( )
A.熔点是1 070 ℃,易溶于水,水溶液能导电
B.熔点是10.31 ℃,液态不导电,水溶液能导电
C.不能溶于水,熔点是1 723 ℃,沸点是2 230 ℃
D.熔点是97.81 ℃,质软、导电,密度是0.97 g·cm-3
3.现代无机化学对硫—氮化合物的研究是最为活跃的领域之一。其中如图所示是已经合成的最著名的硫—氮化合物的分子结构。下列说法正确的是( )
A.该物质的分子式为S4N4
B.该物质具有很大的硬度
C.该物质具有很高的熔、沸点
D.该物质与化合物S2N2互为同素异形体
4.冰晶胞中水分子的空间排列方式与金刚石晶胞类似,其晶胞结构如图所示。下列有关说法正确的是( )
A.冰晶胞内水分子间以共价键结合
B.每个冰晶胞平均含有4个水分子
C.水分子间的氢键具有方向性和饱和性,也是σ键的一种
D.冰变成水,氢键部分被破坏
5.晶胞是晶体结构中可重复出现的最小的结构单位,C60晶胞结构如图所示,下列说法正确的是( )
A.C60的摩尔质量是720
B.C60与苯互为同素异形体
C.在C60晶胞中有14个C60分子
D.每个C60分子周围与它距离最近且等距离的C60分子有12个
6.正硼酸(H3BO3)是一种片层状结构白色晶体,层内的H3BO3分子通过氢键相连(如下图)。下列有关说法正确的是( )
A.正硼酸晶体属于共价晶体
B.H3BO3分子的稳定性与氢键有关
C.分子中硼原子最外层为8电子稳定结构
D.含1 mol H3BO3的晶体中有3 mol氢键
题组二 混合型晶体
7.中科院的科学家已研制出一种高性能超级电容器电极材料——氮掺杂有序介孔石墨烯。该材料可用作电动车的“超强电池”:充电只需7秒钟,即可续航35公里。下面有关石墨晶体的说法不正确的是( )
A.石墨晶体内既有共价键又有分子间作用力
B.石墨晶体熔、沸点很高,硬度很大
C.石墨晶体内每个六边形平均含完整碳原子2个
D.石墨晶体中,每个C原子连接3个六元环
8.石墨烯是从石墨材料中剥离出来、由碳原子组成的只有一层原子厚度的二维晶体,其结构如图。有关说法正确的是( )
A.固态时,碳的各种单质的晶体类型相同
B.石墨烯中含有极性共价键
C.从石墨中剥离石墨烯需要破坏化学键
D.石墨烯具有导电性
题组三 晶体类型的比较
9.下列晶体的分类正确的一组是( )
选项 离子晶体 共价晶体 分子晶体 金属晶体
A CaC2 石墨 Ar Hg
B 玻璃 金刚石 CH3CH2OH Ag
C CH3COONa SiC Mg
D Ba(OH)2 Si C60 NaH
10.下列数据是对应物质的熔点(℃):
BCl3 Al2O3 Na2O NaCl AlF3 AlCl3 干冰 SiO2
-170 2 073 920 801 1 291 190 -51 1 723
据此做出的下列判断错误的是( )
A.铝的化合物的晶体中有的不是分子晶体
B.表中只有BCl3和干冰是分子晶体
C.同族元素的氧化物可形成不同类型的晶体
D.不同族元素的氧化物可形成相同类型的晶体
11.下表所列物质晶体类型全部正确的一组是( )
晶体类型 选项 共价晶体 离子晶体 分子晶体
A 氮化硅 磷酸 单质硫
B 单晶硅 碳酸氢铵 水银
C 金刚石 烧碱 冰
D 铁 尿素 冰醋酸
12.科学家艾哈迈德·泽维尔使“运用激光技术观测化学反应时原子的运动”成为可能。泽维尔研究发现,当激光脉冲照射NaI时,Na+和I-两核间距在10~15 (埃,1 =1×10-10 m),呈现离子键;当两核靠近约2.8 时,呈现共价键。根据泽维尔的研究成果能得出的结论是( )
A.NaI晶体是离子晶体和分子晶体的混合物
B.共价键和离子键没有明显的界限
C.NaI晶体中既有离子键,又有共价键
D.离子晶体可能含有共价键
13.如图是某无机化合物的二聚分子结构示意图,该分子中A、B两种元素都是第3周期的元素,分子中所有原子的最外层都达到8电子稳定结构。下列说法不正确的是( )
A.该物质的化学式是Al2Cl6
B.该物质是离子化合物,在熔融状态下能导电
C.该物质在固态时所形成的晶体是分子晶体
D.该物质中不存在离子键,也不含有非极性键
14.下列关于微粒间作用力与晶体的说法不正确的是( )
A.某物质呈固体时不导电,熔融状态下能导电,则该物质一定是离子晶体
B.H2O和CCl4的晶体类型相同,且每个原子的最外层都达到8电子稳定结构
C.F2、Cl2、Br2、I2的沸点逐渐升高,是因为分子间作用力逐渐增大
D.干冰溶于水中,既有分子间作用力的破坏,也有共价键的断裂
15.观察C60分子结构和晶胞示意图(如图所示),回答下列问题:
(1)一个C60分子中含有σ键的个数为______个。与每个C60分子距离最近且相等的C60分子有______个,其距离为____________________ cm(列出计算式即可)。
(2)C60晶体中,C60和C60之间的作用力属于______________________(填“离子键”“共价键”或“分子间作用力”)。
16.(1)苯胺()的晶体类型是__________。苯胺与甲苯()的相对分子质量相近,但苯胺的熔点(-5.9 ℃)、沸点(184.4 ℃)分别高于甲苯的熔点(-95.0 ℃)、沸点(110.6 ℃),原因是_______________________________________________________
________________________________________________________________________。
(2)CO能与金属Fe形成Fe(CO)5,该化合物熔点为253 K,沸点为376 K,其固体属于________晶体。
(3)碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示:
①在石墨烯晶体中,每个C原子连接________个六元环,每个六元环占有______个C原子。
②在金刚石晶体中,C原子所连接的最小环也为六元环,每个C原子连接____个六元环,六元环中最多有______个C原子在同一平面。
17.据报道科研人员应用计算机模拟出结构类似C60的物质N60。
已知:①N60分子中每个氮原子均以N—N键结合3个N原子而形成8电子稳定结构;
②N—N键的键能为167 kJ·mol-1。
请回答下列问题:
(1)N60分子组成的晶体为__________晶体,其熔、沸点比N2__________(填“高”或“低”),原因是________________________________________________________________________
________________________________________________________________________。
(2)1 mol N60分解成N2时__________(填“吸收”或“放出”)的热量是_____________ kJ(已知N≡N键的键能为942 kJ·mol-1),表明稳定性:N60__________(填“>”“<”或“=”)N2。
(3)由(2)列举N60的用途(举一种):____________________________________________
________________________________________________________________________。
第2课时 分子晶体 混合型晶体
1.D [稀有气体分子内无化学键,A项错误;非金属氧化物中的SiO2为共价晶体,B项错误;分子晶体中不一定存在氢键,如CO2晶体,C项错误;分子晶体中分子间一定存在范德华力,可能存在氢键,所以分子晶体熔化时一定破坏了范德华力,D项正确。]
2.B
3.A [根据分子结构可知,该物质的分子式为S4N4,选项A正确;该物质形成的晶体是分子晶体,分子晶体的硬度一般较小,熔、沸点一般较低,选项B、C错误;由同一种元素形成的不同单质互为同素异形体,该物质是化合物,不是单质,选项D错误。]
4.D [冰晶胞内水分子间以氢键结合,氢键不是化学键,故A错误;由冰晶胞的结构可知,根据均摊法计算,每个冰晶胞平均含有4+8×+6×=8个水分子,故B错误;水分子间的氢键具有方向性和饱和性,但氢键不是化学键,故C错误;冰变成液态水时只是破坏了一部分氢键,液态水中仍存在氢键,故D正确。]
5.D
6.D [A项,正硼酸属于分子晶体;B项,H3BO3分子的稳定性与分子内部的共价键有关,与分子间的氢键无关;C项,分子中的硼原子不符合8电子稳定结构。]
7.B [石墨晶体是混合型晶体,在层内存在共价键,在层之间有分子间作用力,A项正确;由于石墨晶体的层内原子之间以共价键结合,所以石墨的熔、沸点很高,但是由于层与层之间以微弱的分子间作用力结合,所以其硬度很小,B项错误;石墨晶体内每个碳原子属于三个六边形,所以每个六边形平均含完整碳原子数是6×=2,C项正确;石墨晶体中,每个C原子与三个碳原子形成共价键,键角是120°,因此连接3个六元环,D项正确。]
8.D [碳形成的晶体有多种,如石墨、金刚石、C60等,金刚石为共价晶体,C60为分子晶体,故A错误;石墨烯中只含有C—C键,为非极性共价键,故B错误;石墨晶体中,层与层之间的作用力为分子间作用力,从石墨中剥离石墨烯需要破坏分子间作用力,故C错误;石墨烯具有石墨的性质,具有导电性,故D正确。]
9.C [石墨属于混合型晶体,故A不符合题意;玻璃是混合物,不是纯净物,不属于离子晶体,故B不符合题意;CH3COONa是由醋酸根离子和钠离子组成的离子晶体,碳化硅是由碳原子和硅原子组成的共价晶体,属于有机物,属于分子晶体,镁是由金属阳离子和自由电子组成的金属晶体,故C符合题意;NaH是钠离子和氢负离子形成的离子晶体,不属于金属晶体,故D不符合题意。]
10.B [由表中数据分析,氧化铝和氟化铝的熔点很高,两者不是分子晶体,故A正确;表中氯化铝、氯化硼和干冰的熔点都较低,是分子晶体,故B错误;碳和硅同主族,但氧化物的晶体类型不同,分别属于分子晶体和共价晶体,故C正确;钠和铝不同族,但对应的氧化物都为离子晶体,说明不同族元素的氧化物可形成相同类型的晶体,故D正确。]
11.C [A项,磷酸的构成微粒是分子,属于分子晶体;C项,金刚石的构成微粒是原子,属于共价晶体,烧碱的构成微粒是阴、阳离子,属于离子晶体,冰的构成微粒是分子,属于分子晶体;D项,铁的构成微粒是金属阳离子和自由电子,属于金属晶体,尿素的构成微粒是分子,属于分子晶体。]
12.B [NaI是离子化合物,如改变离子的核间距,可能为共价化合物,但为纯净物,不是混合物,故A错误;当激光脉冲照射NaI时,Na+和I-两核间距在10~15 ,呈现离子键,当两核靠近约2.8 时,呈现共价键,由此可知共价键和离子键没有严格的界限,但NaL晶体中不存在既有离子键,又有共价键的情形,故B正确、C错误;NaOH晶体中就有离子键和共价键,但不是泽维尔的研究成果,故D错误。]
13.B [由A、B元素都在第3周期,并且所有原子最外层都达到8电子稳定结构,可知A为Cl元素,B为Al元素,A项正确;因该物质是二聚分子,故其固态时形成分子晶体,该物质是共价化合物,在熔融状态下不导电,B项错误、C项正确;该物质中不含离子键,只含极性键和配位键,D项正确。]
14.B [离子化合物固态时不导电,熔融状态下能导电,故A正确;水中的氢原子达到2电子稳定结构,故B不正确;结构相似且不含氢键的分子晶体相对分子质量越大,分子间作用力越大,晶体的沸点越高,故C正确;干冰变为CO2气体破坏了分子间作用力,二氧化碳与水反应生成碳酸,共价键发生了断裂,故D正确。]
15.(1)90 12 ×1.42×10-7 (2)分子间作用力
解析 (1)根据C60分子结构可知,每个碳原子形成3个σ键,每个σ键被2个碳原子共用,因此,一个C60分子中σ键数目为60×1.5=90。由C60晶胞示意图可知,与每个C60分子距离最近且相等的C60分子有12个,其距离为晶胞面对角线的一半。(2)C60晶体中,C60和C60之间的作用力属于分子间作用力。
16.(1)分子晶体 苯胺分子之间存在氢键
(2)分子 (3)①3 2 ②12 4
解析 (1)大多数有机物都是分子晶体,除了一部分有机酸盐和有机碱盐是离子晶体。苯胺中存在电负性较强的N,可以形成氢键,因此苯胺比甲苯的熔、沸点高。
(3)①每个C原子参与形成3个六元环,每个碳原子对六元环的贡献为,则每个六元环占有6×=2个C原子。②每个C原子周围形成4个共价键,最小的环为6元环,每个单键为3个环共有,则每个C原子连接4×3=12个六元环;根据数学知识,3个C原子可形成一个平面,而每个C原子都可构成1个正四面体,所以六元环中最多有4个C原子共面。
17.(1)分子 高 N60、N2均为分子晶体,且N60的相对分子质量大,分子间作用力大 (2)放出 13 230 < (3)高能炸药(或火箭推进剂)
解析 (1)N60晶体的构成微粒为分子,所以属于分子晶体;N60和N2都是分子晶体, N60的相对分子质量大于N2 ,所以N60的熔、沸点比N2高。
(2)每个N原子均以氮氮单键结合三个氮原子,每个氮氮单键被2个氮原子共用,每个氮原子有1.5个氮氮单键,1个N60分子的结构中含有60×1.5=90个N—N键,则1 mol N60的总键能为167 kJ·mol-1×90 mol=15 030 kJ,生成30 mol N≡N键的键能为942 kJ·mol-1×30 mol=28 260 kJ,则反应放出的能量为28 260 kJ-15 030 kJ=13 230 kJ,1 mol N60分解成N2时放出热量13 230 kJ,N60能量高,所以稳定性:N60
