2023春高中化学选择性必修2 (苏教2019)专题4第二单元 配合物的形成和应用 第2课时 配合物的性质与应用 课时练(含答案)
文档属性
| 名称 | 2023春高中化学选择性必修2 (苏教2019)专题4第二单元 配合物的形成和应用 第2课时 配合物的性质与应用 课时练(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 194.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-03 22:15:10 | ||
图片预览


文档简介
第2课时 配合物的性质与应用
题组一 配合物的性质与应用
1.下列各组离子中因有配离子生成而不能大量共存的是( )
A.K+、Na+、Cl-、NO
B.Mg2+、Ca2+、SO、OH-
C.Fe2+、Fe3+、H+、NO
D.Ba2+、Fe3+、Cl-、SCN-
2.下列过程与配合物的形成无关的是( )
A.除去Fe粉中的SiO2可用强碱溶液
B.向一定量的AgNO3溶液中加浓氨水至沉淀消失
C.向Fe3+溶液中加入KSCN溶液
D.向一定量的CuSO4溶液中加浓氨水至沉淀消失
3.配合物在许多方面有着广泛的应用。下列叙述不正确的是( )
A.以Mg2+为中心的大环配合物叶绿素能催化光合作用
B.Fe2+的卟啉配合物是输送O2的血红素
C.[Ag(NH3)2]+是化学镀银的有效成分
D.向溶液中逐滴加入氨水,可除去硫酸锌溶液中的Cu2+
4.已知NH3分子可与Cu2+形成配合物离子[Cu(NH3)4]2+,则除去硫酸铜溶液中的少量硫酸可选用的试剂是( )
A.NaOH
B.NH3
C.BaCl2
D.Cu(OH)2
5.配合物Na3[Fe(CN)6]可用于离子检验,下列说法不正确的是( )
A.该配合物中存在离子键、配位键、极性键、非极性键
B.配离子为[Fe(CN)6]3-,中心原子为Fe3+,配位数为6
C.该配合物可以用于检验溶液中的Fe2+
D.该配合物为离子化合物
6.实验室测定铁的含量可用络合剂邻二氮菲(),它遇Fe2+形成红色配合物,结构如图所示,下列说法不正确的是( )
A.邻二氮菲中C和N均采取sp2杂化
B.该红色配离子中配位数为6
C.铁与氮之间的化学键为离子键
D.邻二氮菲中所有原子共平面
7.有三个组成均为CrCl3·6H2O的配合物,甲为亮绿色,乙为暗绿色,丙为紫色,相同物质的量的甲、乙、丙的水溶液中加入足量的AgNO3溶液,析出AgCl的物质的量之比为2∶1∶3。已知铬的配位数为6,下列说法正确的是( )
A.甲、乙、丙为同一物质
B.配位体均为Cl-
C.铬元素均显+3价
D.甲的化学式为[Cr(H2O)6]Cl3
题组二 复杂配合物的分析与应用
8.配合物Na2[Fe(CN)5(NO)]可用于离子检验,下列说法不正确的是( )
A.此配合物中存在离子键、配位键、极性键、非极性键
B.配离子为[Fe(CN)5(NO)]2-,中心原子为Fe3+,配位数为6,配位原子有C和N
C.1 mol配合物中σ键数目为12NA
D.该配合物为离子化合物,易电离,1 mol配合物电离共得到3NA个阴、阳离子
9.铁强化酱油中加有NaFeEDTA,其配离子结构如图,则Fe3+的配位数为( )
A.3 B.4
C.5 D.6
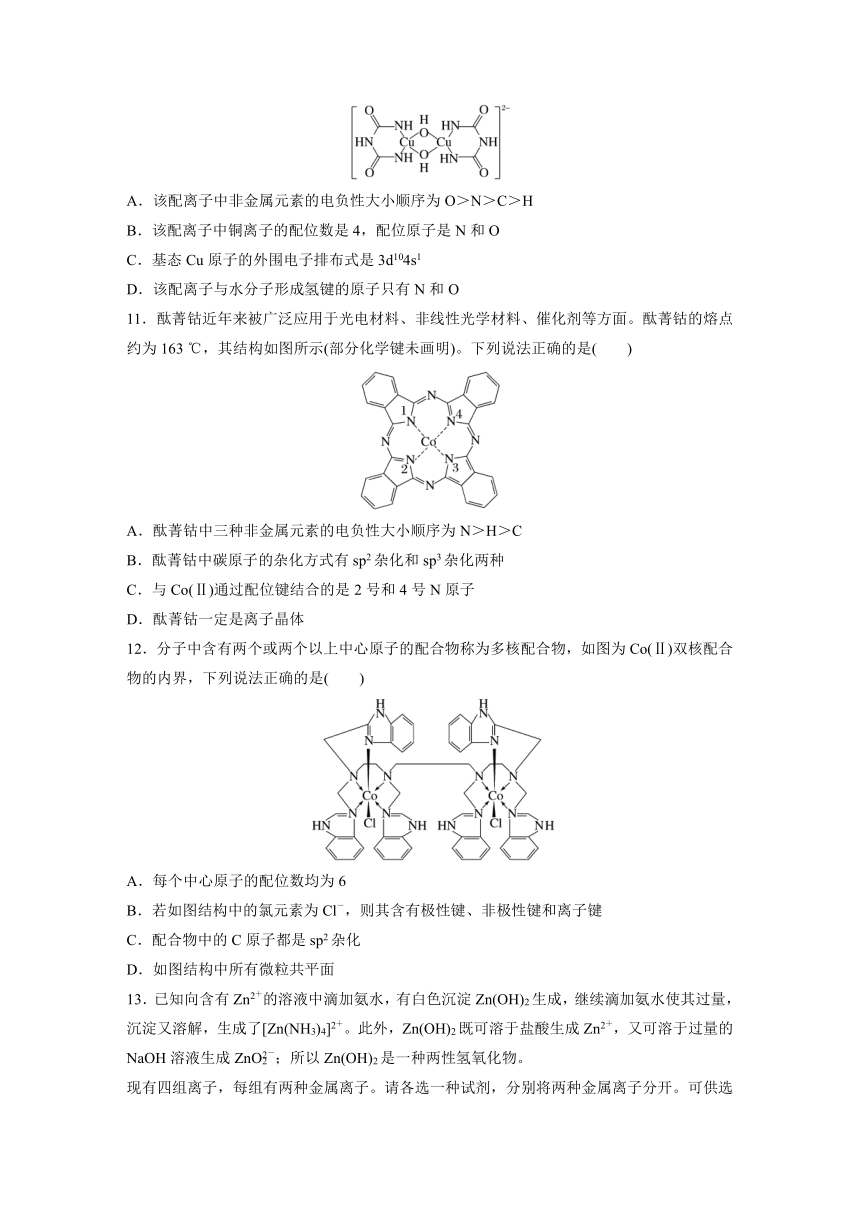
10.在碱性溶液中,Cu2+可以与缩二脲形成紫色配离子,其结构如图所示。下列说法错误的是( )
A.该配离子中非金属元素的电负性大小顺序为O>N>C>H
B.该配离子中铜离子的配位数是4,配位原子是N和O
C.基态Cu原子的外围电子排布式是3d104s1
D.该配离子与水分子形成氢键的原子只有N和O
11.酞菁钴近年来被广泛应用于光电材料、非线性光学材料、催化剂等方面。酞菁钴的熔点约为163 ℃,其结构如图所示(部分化学键未画明)。下列说法正确的是( )
A.酞菁钴中三种非金属元素的电负性大小顺序为N>H>C
B.酞菁钴中碳原子的杂化方式有sp2杂化和sp3杂化两种
C.与Co(Ⅱ)通过配位键结合的是2号和4号N原子
D.酞菁钴一定是离子晶体
12.分子中含有两个或两个以上中心原子的配合物称为多核配合物,如图为Co(Ⅱ)双核配合物的内界,下列说法正确的是( )
A.每个中心原子的配位数均为6
B.若如图结构中的氯元素为Cl-,则其含有极性键、非极性键和离子键
C.配合物中的C原子都是sp2杂化
D.如图结构中所有微粒共平面
13.已知向含有Zn2+的溶液中滴加氨水,有白色沉淀Zn(OH)2生成,继续滴加氨水使其过量,沉淀又溶解,生成了[Zn(NH3)4]2+。此外,Zn(OH)2既可溶于盐酸生成Zn2+,又可溶于过量的NaOH溶液生成ZnO;所以Zn(OH)2是一种两性氢氧化物。
现有四组离子,每组有两种金属离子。请各选一种试剂,分别将两种金属离子分开。可供选择的试剂有:
A.硫酸 B.盐酸 C.硝酸 D.氢氧化钠溶液 E.氨水
离子组 选用试剂(填字母) 沉淀物化学式 保留在溶液中的离子
(1)Zn2+和Al3+
(2)Zn2+和Mg2+
(3)Zn2+和Ba2+
(4)Mg2+和Al3+
14.回答下列问题:
(1)将白色CuSO4粉末溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配位数是4的配合物离子,请写出生成此配合物离子的离子方程式:_____________________,蓝色溶液中的阳离子内存在的全部化学键类型有__________________。
(2)CuSO4·5H2O(胆矾)中含有水合铜离子而呈蓝色,写出胆矾晶体中水合铜离子的结构简式(必须将配位键表示出来):___________________________________________________。
(3)向CuSO4溶液中滴加氨水会生成蓝色沉淀,再滴加氨水到沉淀刚好全部溶解可得到深蓝色溶液,继续向其中加入极性较小的乙醇可以析出深蓝色的[Cu(NH3)4]SO4·H2O晶体。下列说法不正确的是_________(填字母)。
a.[Cu(NH3)4]SO4组成元素中电负性最大的是N元素
b.CuSO4及[Cu(NH3)4]SO4·H2O中S原子均采取sp3杂化
c.[Cu(NH3)4]SO4中含有的化学键有离子键、极性共价键和配位键
d.[Cu(NH3)4]2+中,N原子是配位原子
e.NH3分子中氮原子的杂化轨道类型为sp2杂化
15.Fe3+在溶液中能将I-氧化。但溶液中如有大量的F-存在,则Fe3+与F-结合生成[FeF6]3-,而不能氧化I-,由此可以证明:
(1)[FeF6]3-在溶液中是否容易离解出Fe3+?________(填“容易”或“不容易”)。
(2)Fe3+随其________的减少而氧化性变弱。
(3)在强酸性条件下,将FeCl3、KI、NaF三种溶液混合起来,仍有I2生成,其原因是________________________________________________________________________
________________________________________________________________________。
第2课时 配合物的性质与应用
1.D [A项中各离子能大量共存;B项中因生成沉淀而不能大量共存;C项中因发生氧化还原反应而不能大量共存;D项中Fe3+与SCN-生成[Fe(SCN)n](3-n)+而不能大量共存。]
2.A [二氧化硅和氢氧化钠溶液反应生成硅酸钠和水,硅酸钠和水都不是配合物,与配合物的形成无关,故选A;银离子和浓氨水反应生成氢氧化银沉淀,氢氧化银能和浓氨水反应生成银氨配合物,与配合物的形成有关,故不选B;铁离子和硫氰化钾溶液反应生成硫氰化铁配合物,与配合物的形成有关,故不选C;铜离子和浓氨水反应生成氢氧化铜蓝色沉淀,氢氧化铜和浓氨水反应生成铜氨配合物,与配合物的形成有关,故不选D。]
3.D [D项中Cu2+和氨水反应可形成[Cu(NH3)4]2+,Zn2+和氨水反应也可形成[Zn(NH3)4]2+。]
4.D [除去杂质时不能引入新杂质。如果用NaOH,则引入Na+;用BaCl2,则引入Cl-;NH3与Cu2+可形成配离子;Cu(OH)2难溶,且发生反应:H2SO4+Cu(OH)2===CuSO4+2H2O。]
5.A [配合物Na3[Fe(CN)6]为离子化合物,由Na+和[Fe(CN)6]3-构成,内界[Fe(CN)6]3-和外界Na+间形成离子键,内界[Fe(CN)6]3-中存在配位键,配位体CN-中存在极性键,但不存在非极性键,故A错误、D正确;配合物离子为[Fe(CN)6]3-,中心原子为Fe3+,配位体为CN-,配位数为6,故B正确;Fe2+可与[Fe(CN)6]3-反应生成蓝色沉淀,故该配合物可以用于检验溶液中的Fe2+,故C正确。]
6.C
7.C [由题意知,甲、乙、丙分子式相同,结构不同,属于不同的物质;由题意知,铬的配合物中的配位数均是6,故配位体除氯离子外,还有水;该化合物中铬元素化合价相同,均为+3价。]
8.A [Na+与[Fe(CN)5(NO)]2-存在离子键,NO分子、CN-与Fe3+形成配位键,碳氮之间、氮氧之间存在极性共价键,不存在非极性键,A错误;NO分子、CN-与Fe3+形成配位键,共有6个,配位原子有C和N,B正确;1 mol配合物中σ键数目为(5×2+1×2) mol×NA mol-1=12NA,C正确;配合物Na2[Fe(CN)5(NO)]为离子化合物,1 mol配合物可电离出2 mol Na+与1 mol [Fe(CN)5(NO)]2-,共得到3NA个阴、阳离子,D正确。]
9.D [与铁相连的原子有N和O,其中N已形成三个键,故N与Fe之间为配位键;O-也为饱和的化学键,若与铁相连,则只能形成配位键。]
10.D [根据同周期主族元素的电负性由左到右逐渐增大,同主族元素的电负性由上到下逐渐减小,所以该配离子中的非金属元素的电负性大小顺序为O>N>C>H,A项正确;根据配离子的结构可知,铜离子形成4个共价键,配位原子为N和O,B项正确;基态铜原子的外围电子排布式为3d104s1,C项正确;N原子和O原子可与水分子中的H原子形成氢键,水分子中的O原子也可与配离子中的H原子形成氢键,D项错误。]
11.C [电负性大小顺序为N>C>H,A项错误;酞菁钴中碳原子均形成3个σ键,没有孤电子对,均采取sp2杂化,B项错误;N原子形成3个共价键即可达到8电子稳定结构,所以2号和4号N原子与Co(Ⅱ)通过配位键结合,C项正确;从酞菁钴的熔点来看,酞菁钴应该属于分子晶体,D项错误。]
12.A
13.(1)E Al(OH)3 [Zn(NH3)4]2+
(2)D(或E) Mg(OH)2 ZnO(或[Zn(NH3)4]2+)
(3)A BaSO4 Zn2+
(4)D Mg(OH)2 AlO
解析 (1)Zn2+和Al3+的分离:由于Zn(OH)2和Al(OH)3均为两性氢氧化物,不能用酸、碱加以区分,但Zn2+可与过量氨水反应生成[Zn(NH3)4]2+,Al3+无此性质,可选用试剂氨水(E),生成沉淀Al(OH)3,保留在溶液中的离子为[Zn(NH3)4]2+。
(2)Zn2+和Mg2+的分离:因Zn(OH)2有两性,Mg(OH)2无两性且为难溶于水的沉淀,可选用试剂NaOH溶液(D),沉淀为Mg(OH)2,保留在溶液中的离子为ZnO。此外,还可用氨水(E)予以分离。
(3)Zn2+和Ba2+的分离:由于BaSO4难溶于水且不溶于酸,而ZnSO4能溶于水,可选用试剂H2SO4(A),沉淀为BaSO4,保留在溶液中的离子为Zn2+。
(4)Mg2+和Al3+的分离:Al(OH)3有两性,能溶于过量的NaOH溶液中,Mg(OH)2为沉淀,且不溶于过量的NaOH溶液,可选用试剂NaOH溶液(D),沉淀是Mg(OH)2,保留在溶液中的离子是AlO。
14.(1)Cu2++4H2O===[Cu(H2O)4]2+ 极性共价键、配位键
(2) (3)ae
解析 (1)Cu2+提供空轨道,H2O分子中的O原子提供孤电子对形成配合物离子[Cu(H2O)4]2+。
(2)H2O中的O原子提供孤电子对,Cu2+提供空轨道,所以水合铜离子表示为。
(3)电负性:O>N,a不正确;S原子均与4个O原子形成共价键,所以S原子均采取sp3杂化,b正确;[Cu(NH3)4]SO4中SO与[Cu(NH3)4]2+以离子键结合,NH3、SO中含有极性共价键,[Cu(NH3)4]2+中含有配位键,c正确;[Cu(NH3)4]2+中N原子提供孤电子对,d正确;NH3中N为sp3杂化,e不正确。
15.(1)不容易 (2)浓度 (3)[FeF6]3-离解:[FeF6]3-??Fe3++6F-,酸性条件下发生反应H++F-??HF,使平衡正向移动,Fe3+浓度增大,Fe3+与I-反应:2Fe3++2I-===2Fe2++I2
题组一 配合物的性质与应用
1.下列各组离子中因有配离子生成而不能大量共存的是( )
A.K+、Na+、Cl-、NO
B.Mg2+、Ca2+、SO、OH-
C.Fe2+、Fe3+、H+、NO
D.Ba2+、Fe3+、Cl-、SCN-
2.下列过程与配合物的形成无关的是( )
A.除去Fe粉中的SiO2可用强碱溶液
B.向一定量的AgNO3溶液中加浓氨水至沉淀消失
C.向Fe3+溶液中加入KSCN溶液
D.向一定量的CuSO4溶液中加浓氨水至沉淀消失
3.配合物在许多方面有着广泛的应用。下列叙述不正确的是( )
A.以Mg2+为中心的大环配合物叶绿素能催化光合作用
B.Fe2+的卟啉配合物是输送O2的血红素
C.[Ag(NH3)2]+是化学镀银的有效成分
D.向溶液中逐滴加入氨水,可除去硫酸锌溶液中的Cu2+
4.已知NH3分子可与Cu2+形成配合物离子[Cu(NH3)4]2+,则除去硫酸铜溶液中的少量硫酸可选用的试剂是( )
A.NaOH
B.NH3
C.BaCl2
D.Cu(OH)2
5.配合物Na3[Fe(CN)6]可用于离子检验,下列说法不正确的是( )
A.该配合物中存在离子键、配位键、极性键、非极性键
B.配离子为[Fe(CN)6]3-,中心原子为Fe3+,配位数为6
C.该配合物可以用于检验溶液中的Fe2+
D.该配合物为离子化合物
6.实验室测定铁的含量可用络合剂邻二氮菲(),它遇Fe2+形成红色配合物,结构如图所示,下列说法不正确的是( )
A.邻二氮菲中C和N均采取sp2杂化
B.该红色配离子中配位数为6
C.铁与氮之间的化学键为离子键
D.邻二氮菲中所有原子共平面
7.有三个组成均为CrCl3·6H2O的配合物,甲为亮绿色,乙为暗绿色,丙为紫色,相同物质的量的甲、乙、丙的水溶液中加入足量的AgNO3溶液,析出AgCl的物质的量之比为2∶1∶3。已知铬的配位数为6,下列说法正确的是( )
A.甲、乙、丙为同一物质
B.配位体均为Cl-
C.铬元素均显+3价
D.甲的化学式为[Cr(H2O)6]Cl3
题组二 复杂配合物的分析与应用
8.配合物Na2[Fe(CN)5(NO)]可用于离子检验,下列说法不正确的是( )
A.此配合物中存在离子键、配位键、极性键、非极性键
B.配离子为[Fe(CN)5(NO)]2-,中心原子为Fe3+,配位数为6,配位原子有C和N
C.1 mol配合物中σ键数目为12NA
D.该配合物为离子化合物,易电离,1 mol配合物电离共得到3NA个阴、阳离子
9.铁强化酱油中加有NaFeEDTA,其配离子结构如图,则Fe3+的配位数为( )
A.3 B.4
C.5 D.6
10.在碱性溶液中,Cu2+可以与缩二脲形成紫色配离子,其结构如图所示。下列说法错误的是( )
A.该配离子中非金属元素的电负性大小顺序为O>N>C>H
B.该配离子中铜离子的配位数是4,配位原子是N和O
C.基态Cu原子的外围电子排布式是3d104s1
D.该配离子与水分子形成氢键的原子只有N和O
11.酞菁钴近年来被广泛应用于光电材料、非线性光学材料、催化剂等方面。酞菁钴的熔点约为163 ℃,其结构如图所示(部分化学键未画明)。下列说法正确的是( )
A.酞菁钴中三种非金属元素的电负性大小顺序为N>H>C
B.酞菁钴中碳原子的杂化方式有sp2杂化和sp3杂化两种
C.与Co(Ⅱ)通过配位键结合的是2号和4号N原子
D.酞菁钴一定是离子晶体
12.分子中含有两个或两个以上中心原子的配合物称为多核配合物,如图为Co(Ⅱ)双核配合物的内界,下列说法正确的是( )
A.每个中心原子的配位数均为6
B.若如图结构中的氯元素为Cl-,则其含有极性键、非极性键和离子键
C.配合物中的C原子都是sp2杂化
D.如图结构中所有微粒共平面
13.已知向含有Zn2+的溶液中滴加氨水,有白色沉淀Zn(OH)2生成,继续滴加氨水使其过量,沉淀又溶解,生成了[Zn(NH3)4]2+。此外,Zn(OH)2既可溶于盐酸生成Zn2+,又可溶于过量的NaOH溶液生成ZnO;所以Zn(OH)2是一种两性氢氧化物。
现有四组离子,每组有两种金属离子。请各选一种试剂,分别将两种金属离子分开。可供选择的试剂有:
A.硫酸 B.盐酸 C.硝酸 D.氢氧化钠溶液 E.氨水
离子组 选用试剂(填字母) 沉淀物化学式 保留在溶液中的离子
(1)Zn2+和Al3+
(2)Zn2+和Mg2+
(3)Zn2+和Ba2+
(4)Mg2+和Al3+
14.回答下列问题:
(1)将白色CuSO4粉末溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配位数是4的配合物离子,请写出生成此配合物离子的离子方程式:_____________________,蓝色溶液中的阳离子内存在的全部化学键类型有__________________。
(2)CuSO4·5H2O(胆矾)中含有水合铜离子而呈蓝色,写出胆矾晶体中水合铜离子的结构简式(必须将配位键表示出来):___________________________________________________。
(3)向CuSO4溶液中滴加氨水会生成蓝色沉淀,再滴加氨水到沉淀刚好全部溶解可得到深蓝色溶液,继续向其中加入极性较小的乙醇可以析出深蓝色的[Cu(NH3)4]SO4·H2O晶体。下列说法不正确的是_________(填字母)。
a.[Cu(NH3)4]SO4组成元素中电负性最大的是N元素
b.CuSO4及[Cu(NH3)4]SO4·H2O中S原子均采取sp3杂化
c.[Cu(NH3)4]SO4中含有的化学键有离子键、极性共价键和配位键
d.[Cu(NH3)4]2+中,N原子是配位原子
e.NH3分子中氮原子的杂化轨道类型为sp2杂化
15.Fe3+在溶液中能将I-氧化。但溶液中如有大量的F-存在,则Fe3+与F-结合生成[FeF6]3-,而不能氧化I-,由此可以证明:
(1)[FeF6]3-在溶液中是否容易离解出Fe3+?________(填“容易”或“不容易”)。
(2)Fe3+随其________的减少而氧化性变弱。
(3)在强酸性条件下,将FeCl3、KI、NaF三种溶液混合起来,仍有I2生成,其原因是________________________________________________________________________
________________________________________________________________________。
第2课时 配合物的性质与应用
1.D [A项中各离子能大量共存;B项中因生成沉淀而不能大量共存;C项中因发生氧化还原反应而不能大量共存;D项中Fe3+与SCN-生成[Fe(SCN)n](3-n)+而不能大量共存。]
2.A [二氧化硅和氢氧化钠溶液反应生成硅酸钠和水,硅酸钠和水都不是配合物,与配合物的形成无关,故选A;银离子和浓氨水反应生成氢氧化银沉淀,氢氧化银能和浓氨水反应生成银氨配合物,与配合物的形成有关,故不选B;铁离子和硫氰化钾溶液反应生成硫氰化铁配合物,与配合物的形成有关,故不选C;铜离子和浓氨水反应生成氢氧化铜蓝色沉淀,氢氧化铜和浓氨水反应生成铜氨配合物,与配合物的形成有关,故不选D。]
3.D [D项中Cu2+和氨水反应可形成[Cu(NH3)4]2+,Zn2+和氨水反应也可形成[Zn(NH3)4]2+。]
4.D [除去杂质时不能引入新杂质。如果用NaOH,则引入Na+;用BaCl2,则引入Cl-;NH3与Cu2+可形成配离子;Cu(OH)2难溶,且发生反应:H2SO4+Cu(OH)2===CuSO4+2H2O。]
5.A [配合物Na3[Fe(CN)6]为离子化合物,由Na+和[Fe(CN)6]3-构成,内界[Fe(CN)6]3-和外界Na+间形成离子键,内界[Fe(CN)6]3-中存在配位键,配位体CN-中存在极性键,但不存在非极性键,故A错误、D正确;配合物离子为[Fe(CN)6]3-,中心原子为Fe3+,配位体为CN-,配位数为6,故B正确;Fe2+可与[Fe(CN)6]3-反应生成蓝色沉淀,故该配合物可以用于检验溶液中的Fe2+,故C正确。]
6.C
7.C [由题意知,甲、乙、丙分子式相同,结构不同,属于不同的物质;由题意知,铬的配合物中的配位数均是6,故配位体除氯离子外,还有水;该化合物中铬元素化合价相同,均为+3价。]
8.A [Na+与[Fe(CN)5(NO)]2-存在离子键,NO分子、CN-与Fe3+形成配位键,碳氮之间、氮氧之间存在极性共价键,不存在非极性键,A错误;NO分子、CN-与Fe3+形成配位键,共有6个,配位原子有C和N,B正确;1 mol配合物中σ键数目为(5×2+1×2) mol×NA mol-1=12NA,C正确;配合物Na2[Fe(CN)5(NO)]为离子化合物,1 mol配合物可电离出2 mol Na+与1 mol [Fe(CN)5(NO)]2-,共得到3NA个阴、阳离子,D正确。]
9.D [与铁相连的原子有N和O,其中N已形成三个键,故N与Fe之间为配位键;O-也为饱和的化学键,若与铁相连,则只能形成配位键。]
10.D [根据同周期主族元素的电负性由左到右逐渐增大,同主族元素的电负性由上到下逐渐减小,所以该配离子中的非金属元素的电负性大小顺序为O>N>C>H,A项正确;根据配离子的结构可知,铜离子形成4个共价键,配位原子为N和O,B项正确;基态铜原子的外围电子排布式为3d104s1,C项正确;N原子和O原子可与水分子中的H原子形成氢键,水分子中的O原子也可与配离子中的H原子形成氢键,D项错误。]
11.C [电负性大小顺序为N>C>H,A项错误;酞菁钴中碳原子均形成3个σ键,没有孤电子对,均采取sp2杂化,B项错误;N原子形成3个共价键即可达到8电子稳定结构,所以2号和4号N原子与Co(Ⅱ)通过配位键结合,C项正确;从酞菁钴的熔点来看,酞菁钴应该属于分子晶体,D项错误。]
12.A
13.(1)E Al(OH)3 [Zn(NH3)4]2+
(2)D(或E) Mg(OH)2 ZnO(或[Zn(NH3)4]2+)
(3)A BaSO4 Zn2+
(4)D Mg(OH)2 AlO
解析 (1)Zn2+和Al3+的分离:由于Zn(OH)2和Al(OH)3均为两性氢氧化物,不能用酸、碱加以区分,但Zn2+可与过量氨水反应生成[Zn(NH3)4]2+,Al3+无此性质,可选用试剂氨水(E),生成沉淀Al(OH)3,保留在溶液中的离子为[Zn(NH3)4]2+。
(2)Zn2+和Mg2+的分离:因Zn(OH)2有两性,Mg(OH)2无两性且为难溶于水的沉淀,可选用试剂NaOH溶液(D),沉淀为Mg(OH)2,保留在溶液中的离子为ZnO。此外,还可用氨水(E)予以分离。
(3)Zn2+和Ba2+的分离:由于BaSO4难溶于水且不溶于酸,而ZnSO4能溶于水,可选用试剂H2SO4(A),沉淀为BaSO4,保留在溶液中的离子为Zn2+。
(4)Mg2+和Al3+的分离:Al(OH)3有两性,能溶于过量的NaOH溶液中,Mg(OH)2为沉淀,且不溶于过量的NaOH溶液,可选用试剂NaOH溶液(D),沉淀是Mg(OH)2,保留在溶液中的离子是AlO。
14.(1)Cu2++4H2O===[Cu(H2O)4]2+ 极性共价键、配位键
(2) (3)ae
解析 (1)Cu2+提供空轨道,H2O分子中的O原子提供孤电子对形成配合物离子[Cu(H2O)4]2+。
(2)H2O中的O原子提供孤电子对,Cu2+提供空轨道,所以水合铜离子表示为。
(3)电负性:O>N,a不正确;S原子均与4个O原子形成共价键,所以S原子均采取sp3杂化,b正确;[Cu(NH3)4]SO4中SO与[Cu(NH3)4]2+以离子键结合,NH3、SO中含有极性共价键,[Cu(NH3)4]2+中含有配位键,c正确;[Cu(NH3)4]2+中N原子提供孤电子对,d正确;NH3中N为sp3杂化,e不正确。
15.(1)不容易 (2)浓度 (3)[FeF6]3-离解:[FeF6]3-??Fe3++6F-,酸性条件下发生反应H++F-??HF,使平衡正向移动,Fe3+浓度增大,Fe3+与I-反应:2Fe3++2I-===2Fe2++I2
