2023春高中化学选择性必修2 (苏教2019)专题1揭示物质结构的奥秘 专题2原子结构与元素性质 检测试卷(含解析)
文档属性
| 名称 | 2023春高中化学选择性必修2 (苏教2019)专题1揭示物质结构的奥秘 专题2原子结构与元素性质 检测试卷(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 376.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-03 22:29:15 | ||
图片预览




文档简介
专题1、2检测试卷
(满分:100分)
一、选择题(本题共16小题,每小题3分,共48分。每小题只有一个选项符合题意)
1.用化学用语表示反应CH2==CH2+HCl―→CH3CH2Cl中的相关微粒,其中正确的是( )
A.中子数为8的C原子:C
B.HCl的电子式:
C.乙烯的结构简式:CH2CH2
D.Cl的原子结构示意图:
2.2020年11月24日,嫦娥5号在长征5号火箭巨大的推力下前往月球,经过20多天旅程后带着月壤返回。这是中国航天“探月工程”向世界展示出的“中国力量”,下列有关说法正确的是( )
A.嫦娥5号上升起的“高科技国旗”具有“耐热性、耐高低温、抗静电”等特点,它是以高性能的芳纶纤维材料为主的复合材料
B.嫦娥5号带回的月壤中含有珍贵的3He,它与地球上的4He互为同素异形体
C.长征5号火箭采用液氢、煤油、液氧作为推进剂,液氢、煤油、液氧都属于纯净物
D.登月中所用北斗系统的导航卫星,其计算机芯片材料是高纯度的二氧化硅
3.2020年12月27日,长征四号丙遥三十五运载火箭在酒泉卫星发射中心点火升空,以“一箭双星”的方式成功将遥感三十三号卫星和微纳技术试验卫星送入预定轨道。下列有关说法错误的是( )
A.氕、氘、氚互为同位素
B.火箭中的助燃剂14N16O2分子的中子总数为23
C.利用微纳技术研发的高端芯片,其组成为单晶硅,硅原子核外的L电子层电子数为M电子层电子数的2倍
D.He+H―→He+H+18.4 MeV为氧化还原反应
4.C的衰变反应为C―→X+e,其半衰期(反应物的量被消耗到其初始量的一半需要的时间)为5 730年。下列说法正确的是( )
A.C与X互为同位素
B.C与X的中子数相同
C.C和C的性质相同
D.某考古样品中C的量应为其11 460年前的
5.(2022·郑州高二月考)基态钡原子的核外电子排布式为[Xe]6s2,下列关于钡的说法不正确的是( )
A.其电负性比Cs大
B.位于第6周期ⅡA族
C.能与冷水反应放出氢气
D.第一电离能比Cs小
6.(2022·青岛高二期中)某短周期金属元素X的逐级电离能如图所示,下列说法正确的是( )
A.X可能在元素周期表第2周期
B.X在化合物中可能为+4价
C.X在周期表ⅤA族
D.X的最高价氧化物对应的水化物是两性氢氧化物
7.4p轨道填充一半电子的元素,其原子序数是( )
A.15 B.33 C.35 D.51
8.硒是人体必需的微量元素,它能有效提高人体免疫机能,抑制癌症和心脑血管等疾病的发病率。下列有关说法正确的是( )
A.硒元素位于元素周期表中第15列
B.硒元素原子的外围电子排布式为4s24p4
C.硒的氧化物只有一种
D.硒的基态原子核外电子排布中共有7个能级
9.下列关于基态原子外围电子排布为3s23p4的元素的描述正确的是( )
A.该元素的电负性是同主族中最大的
B.其基态原子的轨道表示式为
C.该元素的第一电离能是同周期元素中最大的
D.该元素可以形成两种常见的氧化物
10.下列说法或有关化学用语的使用正确的是( )
A.在基态多电子原子中,p轨道电子的能量一定高于s轨道电子的能量
B.Fe原子的外围电子轨道表示式为
C.氧的电负性比氮大,故氧元素的第一电离能比氮元素的第一电离能大
D.铜原子的外围电子排布式为3d94s2
11.(2022·杭州高二月考)下列关于元素第一电离能的说法不正确的是( )
A.钾元素的第一电离能小于钠元素的第一电离能,故钾的金属性强于钠
B.因同周期元素的原子半径从左到右逐渐减小(稀有气体元素除外),故第一电离能必依次增大
C.最外层电子排布为ns2np6(当只有K层时为1s2)的原子对应元素的第一电离能较大
D.对于同一种元素而言,电离能:I112.(2021·山东淄博高二期末)氨硼烷(NH3BH3)含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。氨硼烷在催化剂作用下与水反应产生氢气:NH3BH3+2H2ONH4BO2+3H2↑,下列说法不正确的是( )
A.原子半径:B>N>O>H
B.第一电离能:N>O>B
C.电负性:O>N>B
D.熔点:CH3CH3>NH3BH3
13.如图为元素周期表中短周期的一部分,下列关于Y、Z、M的说法正确的是( )
A.电负性:Y>Z>M
B.离子半径:M->Z2->Y-
C.ZM2分子中各原子的最外层均满足8电子稳定结构
D.Z元素基态原子最外层电子轨道表示式为
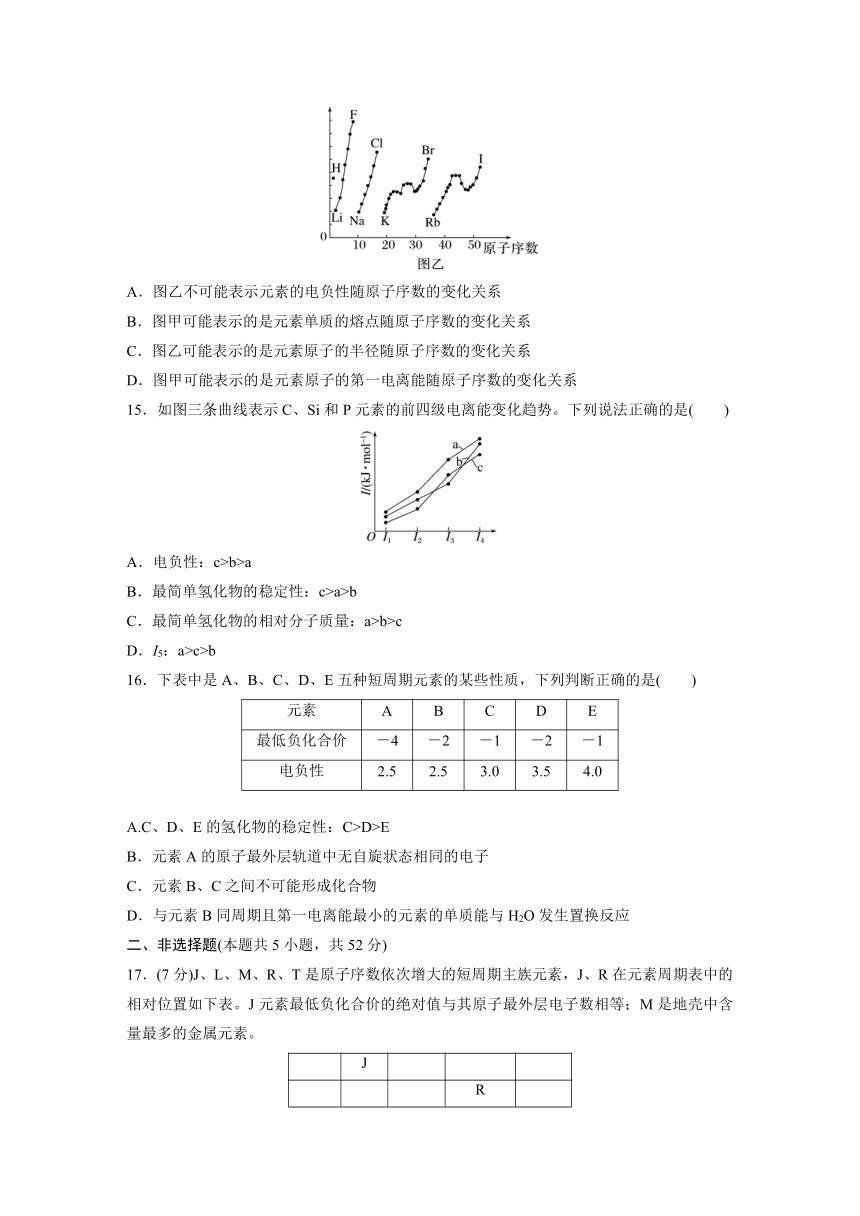
14.图甲和图乙表示的是元素的某种性质随原子序数的变化关系。下列说法正确的是( )
A.图乙不可能表示元素的电负性随原子序数的变化关系
B.图甲可能表示的是元素单质的熔点随原子序数的变化关系
C.图乙可能表示的是元素原子的半径随原子序数的变化关系
D.图甲可能表示的是元素原子的第一电离能随原子序数的变化关系
15.如图三条曲线表示C、Si和P元素的前四级电离能变化趋势。下列说法正确的是( )
A.电负性:c>b>a
B.最简单氢化物的稳定性:c>a>b
C.最简单氢化物的相对分子质量:a>b>c
D.I5:a>c>b
16.下表中是A、B、C、D、E五种短周期元素的某些性质,下列判断正确的是( )
元素 A B C D E
最低负化合价 -4 -2 -1 -2 -1
电负性 2.5 2.5 3.0 3.5 4.0
A.C、D、E的氢化物的稳定性:C>D>E
B.元素A的原子最外层轨道中无自旋状态相同的电子
C.元素B、C之间不可能形成化合物
D.与元素B同周期且第一电离能最小的元素的单质能与H2O发生置换反应
二、非选择题(本题共5小题,共52分)
17.(7分)J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在元素周期表中的相对位置如下表。J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素。
J
R
(1)M的离子结构示意图为________________;元素T在周期表中位于________族。
(2)J元素名称是________,它和氢组成10电子的化合物,其分子式为________,属于________(填“离子化合物”或“共价化合物”)。
(3)R元素符号为________,其最高电子层符号是______。
18.(14分)Ⅰ.(1)第一电离能介于B、N之间的第2周期元素有________种。
(2)依据第2周期元素第一电离能的变化规律,参照如图B、F元素的位置,用小黑点标出C、N、O三种元素的相对位置。
(3)原子的第一电离能是指气态原子失去一个电子形成+1价气态阳离子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为_______________________________。
Ⅱ.已知A、B、C、D、E都是元素周期表中前36号的元素,它们的原子序数依次增大。A原子基态时最外层电子数是其内层电子总数的2倍,B原子基态时s电子数与p电子数相等,C在元素周期表的各元素中电负性最大,D的基态原子核外有6个能级且全部充满电子,E原子基态时未成对电子数是同周期元素中最多的。
(1)基态E原子的外围电子排布式为________,E在________区。
(2)A、B、C的电负性大小顺序为______(填元素符号,下同),第一电离能大小顺序为________。
(3)D的核外电子排布式为__________________________________________________,外围电子轨道表示式为________。
19.(10分)元素A、B、C、D都是短周期元素,A元素原子的2p轨道上仅有两个未成对电子,B的3p轨道上有空轨道,A、B同主族,B、C同周期,C是同周期中电负性最大的,D的气态氢化物的水溶液能使无色酚酞试液变红。试回答:
(1)A的外围电子轨道表示式为____________;B的电子排布式为________________;C的外围电子排布式为____________;D的原子结构示意图为__________________。
(2)已知D与H原子能形成一种高能量的分子D2H2,其中D原子满足8电子结构特征,则该分子的电子式为__________________________________________________________。
(3)B的原子核外电子运动状态有________种,原子轨道数为______________,有________种能量不同的电子,电子占据的最高能量的电子层符号为________。
(4)四种元素最高价氧化物对应水化物的酸性由强到弱的顺序是(用对应化学式回答)________________________________________________________________________
________________________________________________________________________。
20.(11分)回答下列问题:
(1)碳原子的核外电子排布式为____________。与碳同周期的非金属元素N的第一电离能大于O的第一电离能,原因是__________________________________________________。
(2)A、B均为短周期金属元素。依据下表数据,写出B原子的电子排布式:
________________________________________________________________________。
电离能/(kJ·mol-1) I1 I2 I3 I4
A 932 1 821 15 390 21 771
B 738 1 451 7 733 10 540
(3)下表是第3周期部分元素的电离能[单位:eV(电子伏特)]数据。
元素 I1/eV I2/eV I3/eV
甲 5.7 47.4 71.8
乙 7.7 15.1 80.3
丙 13.0 23.9 40.0
丁 15.7 27.6 40.7
下列说法正确的是________(填字母)。
A.甲的金属性比乙强
B.乙的化合价为+1价
C.丙不可能为非金属元素
D.丁一定为金属元素
(4)Mn、Fe均为第4周期过渡金属元素,两元素的部分电离能数据列于下表:
元素 Mn Fe
电离能/(kJ·mol-1) I1 717 759
I2 1 509 1 561
I3 3 248 2 957
锰元素位于第4周期ⅦB族。请写出基态Mn2+的外围电子排布式:________,比较两元素的I2、I3可知,气态Mn2+再失去1个电子比气态Fe2+再失去1个电子难,对此你的解释是________________________________________________________________________
________________________________________________________________________。
21.(10分)现有六种元素,其中A、B、C、D、E为短周期主族元素,F为第4周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
A元素形成的物质种类繁多,其形成的一种固体单质工业上常用作切割工具
B元素原子的核外p电子数比s电子数少1
C元素基态原子p轨道有两个未成对电子
D原子的第一至第四电离能分别是I1=738 kJ·mol-1;I2=1 451 kJ·mol-1;I3=7 733 kJ· mol-1;I4=10 540 kJ·mol-1
E原子核外所有p轨道全充满或半充满
F在周期表的第8纵列
(1)某同学根据上述信息,推断A基态原子的核外电子排布为,该同学所画的轨道表示式违背了________________。
(2)B元素的电负性________(填“大于”“小于”或“等于”)C元素的电负性。
(3)E基态原子中能量最高的电子,其电子云在空间有________个方向。
(4)下列关于F原子的外围电子轨道表示式正确的是________(填字母)。
A.
B.
C.
D.
(5)F3+的核外电子排布式为_________________________________________________。
(6)元素铜与镍的第二电离能分别为ICu=1 959 kJ·mol-1,INi=1 753 kJ·mol-1,ICu>INi的原因是________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
专题1、2检测试卷
1.D [质量数=质子数+中子数,因此中子数为8的C原子的质量数为6+8=14,则表示为C,A错误;HCl为共价化合物,H原子和Cl原子形成共用电子对,其电子式为,B错误;乙烯含有碳碳双键,其结构简式为CH2==CH2,C错误;Cl原子核外有17个电子,其原子结构示意图为,D正确。]
2.A [芳纶纤维材料属于复合材料,具有“耐热性、耐高低温、抗静电”等特点,A正确;3He与4He的质子数都为2,但质量数不同,二者都属于氦元素,互为同位素,B错误;煤油是烃类混合物,C错误;计算机芯片材料是高纯度的硅,而不是二氧化硅,D错误。]
3.D [1个N中含有7个中子,1个O中含有8个中子,则14N16O2分子的中子总数为7+8×2=23,B正确;硅原子为14号元素,原子结构示意图为,L电子层有8个电子,M电子层有4个电子,则L电子层电子数为M电子层电子数的2倍,C正确;He+H―→
He+H+18.4 MeV为核反应,不是化学反应,D错误。]
4.D [由C―→X+e,可知z=7,X为N,C与N质子数不相同,不互为同位素,A错误;C与N的中子数分别为14-6=8、14-7=7,中子数不同,B错误;C和C的核外电子数均为6,核外电子排布相同,则化学性质相同,质量数不同,故性质并不完全相同,C错误;根据半衰期的定义,某考古样品中C的量应为其5 730年前的,为5 730×2=11 460年前的,D正确。]
5.D [Cs、Ba同周期,从左到右,电负性增大,故Ba的电负性大于Cs,A正确;Ba位于第6周期ⅡA族,B正确;同主族元素从上到下元素的金属性逐渐增强,Ca能与冷水反应生成氢气,故Ba也能,C正确;同周期主族元素从左到右元素的第一电离能呈增大趋势,故Ba>Cs,D不正确。]
6.D [据图可知,X的电离能在I3→I4时突然增大,则X应为ⅢA族元素,又因X为短周期金属元素,所以X为Al元素。Al位于第3周期,A错误;Al的最高正价为+3价,B错误;Al位于ⅢA族,C错误;Al的最高价氧化物对应的水化物为Al(OH)3其是两性氢氧化物,D正确。]
7.B [根据构造原理可知,当4p轨道填充一半电子时,3d已经排满10个电子,所以原子序数为2+8+18+5=33。]
8.B [元素周期表中第15列元素为ⅤA族元素,硒元素位于元素周期表中第16列的ⅥA族,A错误;硒为34号元素,有6个外围电子,所以硒的外围电子排布式为4s24p4,B正确;由同主族元素硫存在两种氧化物SO2和SO3,可推得硒也有两种氧化物SeO2和SeO3,C错误;硒是34号元素,其基态原子的电子排布式为1s22s22p63s23p63d104s24p4,应含有8个能级,D错误。]
9.D [外围电子排布为3s23p4的原子是S原子,同主族元素自上而下电负性呈减小趋势,故电负性:S10.B [A项,在基态多电子原子中,(n-1)p轨道上电子的能量低于ns轨道上电子的能量,错误;C项,氧的电负性比氮大,但由于ⅤA族元素的第一电离能出现反常,故氧元素的第一电离能比氮元素的第一电离能小,错误;D项,d轨道全充满时原子更稳定,铜原子的外围电子排布式为3d104s1,错误。]
11.B [钾元素的第一电离能小于钠元素的,说明钾原子的失电子能力比钠强,所以钾的金属性强于钠,故A正确;同周期元素原子半径随着原子序数的增大而减小(稀有气体元素除外),第一电离能随着原子序数的增大而呈增大趋势,但ⅡA族元素和ⅤA族元素第一电离能大于同周期相邻元素,故B错误;最外层电子排布为ns2np6(若只有K层时为1s2)的原子结构较为稳定,较难失去电子,所以对应元素的第一电离能较大,故C正确;对于同一种元素来说,原子失去电子数越多,其失电子能力越弱,所以元素的逐级电离能逐渐增大,故D正确。]
12.D [氢原子半径最小,同周期主族元素从左到右原子半径依次减小,则原子半径:B>N>O>H,A正确;同周期主族元素从左到右第一电离能呈增大趋势,由于N原子的2p轨道半充满,结构更稳定,故第一电离能:N>O>B,B正确;同周期主族元素从左到右电负性依次增大,电负性:O>N>B,C正确;常温下,氨硼烷是固体,乙烷是气体,熔点:CH3CH313.C [由图示位置关系可推知:X为氦元素,Y为氟元素,M为氯元素,Z为硫元素。非金属性:Y>M>Z,元素的电负性关系为Y>M>Z,故A错误;S2-和Cl-2种离子具有相同的电子层结构,F-少一个电子层,离子半径关系为S2->Cl->F-,故B错误;ZM2为SCl2,分子中S元素化合价为+2价,Cl元素化合价为-1价,原子最外层电子数+化合价绝对值=8,满足8电子稳定结构,SCl2的电子式为,故C正确;S元素基态原子最外层电子轨道表示式为,故D错误。]
14.D [电负性是元素的原子在化合物中吸引电子的能力,随着核电荷数的增加呈周期性变化,故图乙可能表示元素的电负性随原子序数的变化关系,故A错误;同周期元素中,非金属单质的熔点较低,与图像不符,故B错误;同周期元素从左到右,原子半径逐渐减小,与图像不符,故C错误;同周期元素第一电离能从左到右呈增大趋势,其中ⅡA、ⅤA族元素的第一电离能大于相邻主族元素,与图像基本符合,故D正确。]
15.D [同主族元素自上而下第一电离能逐渐减小,P元素3p能级为半充满稳定状态,第一电离能高于同周期相邻元素的第一电离能,故Si的第一电离能最小,由图中第一电离能可知,c为Si,P原子第四电离能为失去3s2中1个电子,3s2为全充满稳定状态,不易失去电子,故与第三电离能相差较大,可知b为P、a为C。D项,C、Si失去 4个电子为全充满状态,能量更低,再失去1个电子时,第五电离能与第四电离能相差较大,P失去4个电子为3s1状态,第四电离能与第五电离能均失去3s能级电子,二者能量相差不大,故第五电离能:C>Si>P,正确。]
16.D [根据表中信息可知:A为C元素,B为S元素,C为Cl元素,D为O元素,E为F元素。非金属性:F>O>Cl,元素的非金属性越强,对应的氢化物越稳定,A错误;A为C元素,外围电子排布式为2s22p2,p轨道有2个电子,自旋状态相同,B错误;元素B、C之间可形成化合物S2Cl2等,C错误;与元素B同周期且第一电离能最小的元素的单质为Na,为活泼金属,能与H2O发生置换反应生成氢气,D正确。]
17.(1) ⅦA (2)碳 CH4 共价化合物 (3)S M
解析 J元素最低负化合价的绝对值与其原子最外层电子数相等,说明J的最低化合价与最高化合价的绝对值相等,则J最外层电子数为4,根据J、R都为短周期元素及表中的相对位置可知J为C元素,则R应为S元素,M是地壳中含量最多的金属元素,应为Al元素,而T是原子序数最大的元素,且为短周期主族元素,应为Cl元素,根据元素周期律的递变规律及元素的单质、化合物的性质来解答该题。
18.Ⅰ.(1)3 (2)
(3)O>S>Se
Ⅱ.(1)3d54s1 d (2)F>O>C F>O>C
(3)1s22s22p63s23p64s2(或[Ar]4s2)
19.(1) 1s22s22p63s23p2 3s23p5
(2) (3)14 9 5 M (4)HClO4>HNO3>H2CO3>H2SiO3
解析 根据各元素信息分析可知,A为C元素,B为Si元素,C为Cl元素,D为N元素。
20.(1)1s22s22p2 N原子的2p轨道达到半充满状态,比较稳定 (2)1s22s22p63s2 (3)A (4)3d5 由Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转变为不稳定的3d4状态需要的能量较多;而Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满状态需要的能量相对要少
解析 (2)从表中电离能数值来看,A、B的第三电离能均出现突跃,可见它们是ⅡA族元素,因A、B均为短周期元素,且B的第一、二电离能均比A的小,故B是镁。镁原子的电子排布式为1s22s22p63s2。(3)甲、乙、丙、丁为第3周期元素,甲元素的第一电离能远远小于第二电离能,说明甲元素最外层有1个电子,失去1个电子时达到稳定结构,所以甲为Na元素;乙元素的第二电离能远远小于第三电离能,则乙元素最外层有2个电子,失去两个电子后达到稳定结构,所以乙为Mg元素;丙、丁元素的第一电离能、第二电离能、第三电离能相差不大,说明丙、丁元素最外层大于3个电子,故丙、丁一定为非金属元素。甲为Na元素,乙为Mg元素,故甲的金属性比乙强,A正确;乙为Mg元素,化合价为+2价,B错误;丙、丁一定为非金属元素,C、D错误。
21.(1)洪特规则 (2)小于 (3)3 (4)C
(5)[Ar]3d5(或1s22s22p63s23p63d5) (6)Cu+核外外围电子排布为3d10,3d全充满,比Ni+的3d84s1稳定,难以失去电子
解析 A元素形成的物质种类繁多,其形成的一种固体单质工业上常用作切割工具,为金刚石,则A为碳元素;B元素原子的核外p电子数比s电子数少1,B有2个电子层,核外电子排布为1s22s22p3,故B为氮元素;C元素基态原子p轨道有两个未成对电子,即1s22s22p2或1s22s22p4,但A为碳元素,则C为氧元素;D原子的第一至第四电离能分别是I1=738 kJ·mol-1;I2=1 451 kJ·mol-1;I3=7 733 kJ·mol-1;I4=10 540 kJ·mol-1,即D为镁元素;E原子核外所有p轨道全充满或半充满,为磷元素;F在周期表的第8纵列,为第4周期元素,则F为铁元素。
(满分:100分)
一、选择题(本题共16小题,每小题3分,共48分。每小题只有一个选项符合题意)
1.用化学用语表示反应CH2==CH2+HCl―→CH3CH2Cl中的相关微粒,其中正确的是( )
A.中子数为8的C原子:C
B.HCl的电子式:
C.乙烯的结构简式:CH2CH2
D.Cl的原子结构示意图:
2.2020年11月24日,嫦娥5号在长征5号火箭巨大的推力下前往月球,经过20多天旅程后带着月壤返回。这是中国航天“探月工程”向世界展示出的“中国力量”,下列有关说法正确的是( )
A.嫦娥5号上升起的“高科技国旗”具有“耐热性、耐高低温、抗静电”等特点,它是以高性能的芳纶纤维材料为主的复合材料
B.嫦娥5号带回的月壤中含有珍贵的3He,它与地球上的4He互为同素异形体
C.长征5号火箭采用液氢、煤油、液氧作为推进剂,液氢、煤油、液氧都属于纯净物
D.登月中所用北斗系统的导航卫星,其计算机芯片材料是高纯度的二氧化硅
3.2020年12月27日,长征四号丙遥三十五运载火箭在酒泉卫星发射中心点火升空,以“一箭双星”的方式成功将遥感三十三号卫星和微纳技术试验卫星送入预定轨道。下列有关说法错误的是( )
A.氕、氘、氚互为同位素
B.火箭中的助燃剂14N16O2分子的中子总数为23
C.利用微纳技术研发的高端芯片,其组成为单晶硅,硅原子核外的L电子层电子数为M电子层电子数的2倍
D.He+H―→He+H+18.4 MeV为氧化还原反应
4.C的衰变反应为C―→X+e,其半衰期(反应物的量被消耗到其初始量的一半需要的时间)为5 730年。下列说法正确的是( )
A.C与X互为同位素
B.C与X的中子数相同
C.C和C的性质相同
D.某考古样品中C的量应为其11 460年前的
5.(2022·郑州高二月考)基态钡原子的核外电子排布式为[Xe]6s2,下列关于钡的说法不正确的是( )
A.其电负性比Cs大
B.位于第6周期ⅡA族
C.能与冷水反应放出氢气
D.第一电离能比Cs小
6.(2022·青岛高二期中)某短周期金属元素X的逐级电离能如图所示,下列说法正确的是( )
A.X可能在元素周期表第2周期
B.X在化合物中可能为+4价
C.X在周期表ⅤA族
D.X的最高价氧化物对应的水化物是两性氢氧化物
7.4p轨道填充一半电子的元素,其原子序数是( )
A.15 B.33 C.35 D.51
8.硒是人体必需的微量元素,它能有效提高人体免疫机能,抑制癌症和心脑血管等疾病的发病率。下列有关说法正确的是( )
A.硒元素位于元素周期表中第15列
B.硒元素原子的外围电子排布式为4s24p4
C.硒的氧化物只有一种
D.硒的基态原子核外电子排布中共有7个能级
9.下列关于基态原子外围电子排布为3s23p4的元素的描述正确的是( )
A.该元素的电负性是同主族中最大的
B.其基态原子的轨道表示式为
C.该元素的第一电离能是同周期元素中最大的
D.该元素可以形成两种常见的氧化物
10.下列说法或有关化学用语的使用正确的是( )
A.在基态多电子原子中,p轨道电子的能量一定高于s轨道电子的能量
B.Fe原子的外围电子轨道表示式为
C.氧的电负性比氮大,故氧元素的第一电离能比氮元素的第一电离能大
D.铜原子的外围电子排布式为3d94s2
11.(2022·杭州高二月考)下列关于元素第一电离能的说法不正确的是( )
A.钾元素的第一电离能小于钠元素的第一电离能,故钾的金属性强于钠
B.因同周期元素的原子半径从左到右逐渐减小(稀有气体元素除外),故第一电离能必依次增大
C.最外层电子排布为ns2np6(当只有K层时为1s2)的原子对应元素的第一电离能较大
D.对于同一种元素而言,电离能:I1
A.原子半径:B>N>O>H
B.第一电离能:N>O>B
C.电负性:O>N>B
D.熔点:CH3CH3>NH3BH3
13.如图为元素周期表中短周期的一部分,下列关于Y、Z、M的说法正确的是( )
A.电负性:Y>Z>M
B.离子半径:M->Z2->Y-
C.ZM2分子中各原子的最外层均满足8电子稳定结构
D.Z元素基态原子最外层电子轨道表示式为
14.图甲和图乙表示的是元素的某种性质随原子序数的变化关系。下列说法正确的是( )
A.图乙不可能表示元素的电负性随原子序数的变化关系
B.图甲可能表示的是元素单质的熔点随原子序数的变化关系
C.图乙可能表示的是元素原子的半径随原子序数的变化关系
D.图甲可能表示的是元素原子的第一电离能随原子序数的变化关系
15.如图三条曲线表示C、Si和P元素的前四级电离能变化趋势。下列说法正确的是( )
A.电负性:c>b>a
B.最简单氢化物的稳定性:c>a>b
C.最简单氢化物的相对分子质量:a>b>c
D.I5:a>c>b
16.下表中是A、B、C、D、E五种短周期元素的某些性质,下列判断正确的是( )
元素 A B C D E
最低负化合价 -4 -2 -1 -2 -1
电负性 2.5 2.5 3.0 3.5 4.0
A.C、D、E的氢化物的稳定性:C>D>E
B.元素A的原子最外层轨道中无自旋状态相同的电子
C.元素B、C之间不可能形成化合物
D.与元素B同周期且第一电离能最小的元素的单质能与H2O发生置换反应
二、非选择题(本题共5小题,共52分)
17.(7分)J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在元素周期表中的相对位置如下表。J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素。
J
R
(1)M的离子结构示意图为________________;元素T在周期表中位于________族。
(2)J元素名称是________,它和氢组成10电子的化合物,其分子式为________,属于________(填“离子化合物”或“共价化合物”)。
(3)R元素符号为________,其最高电子层符号是______。
18.(14分)Ⅰ.(1)第一电离能介于B、N之间的第2周期元素有________种。
(2)依据第2周期元素第一电离能的变化规律,参照如图B、F元素的位置,用小黑点标出C、N、O三种元素的相对位置。
(3)原子的第一电离能是指气态原子失去一个电子形成+1价气态阳离子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为_______________________________。
Ⅱ.已知A、B、C、D、E都是元素周期表中前36号的元素,它们的原子序数依次增大。A原子基态时最外层电子数是其内层电子总数的2倍,B原子基态时s电子数与p电子数相等,C在元素周期表的各元素中电负性最大,D的基态原子核外有6个能级且全部充满电子,E原子基态时未成对电子数是同周期元素中最多的。
(1)基态E原子的外围电子排布式为________,E在________区。
(2)A、B、C的电负性大小顺序为______(填元素符号,下同),第一电离能大小顺序为________。
(3)D的核外电子排布式为__________________________________________________,外围电子轨道表示式为________。
19.(10分)元素A、B、C、D都是短周期元素,A元素原子的2p轨道上仅有两个未成对电子,B的3p轨道上有空轨道,A、B同主族,B、C同周期,C是同周期中电负性最大的,D的气态氢化物的水溶液能使无色酚酞试液变红。试回答:
(1)A的外围电子轨道表示式为____________;B的电子排布式为________________;C的外围电子排布式为____________;D的原子结构示意图为__________________。
(2)已知D与H原子能形成一种高能量的分子D2H2,其中D原子满足8电子结构特征,则该分子的电子式为__________________________________________________________。
(3)B的原子核外电子运动状态有________种,原子轨道数为______________,有________种能量不同的电子,电子占据的最高能量的电子层符号为________。
(4)四种元素最高价氧化物对应水化物的酸性由强到弱的顺序是(用对应化学式回答)________________________________________________________________________
________________________________________________________________________。
20.(11分)回答下列问题:
(1)碳原子的核外电子排布式为____________。与碳同周期的非金属元素N的第一电离能大于O的第一电离能,原因是__________________________________________________。
(2)A、B均为短周期金属元素。依据下表数据,写出B原子的电子排布式:
________________________________________________________________________。
电离能/(kJ·mol-1) I1 I2 I3 I4
A 932 1 821 15 390 21 771
B 738 1 451 7 733 10 540
(3)下表是第3周期部分元素的电离能[单位:eV(电子伏特)]数据。
元素 I1/eV I2/eV I3/eV
甲 5.7 47.4 71.8
乙 7.7 15.1 80.3
丙 13.0 23.9 40.0
丁 15.7 27.6 40.7
下列说法正确的是________(填字母)。
A.甲的金属性比乙强
B.乙的化合价为+1价
C.丙不可能为非金属元素
D.丁一定为金属元素
(4)Mn、Fe均为第4周期过渡金属元素,两元素的部分电离能数据列于下表:
元素 Mn Fe
电离能/(kJ·mol-1) I1 717 759
I2 1 509 1 561
I3 3 248 2 957
锰元素位于第4周期ⅦB族。请写出基态Mn2+的外围电子排布式:________,比较两元素的I2、I3可知,气态Mn2+再失去1个电子比气态Fe2+再失去1个电子难,对此你的解释是________________________________________________________________________
________________________________________________________________________。
21.(10分)现有六种元素,其中A、B、C、D、E为短周期主族元素,F为第4周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
A元素形成的物质种类繁多,其形成的一种固体单质工业上常用作切割工具
B元素原子的核外p电子数比s电子数少1
C元素基态原子p轨道有两个未成对电子
D原子的第一至第四电离能分别是I1=738 kJ·mol-1;I2=1 451 kJ·mol-1;I3=7 733 kJ· mol-1;I4=10 540 kJ·mol-1
E原子核外所有p轨道全充满或半充满
F在周期表的第8纵列
(1)某同学根据上述信息,推断A基态原子的核外电子排布为,该同学所画的轨道表示式违背了________________。
(2)B元素的电负性________(填“大于”“小于”或“等于”)C元素的电负性。
(3)E基态原子中能量最高的电子,其电子云在空间有________个方向。
(4)下列关于F原子的外围电子轨道表示式正确的是________(填字母)。
A.
B.
C.
D.
(5)F3+的核外电子排布式为_________________________________________________。
(6)元素铜与镍的第二电离能分别为ICu=1 959 kJ·mol-1,INi=1 753 kJ·mol-1,ICu>INi的原因是________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
专题1、2检测试卷
1.D [质量数=质子数+中子数,因此中子数为8的C原子的质量数为6+8=14,则表示为C,A错误;HCl为共价化合物,H原子和Cl原子形成共用电子对,其电子式为,B错误;乙烯含有碳碳双键,其结构简式为CH2==CH2,C错误;Cl原子核外有17个电子,其原子结构示意图为,D正确。]
2.A [芳纶纤维材料属于复合材料,具有“耐热性、耐高低温、抗静电”等特点,A正确;3He与4He的质子数都为2,但质量数不同,二者都属于氦元素,互为同位素,B错误;煤油是烃类混合物,C错误;计算机芯片材料是高纯度的硅,而不是二氧化硅,D错误。]
3.D [1个N中含有7个中子,1个O中含有8个中子,则14N16O2分子的中子总数为7+8×2=23,B正确;硅原子为14号元素,原子结构示意图为,L电子层有8个电子,M电子层有4个电子,则L电子层电子数为M电子层电子数的2倍,C正确;He+H―→
He+H+18.4 MeV为核反应,不是化学反应,D错误。]
4.D [由C―→X+e,可知z=7,X为N,C与N质子数不相同,不互为同位素,A错误;C与N的中子数分别为14-6=8、14-7=7,中子数不同,B错误;C和C的核外电子数均为6,核外电子排布相同,则化学性质相同,质量数不同,故性质并不完全相同,C错误;根据半衰期的定义,某考古样品中C的量应为其5 730年前的,为5 730×2=11 460年前的,D正确。]
5.D [Cs、Ba同周期,从左到右,电负性增大,故Ba的电负性大于Cs,A正确;Ba位于第6周期ⅡA族,B正确;同主族元素从上到下元素的金属性逐渐增强,Ca能与冷水反应生成氢气,故Ba也能,C正确;同周期主族元素从左到右元素的第一电离能呈增大趋势,故Ba>Cs,D不正确。]
6.D [据图可知,X的电离能在I3→I4时突然增大,则X应为ⅢA族元素,又因X为短周期金属元素,所以X为Al元素。Al位于第3周期,A错误;Al的最高正价为+3价,B错误;Al位于ⅢA族,C错误;Al的最高价氧化物对应的水化物为Al(OH)3其是两性氢氧化物,D正确。]
7.B [根据构造原理可知,当4p轨道填充一半电子时,3d已经排满10个电子,所以原子序数为2+8+18+5=33。]
8.B [元素周期表中第15列元素为ⅤA族元素,硒元素位于元素周期表中第16列的ⅥA族,A错误;硒为34号元素,有6个外围电子,所以硒的外围电子排布式为4s24p4,B正确;由同主族元素硫存在两种氧化物SO2和SO3,可推得硒也有两种氧化物SeO2和SeO3,C错误;硒是34号元素,其基态原子的电子排布式为1s22s22p63s23p63d104s24p4,应含有8个能级,D错误。]
9.D [外围电子排布为3s23p4的原子是S原子,同主族元素自上而下电负性呈减小趋势,故电负性:S
11.B [钾元素的第一电离能小于钠元素的,说明钾原子的失电子能力比钠强,所以钾的金属性强于钠,故A正确;同周期元素原子半径随着原子序数的增大而减小(稀有气体元素除外),第一电离能随着原子序数的增大而呈增大趋势,但ⅡA族元素和ⅤA族元素第一电离能大于同周期相邻元素,故B错误;最外层电子排布为ns2np6(若只有K层时为1s2)的原子结构较为稳定,较难失去电子,所以对应元素的第一电离能较大,故C正确;对于同一种元素来说,原子失去电子数越多,其失电子能力越弱,所以元素的逐级电离能逐渐增大,故D正确。]
12.D [氢原子半径最小,同周期主族元素从左到右原子半径依次减小,则原子半径:B>N>O>H,A正确;同周期主族元素从左到右第一电离能呈增大趋势,由于N原子的2p轨道半充满,结构更稳定,故第一电离能:N>O>B,B正确;同周期主族元素从左到右电负性依次增大,电负性:O>N>B,C正确;常温下,氨硼烷是固体,乙烷是气体,熔点:CH3CH3
14.D [电负性是元素的原子在化合物中吸引电子的能力,随着核电荷数的增加呈周期性变化,故图乙可能表示元素的电负性随原子序数的变化关系,故A错误;同周期元素中,非金属单质的熔点较低,与图像不符,故B错误;同周期元素从左到右,原子半径逐渐减小,与图像不符,故C错误;同周期元素第一电离能从左到右呈增大趋势,其中ⅡA、ⅤA族元素的第一电离能大于相邻主族元素,与图像基本符合,故D正确。]
15.D [同主族元素自上而下第一电离能逐渐减小,P元素3p能级为半充满稳定状态,第一电离能高于同周期相邻元素的第一电离能,故Si的第一电离能最小,由图中第一电离能可知,c为Si,P原子第四电离能为失去3s2中1个电子,3s2为全充满稳定状态,不易失去电子,故与第三电离能相差较大,可知b为P、a为C。D项,C、Si失去 4个电子为全充满状态,能量更低,再失去1个电子时,第五电离能与第四电离能相差较大,P失去4个电子为3s1状态,第四电离能与第五电离能均失去3s能级电子,二者能量相差不大,故第五电离能:C>Si>P,正确。]
16.D [根据表中信息可知:A为C元素,B为S元素,C为Cl元素,D为O元素,E为F元素。非金属性:F>O>Cl,元素的非金属性越强,对应的氢化物越稳定,A错误;A为C元素,外围电子排布式为2s22p2,p轨道有2个电子,自旋状态相同,B错误;元素B、C之间可形成化合物S2Cl2等,C错误;与元素B同周期且第一电离能最小的元素的单质为Na,为活泼金属,能与H2O发生置换反应生成氢气,D正确。]
17.(1) ⅦA (2)碳 CH4 共价化合物 (3)S M
解析 J元素最低负化合价的绝对值与其原子最外层电子数相等,说明J的最低化合价与最高化合价的绝对值相等,则J最外层电子数为4,根据J、R都为短周期元素及表中的相对位置可知J为C元素,则R应为S元素,M是地壳中含量最多的金属元素,应为Al元素,而T是原子序数最大的元素,且为短周期主族元素,应为Cl元素,根据元素周期律的递变规律及元素的单质、化合物的性质来解答该题。
18.Ⅰ.(1)3 (2)
(3)O>S>Se
Ⅱ.(1)3d54s1 d (2)F>O>C F>O>C
(3)1s22s22p63s23p64s2(或[Ar]4s2)
19.(1) 1s22s22p63s23p2 3s23p5
(2) (3)14 9 5 M (4)HClO4>HNO3>H2CO3>H2SiO3
解析 根据各元素信息分析可知,A为C元素,B为Si元素,C为Cl元素,D为N元素。
20.(1)1s22s22p2 N原子的2p轨道达到半充满状态,比较稳定 (2)1s22s22p63s2 (3)A (4)3d5 由Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转变为不稳定的3d4状态需要的能量较多;而Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满状态需要的能量相对要少
解析 (2)从表中电离能数值来看,A、B的第三电离能均出现突跃,可见它们是ⅡA族元素,因A、B均为短周期元素,且B的第一、二电离能均比A的小,故B是镁。镁原子的电子排布式为1s22s22p63s2。(3)甲、乙、丙、丁为第3周期元素,甲元素的第一电离能远远小于第二电离能,说明甲元素最外层有1个电子,失去1个电子时达到稳定结构,所以甲为Na元素;乙元素的第二电离能远远小于第三电离能,则乙元素最外层有2个电子,失去两个电子后达到稳定结构,所以乙为Mg元素;丙、丁元素的第一电离能、第二电离能、第三电离能相差不大,说明丙、丁元素最外层大于3个电子,故丙、丁一定为非金属元素。甲为Na元素,乙为Mg元素,故甲的金属性比乙强,A正确;乙为Mg元素,化合价为+2价,B错误;丙、丁一定为非金属元素,C、D错误。
21.(1)洪特规则 (2)小于 (3)3 (4)C
(5)[Ar]3d5(或1s22s22p63s23p63d5) (6)Cu+核外外围电子排布为3d10,3d全充满,比Ni+的3d84s1稳定,难以失去电子
解析 A元素形成的物质种类繁多,其形成的一种固体单质工业上常用作切割工具,为金刚石,则A为碳元素;B元素原子的核外p电子数比s电子数少1,B有2个电子层,核外电子排布为1s22s22p3,故B为氮元素;C元素基态原子p轨道有两个未成对电子,即1s22s22p2或1s22s22p4,但A为碳元素,则C为氧元素;D原子的第一至第四电离能分别是I1=738 kJ·mol-1;I2=1 451 kJ·mol-1;I3=7 733 kJ·mol-1;I4=10 540 kJ·mol-1,即D为镁元素;E原子核外所有p轨道全充满或半充满,为磷元素;F在周期表的第8纵列,为第4周期元素,则F为铁元素。
