2023春高中化学选择性必修2 (苏教2019)专题3 微粒间作用力与物质性质 检测试卷(含解析)
文档属性
| 名称 | 2023春高中化学选择性必修2 (苏教2019)专题3 微粒间作用力与物质性质 检测试卷(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 800.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-03 22:32:21 | ||
图片预览



文档简介
专题3 微粒间作用力与物质性质 检测试卷
(满分:100分)
一、选择题(本题共16小题,每小题3分,共48分。每小题只有一个选项符合题意)
1.将Na2O2、SiO2、KCl、Al、冰分别加热熔化,需要克服的作用力类型相同的物质有( )
A.2种 B.3种
C.4种 D.5种
2.下列化学式既能表示物质的组成,又能表示物质的一个分子的是( )
A.Fe B.SiO2
C.H2O D.NH4Cl
3.下列各物质中,按熔点由高到低的顺序排列正确的是( )
A.CH4>SiH4>GeH4>SnH4
B.KCl>NaCl>MgO
C.Rb>K>Na>Li
D.石墨>金刚石>SiO2
4.下列说法正确的是( )
A.干冰气化和碘升华克服的作用力相同
B.甲酸甲酯和乙酸相对分子质量相同,熔点相近
C.氯化钠和氯化氢熔化时,破坏的都是离子键
D.碘化氢的范德华力比溴化氢的大,碘化氢稳定性强
5.铁镁合金是目前已发现的储氢密度较高的储氢材料之一,其晶胞结构如图所示(灰球代表Fe,白球代表Mg)。则下列说法错误的是( )
A.铁镁合金的化学式可表示为Mg2Fe
B.晶胞中有14个铁原子
C.晶体中存在的化学键类型为金属键
D.该晶胞的质量是 g(NA表示阿伏加德罗常数的值)
6.Al2O3在一定条件下可转化为硬度大、熔点高的氮化铝晶体,其晶胞结构如图所示。下列说法正确的是( )
A.氮化铝属于离子晶体
B.氮化铝可用于制造切割金属的刀具
C.1个氮化铝晶胞中含有9个Al原子
D.氮化铝晶体中Al原子和N原子数目之比为2∶3
7.下列关于σ键和π键的理解不正确的是( )
A.σ键一般能单独形成,而π键一般不能单独形成
B.σ键可以绕键轴旋转,π键一定不能绕键轴旋转
C.碳碳双键中一定有一个σ键、一个π键,碳碳三键中一定有一个σ键、两个π键
D.CH3—CH3、CH2==CH2、CH≡CH中σ键键能相等,π键键能也相等
8.关于下列粒子的描述不正确的是( )
A.PH3的电子式为,其热稳定性不如NH3
B.HS-的电子式为,是含有极性键的18电子的粒子
C.CH2Cl2的电子式为,分子结构呈四面体
D.KF的电子式为,它是易溶于水的离子化合物
9.通过反应4BI3(g)+As4(g)4BAs(s,晶体)+6I2(g)可制备具有超高热导率半导体材料——BAs晶体。下列说法错误的是( )
A.图(a)表示As4结构,As4分子中成键电子对数与孤电子对数之比为3∶2
B.图(b)表示单质硼晶体B12的基本结构单位,该基本单位为正二十面体
C.图(b)所示单质硼晶体的熔点为2 180 ℃,它属于共价晶体
D.图(c)表示BAs的晶胞结构,距离As原子最近且相等的B原子有4个
10.金属晶体和离子晶体是重要的晶体类型。下列关于它们的说法正确的是( )
A.金属能导电是因为金属阳离子在外电场作用下定向运动
B.在锌晶体中,1个Zn2+只与2个自由电子存在强烈的相互作用
C.离子晶体中的化学键很难断裂,因此离子晶体具有延展性
D.NaCl晶体的晶格能小于MgO晶体的晶格能
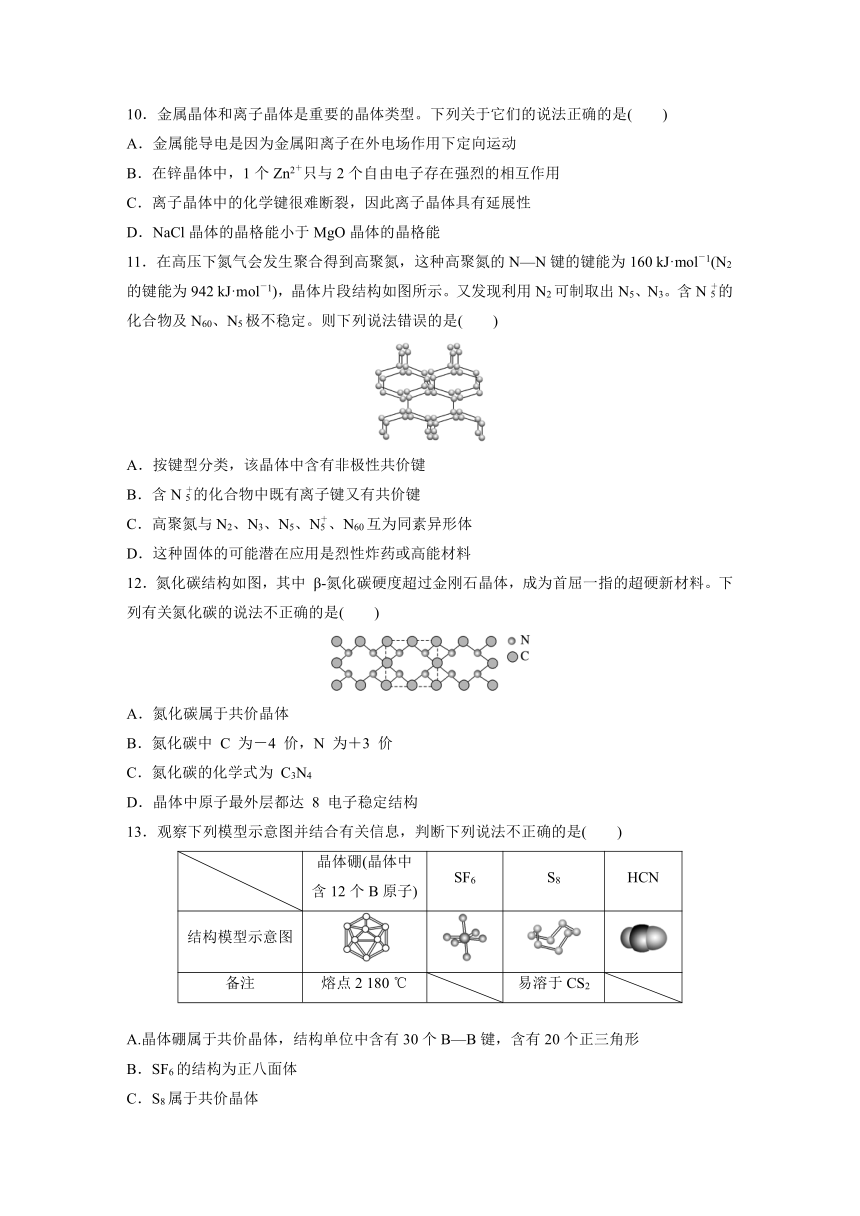
11.在高压下氮气会发生聚合得到高聚氮,这种高聚氮的N—N键的键能为160 kJ·mol-1(N2的键能为942 kJ·mol-1),晶体片段结构如图所示。又发现利用N2可制取出N5、N3。含N的化合物及N60、N5极不稳定。则下列说法错误的是( )
A.按键型分类,该晶体中含有非极性共价键
B.含N的化合物中既有离子键又有共价键
C.高聚氮与N2、N3、N5、N、N60互为同素异形体
D.这种固体的可能潜在应用是烈性炸药或高能材料
12.氮化碳结构如图,其中 β 氮化碳硬度超过金刚石晶体,成为首屈一指的超硬新材料。下列有关氮化碳的说法不正确的是( )
A.氮化碳属于共价晶体
B.氮化碳中 C 为-4 价,N 为+3 价
C.氮化碳的化学式为 C3N4
D.晶体中原子最外层都达 8 电子稳定结构
13.观察下列模型示意图并结合有关信息,判断下列说法不正确的是( )
晶体硼(晶体中含12个B原子) SF6 S8 HCN
结构模型示意图
备注 熔点2 180 ℃ 易溶于CS2
A.晶体硼属于共价晶体,结构单位中含有30个B—B键,含有20个正三角形
B.SF6的结构为正八面体
C.S8属于共价晶体
D.HCN的结构式为H—C≡N
14.最近发现,只含镁、镍和碳三种元素的晶体竟然也具有超导性。鉴于这三种元素都是常见元素,从而引起广泛关注。该新型超导材料的一个晶胞如图所示。该晶体的化学式是( )
A.Mg2CNi3 B.MgC2Ni
C.MgCNi2 D.MgCNi3
15.某离子晶体晶胞如图所示。已知该晶体的密度为ρ g·cm-3,摩尔质量为M g·mol-1,阿伏加德罗常数的值为NA。下列说法正确的是( )
A.该晶胞中阴、阳离子个数均为1
B.其中的阴、阳离子的配位数都是4
C.该晶胞可能是CsCl的晶胞
D.该晶胞中两个阳离子最近的核间距为× cm
16.近年来有多个关于超高压下新型晶体的形成与结构的研究报道。NaCl晶体在50~300 GPa的高压下和Na或Cl2反应,可以形成不同组成、不同结构的晶体。如图给出其中三种晶体的晶胞(大球为氯原子,小球为钠原子),关于这三种晶胞的说法正确的是( )
A.晶胞Ⅰ中钠原子的配位数为6
B.晶胞Ⅱ中含有6个钠原子
C.晶胞Ⅲ所对应晶体的化学式为Na2Cl
D.三种晶体均是由NaCl晶体在50~300 GPa的高压下和Na反应所得
二、非选择题(本题共5小题,共52分)
17.(12分)(1)分析下列物质的物理性质,判断其晶体类型:
①碳化铝,黄色晶体,熔点2 200 ℃,熔融态不导电:____________;
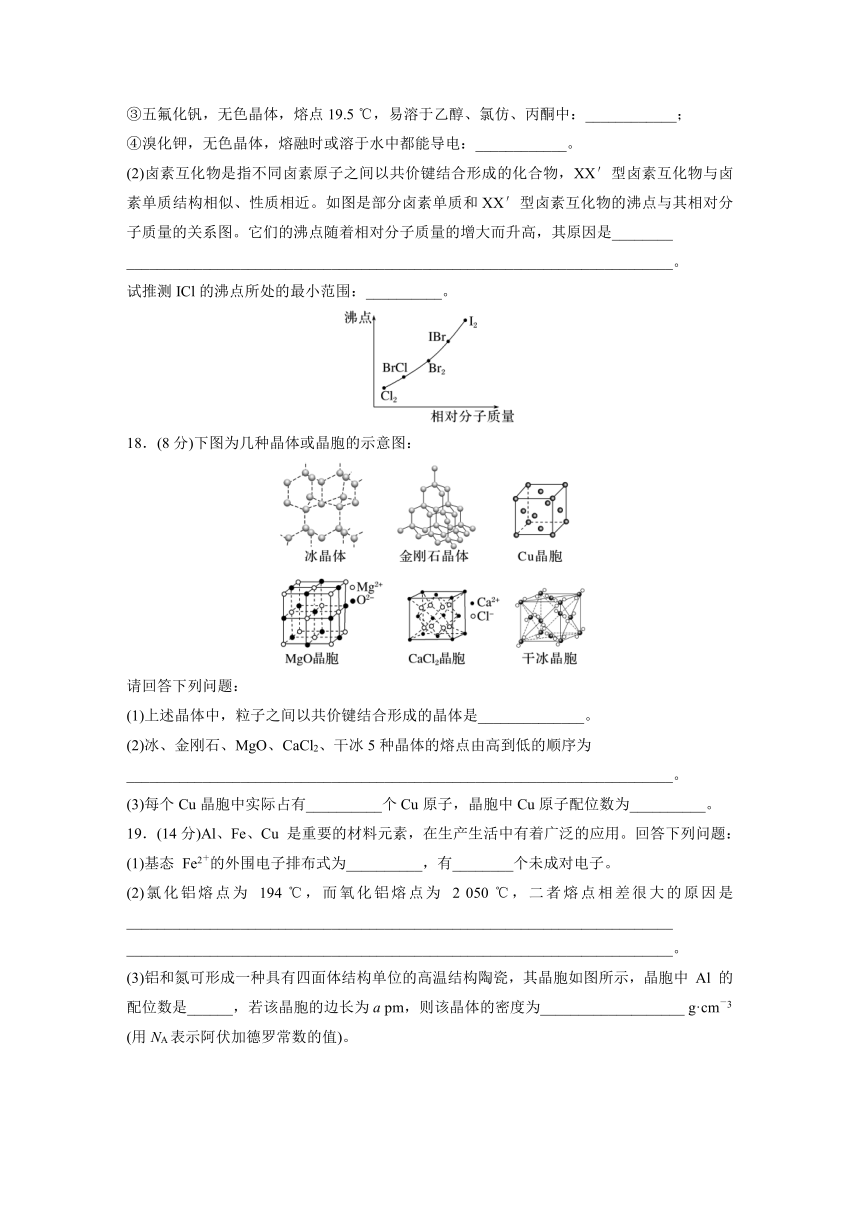
②溴化铝,无色晶体,熔点98 ℃,熔融态不导电:____________;
③五氟化钒,无色晶体,熔点19.5 ℃,易溶于乙醇、氯仿、丙酮中:____________;
④溴化钾,无色晶体,熔融时或溶于水中都能导电:____________。
(2)卤素互化物是指不同卤素原子之间以共价键结合形成的化合物,XX′型卤素互化物与卤素单质结构相似、性质相近。如图是部分卤素单质和XX′型卤素互化物的沸点与其相对分子质量的关系图。它们的沸点随着相对分子质量的增大而升高,其原因是________
________________________________________________________________________。
试推测ICl的沸点所处的最小范围:__________。
18.(8分)下图为几种晶体或晶胞的示意图:
请回答下列问题:
(1)上述晶体中,粒子之间以共价键结合形成的晶体是______________。
(2)冰、金刚石、MgO、CaCl2、干冰5种晶体的熔点由高到低的顺序为
________________________________________________________________________。
(3)每个Cu晶胞中实际占有__________个Cu原子,晶胞中Cu原子配位数为__________。
19.(14分)Al、Fe、Cu 是重要的材料元素,在生产生活中有着广泛的应用。回答下列问题:
(1)基态 Fe2+的外围电子排布式为__________,有________个未成对电子。
(2)氯化铝熔点为 194 ℃,而氧化铝熔点为 2 050 ℃,二者熔点相差很大的原因是________________________________________________________________________
________________________________________________________________________。
(3)铝和氮可形成一种具有四面体结构单位的高温结构陶瓷,其晶胞如图所示,晶胞中 Al 的配位数是______,若该晶胞的边长为a pm,则该晶体的密度为___________________ g·cm-3
(用NA表示阿伏加德罗常数的值)。
(4)一种铜的溴化物晶胞结构如图所示,Cu 填充在Br的四面体空隙,该晶胞中铜的配位数是________,与溴紧邻的溴原子数目是______,由图中 P 点和 Q 点的原子分数坐标可确定 R 点的原子分数坐标为________________。
20.(12分)现有某第4周期过渡金属元素A,其基态原子有四个未成对电子,由此元素可构成固体X。
(1)区分固体X为晶体或非晶体最可靠的科学方法为__________________。若此固体结构如图甲、乙所示,则按甲虚线方向切乙得到的A~D图中正确的是__________________。
(2)写出A的基态原子的电子排布式:____________________________,A2+的外围电子轨道表示式是________________________________________________________________。
(3)A可与CO反应生成A(CO)5,常压下熔点为-20.3 ℃,沸点为103.6 ℃,试推测,该晶体类型是____________________。
(4)A可与另两种元素B、C构成某种化合物,B、C的外围电子排布式分别为3d104s1、3s23p4,其晶胞如图所示,则其化学式为______________。该晶胞上下底面为正方形,侧面与底面垂直,根据如图中所示的数据,则该晶体的密度是_______________________________ g·cm-3(设NA为阿伏加德罗常数的值,列出计算式)。
21.(6分)一种四方结构的超导化合物的晶胞如图1所示。晶胞中Sm和As原子的投影位置如图2所示。图中F-和O2-共同占据晶胞的上下底面位置,若两者的比例依次用x和1-x代表,则该化合物的化学式表示为________________;通过测定密度ρ和晶胞参数,可以计算该物质的x值,完成它们关系表达式:ρ=________________g·cm-3(设NA为阿伏加德罗常数的值)。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标为,则原子2和3的坐标分别为____________、____________。
专题3检测试卷
1.A [Na2O2、KCl加热熔化均克服离子键,SiO2熔化克服共价键,Al熔化克服金属键,冰熔化时需克服分子间作用力;需要克服的作用力类型相同的物质有Na2O2、KCl 2种。]
2.C [铁为金属晶体,由自由电子和金属阳离子构成,不含分子,故A不选;SiO2为共价晶体,晶体中不存在单个分子,故B不选;H2O为分子晶体,晶体中含有单个分子,故C选;NH4Cl为离子晶体,化学式表示晶体中阴、阳离子的个数比为1∶1,晶体中不含单个分子,故D不选。]
3.D [分子组成和结构相似的分子晶体,相对分子质量越大,熔点越高,选项A错误;离子半径越小,所带电荷数越多,晶格能越大,熔点越高,选项B错误;金属性越弱,金属键越强,熔点越高,选项C错误;石墨C—C键的键长比金刚石C—C键的键长短,键能大,所以石墨的熔点比金刚石高,熔点:石墨>金刚石>SiO2,选项D正确。]
4.A [干冰和碘都是分子晶体,状态改变时,均克服分子间作用力,故A正确;乙酸中有氢键,熔点较高,甲酸甲酯中没有氢键,熔点较低,故B错误;分子的稳定性由化学键强弱决定,碘化氢的氢碘键比溴化氢的氢溴键弱,碘化氢稳定性差,故D错误。]
5.B
6.B [根据氮化铝晶体的性质,可知其属于共价晶体,可用于制造切割金属的刀具;根据晶胞结构可知,1个氮化铝晶胞中含有Al原子的个数为1+4×+4×=2,N原子的个数为2×+2×+1=2,Al原子和N原子数目之比为1∶1。]
7.D [分子中可只含σ键,但含π键时一定含σ键,则σ键一般能单独形成,而π键一般不能单独形成,故A正确;σ键为轴对称,π键为镜面对称,则σ键可以绕键轴旋转,π键一定不能绕键轴旋转,故B正确;碳碳双键中有一个σ键、一个π键,碳碳三键中有一个σ键、两个π键,故C正确。]
8.C [PH3为共价化合物,其电子式为,由于非金属性:N>P,所以PH3的热稳定性不如NH3,故A正确;HS-中硫原子核外达到8电子稳定结构,其电子式为,离子中硫氢键为极性共价键,硫氢根离子为18电子的粒子,故B正确;CH2Cl2为共价化合物,其电子式为,分子结构呈四面体,故C错误;氟化钾为离子化合物,其电子式为,氟化钾易溶于水,故D正确。]
9.A [图(a)表示As4结构,每个As原子最外层有5个电子,形成3个σ键,还有1对孤电子对,As4分子中成键电子对数与孤电子对数之比为3∶1,故A项错误;图(b)表示单质硼晶体B12的基本结构单位,每个面都是由3个B原子形成的正三角形,一共有20个正三角形,所以该基本单位为正二十面体,故B项正确;单质硼晶体的熔点为2 180 ℃,熔点较高,且原子间通过共价键结合,属于共价晶体,故C项正确;BAs晶胞中,较大的原子为As原子,距离As原子最近且相等的B原子有4个,故D项正确。]
10.D [金属能导电是因为自由电子在外电场作用下定向运动,A说法错误;在锌晶体中,自由电子属于整个晶体,B说法错误;离子晶体中的化学键很难断裂,离子不能自由移动,因此离子晶体不具有延展性,C说法错误;NaCl晶体中Na+、Cl-的半径分别大于Mg2+、O2-的半径,且所带的电荷数少,则NaCl晶体的晶格能小于MgO晶体的晶格能,D说法正确。]
11.C [高聚氮中含N—N键,则该晶体中含有非极性共价键,故A正确;含N的化合物为离子化合物,还存在N—N键,则含N的化合物中既有离子键又有共价键,故B正确;同素异形体的分析对象为单质,而N为离子,与单质不互为同素异形体,故C错误;N—N键易断裂,高聚氮能量较高,则该固体的可能潜在应用是烈性炸药或高能材料,故D正确。]
12.B [由题给信息,氮和碳以共价键结合,又知β 氮化碳是超硬新材料,符合共价晶体的典型物理性质,故A正确;氮元素的电负性大于碳元素,在氮化碳中氮元素显-3价,碳元素显+4价,故B错误;晶体结构模型中虚线部分是晶体的最小结构单位,正方形的顶点的原子占,边上的原子占,C原子个数为4×+4×=3,N原子个数为4,晶体的化学式为C3N4,故C正确;根据图知,每个碳原子与四个氮原子相连,每个氮原子与三个碳原子相连,均达到8电子稳定结构,故D正确。]
13.C [A项,晶体硼为空间网状结构,且熔点高,应为共价晶体,设晶体硼的结构单位中有x个三角形,则所含B原子数N(B)=3x·=12,解得x=20,故B—B键的个数N(B—B)=3×20×=30;B项,SF6为空间对称结构,是正八面体;C项,S8为小分子物质,且易溶于CS2,应为非极性分子组成的分子晶体;D项,根据价键理论可知,C、N之间应形成三键。]
14.D [碳原子位于该晶胞的体心,该晶胞中含有一个碳原子;镁原子个数为8×=1,镍原子个数为6×=3,该晶胞的化学式为MgCNi3。]
15.D [晶胞中白球位于棱上和体心,晶胞单独占有白球的数目为12×+1=4,黑球位于顶点和面上,晶胞单独占有黑球的数目为8×+6×=4,故A错误;由晶胞结构可知,体心的白球周围有6个黑球,每个黑球周围有6个白球,所以晶体中阴、阳离子的配位数都为6,故B错误;根据均摊法可知,在这个晶胞中阴、阳离子的个数都为4,阴、阳离子的配位数都为6,则晶胞结构与NaCl晶胞相同,可能是NaCl的晶胞,故C错误;晶胞的棱长是 cm,该晶胞中两个阳离子最近的距离是面对角线的一半,则为× cm=× cm,故D正确。]
16.C [晶胞Ⅰ中:Na原子数目为1+8×=2,Cl原子数目为12×=6,化学式为NaCl3;晶胞Ⅱ中:Na原子数目为2+4×=3,Cl原子数目为8×=1,化学式为Na3Cl;晶胞Ⅲ中:Na原子数目为2+4×+2×=4,Cl原子数目为8×=2,化学式为Na2Cl;根据信息:NaCl晶体在50~300 GPa的高压下和Na或Cl2反应,可以形成不同组成、不同结构的晶体,结合原子守恒可知,晶胞Ⅰ所对应的晶体是NaCl晶体在50~300 GPa的高压下和Cl2反应的产物,晶胞Ⅱ、Ⅲ所对应的晶体是NaCl晶体在50~300 GPa的高压下和Na反应的产物,据此分析解答。]
17.(1)①共价晶体 ②分子晶体 ③分子晶体 ④离子晶体 (2)相对分子质量越大,分子间的作用力越强 介于Br2的沸点和IBr的沸点之间
18.(1)金刚石晶体 (2)金刚石>MgO>CaCl2>冰>干冰 (3)4 12
解析 (1)共价晶体中原子间以共价键结合,则粒子之间以共价键结合形成的晶体为金刚石晶体。(2)熔点大小的一般规律:共价晶体>离子晶体>分子晶体,冰和干冰属于分子晶体,但是冰分子间存在氢键,熔点:冰>干冰;氧化镁和氯化钙属于离子晶体,但是氧化镁所含离子半径小,离子所带电荷数多,熔点:氧化镁>氯化钙;金刚石是共价晶体,熔点最高;所以熔点由高到低的顺序为金刚石>MgO>CaCl2>冰>干冰。(3)铜原子占据面心和顶点,则每个Cu晶胞中实际占有的Cu原子数为×8+×6=4;根据铜晶胞结构示意图可知,以顶点铜原子为例,距离最近的铜原子位于晶胞的面心上,这样的原子有12个,因此晶胞中Cu原子的配位数为12。
19.(1)3d6 4 (2)氧化铝是离子晶体,而氯化铝是分子晶体
(3)4 [或] (4)4 12 (,,)
解析 (1)Fe是26号元素,核外电子排布为[Ar]3d64s2,失去两个电子后,外围电子排布式为3d6;根据洪特规则,Fe2+的核外电子中有4个未成对电子。(2)氯化铝是分子晶体,熔点较低;氧化铝是离子晶体,熔点较高。(3)配位数可理解为某离子周围距离最近的带异电荷离子的数目。晶胞中 Al 的配位数是4;根据均摊法,该晶胞中含有Al的数目为8×+6×=4,N在晶胞体内,共计4个。该晶胞的质量为 g,ρ== g·cm-3= g·cm-3。(4)根据该铜的溴化物的晶胞结构可知,Cu周围距离最近的Br有4个,故铜的配位数为4;以顶点Br为例,与其紧邻的Br为面心上的Br,共计12个;根据P、Q点的坐标,可确定R点的坐标为(,,)。
20.(1)X射线衍射实验 A
(2)1s22s22p63s23p63d64s2(或[Ar]3d64s2)
(3)分子晶体
(4)CuFeS2
解析 第4周期过渡金属元素A,其基态原子排布中有四个未成对电子,故A为Fe。(2)A的基态原子核外电子排布式为1s22s22p63s23p63d64s2或[Ar]3d64s2,Fe2+的外围电子排布式为3d6,外围电子轨道表示式为。(3)A可与CO反应生成A(CO)5,常压下熔点为-20.3 ℃,沸点为103.6 ℃,熔、沸点很低,属于分子晶体。(4)B、C的外围电子排布式分别为3d104s1、3s23p4,则B为Cu、C为S,晶胞中Fe原子处于面上、棱心,Fe原子数目为4×+6×=4,Cu原子处于体心、顶点、面上,Cu原子数目为1+8×+4×=4,S原子处于晶胞内部,共有8个,故Cu、Fe、S原子数目之比为4∶4∶8=1∶1∶2,故化学式为CuFeS2。晶胞质量为 g,晶体密度为 g·cm-3。
21.SmFeAsO1-xFx
解析 由晶胞结构中各原子所在位置可知,该晶胞中Sm的原子个数为4×=2,Fe的原子个数为1+4×=2,As的原子个数为4×=2,O或F的原子个数为8×+2×=2,即该晶胞中O和F的个数之和为2,F-的比例为x,O2-的比例为1-x,故该化合物的化学式为SmFeAsO1-xFx。1个晶胞的质量为g=g,1个晶胞的体积为a2c pm3=a2c×10-30 cm3,故密度ρ= g·cm-3。原子2位于底面面心,其坐标为;原子3位于棱上,其坐标为。
(满分:100分)
一、选择题(本题共16小题,每小题3分,共48分。每小题只有一个选项符合题意)
1.将Na2O2、SiO2、KCl、Al、冰分别加热熔化,需要克服的作用力类型相同的物质有( )
A.2种 B.3种
C.4种 D.5种
2.下列化学式既能表示物质的组成,又能表示物质的一个分子的是( )
A.Fe B.SiO2
C.H2O D.NH4Cl
3.下列各物质中,按熔点由高到低的顺序排列正确的是( )
A.CH4>SiH4>GeH4>SnH4
B.KCl>NaCl>MgO
C.Rb>K>Na>Li
D.石墨>金刚石>SiO2
4.下列说法正确的是( )
A.干冰气化和碘升华克服的作用力相同
B.甲酸甲酯和乙酸相对分子质量相同,熔点相近
C.氯化钠和氯化氢熔化时,破坏的都是离子键
D.碘化氢的范德华力比溴化氢的大,碘化氢稳定性强
5.铁镁合金是目前已发现的储氢密度较高的储氢材料之一,其晶胞结构如图所示(灰球代表Fe,白球代表Mg)。则下列说法错误的是( )
A.铁镁合金的化学式可表示为Mg2Fe
B.晶胞中有14个铁原子
C.晶体中存在的化学键类型为金属键
D.该晶胞的质量是 g(NA表示阿伏加德罗常数的值)
6.Al2O3在一定条件下可转化为硬度大、熔点高的氮化铝晶体,其晶胞结构如图所示。下列说法正确的是( )
A.氮化铝属于离子晶体
B.氮化铝可用于制造切割金属的刀具
C.1个氮化铝晶胞中含有9个Al原子
D.氮化铝晶体中Al原子和N原子数目之比为2∶3
7.下列关于σ键和π键的理解不正确的是( )
A.σ键一般能单独形成,而π键一般不能单独形成
B.σ键可以绕键轴旋转,π键一定不能绕键轴旋转
C.碳碳双键中一定有一个σ键、一个π键,碳碳三键中一定有一个σ键、两个π键
D.CH3—CH3、CH2==CH2、CH≡CH中σ键键能相等,π键键能也相等
8.关于下列粒子的描述不正确的是( )
A.PH3的电子式为,其热稳定性不如NH3
B.HS-的电子式为,是含有极性键的18电子的粒子
C.CH2Cl2的电子式为,分子结构呈四面体
D.KF的电子式为,它是易溶于水的离子化合物
9.通过反应4BI3(g)+As4(g)4BAs(s,晶体)+6I2(g)可制备具有超高热导率半导体材料——BAs晶体。下列说法错误的是( )
A.图(a)表示As4结构,As4分子中成键电子对数与孤电子对数之比为3∶2
B.图(b)表示单质硼晶体B12的基本结构单位,该基本单位为正二十面体
C.图(b)所示单质硼晶体的熔点为2 180 ℃,它属于共价晶体
D.图(c)表示BAs的晶胞结构,距离As原子最近且相等的B原子有4个
10.金属晶体和离子晶体是重要的晶体类型。下列关于它们的说法正确的是( )
A.金属能导电是因为金属阳离子在外电场作用下定向运动
B.在锌晶体中,1个Zn2+只与2个自由电子存在强烈的相互作用
C.离子晶体中的化学键很难断裂,因此离子晶体具有延展性
D.NaCl晶体的晶格能小于MgO晶体的晶格能
11.在高压下氮气会发生聚合得到高聚氮,这种高聚氮的N—N键的键能为160 kJ·mol-1(N2的键能为942 kJ·mol-1),晶体片段结构如图所示。又发现利用N2可制取出N5、N3。含N的化合物及N60、N5极不稳定。则下列说法错误的是( )
A.按键型分类,该晶体中含有非极性共价键
B.含N的化合物中既有离子键又有共价键
C.高聚氮与N2、N3、N5、N、N60互为同素异形体
D.这种固体的可能潜在应用是烈性炸药或高能材料
12.氮化碳结构如图,其中 β 氮化碳硬度超过金刚石晶体,成为首屈一指的超硬新材料。下列有关氮化碳的说法不正确的是( )
A.氮化碳属于共价晶体
B.氮化碳中 C 为-4 价,N 为+3 价
C.氮化碳的化学式为 C3N4
D.晶体中原子最外层都达 8 电子稳定结构
13.观察下列模型示意图并结合有关信息,判断下列说法不正确的是( )
晶体硼(晶体中含12个B原子) SF6 S8 HCN
结构模型示意图
备注 熔点2 180 ℃ 易溶于CS2
A.晶体硼属于共价晶体,结构单位中含有30个B—B键,含有20个正三角形
B.SF6的结构为正八面体
C.S8属于共价晶体
D.HCN的结构式为H—C≡N
14.最近发现,只含镁、镍和碳三种元素的晶体竟然也具有超导性。鉴于这三种元素都是常见元素,从而引起广泛关注。该新型超导材料的一个晶胞如图所示。该晶体的化学式是( )
A.Mg2CNi3 B.MgC2Ni
C.MgCNi2 D.MgCNi3
15.某离子晶体晶胞如图所示。已知该晶体的密度为ρ g·cm-3,摩尔质量为M g·mol-1,阿伏加德罗常数的值为NA。下列说法正确的是( )
A.该晶胞中阴、阳离子个数均为1
B.其中的阴、阳离子的配位数都是4
C.该晶胞可能是CsCl的晶胞
D.该晶胞中两个阳离子最近的核间距为× cm
16.近年来有多个关于超高压下新型晶体的形成与结构的研究报道。NaCl晶体在50~300 GPa的高压下和Na或Cl2反应,可以形成不同组成、不同结构的晶体。如图给出其中三种晶体的晶胞(大球为氯原子,小球为钠原子),关于这三种晶胞的说法正确的是( )
A.晶胞Ⅰ中钠原子的配位数为6
B.晶胞Ⅱ中含有6个钠原子
C.晶胞Ⅲ所对应晶体的化学式为Na2Cl
D.三种晶体均是由NaCl晶体在50~300 GPa的高压下和Na反应所得
二、非选择题(本题共5小题,共52分)
17.(12分)(1)分析下列物质的物理性质,判断其晶体类型:
①碳化铝,黄色晶体,熔点2 200 ℃,熔融态不导电:____________;
②溴化铝,无色晶体,熔点98 ℃,熔融态不导电:____________;
③五氟化钒,无色晶体,熔点19.5 ℃,易溶于乙醇、氯仿、丙酮中:____________;
④溴化钾,无色晶体,熔融时或溶于水中都能导电:____________。
(2)卤素互化物是指不同卤素原子之间以共价键结合形成的化合物,XX′型卤素互化物与卤素单质结构相似、性质相近。如图是部分卤素单质和XX′型卤素互化物的沸点与其相对分子质量的关系图。它们的沸点随着相对分子质量的增大而升高,其原因是________
________________________________________________________________________。
试推测ICl的沸点所处的最小范围:__________。
18.(8分)下图为几种晶体或晶胞的示意图:
请回答下列问题:
(1)上述晶体中,粒子之间以共价键结合形成的晶体是______________。
(2)冰、金刚石、MgO、CaCl2、干冰5种晶体的熔点由高到低的顺序为
________________________________________________________________________。
(3)每个Cu晶胞中实际占有__________个Cu原子,晶胞中Cu原子配位数为__________。
19.(14分)Al、Fe、Cu 是重要的材料元素,在生产生活中有着广泛的应用。回答下列问题:
(1)基态 Fe2+的外围电子排布式为__________,有________个未成对电子。
(2)氯化铝熔点为 194 ℃,而氧化铝熔点为 2 050 ℃,二者熔点相差很大的原因是________________________________________________________________________
________________________________________________________________________。
(3)铝和氮可形成一种具有四面体结构单位的高温结构陶瓷,其晶胞如图所示,晶胞中 Al 的配位数是______,若该晶胞的边长为a pm,则该晶体的密度为___________________ g·cm-3
(用NA表示阿伏加德罗常数的值)。
(4)一种铜的溴化物晶胞结构如图所示,Cu 填充在Br的四面体空隙,该晶胞中铜的配位数是________,与溴紧邻的溴原子数目是______,由图中 P 点和 Q 点的原子分数坐标可确定 R 点的原子分数坐标为________________。
20.(12分)现有某第4周期过渡金属元素A,其基态原子有四个未成对电子,由此元素可构成固体X。
(1)区分固体X为晶体或非晶体最可靠的科学方法为__________________。若此固体结构如图甲、乙所示,则按甲虚线方向切乙得到的A~D图中正确的是__________________。
(2)写出A的基态原子的电子排布式:____________________________,A2+的外围电子轨道表示式是________________________________________________________________。
(3)A可与CO反应生成A(CO)5,常压下熔点为-20.3 ℃,沸点为103.6 ℃,试推测,该晶体类型是____________________。
(4)A可与另两种元素B、C构成某种化合物,B、C的外围电子排布式分别为3d104s1、3s23p4,其晶胞如图所示,则其化学式为______________。该晶胞上下底面为正方形,侧面与底面垂直,根据如图中所示的数据,则该晶体的密度是_______________________________ g·cm-3(设NA为阿伏加德罗常数的值,列出计算式)。
21.(6分)一种四方结构的超导化合物的晶胞如图1所示。晶胞中Sm和As原子的投影位置如图2所示。图中F-和O2-共同占据晶胞的上下底面位置,若两者的比例依次用x和1-x代表,则该化合物的化学式表示为________________;通过测定密度ρ和晶胞参数,可以计算该物质的x值,完成它们关系表达式:ρ=________________g·cm-3(设NA为阿伏加德罗常数的值)。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标为,则原子2和3的坐标分别为____________、____________。
专题3检测试卷
1.A [Na2O2、KCl加热熔化均克服离子键,SiO2熔化克服共价键,Al熔化克服金属键,冰熔化时需克服分子间作用力;需要克服的作用力类型相同的物质有Na2O2、KCl 2种。]
2.C [铁为金属晶体,由自由电子和金属阳离子构成,不含分子,故A不选;SiO2为共价晶体,晶体中不存在单个分子,故B不选;H2O为分子晶体,晶体中含有单个分子,故C选;NH4Cl为离子晶体,化学式表示晶体中阴、阳离子的个数比为1∶1,晶体中不含单个分子,故D不选。]
3.D [分子组成和结构相似的分子晶体,相对分子质量越大,熔点越高,选项A错误;离子半径越小,所带电荷数越多,晶格能越大,熔点越高,选项B错误;金属性越弱,金属键越强,熔点越高,选项C错误;石墨C—C键的键长比金刚石C—C键的键长短,键能大,所以石墨的熔点比金刚石高,熔点:石墨>金刚石>SiO2,选项D正确。]
4.A [干冰和碘都是分子晶体,状态改变时,均克服分子间作用力,故A正确;乙酸中有氢键,熔点较高,甲酸甲酯中没有氢键,熔点较低,故B错误;分子的稳定性由化学键强弱决定,碘化氢的氢碘键比溴化氢的氢溴键弱,碘化氢稳定性差,故D错误。]
5.B
6.B [根据氮化铝晶体的性质,可知其属于共价晶体,可用于制造切割金属的刀具;根据晶胞结构可知,1个氮化铝晶胞中含有Al原子的个数为1+4×+4×=2,N原子的个数为2×+2×+1=2,Al原子和N原子数目之比为1∶1。]
7.D [分子中可只含σ键,但含π键时一定含σ键,则σ键一般能单独形成,而π键一般不能单独形成,故A正确;σ键为轴对称,π键为镜面对称,则σ键可以绕键轴旋转,π键一定不能绕键轴旋转,故B正确;碳碳双键中有一个σ键、一个π键,碳碳三键中有一个σ键、两个π键,故C正确。]
8.C [PH3为共价化合物,其电子式为,由于非金属性:N>P,所以PH3的热稳定性不如NH3,故A正确;HS-中硫原子核外达到8电子稳定结构,其电子式为,离子中硫氢键为极性共价键,硫氢根离子为18电子的粒子,故B正确;CH2Cl2为共价化合物,其电子式为,分子结构呈四面体,故C错误;氟化钾为离子化合物,其电子式为,氟化钾易溶于水,故D正确。]
9.A [图(a)表示As4结构,每个As原子最外层有5个电子,形成3个σ键,还有1对孤电子对,As4分子中成键电子对数与孤电子对数之比为3∶1,故A项错误;图(b)表示单质硼晶体B12的基本结构单位,每个面都是由3个B原子形成的正三角形,一共有20个正三角形,所以该基本单位为正二十面体,故B项正确;单质硼晶体的熔点为2 180 ℃,熔点较高,且原子间通过共价键结合,属于共价晶体,故C项正确;BAs晶胞中,较大的原子为As原子,距离As原子最近且相等的B原子有4个,故D项正确。]
10.D [金属能导电是因为自由电子在外电场作用下定向运动,A说法错误;在锌晶体中,自由电子属于整个晶体,B说法错误;离子晶体中的化学键很难断裂,离子不能自由移动,因此离子晶体不具有延展性,C说法错误;NaCl晶体中Na+、Cl-的半径分别大于Mg2+、O2-的半径,且所带的电荷数少,则NaCl晶体的晶格能小于MgO晶体的晶格能,D说法正确。]
11.C [高聚氮中含N—N键,则该晶体中含有非极性共价键,故A正确;含N的化合物为离子化合物,还存在N—N键,则含N的化合物中既有离子键又有共价键,故B正确;同素异形体的分析对象为单质,而N为离子,与单质不互为同素异形体,故C错误;N—N键易断裂,高聚氮能量较高,则该固体的可能潜在应用是烈性炸药或高能材料,故D正确。]
12.B [由题给信息,氮和碳以共价键结合,又知β 氮化碳是超硬新材料,符合共价晶体的典型物理性质,故A正确;氮元素的电负性大于碳元素,在氮化碳中氮元素显-3价,碳元素显+4价,故B错误;晶体结构模型中虚线部分是晶体的最小结构单位,正方形的顶点的原子占,边上的原子占,C原子个数为4×+4×=3,N原子个数为4,晶体的化学式为C3N4,故C正确;根据图知,每个碳原子与四个氮原子相连,每个氮原子与三个碳原子相连,均达到8电子稳定结构,故D正确。]
13.C [A项,晶体硼为空间网状结构,且熔点高,应为共价晶体,设晶体硼的结构单位中有x个三角形,则所含B原子数N(B)=3x·=12,解得x=20,故B—B键的个数N(B—B)=3×20×=30;B项,SF6为空间对称结构,是正八面体;C项,S8为小分子物质,且易溶于CS2,应为非极性分子组成的分子晶体;D项,根据价键理论可知,C、N之间应形成三键。]
14.D [碳原子位于该晶胞的体心,该晶胞中含有一个碳原子;镁原子个数为8×=1,镍原子个数为6×=3,该晶胞的化学式为MgCNi3。]
15.D [晶胞中白球位于棱上和体心,晶胞单独占有白球的数目为12×+1=4,黑球位于顶点和面上,晶胞单独占有黑球的数目为8×+6×=4,故A错误;由晶胞结构可知,体心的白球周围有6个黑球,每个黑球周围有6个白球,所以晶体中阴、阳离子的配位数都为6,故B错误;根据均摊法可知,在这个晶胞中阴、阳离子的个数都为4,阴、阳离子的配位数都为6,则晶胞结构与NaCl晶胞相同,可能是NaCl的晶胞,故C错误;晶胞的棱长是 cm,该晶胞中两个阳离子最近的距离是面对角线的一半,则为× cm=× cm,故D正确。]
16.C [晶胞Ⅰ中:Na原子数目为1+8×=2,Cl原子数目为12×=6,化学式为NaCl3;晶胞Ⅱ中:Na原子数目为2+4×=3,Cl原子数目为8×=1,化学式为Na3Cl;晶胞Ⅲ中:Na原子数目为2+4×+2×=4,Cl原子数目为8×=2,化学式为Na2Cl;根据信息:NaCl晶体在50~300 GPa的高压下和Na或Cl2反应,可以形成不同组成、不同结构的晶体,结合原子守恒可知,晶胞Ⅰ所对应的晶体是NaCl晶体在50~300 GPa的高压下和Cl2反应的产物,晶胞Ⅱ、Ⅲ所对应的晶体是NaCl晶体在50~300 GPa的高压下和Na反应的产物,据此分析解答。]
17.(1)①共价晶体 ②分子晶体 ③分子晶体 ④离子晶体 (2)相对分子质量越大,分子间的作用力越强 介于Br2的沸点和IBr的沸点之间
18.(1)金刚石晶体 (2)金刚石>MgO>CaCl2>冰>干冰 (3)4 12
解析 (1)共价晶体中原子间以共价键结合,则粒子之间以共价键结合形成的晶体为金刚石晶体。(2)熔点大小的一般规律:共价晶体>离子晶体>分子晶体,冰和干冰属于分子晶体,但是冰分子间存在氢键,熔点:冰>干冰;氧化镁和氯化钙属于离子晶体,但是氧化镁所含离子半径小,离子所带电荷数多,熔点:氧化镁>氯化钙;金刚石是共价晶体,熔点最高;所以熔点由高到低的顺序为金刚石>MgO>CaCl2>冰>干冰。(3)铜原子占据面心和顶点,则每个Cu晶胞中实际占有的Cu原子数为×8+×6=4;根据铜晶胞结构示意图可知,以顶点铜原子为例,距离最近的铜原子位于晶胞的面心上,这样的原子有12个,因此晶胞中Cu原子的配位数为12。
19.(1)3d6 4 (2)氧化铝是离子晶体,而氯化铝是分子晶体
(3)4 [或] (4)4 12 (,,)
解析 (1)Fe是26号元素,核外电子排布为[Ar]3d64s2,失去两个电子后,外围电子排布式为3d6;根据洪特规则,Fe2+的核外电子中有4个未成对电子。(2)氯化铝是分子晶体,熔点较低;氧化铝是离子晶体,熔点较高。(3)配位数可理解为某离子周围距离最近的带异电荷离子的数目。晶胞中 Al 的配位数是4;根据均摊法,该晶胞中含有Al的数目为8×+6×=4,N在晶胞体内,共计4个。该晶胞的质量为 g,ρ== g·cm-3= g·cm-3。(4)根据该铜的溴化物的晶胞结构可知,Cu周围距离最近的Br有4个,故铜的配位数为4;以顶点Br为例,与其紧邻的Br为面心上的Br,共计12个;根据P、Q点的坐标,可确定R点的坐标为(,,)。
20.(1)X射线衍射实验 A
(2)1s22s22p63s23p63d64s2(或[Ar]3d64s2)
(3)分子晶体
(4)CuFeS2
解析 第4周期过渡金属元素A,其基态原子排布中有四个未成对电子,故A为Fe。(2)A的基态原子核外电子排布式为1s22s22p63s23p63d64s2或[Ar]3d64s2,Fe2+的外围电子排布式为3d6,外围电子轨道表示式为。(3)A可与CO反应生成A(CO)5,常压下熔点为-20.3 ℃,沸点为103.6 ℃,熔、沸点很低,属于分子晶体。(4)B、C的外围电子排布式分别为3d104s1、3s23p4,则B为Cu、C为S,晶胞中Fe原子处于面上、棱心,Fe原子数目为4×+6×=4,Cu原子处于体心、顶点、面上,Cu原子数目为1+8×+4×=4,S原子处于晶胞内部,共有8个,故Cu、Fe、S原子数目之比为4∶4∶8=1∶1∶2,故化学式为CuFeS2。晶胞质量为 g,晶体密度为 g·cm-3。
21.SmFeAsO1-xFx
解析 由晶胞结构中各原子所在位置可知,该晶胞中Sm的原子个数为4×=2,Fe的原子个数为1+4×=2,As的原子个数为4×=2,O或F的原子个数为8×+2×=2,即该晶胞中O和F的个数之和为2,F-的比例为x,O2-的比例为1-x,故该化合物的化学式为SmFeAsO1-xFx。1个晶胞的质量为g=g,1个晶胞的体积为a2c pm3=a2c×10-30 cm3,故密度ρ= g·cm-3。原子2位于底面面心,其坐标为;原子3位于棱上,其坐标为。
